Производные 1-(1-адамантил)этиламин-n-ациламинокислот и их противогриппозная активность
Иллюстрации
Показать всеИзобретение относится к новым аминокислотным производным 1-(1-адамантил)этиламина указанной ниже общей формулы, а именно к соединениям 1-3, в которых , (соединение 1); R1=Н, (соединение 2) и , (соединение 3). Предлагаемые соединения обладают избирательной противовирусной активностью в отношении вирусов гриппа А, действуют на штаммы, резистентные к действию римантадина гидрохлорида, и могут найти применение в фармакологии и вирусологии. Соединения 1 и 3 обладают также вирулицидной активностью в отношении вирусов гриппа А. 2 з.п. ф-лы, 5 ил., 5 пр.
Реферат
Изобретение относится к новым биологически активным производным 1-(1-адамантил)этиламина (римантадина) и может найти применение в фармакологии и вирусологии. Предлагаемые синтезированные адамалтил-производные в виду их значительной активности и низкой токсичности можно предложить в качестве кандидатов новых противовирусных препаратов
Проблема гриппа - одна из актуальнейших научных задач последнего столетия. Вирусы гриппа активно циркулируют в природе. Актуальность гриппа как медицинской проблемы обусловлена высокой заболеваемостью и смертностью пациентов. На долю гриппа и гриппоподобных заболеваний приходится до 90% всех инфекций. Пандемия 2009/2011 года, вызванная вирусом гриппа A(H1N1)pdm2009 года, показала как крайнюю ограниченность, так и недостаточную эффективность существующих лекарственных средств. ВОЗ сообщает, что по состоянию на 2 октября 2014 года в мире насчитывалось 668 случая (подтвержденных лабораторными исследованиями) инфицирования человека высоковирулентным вирусом гриппа птиц A/H5N1, 394 из которых закончились летальным исходом, при этом уже многие годы летальность от этой инфекции сохраняется высокой. Сохраняется и опасность появления в природе смертельных для человека мутантов вируса гриппа A/H5N1. Последние данные, свидетельствующие о возможности получения таких вариантов в лабораторных условиях, вызвали серьезную тревогу в мире [1].
Поэтому создание новых препаратов, действующих на широкий диапазон штаммов вируса гриппа, в том числе и высоко вирулентных, является неотложной и одной из первостепенных задач здравоохранения.
Первыми эффективными противогриппозными препаратами были на основе аминопроизводных адамантанового карбоцикла: римантадина гидрохлорида - ремантадин и 1-аминоадамантана - амантадин. Ингибирующее действие этих соединений направлено на угнетение функции протон-проводящего канала М2 в оболочке вируса. В настоящее время методами кристаллографии установлено, что четыре субъединицы этого белка образуют в мембране вируса канал, по которому осуществляется транспорт протонов через мембрану вирусной частицы. Попавшие во внутрь вириона протоны запускают процесс диссоциации вирусных белков и выход генетического материала вируса в цитоплазму клетки. Механизм противовирусного действия ремантадина и амантадина состоит в том, чтобы нарушать нормальный ток протонов. В результате химического прессинга ремантадина на вирусы гриппа А к нему возникла резистентность, достигающая 90%. Потерю активности в основном связывают с мутацией в трансмембранном домене белка М2 вируса гриппа.
В настоящее время для лечения и профилактики гриппа используют ингибиторы нейраминидазы - Озельтамивир (Тамифлю) и Занамивир (Реленза), они действуют на этапе выхода вновь синтезированных вирионов вируса гриппа из оболочки клетки, путем блокирования отщепления вирусных частиц от поверхности клеток. Однако известны случаи формирования резистентности к озельтамивиру, в частности практически вся популяция сезонных штаммов вируса гриппа A/H1N1 была резистентна к озельтамивиру [2, 3].
Ранее нами был предложен путь присоединения большого числа функциональных групп к молекуле римантадина гидрохлорида [4]. Этот путь открывает новые возможности для создания эффективных препаратов прямого действия. При появлении новых генотипов вируса гриппа А со структурно измененными белками вируса позволяет быстро, а главное синтетически и экономически доступно вносить изменения в имеющееся адамантил-производное соединение для преодоления резистентности. Важно, что при распаде этих соединений в организме будут образовываться хорошо изученный в биологическом аспекте римантадин гидрохлорид и остатки природных аминокислот.
Сущность изобретения заключается в создании новых синтетических соединений, являющихся производными 1-(1-адамантил)этиламина, а именно трет-бутилоксикарбонил-L-метионинсульфонил-1-адамантаилэтиламин (далее соединение 1), L-метионинсульфонил-1-адамантаилэтиламин хлоргидрат (далее соединение 2) и карбобензилоксикарбонил-L-триптофанил-1-адамантаилэтиламина (далее соединение 3), которые обладают противовирусной активностью в отношении высоко патогенных штаммов вируса гриппа А и ингибируют репродукцию штаммов, резистентных к действию римантадина гидрохлорида. Предлагаемые соединения 1 и 3 обладают вирулицидным действием по отношению к этим штаммам вируса гриппа. Соединения 1, 2 и 3 имеют следующие структурные формулы:
Соединение 1, ;
Соединение 2, R1= -Н;
Соединение 3, , а
Более того, соединения обладают меньшим токсическим эффектом на монослой клеток Madin Darby Canine Kidney (MDCK) и клеток почек эмбриона свиньи (СПЭВ), чем римантадин гидрохлорид.
Для получения соединений 1, 2 и 3 может быть использованы различные подходы, например: карбодиимидный метод, азидный метод, методом активированных эфиров и т.д. Получить соединения 1, 2 и 3 можно также методом смешанных ангидридов (фиг. 1). Однако предложенный метод синтеза не должен рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Технический результат - получены новые, малотоксичные, соединения, обладающие избирательной противогриппозной активностью в отношении штаммов вируса гриппа А, в том числе резистентных к действию римантадина гидрохлорида. Предлагаемые синтезированные адамалтил-производные в виду их значительной активности и низкой токсичности можно предложить в качестве кандидатов новых противовирусных препаратов.
Краткое описание чертежей. Для более ясного понимания сути заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ далее приводится подробное описание со ссылками на фигуры чертежей.
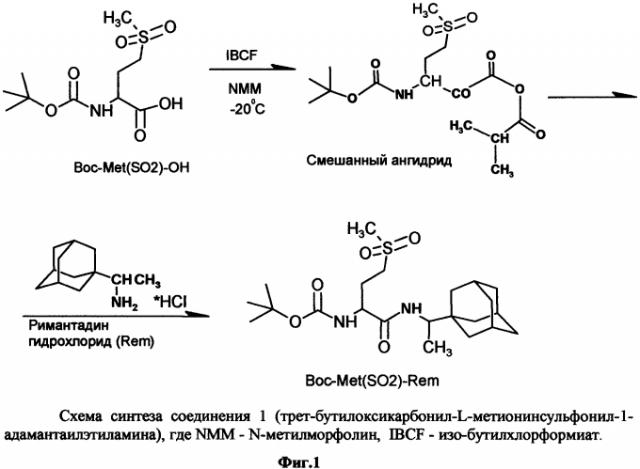
На фиг. 1 представлена схема синтеза производных 1-(1-адамантил)этиламина методом смешанных ангидридов на примере соединения I.
На фиг. 2 представлены в виде таблицы 1 физико-химические константы соединений 1, 2 и 3.
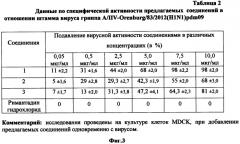
На фиг. 3 представлены в виде таблицы 2 данные влияния различных концентраций соединений 1, 2 и 3 на репродукцию пандемического штамма вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09 в культуре клеток MDCK при добавлении вещества одномоментно с вирусом. Испытания противовирусной активности соединений 1, 2 и 3 проведены в сравнении с римантадином гидрохлоридом.
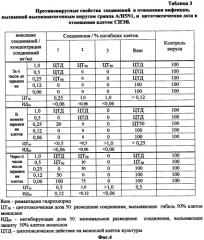
На фиг. 4 представлены в виде таблицы 3 данные противовирусных свойств соединений 1, 2 и 3 в отношении инфекции, вызванной высоко патогенным вирусом гриппа A/duck/Novosibirsk/56/05 (H5N1), а так же цитотоксическое действие этих соединений на монослой клеток СПЭВ.
На фиг. 5 представлены в виде таблицы 4 данные вирулицидной активности синтезированных соединений в отношении высокопатогенного вируса гриппа A/duck/Novosibirsk/56/05 (H5N1).
Один из способов получения соединений 1, 2 и 3 - метод смешанных ангидридов (фиг. 1). Образование пептидной связи между римантадином гидрохлоридом, содержащим аминогруппу, и аминокислотами, защищенными по аминогруппе трет-бутилоксикарбонильной (Вос-) или бензилоксикарбонильной (Z-) группой, проводили в одну стадию в эквимолярном соотношении.
При синтезе соединений использовали рацемический римантадин гидрохлорид фирмы Zhejiang Kangyu Pharmaceutical Со (Китай), L-аминокислоты фирмы Sigma-Aldrich (США). Использовали изо-бутилхлорформиат (TBCF) фирмы «Fluka» (Швейцария), N-метилморфолин (NMM) фирмы Sigma-Aldrich (США). Все используемые для конденсации и удаления защитных групп растворители предварительно абсолютировали и перегоняли по стандартным методикам. Идентификация полученных соединений осуществлялась с помощью тонкослойной хроматографии (ТСХ) на пластинах Silufol (Чехия) в системах: метанол-хлороформ, 13:60 (А), втор-бутанол - 3%-ный аммиак, 100:44 (В), н-бутанол - уксусная кислота - вода - пиридин, 30:3:12:10 (С), позволяющих констатировать полное отсутствие в испытуемых образцах следов римантадина гидрохлорида. Молекулярный вес был установлен на MALDI-TOF-времяпролетном масс-спектрометре Bruker UltraFlex II с программным обеспечением для сбора и обработки масс-спектров flexControl 1.1. и flexAnalys 2.2. Инфракрасные спектры были получены на ИК Фурье спектрометр ИнфраЛЮМ ФТ-10. Удельное оптическое вращение полученных соединения определяли в стандартных условиях на автоматическом поляриметре А1-ЕПЛ (1%-ный раствор в этиловом спирте, длина кюветы 0,5 дм). Температуру плавления полученных соединений измеряли на приборе «SMP 20» Stuart Scientific (Великобритания). Для идентификации аминокислотных остатков в полученных соединениях проводили кислотный гидролиз в 6 н HCl при 105°C в течении 12 часов. Образующиеся свободные аминокислоты идентифицировали с помощью ТСХ в системах фенол - вода, 1:1 и н-бутанол - уксусная кислота - вода, 3:2:2.
Для более конкретного понимания биологических свойств полученных соединений в предлагаемом изобретении под противовирусной и вирулицидной активности нужно понимать следующее.
Вирулицидная активность соединения связана с прямым инактивирующим действием на вирионы в составе вирусной популяции, в результате чего частично или полностью утрачивается инфекционная активность вируса. Чтобы проверить вирулицидные свойства вещества (соединения), достаточно провести инкубацию смеси вируса и вещества в течение определенного времени, после чего проверить инфекционные свойства вируса без исследуемого вещества и вируса в смеси с веществом методом титрования в культурах клеток или в организме лабораторных животных. Достоверное снижение инфекционной активности вируса на 1,0 и более логарифмов (lg) или ее полная утрата по сравнению с вирусом без вещества свидетельствует о проявлении вирулицидной активности исследуемого соединения.
Противовирусная активность соединения, как правило, включает как вирулицидную активность вещества, так и его противовирусные свойства, т.е. способность ингибировать ту или иную стадию репликации вируса, от адсорбции вируса на клетки, его проникновения до влияния на сборку и выход вируса из зараженной клетки. Поэтому противовирусную активность исследуемого вещества проверяют путем обработки монослоя клеток или введением вещества лабораторным животным до заражения вирусом (профилактический эффект вещества), в момент заражения (лечебно-профилактический эффект) и через определенный интервал времени после заражения (лечебный эффект). Противовирусный эффект вещества оценивается как по проценту жизнеспособных инфицированных клеток, или здоровых лабораторных животных, сохранившихся в условиях применения вещества, по сравнению с контрольной группой, так и по его свойству снижать способность инфицированных клеток или зараженных животных продуцировать инфекционный вирус.
Настоящее изобретение проиллюстрировано нижеследующими примерами. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Пример 1. Синтез соединения 1 (Вос-Met(SO2)-Rem)
Синтез осуществляется в две стадии.
1) Синтез Boc-Met(SO2)-OH (трет-бутилоксикарбонил-метионинсулъфон) и его выделение.
1,0 г (5,5 мМ) метионинсульфона и 0,22 г (5,5 мМ) NaOH растворили в 5,0 мл Н2О и 4,0 мл трет-бутилового спирта. При перемешивании при 45°C тремя порциями в течении 1 часа прибавляют 1,4 г (6,42 мМ) ди-трет-бутилдикарбоната (пирокарбонат). По окончанию реакции на роторном испарителе в вакууме 15 мм. р. ст. и температуре 50°C отгоняют трет-бутиловый спирт, остаток разбавляют водой в 1,5 раза, и экстрагируют гексаном (15,0 мл × 3). Затем водный раствор подкисляют раствором 1,36 г KHSO4 в 5 мл H2O до рН 3-3,5.
Полученный раствор в делительной воронке экстрагируют этил ацетатом (15,0 мл × 4). Этилацетатные экстракты сушат безводным Na2SO4, растворитель удаляют в роторном испарителе при вакууме 15 мм. р. ст. при 50°C. В остатке получается масло, которое впоследствии кристаллизуется в белые кристаллы. Выход кристаллического продукта 1,37 г (88%), Тпл. = 112°C, Rf=0,55 (А); Rf=0,81 (B); Rf=0,78 (С), [ α ] 20 D = + 8 ∘ (с=1, спирт).
2) Синтез Boc-Met(SO2)-Rem (трет-бутилоксикарбонил-1-метионинсулъфонил-адамантаилэтиламина) и его выделение, (см фиг. 1)
В трехгорлую колбу, снабженную механической мешалкой, термометром и хлоркальцевой трубкой вносят 1,0 г (3,5 мМ) трет-бутилоксикарбонил-метионинсульфон (Boc-Met(SO2)-OH) в 10,0 мл. CHCl3 с 15,0 мл тетрагидрофурана и прибавляют 0,4 мл (3,5 мМ) N-метилморфолина (NMM). Охлаждают до -25°C и при перемешивании в реакционную массу добавляют 0,47 мл (3,5 мМ) изо-бутилхлорформиата (IBCF). Перемешивают 10 мин. Затем добавляют заранее приготовленный и охлажденный до -20°C хлоргидрат 1-(1-адамантаил)этиламина 0,77 г (3,5 мМ) в 10 мл CHCl3 с 0,4 мл (3,5 мМ) NMM. Перемешивают - 30 мин при -20-15°C, затем еще 1 час при 0°C и 10 часов при комнатной температуре.
Реакционную массу переносят в колбу и растворитель (CHCl3) удаляют на роторном испарителе при 50°C и 15 мм. р. ст. Остаток растворяют в 35,0 мл этилацетата и 10,0 мл H2O. Раствор переносят в делительную воронку и последовательно промывают, 0,5 н серной кислотой (4,0 мл×1), 0,5 н KHCO3 (10,0 мл × 2), затем подкислили 1н H2SO4 и промывают Н2О (5,0 мл × 1). Органический слой отделяют и сушат безводным Na2SO4. Этилацетат удаляют в вакууме, получают вспененное масло, которое при промывке диэтиловым эфиром твердеет.
Выход: 1,31 г. (83%), Тпл. = 152-154°C Rf=0,90 (A); Rf=0,89 (B); Rf=0,91 (С), [ α ] 20 D = + 7 ∘ (с=1, спирт).
Соединение 2 является аналогом соединения 1, в котором аминогруппа деблокирована от трет-бутилоксикарбонильной защитной группировки по следующей методике:
Синтез соединения 2 (HCl*H-Met(SO2)-Rem, 1-метионинсулъфонил-адамантаилэтиламин хлоргидрат) и его выделение.
К раствору 1,0 г (2,26 мМ) Boc-Met(SO2)-Rem в 10,0 мл этилацетата при 5°C прибавляют 4,4 мл этилацетата насыщенного 4 н HCl. Реакционную смесь выдерживают в течение 1 часа при 20°C, периодически помешивая. Контроль за прохождением реакции ведут по ТСХ. По завершению реакции реакционную смесь высаждают диэтиловым эфиром. Растворители декантируют. Остаток сушат в вакууме. Оставшееся масло при растирании в эфире кристаллизуется.
Выход 0,85 г (96%). Тпл. = 138-140°C; [α]D=+6° (с=1, спирт), Rf=0,53 (A), Rf=0,63 (B).
Пример 2. Синтез соединения 3 (Z-Trp-Rem, Карбобензилоксикарбони-L-лтриптофанил-1-адамантаилэтиламин) и его выделение.
Z-Trp-OH (Карбобензилоксикарбонил-L-триптофан) был получен от фирмы Sigma-Aldrich (США). Чистота ≥99.0%, показатель вращения плоскополяризованного света [ α ] 20 D = + 2.9 ± 0.3 ∘ (с=3% в уксусной кислоте), температура плавления 124-127°C. Коммерческий Z-Trp-OH был использован в синтезе конечного соединения.
В трехгорлую колбу, снабженную механической мешалкой, термометром и хлоркальцевой трубкой вносят 1,0 г (2,95 мМ) карбобензилоксикарбони-L-триптофана (Z-Trp-ОН) в 10,0 мл. CHCl3 с 15,0 мл тетрагидрофурана и прибавляют 0,32 мл (2,95 мМ) N-метилморфолина (NMM). Охлаждают до -25°C и при перемешивании в реакционную массу добавляют 0,40 мл (3,0 мМ) изо-бутилхлорформиата (IBCF). Перемешивают 10 мин. Затем добавляют заранее приготовленный и охлажденный до - 20°C хлоргидрат 1-(1-адамантаил)этиламина 0,63 г (2,95 мМ) в 10 мл CHCl3 с 0,4 мл (3,5 мМ) NMM. Перемешивают - 30 мин при -20 -15°C, затем еще 1 час при 0°C и 10 часов при комнатной температуре.
Реакционную массу переносят в колбу и растворители удаляют на роторном испарителе при 50°C и 15 мм. р. ст. Остаток растворяют в 35,0 мл этилацетата и 10,0 мл Н2О. Раствор переносят в делительную воронку и последовательно промывают, 0,5 н серной кислотой (4,0 мл × 1), 0,5 н KHCO3 (10,0 мл × 2), затем подкислили 1н H2SO4 и промывают Н2О (5,0 мл × 1). Органический слой отделяют и сушат безводным Na2SO4. Этилацетат удаляют в вакууме, получают вспененное масло, которое при промывке диэтиловым эфиром твердеет.
Выход: 1,41 г. (95,5%), аморфный, Rf=0,85 (A); Rf=0,93 (B); Rf=0,69 (С), [ α ] 20 D = + 5 ∘ (с=1, спирт).
Пример 3. Определение противовирусной активности синтетических соединений в отношении вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09
Изучение специфической противовирусной активности синтетических соединений проводили на 96-луночных панелях со сформировавшимся монослоем клеток культуры ткани MDCK. Одномоментно с инфицированием в монослой клеток вносили римантадин гидрохлорид (референс препарат) и изучаемые синтетические соединения в концентрациях 0,05, 0,5, 2,5, 5,0, 7,5 и 10,0 мкг/мл. Панели инкубировали 24 часа при 37°C, а затем останавливали реакцию фиксированием клеток 80% ацетоном на фосфатном буфере. Постановку метода клеточного иммуноферментного анализа (ИФА) проводили согласно методике, описанной ранее [5, 6]. Процент ингибирования вирусной активности соединениями определяли по формуле (1):
где ОПопыт - оптическая плотность опытной лунки (с веществом) при 492 н.м., ОП кл.к - ОП492 клеточного контроля, ОП вир.к. - ОП492 вирусного контроля.
На фиг. 3 представлены средние значения результатов испытания противовирусной активности синтезированных соединений из параллельных опытов, проводимых в аналогичных условиях. Значения результатов показанных в этих опытах соответствовали нормальному распределению.
Из данных фиг. 3 видно, что синтезированные соединения 1, 2 и 3 защищают клетки монослоя MDCK от цитопатического действия вируса. Соединения 1, 2 и 3 показали значительный процент ингибирования репродукции штамма вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09, устойчивого к действию римантадина гидрохлорида. Ингибирующая доза (ИД50) для соединения 1 составила 5 мкг/мл, а для соединений 2 и 3 7,5 мкг/мл. Отсутствие ингибирующего эффекта римантадина гидрохлорида косвенно свидетельствует о резистентности данного штамма к препаратам адамантанового ряда.
Пример 4. Определение противовирусной активности предлагаемых соединений в отношении высокопатогенного вируса гриппа A/H5N1 и их цитотоксического действия.
Изучение противовирусной активности синтезированных соединений и их цитотоксического действия проводили на панелях со сформировавшимся монослоем СПЭВ. В качестве высокопатогенного вируса гриппа А использовали штамм вируса гриппа A/duck/Novosibirsk/56/05 (H5N1) [7]. Противовирусную активность проверяли в трех схемах введения соединений в культуру клеток: за 6 часа до заражения клеток, в момент заражения и через 6 часа после заражения культур клеток СПЭВ. Соединения вносили в концентрациях 1,0, 0,5, 0,25, 0,12 и 0,06 мг/мл. Оценку цитотоксического действия синтезированных соединений определяли колориметрическим методом после инкубации клеток с предлагаемыми соединениями в них в течение 72 часов при 37°C.
Противовирусный эффект вещества оценивается по проценту жизнеспособных инфицированных клеток, путем сравнения интенсивности окрашивания раствора в контрольных и опытных лунках при добавлении нейтрального красного на автоматическом спектрофотометре при длине волны 450 нм. Концентрация, которая обеспечивала выживание 50% клеток СПЭВ, принималась за величину ИД50 (Фиг. 4).
Токсический эффект предлагаемых соединений оценивается по проценту погибших клеток монослоя. Концентрация, которая вызывала гибель 50% клеток СПЭВ, принималась за величину ЦТ50 (Фиг. 4)
Из данных фиг. 4 видно, соединение 1 было эффективно во всех схемах внесения соединения. Наиболее эффективно соединение 1 при внесении за 6 часов до заражения и одномоментно (одновременно) с вирусом (ИД50<0,06 мг/мл). Соединение 2 было эффективно при внесении соединения 1 за 6 часов до заражения и одномоментно с вирусом (ИД50<0,06 мг/мл), однако при внесении через 6 часов после заражения ингибирующая концентрация уменьшилась вдвое (ИД50<0,12 мг/мл). Соединение 3 также проявляло высокий эффект защиты клеток при всех схемах внесения (ИД50<0,06 мг/мл), а по показателю ЦТ50 это соединение превосходит соединение 1 и 2, т.е. соединение 3 менее токсично, чем соединения 1 и 2.
Пример 5. Исследование вирулицидной активности соединений в отношении вируса гриппа A/duck/Novosibirsk/56/05 (H5N1)
В опыте использованы концентрации соединений 10,0 мг/мл, которые смешивали с вирусом следующим образом - 200,0 мкл раствора соединения с добавлением 100,0 мкл вируссодержащего материала в исходной концентрации. Экспозиция с вируссодержащим материалом проведена при комнатной температуре в течение 20 минут, после чего титровали инфекционную активность вируса в каждом варианте опыта в культурах клеток СПЭВ при различных разведениях смеси соединений с вирусом. По разнице титров вируса о контрольных и опытных экспертиментах судили о вирулицидной активности соединения - его способности подавлять инфекционную активность вируса гриппа A/duck/Novosibirsk/56/05 (H5N1). Вирулицидная активность синтетических соединений проиллюстрирована в таблице 4 (фиг. 5). В опытных экспериментах 200,0 мкл раствора соединения (концентрация 10 мг/мл) смешивали со 100,0 мкл вируссодержащего материала в исходной концентрации. В качестве контроля - вируссодержащий материал без предлагаемого соединения (вещества). Экспозиция 20 мин ТЦИД50/200 мкл - тканевая инфекционная доза вируса, заражающая 50% экспонированных клеточных культур, при внесении 200 мкл раствора предлагаемого соединения.
В результате была обнаружена высокая вирулицидная активность для синтетических соединений 1 и 3. Снижение инфекционного титра составило около четырех логарифмов (1000 раз) по отношению к вирусному контролю. Соединение 2 снижало активность вируса на 1,5 логарифма.
Т.о., получены новые соединения формулы 1, 2 и 3 на основе адамантил-аминокислот, обладающие избирательной противовирусной активностью в отношении высокопатогенных вирусов гриппа А. Соединения 1-3 in vitro обладают меньшей токсичностью по сравнению с ремантадином. Причем соединение 3 имеет наибольшую ЦТ50, по сравнению с соединениями 1 и 2 а также с римантадином гидрохлоридом. Соединения 1 и 3 проявляют вирулицидную активность в отношении высоковирулентного вируса гриппа птиц A/H5N1. Механизм противовирусного действия полученных соединений до конца не ясен. Основной предполагаемый механизм противовирусного действия, вероятно, сходен с действием римантадина гидрохлорида на протонный канал М2 вируса гриппа А [8, 9].
Предлагаемые соединения могут быть применены для создания новых противовирусных препаратов, ингибиторов функции протонных каналов вируса. Причем созданные лекарственные средства на основе предлагаемых соединений могут использоваться как в виде индивидуального лекарства, так и в составе комплексной терапии.
ЛИТЕРАТУРА
1. Herfst S., Schrauven E.J.A., Linster M., et al. Airborne Transmission of Influenza A/H5N1 Virus Between Ferrets. // Science. - 2012. V. 336. №6088. P. 1534-1541.
2. Львов Д.К., Бурцева Е.И., Галегов Г.А. и др. Чувствительность эпидемических и пандемических штаммов вирусов гриппа к занамивиру (Релензе™) в опытах in vitro // Вопр. вирусол., 2010. 55(6), с. 10-14.
3. Смирнов B.C., Гаршинина А.В., Штро А.А. Протективная активность комбинации глутамил-триптофана и глицирризиновой кислоты при пероральном введении на модели экспериментальной летальной гриппозной инфекции у белых мышей, вызванной осельтамивирустойчивым штаммом вируса. // Вопр. вирусол., 2014. 59(5), с. 31-38.
4. Шибнев В.А., Гараев Т.М., Финогенова М.П. и др. Производные 1-(1-адамантил)этиламина и их противовирусная активность, Патент РФ RU 2461544 С1 приоритет от 19 апреля 2011 г.
5. Бурцева Е.И., Шевченко Е.С., Ленева И.А. и др. Чувствительность к ремантадину и арбидолу вирусов гриппа, вызвавших эпидемические подъемы заболеваемости в России в сезоне 2004-2005 гг. // Вопр. вирусол. 2007. №2. С. 24-29.
6. Ленева И.А., Фадеева Н.И., Федякина И.Т. и др. Применение иммуноферментной индикации вирусспецифических антигенов в изучении нового противовирусного препарата. // Хим. - фарм. журнал. 1994. №9. С. 4-15.
7. Львов Д.К., Щелканов М.Ю., Дерябин П.Г. и др. Метод первичной изоляции штаммов вируса гриппа А, штамм virus A/duck/Novosibirsk/56/05 H5N1 для приготовления диагностических, профилактических и лечебных препаратов, для оценки противовирусной активности различных соединений. Патент РФ RU 2309983 С1 приоритет от 25 ноября 2005 г.
8. Hu F., Luo W., Hong М. «Mechanisms of Proton Conduction and Gating in Influenza M2 Proton Channels from Solid-State NMR». Science, v. 330 no. 6003, p. 505-508 (2010).
9. Balannik V., Carnevale V., Fiorin G., «Functional studies and modeling of pore-lining residue mutants of the influenza a virus M2 ion channel». Biochemistry v. 49, p. 696-708 (2010).
1. Аминокислотные производные 1-(1-адамантил)этиламина общей формулы ,соединение 1: ; ,соединение 2: R1=Н; ,соединение 3: , .
2. Соединения по п.1, обладающие избирательной противовирусной активностью в отношении вирусов гриппа А и действующие на штаммы, резистентные к действию римантадина гидрохлорида.
3. Соединения 1 и 3 по п.1, обладающие вирулицидной активностью в отношении вирусов гриппа А.