Кристаллический ингенол мебутат
Иллюстрации
Показать всеИзобретение относится к новой кристаллической форме ингенол мебутата, характеризующейся FTIR-ATR спектром, демонстрирующим пики в спектре нарушенного полного внутреннего отражения с частотами при 3535, 2951, 1712, 1456, 1378, 1246, 1133, 1028 и/или 956 см-1 (±3 см-1), и кривая которой, полученная с помощью дифференциальной сканирующей калориметрии, демонстрирует скачок при температуре 153±5°C; а также к способам ее получения и к ее применению для лечения кожных повреждений. Более конкретно, настоящее изобретение относится к превращению аморфного ингенол мебутата (ингенол-3-ангелата, PEP005) в новую кристаллическую форму, которая имеет высокую степень чистоты и охарактеризована данными рентгеновской кристаллографии монокристалла (XRC), инфракрасной спектроскопии нарушенного полного внутреннего отражения с Фурье преобразованием (FTIR-ATR) и дифференциальной сканирующей калориметрии (DSC). 10 н. и 27 з.п. ф-лы, 1 ил., 4 табл., 3 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новой кристаллической форме ингенол мебутата, к способам ее получения и к ее применению.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
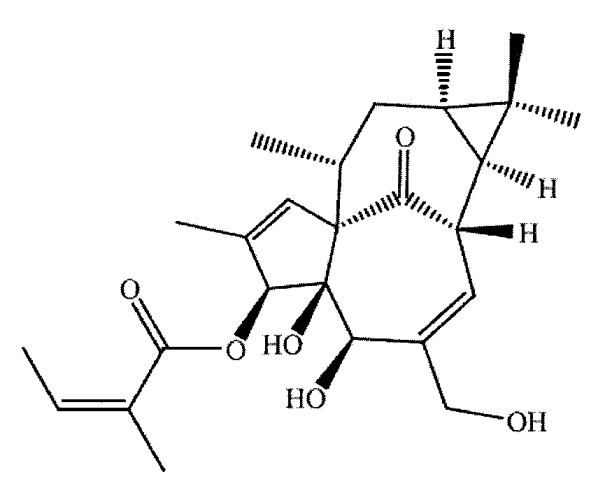
Ингенол мебутат имеет структуру, представленную формулой 1, и имеет следующие химические наименования:
1) 2-метил(1aR,2S,5R,5aS,6S,8aS,9R,10aR)-1a,2,5,5a,6,9,10,10a-октагидро-5,5a-дигидрокси-4-(гидроксиметил)-1,1,7,9-тетраметил-11-оксо-1H-2,8a-метаноциклопента[a]циклопропа[e]циклодецен-6-иловый эфир (2Z)-2-бутеновой кислоты,
2) (1aR,2S,5R,5aS,6S,8aS,9R,10aR)-5,5a-дигидрокси-4-(гидроксиметил)-1,1,7,9-тетраметил-11-оксо-1a,2,5,5a,6,9,10,10a-октагидро-1H2,8a-метаноциклопента[a] циклопропа[e]циклодецен-6-ил(2Z)-2-метилбут-2-еноат)
Формула 1 - Ингенол мебутат
Ингенол мебутат (синонимы: PEP005, ингенол-3-ангелат, CAS no. 75567-37-2) можно выделить из различных видов эуфорбии (Euphorbia), и в частности, из Euphorbia peplus и Euphorbia drummondii. Ингенол мебутат имеет структуру, представленную формулой 1.
Получение ингенол мебутата путем экстрагирования 95% этанолом из сока Euphorbia peplus, Euphorbia hirta и/или Euphorbia drummondi, с последующей хроматографической очисткой было раскрыто в EP1015413 B1, который включен сюда путем ссылки во всей своей полноте. Выделение из Euphorbia peplus также было раскрыто Hohmann et. al. Planta Med. 66, 3, (2000), содержание которой включено сюда путем ссылки во всей своей полноте. Другие патентные заявки, относящиеся к ингенол мебутату и другим фармацевтически активным производным ингенола, включают WO 2008/131491, WO 2007/068963, WO 2007/059584 и WO 2007/053912, каждая из которых включена сюда путем ссылки во всей своей полноте.
Было обнаружено, что ингенол мебутат высоко токсичен в отношении клеток рака кожи за счет быстрого разрушения митохондрий и гибели клеток в результате первичного некроза, тогда как здоровые клетки менее чувствительны к ингенол мебутату.
Было также показано, что ингенол мебутат является эффективным противораковым лекарственным средством и обладает терапевтической эффективностью в количестве микрограмм. Последние результаты с фазы III исследований, оценивающие ингенол мебутат при лечении актинического кератоза (AK), обычного предшественника рака кожи, были представлены на 68 ежегодной конференции Американской академии дерматологии (American Academy of Dermatology (AAD)) (Scientific Session Poster Discussion: P105). Результаты REGION-I исследований демонстрируют, что нанесение ингенол мебутата в виде геля один раз в день в течение 2 последовательных дней (n=117) на участки, расположенные не на голове, приводит к значительной очистке AK поражений по сравнению с результатами для носителя или плацебо (n=118). Исследования показали среднее очищение порядка около 66,7% от числа AK поражений, (p<0,0001), и полное очищение порядка около 27,4% (p<0,0001), включая крайне трудно обрабатываемые участки тыльных частей кисти и руки, и степень частичного очищения порядка около 44,4% (p<0,0001).
Ингенол мебутат коммерчески доступен в аморфной форме, например, от Sigma-Aldrich. Однако до сих пор не сообщалось о кристаллической форме ингенол мебутата.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Рассматриваемое изобретение относится к новой кристаллической форме ингенол мебутата, к фармацевтическим композициям, включающим указанную кристаллическую форму, и к способам ее получения и применения.
Таким образом, первый вариант настоящего изобретения включает кристаллическую форму соединения формулы 1.
В одном варианте кристаллическая форма соединения формулы 1 имеет инфракрасный спектр нарушенного полного внутреннего отражения с Фурье преобразованием (FTIR-ATR), практически аналогичный представленному на Фиг. 1.
Фиг. 1 представляет собой характеристический FTIR-ATR спектр кристаллического ингенол мебутата, полученный с использованием универсального устройства для спектров нарушенного полного внутреннего отражения на спектрометре Perkin Elmer Spectrum One FTIR.
В другом варианте кристаллическая форма соединения формулы 1 характеризуется инфракрасным спектром нарушенного полного внутреннего отражения с Фурье преобразованием (FTIR-ATR), демонстрирующим один или более из пиков спектра нарушенного полного внутреннего отражения с частотой приблизительно при 3535, 2951, 1712, 1456, 1378, 1246, 1133, 1028 и/или 956 см-1 (±3 см-1), соответственно.
В еще одном варианте кристаллическая форма соединения формулы 1 характеризуется кривой, полученной с помощью дифференциальной сканирующей калориметрии (DSC), демонстрирующей скачок у около 153°C (±5°C). Характеристическая DSC кривая получена с использованием Perkin Elmer DSC 8500, при скорости нагревания 20°C/мин.
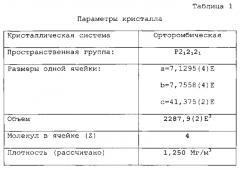
В еще одном варианте кристаллическая форма соединения формулы 1 имеет один или более из параметров монокристалла, перечисленных в таблице 1:
В еще одном варианте кристаллическая форма соединения формулы 1 включает атомы в атомных положениях относительно исходных в ячейке, как представлено далее в таблице 2, или длины связей или углы между связями, как представлено далее в таблице 3.
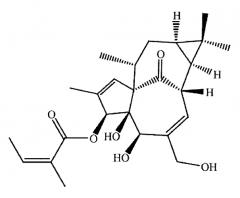
В еще одном варианте кристаллическая форма соединения формулы 1 имеет структуру, полученную с использованием рентгеновской кристаллографии монокристалла (XRC), как представлено в Формуле 2:
Получено с использованием рентгеновской кристаллографии монокристалла (XRC). Термические эллипсоиды изображены с 35% уровнем вероятности.
В некоторых вариантах в настоящем изобретении предложен кристаллический ингенол мебутат. В некоторых вариантах кристаллическая форма не является сольватом. В некоторых вариантах кристаллическая форма является орторомбической. В некоторых вариантах кристаллическая форма характеризуется далее FTIR-ATR спектром, демонстрирующим пики на спектре нарушенного полного внутреннего отражения при частоте приблизительно 3535, 2951, 1712, 1456, 1378, 1246, 1133, 1028 и/или 956 см-1 (±3 см-1). В некоторых вариантах кристаллическая форма характеризуется кривой, полученной с помощью дифференциальной сканирующей калориметрии, демонстрирующей скачок у около 153°C ± около 5°C. В некоторых вариантах кристаллическую форму получают путем кристаллизации соединения формулы 1 из ацетона, ацетонитрила, этанола, 2-пропанола, гептана, метил трет-бутилового эфира, моноглима, толуола, смеси ацетона и гептана, смеси ацетона и c-гексана, смеси ацетона и i-октана, смеси ацетона и ксилола, смеси ацетонитрила и воды, смеси этанола и воды, смеси 2-пропанола и воды, смеси 2-пропанола и гептана, смеси 1,4-диоксана и гептана, смеси 1,4-диоксана, диметилсульфоксида и гептана или смеси толуола и гептана. В вариантах настоящего изобретения кристаллический ингенол мебутат получают из ацетонитрила или из смеси этанола и воды. В некоторых вариантах параметры монокристалла кристаллической формы, полученные с помощью XRC, практически идентичны параметрам, представленным в таблице 1. В некоторых вариантах, кристаллическая форма включает атомы в атомных положениях относительно исходных положений в ячейке, как представлено далее в таблице 2, или имеет длины связей или углы между связями, как представлено далее в таблице 3.
Предпочтительно, чтобы кристаллический ингенол мебутат настоящего изобретения имел степень кристалличности по меньшей мере около 99,5% (например, по данным ВЭЖХ, как раскрыто в примере 1). В некоторых вариантах, степень кристалличности составляет по меньшей мере около 99,7% или более предпочтительно около 99,72%. В некоторых вариантах, степень кристалличности составляет по меньшей мере около 99,9%.
В настоящем изобретении предложен кристаллический ингенол мебутат или кристаллический ингенол мебутат высокой степени чистоты для применения в качестве лекарственного средства. В настоящем изобретении также рассматривают применение кристаллического ингенол мебутата или кристаллического ингенол мебутата высокой степени чистоты для местного лечения кожных заболеваний, а именно раковых заболеваний или других состояний кожи, включающих неопластические клетки, таких как солнечный кератоз или актинический кератоз. Рак кожи, рассматриваемый в настоящем изобретении, включают, наряду с другими, рак кожи, меланому, злокачественную меланому, клеточную карциному Меркеля, сквамозную клеточную карциному и карциному базальных клеток (BCC), включая поверхностную карциному базальных клеток (sBCC).
В настоящем изобретении предложена фармацевтическая композиция, содержащая кристаллический ингенол мебутат или ингенол мебутат высокой степени чистоты, и один или более из фармацевтически приемлемых носителей или средств доставки. В некоторых вариантах фармацевтическая композиция пригодна для местного введения фармацевтической композиции для доставки эффективного количества кристаллического ингенол мебутата на обрабатываемый участок кожи для лечения кожного поражения. В соответствии с настоящим изобретением фармацевтическую композицию можно получать в жидкой или полужидкой форме, такой как гель, крем, мазь, целебная мазь, бальзам, жидкость, суспензия или лосьон. В настоящем изобретении предложен способ получения фармацевтической композиции, содержащей кристаллический ингенол мебутат, причем указанный способ включает объединение кристаллического ингенол мебутата с фармацевтически приемлемым носителем или средством доставки.
В настоящем изобретении также предложен способ лечения кожных поражений, таких как рак или другие состояния, включающие неопластические клетки, причем указанный способ включает нанесение эффективного количества фармацевтической композиции настоящего изобретения на обрабатываемый участок нуждающегося в этом субъекта.
ОПРЕДЕЛЕНИЯ
Термин "C1-C6 неразветвленные или разветвленные алкиловые спирты" включает метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, трет-бутанол и 2-бутанол.
Термин "C2-C6 неразветвленные или разветвленные алкилнитрилы" включает ацетонитрил и пропионитрил.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой кристаллической форме ингенол мебутата. Неожиданно оказалось, что указанная кристаллическая форма обладает физическими свойствами, которые, как считают, облегчают обработку и изготовление API (активный фармацевтический ингредиент) и целевых дозированных форм.
Хорошо известно, что простота и безопасность, с которой получают дозированные формы, также как свойства лекарственных средств, могут зависеть от таких факторов, как, но ими не ограничиваются, чистота, растворимость, гомогенность, гигроскопичность и реологические характеристики активного фармацевтического ингредиента (API). Указанные характеристики можно изменить или улучшить, если получить специфическую кристаллическую, а не аморфную форму API. В соответствии с настоящим изобретением неожиданно было обнаружено, что эксплуатационные и физикохимические характеристики кристаллического ингенол мебутата являются выигрышными. Для фармацевтических композиций настоящего изобретения доступность кристаллического ингенол мебутата уникально обеспечивает целый круг препаратов для наружного применения, с использованием, например, суспензий или очень тонкого измельчения или методик нанотехнологий. Способ получения кристаллической формы соединения формулы I дополнительно повышает чистоту соединения и исключает появление побочных продуктов с предыдущих стадий выделения.
Фиг. 1 выше представляет собой характеристический FTIR-ATR спектр кристаллической формы.
В представленной выше таблице 1 представлены параметры монокристалла для указанной кристаллической формы. Выбранные координаты атомов и изотропные тепловые параметры определяют из результатов, представленных в таблице 2. Длины связей и величины углов между связями представлены далее в таблице 3. Другие данные о кристалле и подробности уточнения структуры представлены в таблице 4.
Формула 2 выше демонстрирует конфигурацию монокристалла кристаллического ингенол мебутата.
Кристаллическую композицию раскрытого в описании вещества можно получить из аморфного (т.е. некристаллического) или нечистого ингенол мебутата. Получение ингенол мебутата раскрыто в EP1015413 B1 или у Hohmann et. al. Planta Med. 66, 3, (2000), причем обе работы включены сюда путем ссылки во всей своей полноте.
Предпочтительный в данном случае способ получения кристаллического ингенол мебутата включает растворение указанного аморфного соединения в растворителе или в смеси растворителей. Предпочтительные в данном случае растворители включают C1-C6 неразветвленные или разветвленные алкиловые спирты, такие как этанол, и C2-C6 неразветвленные или разветвленные алкилнитрилы, такие как ацетонитрил. В настоящем изобретении указанными растворителями являются ацетон, этанол, 2-пропанол, гептан, метил трет-бутиловый эфир, моноглим, толуол, смеси ацетона и гептана, смеси ацетона и c-гексана, смеси ацетона и i-октана, смеси ацетона и ксилола, смеси ацетонитрила и воды, смеси 2-пропанола и воды, смеси 2-пропанола и гептана, смеси 1,4-диоксана и гептана, смеси 1,4-диоксана, диметилсульфоксида и гептана или смеси толуола и гептана.
Предпочтительно указанный растворитель нагревают, растворяют в нем указанное аморфное соединение до концентрации, приблизительно соответствующей насыщению, необязательно добавляют воду и полученный раствор оставляют остывать до температуры, при которой полное количество соединения в растворе более не растворимо в указанном растворителе или в смеси растворителей. Кристаллы выделяют путем фильтрования и сушат необязательно в вакууме необязательно при повышенной температуре.
В еще одном аспекте настоящее изобретение относится к выделенному кристаллическому ингенол мебутату настоящего изобретения, как определено выше, полиморфная степень чистоты которого составляет по меньшей мере около 80%, например около 81%, около 82%, около 83%, около 84%, около 85%, около 86%, около 87%, около 88%, около 89%, около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99% или около 100%.
В еще одном аспекте настоящее изобретение относится к выделенному ингенол мебутату настоящего изобретения, как определенно выше, степень кристалличности которого составляет по меньшей мере около 80%, например около 81%, около 82%, около 83%, около 84%, около 85%, около 86%, около 87%, около 88%, около 89%, около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99% или около 100%.
В еще одном аспекте настоящее изобретение относится к выделенному кристаллическому ингенол мебутату настоящего изобретения, как определено выше, который содержит по меньшей мере около 90% изоформы 'b', т.е. ингенол-3-мебутата, например около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99% или около 100%.
Фармацевтические композиции и способы лечения
Следующий вариант настоящего изобретения включает фармацевтические композиции, содержащие кристаллическую форму соединения формулы 1 и один или более из фармацевтически приемлемых носителей или средств доставки.
Фармацевтические композиции могут включать композиции для местного, перорального, ректального, парэнтерального (внутривенного, внутримышечного), чрескожного, буккального, назального, сублингвального или подкожного введения.
В одном конкретном варианте фармацевтические композиции настоящего изобретения можно использовать для местного введения.
Кристаллическую форму соединения формулы I можно использовать в фармацевтических композициях, в которых соединение остается в кристаллической форме, как, например, в суспензиях.
Суспензии можно приготовить из обработанного кристаллического ингенол мебутата, такого как микроизмельченный или обработанный с помощью нанотехнологий кристаллический ингенол мебутат. Указанную суспензию можно использовать как она есть, например, в виде аэрозолей, или переработать в другие фармацевтические композиции, такие как кремы, гели, мази или другие композиции, пригодные для местного нанесения.
Обычно кристаллический ингенол мебутат диспергируют в средстве доставки. Указанным средством доставки может быть вода или другое подходящее средство доставки, где кристаллический ингенол мебутат поддерживают в виде суспензии, которая имеет вязкость, подходящую для доставки и для предотвращения оседания активного вещества во время хранения. Указанным средством доставки могут также быть смеси растворителей.
Дополнительными добавками могут быть стабилизаторы, эмульгаторы, усилители проницаемости, желирующие агенты и другие компоненты, которые обычно используют в композициях для кожи, например антиоксиданты, консерванты, пигменты, смягчающие кожу агенты, залечивающие кожу агенты и кондиционирующие кожу агенты, см. CTFA Cosmetic Ingredients Handbook, 2 Ed., 1992. В одном варианте настоящего изобретения консервантом является бензиловый спирт.
В настоящем изобретении предложена суспензия кристаллического ингенол мебутата для фармацевтических целей, как раскрыто выше. Концентрацию соединения в фармацевтической композиции определяют на основании подлежащего лечению заболевания. Для местного введения кристаллический ингенол мебутат обычно может присутствовать в количестве от около 0,001 до около 20% от массы композиции, например от около 0,01% до около 10%. В других вариантах настоящего изобретения кристаллический ингенол мебутат присутствует в количестве от около 0,05% до около 1% масс.. В другом варианте настоящего изобретения кристаллический ингенол мебутат присутствует в количестве от около 0,01% до около 0,5%. В еще одном варианте настоящего изобретения кристаллический ингенол мебутат присутствует в концентрации около 0,1%.
Примеры фармацевтических композиций настоящего изобретения включают фармацевтические гели для местного применения, содержащие, например, 0,015% или 0,05% ингенол мебутата (аморфного или кристаллизованного) от массы геля, изопропиловый спирт, гидроксиэтилцеллюлозу, моногидрат лимонной кислоты, дигидрат цитрата натрия, бензиловый спирт и очищенную воду.
При лечении, например, актинического кератоза на лице и/или скальпе субъекта гель настоящего изобретения для местного нанесения, содержащий 0,015% ингенол мебутата, можно наносить на лицо и скальп на пораженный участок кожи (обрабатываемая зона) раз в день в течение трех последовательных дней.
При лечении, например, актинического кератоза на туловище и/или конечностях субъекта гель настоящего изобретения для местного нанесения, содержащий 0,05% ингенол мебутата, можно наносить на туловище и конечности на участки поврежденной кожи (обрабатываемая зона) раз в день в течение 2 последовательных дней.
Обрабатываемый участок можно определить, например, как один непрерывный участок площадью приблизительно 25 см2 (например, 5 см ×5 см). Гель из, например, единичного дозового тюбика или упаковки, содержащей приблизительно 0,47 г геля, можно выдавить на кончик пальца и равномерно распределить по всему обрабатываемому участку, оставляя гель высыхать в течение около 15 минут. Предпочтительно для одного обрабатываемого участка использовать один тюбик с единичной дозой (тюбик с завинчивающейся крышкой или индивидуальные упаковки). Немедленно после нанесения геля на обрабатываемый участок субъектам следует вымыть руки.
В условиях максимального использования, например, если непрерывный обрабатываемый участок площадью около 100 см2 подвергается поверхностной обработке 4 единичными дозами геля, содержащего 0,05% ингенол мебутата, один раз в день в течение 2 последовательных дней, считают, что происходит незначительная или вовсе не происходит системная абсорбция ингенол мебутата. Таким образом, настоящее изобретение предполагает, что вплоть до по меньшей мере около 2 единичных дозовых тюбиков, каждый из которых заполнен 0,05% гелем ингенол мебутата в количестве около 0,47 г, или около 6 единичных дозовых тюбиков, заполненных 0,015% гелем ингенол мебутата в количестве около 0,47 г, можно наносить на обрабатываемый участок один раз в день в течение 2 последовательных дней, на полный максимальный обрабатываемый участок, пораженный актиническим кератозом, площадью около 100 см2, без риска абсорбции ингенол мебутата лимфатической системой при такой обработке.
Следующий вариант настоящего изобретения включает применение кристаллической формы соединения формулы 1 в качестве лекарственного средства.
В другом варианте настоящего изобретения предложена кристаллическая форма соединения формулы 1 для лечения актинического кератоза или солнечного кератоза или себорейного кератоза.
В другом варианте настоящего изобретения предложена кристаллическая форма соединения формулы 1 для лечения рака или других состояний, включающих неопластические клетки, вирусные инфекции, бактериальные инфекции, залечивание ран, фотоповреждения кожи и морщины кожи.
В одном из вариантов настоящего изобретения предложена кристаллическая форма соединения формулы 1 для применения для лечения карциномы базальных клеток (BCC), узелковой BCC, поверхностной карциномы базальных клеток(sBCC), сквамозной клеточной карциномы или сквамозной клеточной карциномы in situ (SCCIS).
В одном из вариантов настоящего изобретения предложена кристаллическая форма соединения формулы 1 для применения для лечения актинического кератоза.
В одном из вариантов настоящего изобретения предложена кристаллическая форма соединения формулы 1 для применения для лечения себорейного кератоза.
В одном из вариантов настоящего изобретения предложена кристаллическая форма соединения формулы 1 для применения для лечения фотоповрежденной кожи и мелких морщин.
В одном из вариантов настоящего изобретения предложена кристаллическая форма соединения формулы 1 для применения для лечения язв или нарушений, вызванных ВПЧ (вирусом папилломы человека, HPV) инфекцией.
В одном из вариантов настоящего изобретения поражением является обычная бородавка или генитальная или перианальная бородавка.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения актинического кератоза или солнечного кератоза.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения себорейного кератоза.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для получения лекарственного средства для лечения рака или других состояний, включающих неопластические клетки.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения вирусных инфекций, бактериальных инфекций, заживления ран, для лечения фотоповреждений кожи и морщин кожи.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения карциномы базальных клеток(BCC), узелковой BCC, поверхностной карциномы базальных клеток (sBCC), сквамозной клеточной карциномы или сквамозной клеточной карциномы in situ (SCCIS).
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения фотоповреждений кожи и неглубоких морщин.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения язв или нарушений, вызванных ВПЧ инфекцией.
В одном из вариантов настоящего изобретения кристаллическую форму соединения формулы 1 предлагают для применения для получения лекарственного средства для лечения обыкновенных бородавок или генитальных или перианальных бородавок.
Термин "рак" в контексте настоящего изобретения включает раковые заболевания кожи, такие как немеланомный рак кожи, меланома, злокачественная меланома, клеточная карцинома Меркеля, сквамозная клеточная карцинома и карцинома базальных клеток. Карциномы базальных клеток включают поверхностные карциномы базальных клеток, также как узелковые карциномы базальных клеток. Другие типы раковых заболеваний включают гематологические раковые заболевания, такие как миелоидные раковые заболевания, в частности, такие как острая миелоидная лейкемия и хроническая миелоидная лейкемия; рак простаты и рак мочевого пузыря, включая доброкачественную гиперплазию простаты, внутриэпителиальную карциному простаты, карциному мочевого пузыря, аденокарциному простаты и карциному почечных клеток. Другие раковые заболевания включают связанный со СПИДом (AIDS) рак, акустическую неому, аденоцистную карциному, адренокортикальный рак, агногенную миелоидную метаплазию, алопецию, альвеолярную саркому мягких тканей, рак анального канала, ангиосаркому, апластическую анемию, астроцитому, телеангиоэктатическую атаксию, карциному базальных клеток (bcc), рак мочевого пузыря, рак костей, рак кишечника, глиому ствола головного мозга, раковые заболевания мозга и ЦНС, рак груди, раковые заболевания ЦНС, карциноидные раковые заболевания, рак шейки матки, детские раковые заболевания мозга, детский рак, детскую саркому мягких тканей, хондросаркому, хориокарциному, колоректальные раки, лимфому Т-клеток кожи, dermatof[iota]brosarcoma-protuberans, десмопластическую мелкокруглоклеточную опухоль, дуктальный рак, эндокринные раковые заболевания, эндометриальный рак, эпендимому, эзофагеальный рак, саркому Эвинга, рак общего печеночного прохода, рак глаза, меланому, ретинобластому, рак фаллопиевых труб, анемию Фанкони, фибросаркому, рак желчного пузыря, рак желудка, раковые заболевания желудочно-кишечного тракта, карциноидный рак желудочно-кишечного тракта, уриногенитальные раковые заболевания, герминогенный рак, гестационную трофобластическую болезнь, глиому, гинекологические раковые заболевания, гематологическую злокачественную опухоль, рак головы и шеи, гепатоцеллюлярный рак груди, наследственный рак груди, гистоцитоз, болезнь Ходжкина, вирус папилломы человека, холеонадиному, гиперкальцемию, рак гортанной части глотки, внутриглазную меланому, связанный с волчанкой T-клеточный рак, саркому Капоши, рак почки, клеточный гистоцитоз Лангерана, рак гортани, лейомиосаркому, синдром Ли-Фраумени, рак губы, липосаркому, рак печени, рак легких, лимфедему, лимфому, лимфому Ходжкина, не-Ходжкинскую лимфому, мужской рак груди, злокачественный палочковидный рак почки, медуллобластому, мезотелиому, метастатический рак, рак ротовой полости, множественную эндокринную неоплазию, грибовидный микоз, синдромы миелодисплазии, миелому, миелопролиферативные нарушения, носовой рак, назофарингеальный рак, нефробластому, нейробластому, нейрофиброматоз, синдром разрыва Неймегена, немелкоклеточный рак легких (nsclc), офтальмологические раковые заболевания, эзофагеальный рак, рак ротовой полости, рак ротовой части глотки, остеосаркому, рак яичников, рак поджелудочной железы, параназальный рак, рак паращитовидной железы, рак параушной железы, рак полового члена, периферические нейроэктодермальные раковые заболевания, рак гипофиза, истинную полицитемию, рак простаты, редкие раки и связанные с ними нарушения, ретинобластому, рабдомиосаркому, синдром Ротмунда-Томсона, рак слюнной железы, саркому, шванному, синдром Сезари, мелкоклеточный рак легких (sclc), рак тонкого кишечника, саркому мягких тканей, раковые заболевания спинного мозга, рак желудка, синовиальную саркому, рак яичек, рак тимуса, рак щитовидной железы, переходно-клеточный рак мочевого пузыря (мочевого пузыря), переходно-клеточный рак (почек-почечной лоханки/матки), трофобластический рак, рак матки, рак мочеполовой системы, уроплакины, саркому матки, рак матки, вагинальный рак, рак вульвы, макроглобулинемию Вальденстрома и рак Уилмса. Солидный рак, который лечат, используя способы настоящего изобретения, может быть первичным поражением или может быть результатом метастаз первичного рака. Кроме того, если солидный рак представляет собой метастазы первичного рака, первичный рак может быть или первичным солидным раком, как раскрыто выше, или может быть дисперсным первичным раком.
В одном из вариантов настоящего изобретения термин "рак" обозначает рак кожи. В вариантах настоящего изобретения, рак кожи представляет собой немеланомный рак кожи, злокачественную меланому, клеточную карциному Меркеля, сквамозную клеточную карциному, сквамозную клеточную карциному или карциному базальных клеток, такую как поверхностная карцинома базальных клеток или узелковая карцинома базальных клеток.
Термин "фотоповрежденная кожа" в контексте настоящего изобретения включает тонкие линии, морщины и УФ-старение. УФ-старение часто проявляется в увеличении толщины эпидермального слоя или в атрофии эпидермального слоя, и чаще всего солнечным эластозом, накоплением содержащего эластин материала непосредственно под дермальным-эпидермальным соединением. Коллаген и эластичные волокна фрагментируются и разрушаются. На косметическом уровне это можно наблюдать как покраснение и/или уплотнение кожи, что приводит к кожаному внешнему виду, к хрупкости кожи и к неравномерной пигментации, утрате тонуса и эластичности, также как к образованию морщин, к сухости, к появлению веснушек и к образованию глубоких морщин.
Термин "вирусные инфекции" в контексте настоящего изобретения включает ВПЧ инфекции, приводящие к образованию на теле бородавок, например на коже, на гениталиях и во рту. ВПЧ относится к вирусу папилломы человека. Другие вирусы выбирают из аденовируса, паповавируса, герпесвируса (такого как симплекс), вируса ветряной оспы, вируса Эпштейна-Барра, CMV, вируса оспы (такой как черная оспа), вакцинии, гепатита A, гепатита B, гепатита C, риновируса, полиовируса, вируса коревой краснухи, арбовируса, вируса бешенства, вируса инфлюенцы A и B, вируса краснухи, вируса инфекционного паротита и HIV, HTLV I и II. В одном из вариантов настоящего изобретения ВПЧ инфекцией называют обычные бородавки и генитальные бородавки.
Термин "бактериальные инфекции" в контексте настоящего изобретения включает прокариотные и эукариотные бактериальные инфекции и Грам-положительные, и Грам-отрицательные, и Грам-вариабельные бактерии и внутриклеточные бактерии. Примеры бактерий включают Treponema, Borrelia, Neisseria, Legionella, Bordetella, Escherichia, Salmonella, Shigella, Klebsiella, Yersinia, Vibrio, Hemophilus, Rickettsia, Chlamydia, Mycoplasma, Staphylococcus, Streptococcus, Bacillus, Clostridium, Corynebacterium, Proprionibacterium, Mycobacterium, Ureaplasma и Listeria. В частности, виды: Treponema pallidum, Borrelia Burgdorferi, Neisseria gonorrhoea, Legionella pneumophila, Bordetella pertussis, Escherichia coli, Salmonella typhi, salmonella typhimurium, Shigella dysenteriae, Klebsiella pneumoniae, Yersinia pestis, Vibrio cholerae, Hemophilus influenza, Rickettsia rickettsii, Chlamydia trachomatis, Mycoplasma pneumonia, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Bacillus anthracis, Clostridium botulinum, Clostridium tetani, Clostridium perfringens, Corynebacterium diphteriae, Proprionibacterium acne, Mycobacterium tuberculosis, Mycobacterium leprae и Listeriare monocytogenes. Низшие эукариотные организмы включают дрожжи и грибки, такие как Pneumocystis nerinii, Candida albicans, Aspergillus, Histoplasma capsulatum, Blastomyces dermatitidis, Cryptococcus neoformans, Trichophyton и Microsporum. Сложные эукариотные организмы включают червей, насекомых, паукообразных, нематоды, амебы, Entamoeba histolytica, Giardia lamblia, Trichonomonas vaginalis, Trypanosoma brucei gembiense, Trypanosoma cruzi, Blantidium coli, Toxoplasma gondii, Cryptosporidium или Leishmania.
В контексте настоящего изобретения термин "залечивание ран" означает: уменьшение или минимизацию рубцевой ткани или улучшение косметического или функционального терапевтического эффекта в отношении раны и уменьшение шрама, где рана представляет собой кожное, хроническое или, например, связанное с диабетом поражение, и включают порезы и рваные раны, хирургические разрезы, проколы, украшения, шрамы, компрессионные поражения, ссадины, фрикционные поражения, хронические раны, язвы, раны от ожогов, химические поражения, раны, образовавшиеся в результате патогенных инфекций, участки кожных трансплантатов у доноров трансплантатов и реципиентов, состояния иммунных реакций, раны ротовой полости, раны желудка или кишечника, повреждения хрящей или костей, зоны ампутаций и повреждения роговицы.
Дальнейший вариант настоящего изобретения включает кристаллическую форму соединения формулы 1 для лечения рака, где рак представляет собой рак кожи, такой как злокачественная меланома, клеточная карцинома Меркеля, сквамозная клеточная карцинома или базальная клеточная карцинома.
Настоящее изобретение далее иллюстрируется следующими неограничивающими примерами.
ПРИМЕРЫ
Пример 1: Получение кристаллического ингенол мебутата
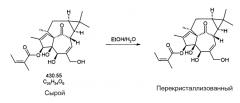
Четыре порции ингенол мебутата (около 22 г, 51,1 ммоль) объединяют в реакторе объемом 500 мл. В реактор добавляют этанол (около 154 мл) и полученную смесь перемешивают при температуре от около 15 до 25°C (большая часть сырого ингенол мебутата оказывается в растворе после 5 минутного перемешивания). Реактор помещают на масляную баню, предварительно нагретую до около 40°C (это приводит к полному растворению). В реактор добавляют по каплям очищенную воду (около 176 мл) до тех пор, пока смесь не становится полностью непрозрачной. Полученную смесь перемешивают в течение около 5-6 минут при температуре от около 30 до 35°C (внутренняя температура), к этому времени полученная смесь становится слегка непрозрачной и тогда добавляют еще порцию воды (22 мл). Полученную смесь перемешивают еще в течение от около 10 до 12 минут при температуре от около 35 до 40°C (внутренняя температура), затем источник тепла удаляют и непрозрачную смесь охлаждают до температуры от около 20 до 25°C и перемешивают при указанной температуре в течение от около 45 до 50 минут. Реакционную смесь охлаждают далее до температуры от около 0 до 5°C и перемешивают при указанной температуре в течение от около 130 до 135 минут. Используют вакуумное фильтрование полученной суспензии и собранную твердую часть промывают половиной отфильтрованных перекристаллизационных растворов (использованных для промывания реактора). Собранное твердое вещество затем промывают очищенной водой (2×110 мл), затем гептаном (2×110 мл) и фильтровальную лепешку сушат в вакууме в течение около 140 минут. Собранное твердое вещество затем сушат в вакуумном термостате при температуре от около 40 до 45°C, получая ингенол мебутат в виде твердого вещества (около 19,85 г, около 90%, около 90% масс./масс.). Степень чистоты по данным ВЭЖХ анализа: около 99,72% площади.
Пример 2: Получение кристаллического ингенол мебутата
Пять порций сырого ингенол мебутата объединяют, получая около 43,6 г (содержание около 28,07 г ингенол мебутата) путем повторного суспендирования в ацетоне (около 233 мл), и переносят в круглодонную колбу, после чего выпаривают досуха в роторном испарителе. Высушенный объем сырого ингенол мебутата добавляют к примерно 38 мл ацетонитрила и затем медленно вращают в течение около 10 минут в роторном испарителе, при этом осуществляя нагревание с помощью водяной бани (около 40°C). В результате происходит полное растворение ингенол мебутата, после чего тмпературу в водяной бане снижают на около 5°C примерно каждые 25-30 минут до тех пор, пока температуру не фиксируют около 25°C еще на около 25 минут. Колбу вынимают из роторного испарителя и закрывают перед тем, как помещают ее в морозильник при температуре около -20°C примерно на 11 дней. Кристаллы начинают расти после примерно 5 дней. Надосадочную жидкость (около 15,5 мл) удаляют, используя пастеровскую пипетку, перед тем как кристаллы ингенол мебутата собирают на политетрафторэтиленовом (PTFE) мембранном фильтре, используя вакуумную фильтрацию. Кристаллизационную колбу промывают, используя предварительно охлажденный ацетонитрил (24 мл), и кристаллы распределяют таким образом, чтобы равномерно покрыть фильтр перед тем, как проводят дополнительную промывку по каплям, используя предварительно охлажденный ацетонитрил (2×24 мл). После завершения промывки полученные кристаллы частично сушат в вакууме в течение около 15 минут, после чего обрабатывают потоком азота в течение около 1,5 часа. В результате получают около 10,9 г кристаллов ингенол мебутата (выход около 39% в расчете на ингенол мебутат).
Пример 3: Структура монокристалла кристаллическо