Способ усовершенствования процесса удаления вирусов при очистке белков
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Способ улучшения производительности вирусного фильтра во время очистки белков предусматривает обработку композиции, содержащей белок, подлежащий очистке, на стадии катионного обмена и на стадии удаления эндотоксинов, одновременно или в любом порядке, перед пропусканием через указанный вирусный фильтр. При этом вирус, подлежащий удалению фильтрацией, является парвовирусом. Использование способа позволяет повысить эффективность работы вирусных фильтров. 18 з.п. ф-лы, 5 ил., 1 табл., 1 пр.
Реферат
Уровень техники
Область изобретения
Настоящее изобретение относится к области очистки белков. В частности, настоящее изобретение относится к способам повышения производительности вирусных фильтров путем комплексного применения удаления эндотоксинов и катионообменных сред в процессе подготовки к фильтрации.
Описание уровня техники в данной области
Линии клеток млекопитающих заняли основное место среди используемых продуцентов терапевтических средств на основе рекомбинантных белков вследствие их способности правильно осуществлять укладку белка и посттрансляционную модификацию, например, гликозилирование (Chu and Robinson Current Opinion in Biotechnology 12: 180-187, 2001). В то же время известно, что эти клетки содержат ретровирус-подобные частицы (Lieber et al. Science 182: 56-59, 1973; Lubiniecki et al. Dev Biol Stand 70: 187-191, 1989), и их использование сопряжено с риском возможного загрязнения посторонними вирусами (Gamick, Dev Biol Stand. Basel: Karger 93: 21-29, 1998). Хотя биофармацевтическая промышленность, производящая лекарственные средства на основе рекомбинантных белков, характеризуется хорошими показателями безопасности, в. прошлом были случаи вирусного заражения крови и продуктов на основе плазмы крови (Brown, Dev. Biol. Stand. 81, 1993; Thomas, Lancet 343: 1583-1584, 1994). Для уменьшения риска вирусного загрязнения во время производства рекомбинантных белков, в последующие процессы очистки включают стадии процессов, удаляющих эндогенные и посторонние вирусы. Очистка от вирусов в соответствии с требованиями достигается за счет комбинирования нескольких этапов процесса, обеспечивающих либо инактивацию вируса, либо удаление вируса из потока поступающего материала. В то время как инактивация вирусов достигается с помощью таких способов, как инкубирование при низких значениях pH, температурная обработка и обработка детергентами, удаление вирусов обычно осуществляют с помощью хроматографии и фильтрации (Curtis et al., Biotechnology and Bioengineering 84(2): 179-186, 2003).
В отличие от хроматографических сред, которые удаляют вирусы на основе таких физико-химических свойств, как суммарный заряд, фильтрация вирусов удаляет вирусы за счет исключения по размеру и поэтому считается более надежной методикой. На сегодняшний день фильтрация вирусов в процессе дальнейшей очистки биотерапевтических средств, получаемых из культур клеток млекопитающих, ограничена удалением ретровирусов (диаметром 80-100 нм) вследствие отсутствия мембран с высокой пропускной способностью и номинальным размером пор менее 60 нм.
Последние достижения в технологии мембран сделали возможным производство мембран с высокой пропускной способностью и номинальным размером пор около 20 нм. Эти вирусные фильтры удерживают парвовирусы (диаметром 18-26 нм) и пропускают белки размером до 160 кДа (~8 нм), например, моноклональные антитела (mAb).
Высокой селективности и высокой пропускной способности фильтров парвовирусов достигают путем наложения тонкого удерживающего мембранного слоя на микропористую подложку. Этот тонкий удерживающий слой позволяет осуществлять очень точное разделение белков и вирусов, и в то же время чувствителен к засорению примесями, присутствующими в потоке поступающего материала, приводящему к снижению производительности фильтра и потока. Засорение вирусных фильтров связано с такими загрязнителями, как белковые агрегаты и денатурированный белок. Bohonak и Zydney (Bohonak and Zydney, Journal of Membrane Science 254(1-2): 71-79, 2005) показали, что потеря производительности фильтра может быть обусловлена образованием осадка на фильтре или закупоркой пор. Другие современные публикации (Bolton et al., Biotechnol. Appl. Biochem. 43: 55-63, 2006; Levy et al., Filtration in the Biopharamaceutical Industry. (Meltzer, Т.Н. and Jomitz, M.W., eds.) pp.619-646, Marcel Dekker, New York, 1998) посвящены возможной причине засорения фильтров - адсорбции примесей на стенках пор. В нескольких публикациях (Bolton et al., Biotechnology and Applied Biochemistry 42: 133-142, 2005; Hirasaki et al., Polymer Journal 26(11): 1244-1256, 1994; Omar and Kempt, Transfusion 42(8): 1005-1010, 2002) также продемонстрировано, что понижение производительности фильтра или закупорка пор может снижать удерживание вирусов на несколько порядков величины, влияя на надежность типового технологического процесса.
Таким образом, значительное количество современных исследований сфокусировано на подыскании предварительных фильтров для удаления засоряющих примесей из потока поступающего материала для минимизации засорения вирусного фильтра и обеспечения высокой производительности, пропускной способности и надежного удерживания вирусов. Bolton et al. (Bolton et al. 2006) выполнили тщательное исследование, включавшее тестирование нескольких мембран в качестве предварительных фильтров и продемонстрировало, что за счет использования глубинного фильтра Viresolve™ в качестве предварительного фильтра можно увеличить производительность мембран по отношению к парвовирусам при нормальном потоке (NFP) почти на порядок. Brown et al. (Brown et al. 2008, Use of Charged Membranes to Identify Soluble Protein Foulants in order to Facilitate Parvovirus Filtration. IBC's 20th Antibody Development and Production, San Diego, CA) выполнили оценку сильного катионообменного мембранного адсорбера в качестве предварительного фильтра перед фильтром, удерживающим парвовирусы, и показали, что производительность вирусного фильтра можно повысить в несколько раз для 11 различных потоков mAb. Авторы предложили гипотезу, что катионообменный мембранный адсорбер удалял высокомолекулярные (~600-1500 кДа) белковые агрегаты из поступающего потока за счет конкурентной адсорбции, предотвращая засорение вирусного фильтра. В патенте США №7,118,675 (Siwak et al.) описан процесс, использующий заряженные мембраны для удаления белковых агрегатов из раствора белка с целью предотвращения засорения вирусного фильтра.
Краткое описание изобретения
Настоящее изобретение, по меньшей мере, частично основано на экспериментально полученных данных о том, что засорение парвовирусных фильтров может вызываться примесями, не упоминавшимися в литературе, и для улучшения производительности фильтрации вирусов требуются более совершенные решения в области предварительной фильтрации. Соответственно, настоящее изобретение представляет новое решение в области предварительной фильтрации, значительно превосходящее по функциональности лучшие подходы в области предварительной фильтрации, описанные в литературе (катионообменные мембранные адсорберы).
В одном из аспектов, настоящее изобретение относится к способу улучшения производительности вирусного фильтра во время очистки белков, включающему обработку композиции, содержащей белок, подлежащий очистке, на стадии катионного обмена и на стадии удаления эндотоксинов (в любом порядке), перед пропусканием через указанный вирусный фильтр.
В одном из вариантов реализации, диаметр пор вирусного фильтра составляет от приблизительно 15 до приблизительно 100 нм.
В еще одном из вариантов реализации, диаметр пор вирусного фильтра составляет от приблизительно 15 до приблизительно 30 нм.
В еще одном из вариантов реализации, размер пор вирусного фильтра составляет приблизительно 20 нм.
В одном из дальнейших вариантов реализации, вирус, подлежащий удалению, является парвовирусом.
В еще одном из дальнейших вариантов реализации, диаметр парвовируса составляет от приблизительно 18 до приблизительно 26 нм.
В другом варианте реализации, белок представляет собой антитело или фрагмент антитела, например, антитело, полученное с использованием технологий рекомбинантных ДНК, или его фрагмент.
В еще одном варианте реализации, антитело является терапевтическим антителом.
В еще одном варианте реализации, рекомбинантное антитело или фрагмент антитела продуцируют в клетке-хозяине млекопитающего, например, клетке яичника китайского хомячка (СНО).
В одном из дальнейших вариантов реализации, композицию, содержащую белок, подлежащий очистке, перед фильтрацией вирусов вначале подвергают обработке на стадии катионного обмена, а затем - на стадии удаления эндотоксинов.
В еще одном из дальнейших вариантов реализации, композицию, содержащую белок, подлежащий очистке, перед фильтрацией вирусов вначале подвергают обработке на стадии удаления эндотоксинов, а затем - на стадии катионного обмена.
В еще одном из вариантов реализации, композицию, содержащую белок, подлежащий очистке, перед фильтрацией вирусов одновременно подвергают обработке на стадии катионного обмена и удаления эндотоксинов путем совместного содержания этих двух материалов в одном модуле.
В еще одном варианте реализации, фильтрацию вирусов осуществляют сразу после стадии удаления эндотоксинов.
В одном из дальнейших вариантов реализации, фильтрацию вирусов осуществляют сразу после стадии катионного обмена.
В другом варианте реализации, фильтрацию вирусов осуществляют при значениях pH между приблизительно 4 и приблизительно 10.
В еще одном варианте реализации, концентрация белка, подлежащего очистке, в композиции составляет приблизительно 1-40 г/л.
В еще одном варианте реализации, антитело, подлежащее очистке, представляет собой антитело к одному или нескольким антигенам, выбираемым из группы, состоящей из HER1 (EGFR), HER2, HER3, HER4, VEGF, CD20, CD22, CD11a, CD11b, CD11c, CD18, ICAM, VLA-4, VCAM, IL-17A и/или F, IgE, DR5, CD40, Apo2L/TRAIL, EGFL7, NRP1, митоген-активируемой протеинкиназы (МАРК) и Фактора D.
В одном из дальнейших вариантов реализации, антитело выбирают из группы, включающей антиэстрогенное рецепторное антитело, рецепторное антитело к прогестерону, антитело к р53, антитело к катепсину D, антитело к Bc1-2, антитело к Е-кадгерину, антитело к СА125, антитело к СА15-3, антитело к СА19-9, антитело к с-еrbВ-2, антитело к Р-гликопротеину, антитело к СЕА, антитело к белку ретинобластомы, антитело к онкобелку ras, антитело к Lewis X, антитело к Ki-67, антитело к PCNA, антитело к CD3, антитело к CD4, антитело к CD5, антитело к CD7, антитело к CD8, антитело к CD9/p24, антитело к CD 10, антитело к CD11c, антитело к CD13, антитело к CD14, антитело к CD15, антитело к CD19, антитело к CD23, антитело к CD30, антитело к CD31, антитело к CD33, антитело к CD34, антитело к CD35, антитело к CD38, антитело к CD41, антитело к LCA/CD45, антитело к CD45RO, антитело к CD45RA, антитело к CD39, антитело к CD100, антитело к CD95/Fas, антитело к CD99, антитело к CD 106, антитело к убиквитину, антитело к CD71, антитело к с-mус, антитело к цитокератинам, антитело к виментинам, антитело к белкам HPV, антитело к легким цепям каппа, антитело к легким цепям лямбда, антитело к меланосомам, антитело к простатоспецифическому антигену, антитело к S-100, антитело к тау-антигену, антитело к фибрину, антитело к кератину и антитело к Tn-антигену.
Краткое описание чертежей
Фигура 1: Схема экспериментальной установки, использованной для исследований фильтрации вирусов.
Фигура 2: Действие стерилизующего и глубинного фильтра на производительность фильтра Viresolve Pro, удерживающего парвовирусы. Эксперименты выполняли при pH 5,5 и электропроводности 8,5 мСм/см. Концентрация mAb составляла приблизительно 13 г/л.
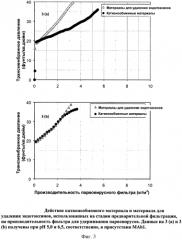
Фигура 3 (а) и (b): Действие катионообменного мембранного адсорбера и мембранного адсорбера для удаления эндотоксинов, использованных в качестве предварительных фильтров, на производительность фильтра Viresolve Pro, удерживающего парвовирусы. Данные на 3 (а) и 3 (b) получены при pH 5,0 и 6,5, соответственно, в присутствии МАb1.
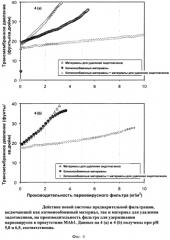
Фигура 4 (а) и (b): Действие новой системы предварительной фильтрации, включающей как катионообменный мембранный адсорбер, так и мембранный адсорбер для удаления эндотоксинов, на производительность фильтра Viresolve Pro, удерживающего парвовирусы, в присутствии МАb1. Данные на 4 (а) и 4 (b) получены при pH 5,0 и 6,5, соответственно.
Фигура 5: Действие новой системы предварительной фильтрации, включающей как катионообменный мембранный адсорбер, так и мембранный адсорбер для удаления эндотоксинов, по сравнению с использованием катионообменного материала для предварительной фильтрации, на производительность фильтра Viresolve Pro, удерживающего парвовирусы, в присутствии MAb2.
Подробное описание предпочтительных вариантов реализации
I. Определения
Под "белком" понимают последовательность аминокислот, длина цепи которой достаточна для образования более высоких уровней третичной и/или четвертичной структуры. Таким образом, белки отличают от "пептидов", которые также являются молекулами на основе аминокислот, не обладающими такой структурой. Для целей настоящего изобретения, белок обычно обладает молекулярной массой, равной, по меньшей мере, 15-20 кДа, предпочтительно, по меньшей мере, приблизительно 20 кДа.
Примеры белков, входящих в рамки определения, приведенного в настоящем документе, включают белки млекопитающих, например, CD4, интегрины и их субъединицы, например, бета-7, гормон роста, включая гормон роста человека и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; α-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, например, фактор VIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда; антикоагулянты, например, протеин С; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, например, урокиназа или тканевой активатор плазминогена (t-PA, например, Activase®, TNKase®, Retevase®); бомбазин; тромбин; факторы некроза опухолей α и β; энкефалиназа; хемокин, экспрессируемый и выделяемый Т-клетками при активации; макрофагальный белок воспаления человека (MIP-1-α); сывороточный альбумин, например, человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; пептид, связанный с гонадотропином мыши; ДНКаза; ингибин; активин; фактор роста эндотелия сосудов (ФРЭС); IgE, рецепторы гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; нейротрофические факторы, например, нейротрофический фактор костей (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, например, NGF-β; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, например, aFGF и bFGF; эпидермальный фактор роста (ЭФР); трансформирующий ростовой фактор (ТРФ), например, ТРФ-α и ТРФ-β, включая ТРФ-β1, ТРФ-β2, ТРФ-β3, ТРФ-Р4 или ТРФ-Р5; инсулиноподобный фактор роста-1 и -II (ИФР-1 и ИФР-П); дез(1-3)-ИФР-1 (ИФР-1 головного мозга); белки, связывающие инсулиноподобный фактор роста; другие CD-белки, например, CD3, CD8, CD19 и CD20; эритропоэтин (ЕРО); тромбопоэтин (ТРО); остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (КМБ); интерферон, например, интерферон-α, -β и -γ; колониестимулирующие факторы (КСФ), например, М-КСФ, ГМ-КСФ и Г-КСФ; интерлейкины (ИЛ), например, от ИЛ-1 до ИЛ-10; супероксиддисмутаза; рецепторы Т-клеток; поверхностные белки мембран; стимулятор гемолиза (DAF-фактор); вирусный антиген, например, фрагмент оболочки ВИЧ; транспортные белки; "хоминг"-рецептор; адрессины; регуляторные белки; интегрины, например, CD11a, CD11b, CD11c, CD18, фактор межклеточной адгезии (ICAM), VLA-4 и фактор адгезии сосудистого эндотелия (VCAM); опухолеассоциированный антиген, например, рецептор HER1 (EGFR), HER2, HER3 или HER4; Apo2L/TRAIL и фрагменты любого из вышеперечисленных полипептидов; а также иммуноадгезины и связывающиеся с ними антитела; и биологически активные фрагменты или варианты любого из вышеперечисленных белков.
В частности, в рамки термина "белок", в соответствии с определением, приведенным в настоящем документе, включают терапевтические антитела и иммуноадгезины, включая, в том числе, антитела к одному или нескольким из следующих антигенов: HER1 (EGFR), HER2, HER3, HER4, VEGF, CD20, CD22, CD11a, CD11b, CD11c, CD18, фактор межклеточной адгезии (ICAM), VLA-4, фактор адгезии сосудистого эндотелия (VCAM), IL-17A и/или F, IgE, DR5, CD40, Apo2L/TRAIL, EGFL7, NRP1, митоген-активируемая протеинкиназа (МАРК) и фактор D, а также их фрагменты.
Другие типичные антитела включают антитела, выбираемые из группы, включающей антиэстрогенное рецепторное антитело, рецепторное антитело к прогестерону, антитело к р53, антитело к катепсину D, антитело к Bc1-2, антитело к Е-кадгерину, антитело к СА125, антитело к СА15-3, антитело к СА19-9, антитело к с-егЬВ-2, антитело к Р-гликопротеину, антитело к СЕА, антитело к белку ретинобластомы, антитело к онкобелку ras, антитело к Lewis X, антитело к Ki-67, антитело к PCNA, антитело к CD3, антитело к CD4, антитело к CD5, антитело к CD7, антитело к CD8, антитело к CD9/p24, антитело к CD10, антитело к CD11c, антитело к CD13, антитело к CD14, антитело к CD15, антитело к CD19, антитело к CD23, антитело к CD30, антитело к CD31, антитело к CD33, антитело к CD34, антитело к CD35, антитело к CD38, антитело к CD41, антитело к LCA/CD45, антитело к CD45RO, антитело к CD45RA, антитело к CD39, антитело к CD 100, антитело к CD95/Fas, антитело к CD99, антитело к CD106, антитело к убиквитину, антитело к CD71, антитело к с-mус, антитело к цитокератинам, антитело к виментинам, антитело к белкам HPV, антитело к легким цепям каппа, антитело к легким цепям лямбда, антитело к меланосомам, антитело к простатоспецифическому антигену, антитело к S-100, антитело к тауантигену, антитело к фибрину, антитело к кератину и антитело к Tn-антигену, но не ограничиваются ими.
"Выделенный" белок, например антитело, представляет собой белок, определенный и извлеченный и/или отделенный от других компонентов своего природного окружения. Загрязняющие компоненты природного окружения представляют собой материалы, которые мешают диагностическому или терапевтическому использованию белка, например, антитела, и могут включать ферменты, гормоны и другие белковоподобные или небелковоподобные растворенные вещества. В предпочтительных вариантах реализации, белок, например, антитело, очищают (1) до более чем 95 масс.% в соответствии с определением по Лоури, и более предпочтительно - до более чем 99 масс.%, (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с помощью секвенатора с вращающимся стаканом, или (3) до гомогенности, определяемой при электрофорезе в ДСН-ПААГ при восстанавливающих или невосстанавливающих условиях с помощью окрашивания кумасси голубым или, предпочтительно, серебром.
Белок, предпочтительно, является практически чистым, и желательно - практически гомогенным (т.е. свободным от загрязняющих белков). Термин "практически чистый" белок означает композицию, содержащую, по меньшей мере, приблизительно 90 масс.%, предпочтительно - по меньшей мере, приблизительно 95 масс.% данного белка от общей массы композиции.
Термин "практически гомогенный" белок означает композицию, содержащую, по меньшей мере, приблизительно 99 масс.% белка от общей массы композиции.
Термин "антитело" используют в его наиболее широком смысле; в частности, он охватывает моноклональные антитела (включая полноразмерные антитела, содержащие Fc-фрагмент иммуноглобулина), композиции антител с полиэпитопной специфичностью, биспецифические антитела, диатела и одноцепочечные молекулы, а также фрагменты антител (например, Fab, F(ab')2 и Fv).
Стандартное 4-цепочечное антитело представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Антитело IgM состоит из 5 стандартных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и содержит 10 сайтов связывания с антигеном, в то время как антитела IgA включают 2-5 стандартных 4-цепочечных единиц, которые могут полимеризоваться, образуя поливалентные комплексы в комбинации с J-цепью. В случае IgG, 4-цепочечная единица обычно имеет молекулярную массу около 150000 дальтон. Каждая L-цепь соединяется с Н-цепью посредством одной ковалентной дисульфидной связи, в то время как две Н-цепи соединяются друг с другом посредством одной или нескольких дисульфидных связей, в зависимости от изотипа Н-цепи. Каждая Н- и L-цепь также содержит регулярно расположенные дисульфидные мостики внутри цепи. Каждая Н-цепь содержит на N-конце вариабельный домен (VH), за которым в α и γ-цепях следуют три константных домена (СН), а в µ и ε-изотипах - четыре СН-домена. Каждая L-цепь на М-конце несет вариабельный домен (VL), за которым следует константный домен на другом конце. VL присоединен к VH, a Cl - к первому константному домену тяжелой цепи (СН1). Считается, что определенные аминокислотные остатки образуют связующее звено между вариабельными доменами легкой и тяжелой цепей. Соединение VH и VL в единое целое образует единичный сайт связывания с антигеном. Информацию о структуре и свойствах различных классов антител см., например, в Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parsolw (eds), Appleton & Lange, Norwalk, CT, 1994, ст.71 и Глава 6.
L-цепь любого вида позвоночных на основе аминокислотной последовательности ее константного домена можно отнести к одному из двух обособленных типов, называемых каппа и лямбда. В зависимости от аминокислотной последовательности константного домена тяжелых цепей (СН), иммуноглобулины можно отнести к различным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, несущие тяжелые цепи, обозначаемые как α, δ, ε, γ и µ, соответственно. Кроме того, классы γ и µ подразделяют на подклассы на основе сравнительно небольших различий в последовательности и функциях СН; например, у человека экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин "вариабельный" относится к тому факту, что последовательности определенных сегментов вариабельного домена различаются от антитела к антителу в широких пределах. V-домен опосредует связывание с антигеном и определяет специфичность конкретного антитела к конкретному антигену. В то же время, вариабельность неравномерно распределена на всем протяжении вариабельного домена. Напротив, V-области состоят из относительно невариабельных фрагментов из 15-30 аминокислотных остатков, называемых каркасными участками (FR) и разделенных более короткими крайне вариабельными областями, называемыми "гипервариабельными участками" или, иногда, "участками, определяющими комплементарность" (CDR), длина каждого из которых составляет приблизительно 9-12 аминокислотных остатков. Вариабельные домены природных легких и тяжелых цепей содержат четыре FR, преимущественно принимающих конфигурацию β-листа и соединенных тремя гипервариабельными участками, образующими петли, соединяющие структуры β-типа, а в некоторых случаях - являющиеся их частью. Гипервариабельные участки каждой цепи объединены друг с другом в непосредственной близости от FR и, вместе с гипервариабельными участками другой цепи, участвуют в образовании антиген-связывающего сайта антитела (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). Константные домены не вовлечены напрямую в связывание антитела с антигеном, однако проявляют различные эффекторные функции, например, участвуют в антителозависимой клеточно-обусловленной цитотоксичности (ADCC).
Термин "гипервариабельный участок" (а также "участки, определяющие комплементарность" или CDR) в настоящем документе относится к аминокислотным остаткам в составе антитела, которые (обычно три или четыре коротких участка с крайней вариабельностью последовательности) располагаются в пределах V-региона домена иммуноглобулина, образуют сайт связывания с антигеном и являются основными детерминантами специфичности к антигену. Существует, по меньшей мере, два способа идентификации остатков CDR: (1) Подход на основе межвидовой изменчивости последовательностей (т.е., Kabat et al., Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, MS 1991); и (2) подход на основе кристаллографических исследований комплексов антиген-антитело (Chothia, С. et al., J. Mol. Biol. 196: 901-917 (1987)). Однако, в тех случаях, когда эти две методики идентификации остатков определяют перекрывающиеся, но не идентичные области, их можно комбинировать для определения гибридного CDR.
Термин "моноклональное антитело" в настоящем описании относится к антителу, полученному из популяции в значительной степени однородных антител, т.е. отдельные антитела в составе популяции являются идентичными, за исключением возможных мутаций, происходящих по естественным причинам, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифичными, поскольку они направлены против одиночной антигенной детерминанты. Кроме того, по сравнению с традиционными (поликлональными) препаратами антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одиночной детерминанты антигена. Кроме специфичности, моноклональные антитела обладают преимуществом, заключающимся в том, что они синтезируются культурой гибридомы, не загрязненной другими иммуноглобулинами. Определение "моноклональное" указывает на особенность антител, заключающуюся в том, что они получены из практически однородной популяции антител, и не должно расцениваться как необходимость получения антител с помощью какого-либо конкретного способа. Например, моноклональные антитела для использования в соответствии с настоящим изобретением можно получить с помощью гибридомной технологии, впервые описанной в работе Kohler et al., Nature, 256: 495 (1975), либо с помощью технологии рекомбинантных ДНК (см., например, патент США №4,816,567). "Моноклональные антитела" также можно выделить из фаговой библиотеки антител с помощью методик, описанных, например, в публикациях Clackson et al, Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991).
Моноклональные антитела в настоящем описании, в частности, включают "химерные" антитела (иммуноглобулины), в которых фрагмент тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям антител, полученных из организмов конкретной видовой принадлежности, или принадлежащих к конкретному классу или подклассу антител, в то время как остальная часть цепи(ей) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, полученных из организмов другой видовой принадлежности, или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают желательной биологической активностью (патент США №4,816,567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)).
"Интактным" антителом является антитело, включающее сайт связывания с антигеном, а также CL и, по меньшей мере, домены тяжелой цепи СН1, СН2 и СН3.
"Фрагмент антитела" содержит фрагмент интактного антитела, предпочтительно сайт связывания с антигеном и/или вариабельный участок интактного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела (см. патент США 5,641,870, Пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]); молекулы одноцепочечных антител и полиспецифические антитела, сформированные из фрагментов антител.
Папаиновый гидролиз антител позволял получить два идентичных антигенсвязывающих фрагмента, названных "Fab”-фрагментами, и остаточный "Fc"-фрагмент, указывающий на хорошую способность к кристаллизации. Fab-фрагмент состоит из полноразмерной L-цепи вместе с вариабельным доменом Н-цепи (VH) и первым константным доменом одной из тяжелых цепей (СН1). Каждый Fab-фрагмент является моновалентным по отношению к связыванию с антигеном, т.е. содержит единственный сайт связывания с антигеном. Обработка антител пепсином позволяет выделить одиночный крупный F(ab')2-фрагмент, который приблизительно соответствует двум Fab-фрагментам с различной антигенсвязывающей активностью, соединенным дисульфидной связью, и сохраняет способность к перекрестному связыванию антигена. Fab'-фрагменты отличаются от Fab-фрагментов тем, что несут несколько дополнительных остатков на С-конце СН1-домена, включая один или несколько остатков цистеина из шарнирной области антитела. Fab'-SH в настоящем документе представляет собой обозначение Fab', в котором остаток(ки) цистеина в константных доменах несет(ут) свободную тиоловую группу. Фрагменты антител F(ab')2 исходно получали в виде пар Fab'-фрагментов, между которыми расположены шарнирные остатки цистеина. Кроме того, известны другие варианты химического соединения фрагментов антител.
Fc-фрагмент включает С-концевые фрагменты обеих Н-цепей, соединенные друг с другом дисульфидными связями. Эффекторные функции антител определяются последовательностями Fc-области, которую также распознают Fc-рецепторы (FcR), встречающиеся на некоторых типах клеток.
"Fv" представляет собой минимальный фрагмент антитела, содержащий полный сайт распознавания и связывания антигена. Этот фрагмент состоит из димера вариабельных доменов одной тяжелой и одной легкой цепей, жестко связанных посредством нековалентных связей. При укладке этих двух доменов наружу выступают шесть гипервариабельных петель (по три петли из Н- и L-цепи), аминокислотные участки которых участвуют в связывании с антигеном и придают антителу специфичность по отношению к связыванию антигена. В то же время, даже одиночный вариабельный домен (или половина Fv-фрагмента, включающая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью по сравнению с полноразмерным сайтом связывания.
"Одноцепочечные Fv", также сокращенно обозначаемые как "sFv" или "scFv" представляют собой фрагменты антител, включающие домены VH и VL, соединенные в составе одиночной полипептидной цепи. Предпочтительно, полипептид sFv также содержит полипептидный линкер между доменами VH и VL, позволяющий sFv формировать структуру, желательную для связывания с антигеном. Обзор sFv описан Pluckthun в The Pharmacology of Monoclonal Antibodies, vol.113, Rosenburg and Moore eds., Springer-Verlag, New York, pp.269-315 (1994).
Термин "диатела" относится к небольшим фрагментам антител, полученным путем конструирования sFv-фрагментов (см. предыдущий абзац) с короткими линкерами (около 5-10) остатков) между доменами VH и VL, благодаря чему достигается межцепочечное, а не внутрицепочечное сопряжение V-доменов, приводящее к образованию бивалентного фрагмента, т.е. фрагмента, несущего два сайта связывания с антигеном. Биспецифические антитела представляют собой гетеродимеры двух "скрещенных" sFv-фрагментов, в которых VH- и VL-домены двух антител присутствуют на различных полипептидных цепях. Более подробное описание диател приведено, например, в источниках ЕР 404,097; WO 93/11161; Hollinger et al., Proc. Nail. Acad. Sci. USA 90: 6444-6448 (1993).
Антитело, которое "связывается" с молекулой-мишенью или целевым антигеном, представляет собой антитело, способное связывать указанный антиген с достаточной аффинностью, что делает возможным использование этого антитела для адресного воздействия на клетку, экспрессирующую данный антиген.
Антитело, которое "специфически связывается с" или является "специфичным к" определенному полипептиду или эпитопу в составе определенного полипептида, представляет собой антитело, которое связывается с указанным определенным полипептидом или эпитопом в составе определенного полипептида и практически не связывается с любым другим полипептидом или эпитопом полипептида. В таких вариантах реализации, степень связывания антител с этими другими полипептидами или эпитопами полипептидов составляет менее 10% согласно показаниям флуоресцентной сортировки активированных клеток (FACS) или радиоиммунопреципитационного анализа (RIA) по сравнению со связыванием с целевым полипептидом или эпитопом-мишенью.
"Гуманизированные" формы антител нечеловеческого происхождения (например, мыши) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (например, Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), состоящие главным образом из последовательностей, характерных для человека, и содержащие минимальное количество последовательностей, происходящих из иммуноглобулинов нечеловеческого происхождения. В большинстве случаев, гуманизированные антитела представляют собой иммуноглобулины человека (антитела реципиента), в которых остатки из гипервариабельного участка (CDR) реципиента замещены остатками из гипервариабельного участка антитела нечеловеческого происхождения (антитела донора), например, антитела мыши, крысы или кролика, обладающими желательной специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасного участка Fv (FR) иммуноглобулина человека замещают соответствующими остатками нечеловеческого происхождения. Кроме того, "гуманизированные антитела" в настоящем описании также могут содержать остатки, не присутствующие ни в антителах реципиента, ни в антителах донора. Эти модификации вносят для дальнейшей очистки и оптимизации функционирования антител. Гуманизированные антитела в оптимальном варианте также содержат, по меньшей мере, фрагмент константного участка иммуноглобулина (Fc), обычно происходящий из иммуноглобулина человека. Более подробное описание см. в публикациях Jones et al., Nature, 321: 522-525 (1986); Reichmann et al, Nature, 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992).
"Эффекторные функции" антитела относятся к его биологической активности, относимой на счет Fc-участка (последовательности природного Fc-участка или аминокислотной последовательности мутантного Fc-участка) антитела, и меняются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание с C1q и комплементзависимую цитотоксичность; связывание с рецептором Fc; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; подавление рецепторов поверхности клетки (например, рецепторов В-клеток); и активацию В-клеток.
"Антителозависимая клеточно-опосредованная цитотоксичность" или ADCC относится к форме цитотоксичности, при которой секретируемые Ig связываются с Fc-рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, естественных киллерах (NK-клетках), нейтрофилах и макрофагах), позволяя этим цитотоксическим эффекторным клеткам специфически связываться с клетками-мишенями, несущими антигены, и, как следствие, уничтожать эти клетки-мишени с помощью цитотоксинов. Антитела "вооружают" (сенсибилизируют) цитотоксические клетки и необходимы для уничтожения клеток-мишеней в соответствии с этим механизмом. Основные опосредующие ADCC клетки - NK-клетки - экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия Fc на поверхности гематопоэтических клеток кратко изложена в Таблице 3 на странице 464 работы Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Для оценки ADCC-активности молекулы, представляющей интерес, можно выполнить анализ ADCC in vitro, например, согласно описанию в патентах США №5,500,362 или 5,821,337. Эффекторные клетки, пригодные для такого анализа, включают мононуклеары периферической крови (РВМС) и естественные киллеры (NK). В качестве альтернативы или дополнения, ADCC-активность молекулы, представляющей интерес, можно оценить т vivo, например, на животной модели, например, согласно описанию в публикации Clynes et al., PNAS USA 95: 652-656 (1998).
Термин "Fc-рецептор" или "FcR" описывает рецептор, связывающийся с Fc-участком антитела. Предпочтительный FcR представляет собой нативную последовательность FcR человека. При этом предпочтительный FcR представляет собой рецептор, связывающийся с антителом IgG (гамма-рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы этих рецепторов, подвергшиеся альтернативным вариантам сплайсинга, рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые обладают сходными аминокислотными последовательностями, отличающимися главным образом в области их цитоплазматических доменов. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный тирозиновый активирующий мотив (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене иммунорецепторный тирозиновый ингибирующий мотив (ITIM) (см. М. Daeron, Annu. Rev. Immunol. 15: 203-234 (1997). Обзор FcR приведен в работах Ravetch and Kinet, Annu. Rev, Immunol. 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. din. Med. 126: 330-41 (1995). Другие FcR, включая рецепторы, которые будут идентифицированы в будущем, входят в рамки термина "FcR" в настоящем документе. Этот термин также включает неонатальный рецептор, FcRn, который отвечает за передачу материнских IgG плоду. Guyer et al., J. Immunol. 117: 587 (1976) и Kirn et al., J. Immunol. 24: 249 (1994).
"Эффекторные клетки человека" представляют собой лейкоциты, экспрессирующие один или несколько FcR и выполняющие Эффекторные функции. Предпочтительно, эти клетки экспрессируют, по меньшей мере, FcγRIII и выполняют эффекторную функцию ADCC. Прим