Удаление агрегатов с высокой молекулярной массой путем хроматографии на гидроксиапатитах
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Способ выделения мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, предусматривает контактирование состава с гидроксиапатитовой смолой и элюирование очищенного антитела из смолы. Способы позволяют получать состав, в котором содержание агрегатов антител с высокой молекулярной массой снижено до 1%. 3 н. и 18 з.п. ф-лы, 4 ил., 14 табл., 11 пр.
Реферат
Данная заявка испрашивает приоритет согласно предварительной патентной заявке США №60/523,335, зарегистрированной 20 ноября 2003 г., и предварительной патентной заявке США №60/514,018, зарегистрированной 27 октября 2003 г., содержание которых полностью включено в настоящее описание в виде ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам удаления агрегатов с высокой молекулярной массой из препаратов антител с помощью гидроксиапатитовой хроматографии. В определенных вариантах реализации настоящего изобретения содержание агрегатов с высокой молекулярной массой, присутствующих в конечном препарате, может быть существенно снижено, например, с 40% до менее, чем 1%.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Изобретение направлено на создание таких способов очистки белков, которые бы не вызывали разрушения или существенного уменьшения биологической активности белка. Удаление загрязняющих веществ из препаратов антител необходимо для того, чтобы их можно было использовать в диагностических целях, терапевтических целях, для прикладной клеточной биологии и функциональных исследований. Так, например, препараты антител, полученные из линий клеток гибридомы, часто содержат нежелательные компоненты, в частности, агрегаты с высокой молекулярной массой (high molecular weight aggregates, HMWA) антитела, полученного из линии клеток. Это образование агрегатов может отрицательно влиять на безопасность продукта, вызывая при введении активацию комплемента или анафилаксию. Кроме того, образование агрегатов может мешать процессу производства, вызывая уменьшение выхода продукта, расширение пика и потерю активности.
Наиболее общие способы очистки белка основаны на различиях размера, заряда и растворимости белка, подлежащего очистке, и загрязняющих веществ. Протоколы, основанные на этих параметрах, включают аффинную хроматографию, ионообменную хроматографию, эксклюзионную хроматографию и хроматографию гидрофобного взаимодействия. Однако эти хроматографические методы иногда вызывают технические трудности при разделении агрегированных или многомерных типов антител. Например, такие способы, как ионообменная хроматография и хроматография гидрофобного взаимодействия, могут вызывать образование агрегатов вследствие повышенной концентрации белка или необходимых изменений концентрации буфера и/или рН в процессе элюирования. Кроме того, в некоторых случаях антитела проявляют слишком малые отличия в изоэлектрических точках, чтобы обеспечить их разделение с помощью ионообменной хроматографии. Tarditi, J. Immunol. Methods 599:13-20 (1992). Эксклюзионная хроматография является трудоемким способом и приводит к существенному разбавлению продукта, что является препятствием для крупномасштабных производительных технологических процессов. Утечка лигандов, которая может происходить из колонок при аффинной хроматографии, вызывает нежелательное загрязнение элюированного продукта. Steindl, J. Immunol. Methods 235:61-69 (2000). Заявители попытались удалить HMWA из препарата aHTH-GDF-9-антитела с помощью анионообменной хроматографии, катионообменной хроматографии, а также хроматографии гидрофобного взаимодействия. Однако все эти способы оказались неспособными удалить HMWA из препарата анти-СОР-9 - антитела в достаточной степени.
Гидроксиапатитовая хроматография представляет собой способ очистки белков, в котором используют нерастворимый гидроксилированный фосфат кальция [Са10(РO4)6(ОН)2], образующий матрицу и лиганд. Функциональные группы состоят из пар положительно заряженных ионов кальция (С-сайтов) и кластеров отрицательно заряженных фосфатных групп (Р-сайтов). Взаимодействия между гидроксиапатитом и белками являются сложными и многомодовыми. Однако в одном из типов взаимодействия положительно заряженные аминогруппы белков взаимодействуют с отрицательно заряженными Р-сайтами, а карбоксильные группы белков взаимодействуют с С-сайтами посредством координационного комплексообразования. См. Shepard, J. Chromatography 981:93-98 (2000).
Кристаллический гидроксиапатит представлял собой первый тип гидроксиапатита, который нашел применение в хроматографии, однако, оно было ограничено вследствие структурных сложностей. Керамический гидроксиапатит (ceramic hydroxyapatite, cHA) разработали для преодоления некоторых трудностей, связанных с кристаллическим гидроксиапатитом, в частности, с ограниченными скоростями потока. Керамический гидроксиапатит обладает высокой долговечностью, хорошей способностью связывать белки и может применяться при более высоких скоростях потока и давлениях, чем кристаллический гидроксиапатит. Vola et al., BioTechniques 14:650-655 (1993).
Гидроксиапатит используют для хроматографического разделения белков, нуклеиновых кислот, а также антител. В гидроксиапатитовой хроматографии колонку обычно уравновешивают и вводят образец в фосфатном буфере с низкой концентрацией, а затем элюируют адсорбированные белки в градиенте концентраций фосфатного буфера. Giovannini, Biotechnology and Bioengineering 73:522-529 (2000). Иногда для элюирования белков успешно применяют небольшие градиенты концентрации фосфата натрия, в то время как в других случаях с успехом используют градиенты концентраций до 400 мМ фосфата натрия. См., например, Stanker, J. Immunological Methods 76:157-159 (1985) (градиент фосфата натрия для элюирования от 10 мМ до 30 мМ); Shepard, J. Chromatograpy 891:93-98 (2000) (градиент фосфата натрия для элюирования от 10 мМ до 74 мМ); Tarditi, J. Chromatograpy 599:13-20 (1992) (градиент фосфата натрия для элюирования от 10 мМ до 350 мМ). Хотя соли, в частности, NaCl, вводят в связующий буфер для очистки антитела с помощью гидроксиапатитовой хроматографии, Giovannini, Biotechnology and Bioengineering 73:522-529 (2000), влияние таких солей, как NaCl и (NH4)2SO4 на элюирование белков в гидроксиапатитовой хроматографии ранее не было известно. Karlsson et al., Ion Exchange Chromatography, в Protein Purification, VCH Publishers, Inc. (Janson and Ryden eds., 1989).
В некоторых случаях исследователям не удалось селективно элюировать антитела из гидроксиапатита или получить достаточно чистый продукт с помощью гидроксиапатитовой хроматографии. Junbauer, J. Chromatograpy 476:257-268 (1989); Giovannini, Biotechnology and Bioengineering 73:522-529 (2000). Заявители безуспешно пытались отделить агрегаты с высокой молекулярной массой от препарата антитела с помощью хроматографии с керамическим гидроксиапатитом и элюированием фосфатом натрия при помощи известных способов (фигура 1). Кроме того, как известно, жесткие условия элюирования, применяемые с целью разрушения плотного связывания белка с матрицей, нарушают биологическую активность белка. Поэтому существует потребность в эффективных способах удаления загрязнений, в частности, агрегатов с высокой молекулярной массой из препаратов антител, которые не нарушают биологическую активность антител.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Заявители установили, что NaCl можно использовать в новом способе гидроксиапатитовой хроматографии для очистки иммуноглобулинов и удаления HMWA из различных неочищенных материалов (фигура 2). Таким образом, настоящее изобретение относится к способам удаления агрегатов с высокой молекулярной массой из препаратов антител путем контактирования указанного препарата с гидроксиапатитовой смолой и селективного элюирования антитела из смолы. В альтернативном способе препарат антитела можно ввести в уравновешивающий буфер с помощью буферного обмена, а затем пропустить через гидроксиапатитовую смолу. Для очистки препаратов антител можно использовать также комбинацию этих связывающих/проточных способов гидроксиапатитовой хроматографии.
Изобретение использует элюэнтный буфер или загрузочный буфер, который содержит от 1 до 20 мМ фосфата натрия и от 0,2 до 2,5 М NaCl, при этом элюэнтный буфер или загрузочный буфер имеет рН от 6,4 до 7,6.
При сочетании режима связывания/проточного режима изобретение использует уравновешивающий буфер и промывной буфер, который содержит от 1 до 20 мМ фосфата натрия, от 0,01 до 2,0 М NaCl, от 0 до 200 мМ аргинина и от 0 до 200 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновой кислоты), при этом уравновешивающий буфер и промывной буфер имеют рН от 6,2 до 8,0.
В одном варианте реализации очищенное антитело содержит менее 5% агрегатов с высокой молекулярной массой.
В другом варианте реализации очищенное антитело содержит менее 1% агрегатов с высокой молекулярной массой.
В следующем варианте реализации препарат антитела содержит по меньшей мере одно антитело IgG. Более конкретно, препарат антитела содержит по меньшей мере одно антитело, выбранное из группы, включающей рецептор анти-IL-21, анти-GDF-S, анти-Abeta, анти-СD22, анти-Lewis Y, анти-IL-13 и анти-IL-22.
В сочетании с гидроксиапатитовой хроматографией согласно изобретению можно использовать по меньшей мере один способ очистки. Возможно использование различных способов очистки, в частности, но без ограничения, хроматографии с протеином А, аффинной хроматографии, хроматографии гидрофобного взаимодействия, аффинной хроматографии с иммобилизацией металла, эксклюзионной хроматографии, диафильтрации, ультрафильтрации, фильтрации для удаления вирусов, анионообменной хроматографии и/или катионообменной хроматографии.
В одном варианте реализации анионообменную хроматографию и хроматографию с протеином А используют в сочетании с хроматографией с применением керамического гидроксиапатита. Анионообменную хроматографию и хроматографию с протеином А можно использовать в комбинации, например, путем контактирования препарата антитела с подложкой из протеина А обеспечить адсорбцию антитела на подложке, промыть подложку и адсорбированное антитело по меньшей мере одним промывным буфером протеина А, элюировать адсорбированное антитело по меньшей мере одним элюэнтным буфером, обеспечить контакт препарата с ионообменной подложкой, пропустить антитело через подложку, промыть подложку по меньшей мере одним ионообменным промывным буфером, путем контактирования ионообменного потока с гидроксиапатитовой смолой обеспечить адсорбцию потока на смоле, промыть смолу по меньшей мере одним промывным буфером для промывки гидроксиапатита и элюировать очищенное антитело из смолы по меньшей мере одним элюэнтным буфером для гидроксиапатита.
В другом варианте реализации можно использовать комбинацию анионообменной хроматографии и хроматографии с применением протеина А, например, путем контактирования препарата с подложкой из протеина А обеспечить адсорбцию антитела на подложке из протеина А, промыть подложку из протеина А и адсорбированное антитело по меньшей мере одним промывным буфером протеина А, элюировать адсорбированное антитело по меньшей мере одним элюэнтным буфером для протеина А, обеспечить контакт элюата препарата А с ионообменной подложкой, пропустить антитело через ионообменную подложку, промыть ионообменную подложку по меньшей мере одним ионообменным промывным буфером, путем обмена ввести ионообменный поток в загрузочный буфер, содержащий от 1 до 20 мМ фосфата натрия и от 0,2 до 2,5 М NaCl, обеспечить контактирование ионообменного потока с гидроксиапатитовой смолой и промыть смолу по меньшей мере одним промывным буфером для гидроксиапатита.
В следующем варианте реализации используют анионообменную хроматографию и хроматографию с применением протеина А в комбинации с хроматографией с применением керамического гидроксиапатита. Анионообменную хроматографию и хроматографию с применением протеина А можно использовать в комбинации, например, путем контактирования препарата антитела с подложкой из протеина А обеспечить адсорбцию антитела на подложке, промыть подложку и адсорбированное антитело по меньшей мере одним промывным буфером для протеина А, элюировать адсорбированное антитело по меньшей мере одним элюэнтным буфером для протеина А, обеспечить контакт элюата препарата А с ионообменной подложкой, пропустить антитело через ионообменную подложку, промыть подложку по меньшей мере одним ионообменным промывным буфером, путем контактирования ионообменного потока с гидроксиапатитовой смолой обеспечить адсорбцию потока на смоле, обеспечить более плотное связывание HMWA, чем с мономером антитела, и по мере продолжения загрузки обеспечить вытеснение связанного мономера HMWA, промыть гидроксиапатитовую смолу по меньшей мере одним промывным буфером для гидроксиапатита и отобрать вытесненный мономер антитела.
Другие задачи и достоинства изобретения частично приведены следующем разделе описания, а частично будут очевидными из описания или могут быть установлены при практической реализации изобретения. Задачи изобретения решаются, а достоинства реализуются с помощью элементов и комбинаций, указанных, в частности, в прилагаемой формуле изобретения.
Следует понимать, что предшествующее общее описание и приведенное ниже подробное описание являются только иллюстративными и пояснительными и не ограничивают изобретения, соответствующего прилагаемой формуле.
Прилагаемые фигуры, являющиеся частью настоящей заявки, совместно с описанием служат для пояснения принципов изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 показывает невозможность известного способа элюирования с градиентом фосфата отделить HMWA от препарата анти-СDF-8-антитела.
Фигура 2 показывает, что применение элюирования с градиентом NaCl приводит к отделению большой части HMWA от препарата анти-GDF-8-антитела.
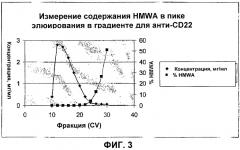
Фигура 3 показывает отделение HMWA от препарата анти-СD22-антитела при помощи хроматографии с сНА.
Фигура 4 показывает отделение HMWA от препарата анти-Аbeta-антитела при помощи хроматографии с сНА.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Определения
Для облегчения понимания настоящего изобретения вначале необходимо определить некоторые термины. Дополнительные определения приведены далее при подробном описании.
Термин "антитело" относится к любому иммуноглобулину или его фрагменту и включает все полипептиды, содержащие антигенсвязывающий сайт. Термин включает, в частности, но без ограничения, поликлональные, моноклональные, моноспецифические, полиспецифические, неспецифические, гуманизированные, человеческие, одноцепочечные, химерные, синтетические, рекомбинантные, гибридные, мутированные, привитые и полученные in vitro антитела. Термин "антитело" включает также фрагменты антител, в частности, Fab, F(ab')2, Fv, scFv, Fd, dAb и другие фрагменты антител, которые сохраняют антигенсвязывающую функцию. Обычно такие фрагменты содержат антигенсвязывающий домен.
Антитела, которые можно очистить с помощью настоящего изобретения, включают также химически модифицированные формы, в частности, полученные в результате обработки полиэтиленгликолем, и слитые белки, содержащие иммуноглобулиновую группу. Антитело или его фрагмент можно выбрать из любых известных изотипов антител и их конформаций, например, мономеры IgA, IgG, IgD, IgE, IgM, димеры IgA, тримеры IgA или пентамеры IgM.
Термин "препарат антитела" относится к составу, содержащему антитело и/или нежелательные компоненты, в частности, агрегаты с высокой молекулярной массой указанного антитела.
Термин "керамический гидроксиапатит" или "сНА" относится к нерастворимому гидроксилированному фосфату кальция с формулой [Са10(РO4)6(ОН)2], который при спекании при высокой температуре принимает сферическую макропористую керамическую форму. Термин "сНА" включает, в частности, но без ограничения, керамический гидроксиапатит типа I и типа II. Если не указано иного, "сНА" относится к любому размеру частиц, включая, в частности, но без ограничения, 20, 40 и 80 мкм.
Термин "агрегаты с высокой молекулярной массой" или " HMWA" (high molecular weight aggregates) относится к соединению по меньшей мере двух антител. Соединение может быть образовано любым способом, включая, в частности, но без ограничения, ковалентные, не ковалентные, дисульфидные или не распадающиеся поперечные связи. По меньшей мере два антитела могут связываться с одинаковыми или различными антигенами. По меньшей мере два антитела могут иметь форму антитела, фрагмента антитела или другие формы, описанные в приведенном выше определении термина "антитело".
Термин "проточный режим" относится к режиму отделения препарата антитела, при котором по меньшей мере одно антитело, содержащееся в препарате, пропускают через хроматографическую смолу или подложку, при этом по крайней мере одно потенциально загрязняющее вещество или примесь связывается с хроматографической смолой или подложкой. Проточный режим можно использовать, например, в гидроксиапатитовой хроматографии и в ионообменной хроматографии.
Термин "режим связывания" относится к способу отделения препарата антитела, при котором по меньшей мере одно антитело, содержащееся в препарате, связывается с хроматографической смолой или подложкой, при этом по крайней мере одно загрязняющее вещество или примесь проходит насквозь. Режим связывания можно использовать, например, в гидроксиапатитовой хроматографии и в ионообменной хроматографии.
Б. Описание способа
Настоящее изобретение обеспечивает способы удаления агрегатов с высокой молекулярной массой (HMWA) из препаратов антител с помощью гидроксиапатитовой хроматографии в режиме связывания, в проточном режиме или в их комбинации. Настоящее изобретение применяется в условиях крупномасштабной очистки препаратов антител.
В режиме связывания способ использует гидроксиапатитовую подложку, загруженную фосфатом с нейтральным рН и низкой ионной силой, чтобы связать антитело и HMWA. Затем колонку промывают фосфатным буфером, чтобы удалить слабо связанные загрязнения. Далее антитело селективно вымывают с помощью фосфатного буфера с высокой ионной силой, содержащего от 0,2 до 2,5 М NaCl при рН от слабо кислотного до слабо щелочного. HMWA можно последовательно вымывать из смолы с помощью буфера с еще более высокой ионной силой и концентрацией фосфата при нейтральном рН. И, наконец, смолу можно регенерировать с помощью раствора гидроксида натрия и фосфата калия.
В проточном режиме препарат антитела с помощью буферного обмена переводят в загрузочный буфер, содержащий от 0,2 до 2,5 М NaCl при рН от слабо кислотного до слабо щелочного. Затем препарат антитела пропускают через колонку с гидроксиапатитом, при этом загрязнения, в частности, HMWA, связываются в колонке. Колонку можно последовательно промывать, чтобы обеспечить дополнительное протекание очищенного антитела через колонку. И, наконец, можно произвести десорбирование колонки и регенерацию с помощью раствора гидроксида натрия и фосфата калия.
В одном варианте реализации изобретения очищенное антитело содержит менее 5% HMWA, в другом варианте - менее 3% HMWA, и в третьем варианте - менее 1% HMWA.
1. Антитела
Препараты антитела согласно изобретению можно выделить из нескольких источников, включая, в частности, но без ограничения, сыворотку иммунизированных животных, асцитную жидкость, надосадочную жидкость гибридомы или миеломы, кондиционированную среду, полученную в результате культивирования рекомбинантной клеточной линии, которая экспрессирует молекулу антитела, и все клеточные экстракты клеток, образующих антитела. В одном варианте реализации изобретения производят очистку антител от среды кондиционированной клеточной культуры множества рекомбинантных клеточных линий, образующих антитела. Исходя из данного описания, можно ожидать некоторых отличий для разных клеточных линий и различных продуктов антител, однако, компетенции рядового специалиста в данной области техники вполне достаточно, чтобы адаптировать настоящее изобретение к конкретной комбинации белка антитела и продуктивной клеточной линии.
Исключительно в иллюстративных целях данное изобретение применили для очистки нескольких антител изотипа IgG с основным рl. Более конкретно, данное изобретение применили к моноклональным анти-СDF-8-антителам, описанным в предварительной патентной заявке США №60/419, 964 (именуемым далее "Муо-29"), к моноклональным антителам, специфически активным к антигену CD22, описанным в патентной заявке США №10/428, 894 (именуемым далее "анти-СD22") и к моноклональным анти-Аbeta-антиген-антителам, описанным в международной патентной заявке PCT/US01/46587 (именуемым далее "анти-Abeta"). Структура рекомбинантных систем для получения антител Муо-29, CD22 и Abeta подробно описана в указанных заявках.
2. Гидроксиапатитовая смола
Серийно выпускаются различные гидроксиапатитовые смолы, при этом все доступные формы материала можно использовать для реализации настоящего изобретения. В одном из вариантов реализации изобретения используют гидроксиапатит в кристаллической форме. Гидроксиапатиты для применения согласно данному изобретению могут быть агломерированы для образования частиц и спечены при высоких температурах в стабильную пористую керамическую массу.
Размер частиц гидроксиапатита может изменяться в широких пределах, однако, типичный размер частиц составляет от 1 мкм до 1000 мкм в диаметре и может быть равным от 10 мкм до 100 мкм. В одном варианте реализации изобретения размер частиц составляет 20 мкм. В другом варианте реализации изобретения размер частиц составляет 40 мкм. И, наконец, в еще одном варианте реализации изобретения размер частиц составляет 80 мкм.
Для получения колонок с сНА можно использовать ряд хроматографических подложек. Наиболее широко применяют гидроксиапатит типа I и типа II. Тип I имеет высокую способность связывания белка и лучшую способность для кислых белков. Тип II имеет более низкую способность связывания белка, однако, лучшее разрешение для нуклеиновых кислот и некоторых белков. Материал типа II имеет также очень низкое сродство к альбумину и является особенно пригодным для очистки многих видов и классов иммуноглобулинов. Опытный специалист в данной области техники может оптимально выбрать конкретный тип гидроксиапатита.
Данное изобретение можно использовать с гидроксиапатитовой смолой, которая находится в свободной форме, загружена в колонку или содержится в хроматографе непрерывного годового действия. Опытный специалист может осуществить выбор размеров колонки. В одном из вариантов реализации изобретения для очистки в небольших объемах диаметр колонки может составлять по меньшей мере 0,5 см с высотой слоя около 20 см. В другом варианте реализации изобретения можно использовать диаметр колонки примерно от 35 см до примерно 60 см. И, наконец, в еще одном варианте реализации изобретения можно использовать диаметр колонки от 60 см до 85 см. В некоторых вариантах реализации для загрузки колонны при постоянной скорости потока примерно 4 см/мин или под действием силы тяжести можно использовать суспензию смолы керамического гидроксиапатита в растворе 200 мМ Na2HPO4 при рН 9,0.
2. (3?) Составы буферов и условия загрузки
Перед контактированием гидроксиапатитовой смолы с препаратом антитела может оказаться необходимым откорректировать такие параметры, как рН, ионная сила и температура, а в некоторых случаях - добавить различные вещества. Так, например, возможной операцией является уравновешивание гидроксиапатитовой матрицы путем ее промывки определенным раствором (например, буфером для корректировки рН, ионной силы и т.п., или для введения детергента) с целью обеспечения необходимых характеристик для очистки препарата антитела.
При сочетании режима связывания/проточного режима гидроксиапатитовой хроматографии гидроксиапатитовую матрицу уравновешивают и промывают специальным раствором, обеспечивая необходимые характеристики для очистки препарата антитела. В одном из вариантов реализации настоящего изобретения матрицу можно уравновесить с помощью раствора, содержащего от 0,01 до 2,0 М NaCl при рН от слабощелочного до слабокислотного. Так, например, уравновешивающий буфер в различных вариантах реализации изобретения может иметь содержание фосфата натрия от 1 до 20 мМ, от 1 до 10 мм, от 2 до 5 мМ, 2 мМ и 5 мМ. Содержание NaCl в уравновешивающем буфере в различных вариантах реализации изобретения может составлять от 0,01 до 2,0 М, от 0,025 до 0,5 М, 0,05 М и 0,1 М. рН загрузочного буфера в одном варианте реализации может находиться в пределах от 6,2 до 8,0, в другом - от 6,6 до 7,0 и в третьем - может быть равным 7,3. Уравновешивающий буфер иметь содержание аргинина в одном варианте реализации от 0 до 200 мМ, в другом - 120 мМ и в третьем -100 мМ. Уравновешивающий буфер иметь содержание HEPES в одном варианте реализации от 0 до 200 мМ, в другом - 20 мМ и в третьем - 100 мМ.
Можно также произвести буферный обмен препарата антитела для его введения в соответствующий буфер или в загрузочный буфер при подготовке к проточному режиму гидроксиапатитовой хроматографии. В одном варианте реализации изобретения препарат антитела с помощью буферного обмена может быть переведен в загрузочный буфер, содержащий от 0,2 до 2,5 М NaCl при рН от слабощелочного до слабокислотного. Так, например, загрузочный буфер может содержать от 1 до 20 мМ фосфата натрия, в другом варианте реализации он может содержать от 2 до 8 мМ фосфата натрия, в третьем - от 3 до 7 мМ и в четвертом - 5 мМ фосфата натрия. В одном варианте реализации загрузочный буфер может содержать от 0,2 до 2,5 М NaCl, в другом - от 0,3 до 1,0 М NaCl и в третьем - 350 мМ NaCl. рН загрузочного буфера может лежать в пределах от 6,4 до 7,6. В одном варианте реализации изобретения рН может составлять от 6,5 до 7,0, а в другом - 6,8.
Контактирование препарата антитела с гидроксиапатитовой смолой в режиме связывания, в проточном режиме или в их комбинации можно производить в колонке с фильтрующим слоем, в колонке с псевдоожиженным/расширяющимся слоем, содержащим матрицу из твердой фазы, и/или простом периодическим способом, когда матрицу из твердой фазы смешивают с раствором в течение определенного времени.
После контактирования гидроксиапатитовой смолы с препаратом антитела можно провести факультативную операцию промывки. Однако, в некоторых случаях, когда очень высокая чистота иммуноглобулина не является критичной или не требуется дополнительного проточного пропускания антитела, процедуру промывки можно опустить в целях сокращения технологического процесса и экономии промывного раствора. Используемые промывные буферы зависят от природы гидроксиапатитовой смолы, применяемого режима гидроксиапатитовой хроматографии и, следовательно, могут быть определены рядовым специалистом в данной области техники. В проточном режиме и в сочетании режима связывания и проточного режима поток очищенного антитела, полученный после возможной промывки колонки, можно объединить с другими фракциями очищенного антитела.
В режиме связывания антитело можно элюировать из колонки после факультативной операции промывки. Для элюирования антитела из колонки согласно настоящему изобретению используют фосфатный буфер с высокой ионной силой, содержащий примерно от 0,2 до 2,5 М NaCl при рН от слабокислотного до слабощелочного. Так, например, буфер для элюирования может содержать от 1 до 20 мМ фосфата натрия, в другом варианте - от 2 до 8 мМ фосфата натрия, в третьем варианте - от 2 до 6 мМ, в четвертом варианте -3 мМ и в пятом варианте - 5 мМ фосфата натрия. Буфер для элюирования может содержать от 0,2 до 2,5 М NaCl, в одном варианте - от 0,2 до 1,5 М NaCl, в другом варианте - от 0,3 до 1,1 М NaCl, в третьем варианте - 1,0 М NaCl и в четвертом варианте - 0,35 М NaCl. рН буфера для элюирования может составлять от 6,4 до 7,6. В одном варианте реализации рН может составлять от 6,5 до 7,3, в другом варианте реализации - 7,3, в третьем варианте реализации - 7,2 и в четвертом варианте реализации - 6,8. Для элюирования антитела из колонки буфер для элюирования может изменяться с непрерывным или ступенчатым градиентом.
В режиме связывания, в проточном режиме и в их сочетании матрицу из твердой фазы можно очистить, т.е подвергнуть десорбционной обработке, и регенерировать после элюирования или пропускания антитела. Эту процедуру обычно проводят регулярно, чтобы минимизировать накопление загрязнений на поверхности твердой фазы и/или стерилизовать матрицу во избежание загрязнения продукта микроорганизмами.
Компоненты буфера можно корректировать в соответствии со знаниями рядовых специалистов в данной области техники. Пределы содержания компонентов и рН в примерах буферов для режима связывания, проточного режима и их комбинации приведены в таблице 1, таблице 2 и таблице 3, соответственно. Не все буферы или операции являются обязательными, но указаны только в качестве иллюстрации. Так, например, может оказаться необязательным использовать две отдельных операции уравновешивания, а также может быть необязательным десорбировать, регенерировать или сохранять гидроксиапатитовую смолу. Высокопродуктивный скрининг, описанный в примере 11, можно использовать для эффективной оптимизации параметров буфера для колоночной хроматографии с применением сНА.
| Таблица 1. Пределы состава компонентов в примерах буферов для режима связывания | ||
| Буфер | Пределы содержания компонентов и рН | Примеры составов |
| Уравновешивание 1 | От 10 до 500 мМ фосфата натрия 1,0 M NaCl рН от 6,4 до 7,4 | 0,3 мМ фосфата натрия 1,0 М NaCl рН 6,8 |
| Уравновешивание 2 | От 1 до 20 мМ фосфата натрия от 0 до 200 мМ NaCl рН от 6,4 до 7,4 | 5,0 мМ фосфата натрия 50 мМ NaCl рН 7,2 |
| Промывка | От 1 до 20 мМ фосфата натрия От 0 до 200 мМ NaCl рН от 6,4 до 7,4 | 5,0 мМ фосфата натрия 50 мМ NaCl рН 7,2 |
| Элюирование | От 1 до 20 мМ фосфата натрия От 0 до 200 мМ NaCl рН от 6,4 до 7,4 | 5,0 мМ фосфата натрия 350 мМ NaCl рН 6,8 или 35,0 мМ фосфата натрия 1,0 М NaCl рН 7,2 |
| Десобрция | От 10 мМ до 500 мМ фосфата натрия 1,О М NaCl рН от 6,4 до 7,4 | 0,3 мМ фосфата натрия 1,0 М NaCl рН 6,8 |
| Регенерация | От 0,5 до 1,0 М фосфата калия 1,0 М NaOH | 0,5 мМ фосфата калия 1,0 М NaOH |
| Хранение | От 10 до 50 мМ NaOH | 20 мМ NaOH |
| Таблица 2. Пределы состава компонентов в примерах буферов для проточного режима | ||
| Буфер | Пределы содержания компонентов и рН | Примеры составов |
| Уравновешивание 1 | От 10 до 500 мМ фосфата натрия 1,0 М NaCl рН от 6,4 до 7,4 | 0,3 мМ фосфата натрия 1,0 М NaCl рН 6,8 |
| Уравновешивание 2 | От 1 до 20 мМ фосфата натрия От 0,2 до 2,5 М NaCl рН от 6,4 до 7,6 | 5,0 мМ фосфата натрия 350 мМ NaCl рН 6,8 |
| Загрузочный буфер | От 1 до 20 мМ фосфата натрия От 0,2 до 2,5 М NaCl рН от 6,4 до 7,6 | 5,0 мМ фосфата натрия 350 мМ NaCl рН 6,8 |
| Промывка | От 1 до 20 мМ фосфата натрия От 0,2 до 2,5 М NaClрН от 6,4 до 7,6 | 5,0 мМ фосфата натрия 350 мМ NaClрН 6,8 |
| Десорбция | От 10 мМ до 500 мМ фосфата натрия 1,0 M NaCl рН от 6,4 до 7,4 | 0,3 мМ фосфата натрия 1,0 M NaCl рН 6,8 |
| Регенерация | От 0,5 до 1,0 М фосфата калия 1,0 M NaOH | 0,5 мМ фосфата калия 1,0 М NaOH |
| Хранение | От 10 до 50 мМ NaOH | 20 мМ NaOH |
| Таблица 3. Пределы состава компонентов в примерах буферов для комбинации режима связывания/проточного режима | ||
| Буфер | Пределы содержания компонентов и рН | Примеры составов |
| Уравновешивание 1 | От 10 до 500 мМ фосфата натрия 1,0 M NaCl рН от 6,4 до 7,4 | 0,3 мМ фосфата натрия 1,0 M NaCl рН 6,8 |
| Уравновешивание 2 | От 1 до 20 мМ фосфата натрия От 0,01 до 2,0 М NaCl От 0 до 200 мМ аргинина От 0 до 200 мМ HEPES рН от 6,2 до 8,0 | 2,0 мМ фосфата натрия 50 мМ NaCl 100 мМ аргинина 100 мМ HEPES рН 7,3 или 5,0 мМ фосфата натрия 100 мМ NaCl 120 мМ аргинина 20 мМ HEPES рН 7,3 |
| Промывка | От 1 до 20 мМ фосфата натрия От 0,01 до 2,0 М NaCl От 0 до 200 мМ аргинина От 0 до 200 мМ HEPES рН От 6,2 до 8,0 | 2,0 мМ фосфата натрия 50 мМ NaCl 100 мМ аргинина 100 мМ HEPES рН 7,3 или 5,0 мМ фосфата натрия 100 мМ NaCl 120 мМ аргинина 20 мМ HEPES рН 7,3 |
| Десорбция | От 10 мМ до 500 мМ фосфата натрия 1,0 М NaCl рН от 6,4 дДО 7,4 | 0,3 мМ фосфата натрия 1,0 М NaClрН 6,8 |
| Регенерация | От 0,5 до 1,0 М фосфата калия 1,0 M NaOH | 0,5 мМ фосфата калия 1,0 M NaOH |
| Хранение | От 10 до мМ NаОН | 20 мМ NaOH |
В одном варианте реализации изобретения загрузку в смолу сНА можно производить при уровне загрузки ≤20 мг/мл и исходном содержании агрегатов в загрузке ≤40% HMWA. В некоторых других вариантах реализации изобретения можно использовать уровень загрузки от 1,8 до 10,4 мг/мл с исходным содержанием агрегатов в загрузке около 15%.
В еще одном варианте реализации изобретения смолу сНА загружают при уровне загрузки по меньшей мере 20 мг/мл и исходном содержании агрегатов в загрузке 5 40% HMWA. В некоторых других вариантах реализации изобретения можно использовать уровень загрузки от 30 до 40 мг/мл с исходным содержанием агрегатов в загрузке около 27%.
3. (4?) Дополнительные возможные операции
Установлено, что для отделения мономерных IgG от агрегатов гидроксиапатитовую хроматографию можно использовать отдельно, однако, как указано выше, способ очистки согласно изобретению можно использовать в сочетании с другими способами очистки белков. В одном из вариантов реализации изобретения одна или несколько операций, предшествующих гидроксиапатитовой хроматографии, могут оказаться желательными для снижения уровня загрузки загрязняющих веществ или примесей. В другом варианте реализации изобретения одна или несколько операций очистки после гидроксиапатитовой хроматографии могут оказаться желательными для дополнительного удаления загрязнений или примесей.
Описанную процедуру очистки с помощью сНА можно комбинировать с другими способами очистки, включая, в частности, но без ограничения, хроматографию с протеином А, аффинную хроматографию, хроматографию гидрофобного взаимодействия, аффинную хроматографию с иммобилизацией металла, эксклюзионную хроматографию, диафильтрацию, ультрафильтрацию, фильтрацию для удаления вирусов и/или ионообменную хроматографию.
В одном из вариантов реализации перед очисткой с помощью сНА можно предварительно очистить собранную среду, используя хроматографию с протеином А. Так, например, можно успешно применять PROSEP-A™ (Millipore, U.K.), который состоит из протеина А, ковалентно связанного со стеклом, имеющим контролируемую пористость. Другие полезные составы протеина А включают сефарозу протеина A FAST FLOW™ (Amersham Biosciences, Piscataway, NJ), TOYOPEARL™ 650M Protein A (TosoHaas Co., Philadelphia, PA) и колонки MABSELECT™ (Amersham Biosciences, Piscataway, NJ).
Перед очисткой с помощью сНА можно предварительно использовать ионообменную хроматографию. Для этого к матрице могут быть присоединены различные анионные или катионные заместители с целью получения анионных или катионных подложек для хроматографии. Анионные обменные заместители включают диэтиламиноэтил (DEAE), триэтиламиноэтилакриламид (ТМАЕ), четвертичный аминоэтил (QAE) и четвертичные аминные группы (Q). Катионные обменные заместители включают карбоксиметил (СМ), сульфоэтил (SE), сульфопропил (SP), фосфат (Р) и сульфонат (S). Whatman Ltd. Maidstone, Kent, U.K. поставляет целлюлозные ионообменные смолы, в частности, DE23, DE32, DE52, СМ-23, СМ-32 и СМ-52. Известны также ионообменные соединения на основе сефандекса с поперечными связями. Так, например, DEAE-, QAE-, CM- и SP-сефандекс, DEAE-, QAE-, CM- и SP-сефарозу и сефарозу поставляет Amersham Biosciences, Piscataway, NJ. Кроме того, TosoHaas Co., Philadelphia, PA, поставляет производный DEAE и CM сополимер этиленгликоля и метакрилата, в частности, TOYOPEARL™ DEAE-650S или М и TOYOPEARL™ CM-650S или М.
В одном варианте реализации изобретения ионообменную хроматографию можно использовать в режиме связывания или в проточном режиме.
В некоторых вариантах реализации изобретения сначала проводят хроматографию с протеином А, затем - ионообменную хроматографию и после этого хроматографию с сНА.
4. (5?)Удаление других загрязнений
Кроме удаления HMWA хроматография с применением сНА является полезной для удаления других загрязнений из препаратов антител. Другие загрязнения, которые могут быть удалены способами хроматографии с сНА согласно изобретению, включают, в частности, но без ограничения, ДНК, белок клетки-хозяина, адвентициальные вирусы и загрязнения протеина А, оставшиеся с предыдущих операций очистки.
В одном варианте реализации изобретение обеспечивает удаление протеина А из препарата антитела. В некоторых вариантах реализации настоящего изобретения содержание протеина А в конечном препарате можно существенно уменьшить, в частности, от 300 промилей до менее, чем 1 промиль.
С. Примеры
Следующие примеры приведены исключительно в иллюстративных целях.
Пример 1: очистка анти-GDF-S антитела
Способ очистки, описанный ниже, был разработан для моноклонального анти-GDF-8-антитела (называемого далее "Муо-29"). Антитело Муо-29 представляет собо