Такролимус для улучшенного лечения пациентов с трансплантатами
Иллюстрации
Показать всеОписывается способ обеспечения иммуносупрессивного лечения пациента в режиме один раз в сутки, предпочтительно пациента с трансплантатом почки или печени, путем введения пероральной таблетки с пролонгированным высвобождением. Таблетка включает от 0,1 до 15 мг такролимуса, гидроксипропилметилцеллюлозу, моногидрат лактозы, полиэтиленгликоль 6000, полоксамер 188, стеарат магния, винную кислоту, бутилированный гидрокситолуол и диметикон 350. Таблетка такролимуса высвобождает активное вещество с линейным профилем высвобождения нулевого порядка от момента времени 8 часов до момента времени 15 часов. Также она обеспечивает улучшенные фармакокинетические параметры, включая сниженные максимальные концентрации, несмотря на повышенную биодоступность, продленные периоды времени максимальной концентрации и более высокие минимальные концентрации по сравнению с традиционными лекарственными формами такролимуса. 9 н. и 9 з.п. ф-лы, 10 ил., 30 табл., 24 пр.
Реферат
РОДСТВЕННАЯ ЗАЯВКА США
По данной заявке испрашивается приоритет по предварительной заявке США № 61/079015, поданной 8 июля 2008 года, которая включена в настоящий документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к пероральной лекарственной форме с пролонгированным высвобождением, содержащей в качестве активного вещества такролимус или его фармацевтически активный аналог, для применения раз в сутки при иммуносупрессивном лечении пациента, нуждающегося в этом, причем эта лекарственная форма высвобождает активное вещество в течение значительно пролонгированного периода времени и обеспечивает in vivo высокую биодоступность и улучшенный фармакокинетический профиль по сравнению с традиционными лекарственными формами.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Такролимус, также известный как FK-506 или FR-900506, представляет собой активный ингредиент Prograf®, Protopic® и Advagraf®, одобренного European Agency for the Evaluation of Medicinal Products (EMEA) 23 апреля 2007 года. В процессе разработки Advagraf®, продукт был известен как MR4. Детальные характеристики Advagraf описаны в EPAR (European Public Assessment Reports) для медицинских продуктов, разрешенных для применения у человека, в том числе в документе Scientific Discussion, который EMEA сделал общедоступным после одобрения, и Product Information (обозначение, 25/01/2008 Advagraf-H-C-712-T-03), который включен в качестве ссылки. Такролимус (Prograf®) одобрен FDA в апреле 1994 года под NDA № 050708 для профилактики отторжения органов у пациентов, получивших аллогенные трансплантаты печени. Также он одобрен в Европейском Союзе, Японии, Канаде и Швейцарии и многих других странах под тем же торговым названием. Он одобрен для профилактики отторжения органов у пациентов, получивших аллогенные трансплантаты печени, почки или сердца. Согласно оценке 72% всех реципиентов трансплантатов почки и 89% всех реципиентов трансплантатов печени получают такролимус.
Такролимус, вводимый в качестве капсул Prograf®, проявляет значительную внутри- и межиндивидуальную изменчивость всасывания и метаболизма. Вследствие этой изменчивости стандартное дозирование не является точным предсказателем концентрации. При клиническом применении часто требуется коррекция доз такролимуса, основанная на мониторинге концентраций такролимуса в крови. Такролимус имеет форму белых кристаллов или кристаллического порошка. Он практически нерастворим в воде, легко растворим в этаноле и высоко растворим в метаноле и хлороформе.
Препарат такролимуса описан в EP-A-0184162, и аналоги такролимуса описаны, например, в EP-A-0444659 и US 6387918, оба из которых включены в качестве ссылок.
Такролимус представляет собой макролидное соединение с полезной иммуносупрессивной активностью, противомикробной активностью и другими фармакологическими видами активности и является ценным для лечения или профилактики реакций отторжения при трансплантации органов или тканей, реакций "трансплантат против хозяина", аутоиммунных заболеваний и инфекционных заболеваний.
Такролимус ингибирует активацию T-лимфоцитов, хотя точный механизм его действия неизвестен. Экспериментальные данные указывают на то, что такролимус связывается с внутриклеточным белком FKBP-12. Затем образуется комплекс такролимус-FKBP-12 с кальцием, кальмодулином и кальциневрином, и фосфатазная активность кальциневрина ингибируется. Этот эффект может предотвращать дефосфорилирование и транслокацию ядерного фактора активированных T-клеток - компонента ядра, предположительно инициирующего транскрипцию генов для образования лимфокинов. Конечным результатом является ингибирование активации T-лимфоцитов, т.е. иммуносупрессия.
Такролимус в значительной степени метаболизируется изоферментом CYP3A4 в стенке пищеварительного канала и печени. Изофермент CYP3A4 присутствует или экспрессируется во всех сегментах желудочно-кишечного тракта, в том числе в толстом кишечнике. Было выявлено, что на его всасывание отрицательно влияет одновременный прием пищи. Таким образом, скорость и степень всасывания такролимуса являются наибольшими в условиях натощак.
Известно, что такролимус индуцирует значительные побочные эффекты нефро- или нейротоксического происхождения, а также побочные эффекты в желудочно-кишечном тракте и другие побочные эффекты.
Всасывание такролимуса из желудочно-кишечного тракта после перорального введения является быстрым со средним временем до максимальной концентрации (Tmax) приблизительно 1-2 часа после введения здоровым субъектам или пациентам с трансплантированными почкой или печенью, однако оно является неполным и вариабельным. Биодоступность после перорального введения, как правило, составляет не более приблизительно 20%.
Часто наблюдаемыми побочными эффектами являются рвота и тошнота, однако также наблюдают такие побочные эффекты, как тремор, головная боль, гипертензия, дисфункция почек, гиперкалиемия, гипомагниемия, гипергликемия, бессонница, диарея, запор, боль в животе, нефротоксичность и нейротоксичность.
Для перорального введения такролимус обычно изготавливают и поставляют на рынок в качестве мягких желатиновых капсул, содержащих эквивалент 0,5, 1 или 5 мг безводного такролимуса, и его поставляют на рынок под торговым названием Prograf®. Рекомендованная начальная пероральная доза для пациентов составляет приблизительно от 0,1 до 0,2 мг/кг/сутки. Доза нацелена на определенный минимальный уровень в плазме от приблизительно 5 до приблизительно 20 нг/мл. Prograf® показан для профилактики отторжения органов у пациентов, получивших аллогенные трансплантации печени или почки. Подробное описание клинической фармакологии, фармакокинетики и клинических испытаний представлено на ярлыке, одобренном FDA от 04/27/2006 для Prograf®, NDA № 50708, который включен в качестве ссылки.
Остается необходимость в новых содержащих такролимус фармацевтических композициях и/или лекарственных формах, проявляющих повышенную биодоступность и улучшенные фармакокинетические свойства. Повышенная биодоступность в комбинации с пролонгированным высвобождением состава может позволить уменьшить прием лекарственных единиц пациентом, например, вплоть до одной дозы раз в сутки без риска недостаточного клинического эффекта вследствие низких доз в последней части интервала между введениями доз. Более того, могут значительно снижаться флуктуации в профиле концентрации в плазме по отношению ко времени. Кроме того, повышенная биодоступность также может приводить к более воспроизводимому (т.е. менее изменчивому по сравнению с Prograf®) профилю высвобождения.
Составы такролимуса с замедленным высвобождением описаны в WO99/49863 (Fujisawa Pharmaceutical Co.), в частности, признанной в качестве патентов США № US 6440458, US 6576259 и US 6884433, касающихся состава, где время растворения 63,2% (величина T63,2%) такролимуса составляет от 0,7 до 15 часов. Однако состав, где 63,2% высвобождается в течение 42 минут, по-видимому, только немного отличается от общепринятого состава такролимуса с немедленным высвобождением, в случае которого в течение 30 минут высвобождается 68,4%. Утверждается, что, когда состав имеет значение T63,6 более 15 часов, высвобождение активного ингредиента является настолько замедленным, что активный ингредиент выводится из организма до достижения эффективной концентрации в крови. Наиболее предпочтительным вариантом осуществления является состав с непрерывным высвобождением с величиной T63,6, составляющей 2-5 часов. Все составы, полученные согласно примерам данной заявки, имеют величину T63,6% от 1,9 (состав с наиболее быстрым высвобождением) до 8,2 часа для состава с наиболее медленным высвобождением. Кроме того, утверждается, что такролимус превосходно всасывается, и варьирование его всасываемости снижается благодаря составам с непрерывным высвобождением. В примерах этих документов повышенной биодоступности достигают для всех протестированных составов. Величины T63,6%, описанные для этих составов, составляют 3,0, 3,3, 2,0 и 2,5, соответственно.
В патентной заявке WO 2005/020993 авторы изобретения настоящей заявки также протестировали различные составы такролимуса у собак породы бигль и у карликовых свиней, однако показали, что как таблетка с быстрым высвобождением (пример 18), так и таблетка с медленным высвобождением (пример 19) могут приводить к повышенной биодоступности по сравнению с Prograf®. Это указывает на то, что повышенная биодоступность может быть связана с наличием такролимуса в лекарственной форме в растворенном состоянии, что также следует из WO 2005/020994 тех же авторов изобретения, касающейся твердых дисперсий, содержащих такролимус. Традиционный продукт с быстрым высвобождением Prograf® содержит такролимус в физической смеси HPMC, лактозы, кроскармеллозы натрия, как описано в примере 31 WO99/49863, указанной выше и принадлежащей Fujisawa Pharmaceutical Co. (в настоящее время Asteilas), которая разработала Prograf®.
Одна из основных проблем с модифицированными лекарственными формами или лекарственными формами с пролонгированным высвобождением состоит в трудности достижения достаточного всасывания в нижней части желудочно-кишечного тракта, поскольку пероральные лекарственные формы, попадающие в толстый кишечник, могут легко экскретироваться до существенного высвобождения. Высвобождение, как правило, снижается вследствие недостатка жидкостей и физического взаимодействия лекарственных форм при возрастающем содержании твердых веществ в толстом кишечнике. Кроме того, поверхность всасывания в несколько раз меньше, чем поверхность всасывания в тонком кишечнике, и этот фактор повышает время, в течение которого высвобожденные активные вещества подвергаются возможной деградации и включению в твердые вещества, присутствующие в толстом кишечнике.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Общепризнано, что чрезмерное пролонгирование высвобождения может серьезно повлиять на биодоступность, даже в случае веществ, предположительно имеющих хорошую проникающую способность в толстом кишечнике. Для веществ, являющихся субстратами для CYP3A4, в нижнем отделе желудочно-кишечного тракта можно ожидать преимущества с точки зрения биодоступности в виде меньшей концентрации метаболизирующих ферментов. С другой стороны, относительно более высокая концентрация транспортной системы, P-гликопротеинов, в нижнем отделе желудочно-кишечного тракта обычно противодействует эффекту низкой концентрации ферментов CYP3A4, поскольку молекулы, которые проникают в энтероцит, транспортируются переносчиком обратно в просвет кишечника. Такролимус является известным субстратом для этих механизмов: как для метаболизма CYP3A4, так и для системы переносчика P-гликопротеина. Таким образом, повышенную биодоступность нельзя коррелировать с продлением высвобождения простым линейным образом. Высвобождение можно с осторожностью адаптировать до данного уровня, учитывая несколько противодействующих факторов. В толстом кишечнике эти факторы включают более низкие площади всасывания, более низкое содержание жидкости, более высокое содержание твердых веществ, бактериальную деградацию, более высокое влияние транспортной системы P-гликопротеина, более низкую подвижность, отличия в слизистом барьере и/или составе слизи и отличия в pH вдоль толстого кишечника по сравнению с тонким кишечником. Таким образом, контроль и расчет времени высвобождения in vivo пролонгированной лекарственной формы для получения предсказуемого высвобождения в различных физических условиях, присутствующих вдоль желудочно-кишечного тракта, является трудным, особенно учитывая, что иммуносупрессивное лечение у пациентов с трансплантатами требует концентраций в крови в очень узких пределах для баланса эффективности (отсутствия отторжения) и побочных эффектов (инфекции, нефротоксичность, метаболическое и сердечно-сосудистое заболевание, и т.д.). Предоставление улучшенного состава для лечения один раз в сутки, где высвобождение является пролонгированным до точного уровня, где конечные фармакокинетические параметры являются полностью оптимизированными без риска для безопасности, т.е. если изменчивость важных фармакокинетических параметров у пациента или между пациентами является высокой, если корреляция между минимальной концентрацией и биодоступностью отсутствует, является ключевым фактором при лечении лекарственным средством с узким терапевтическим индексом, таким как такролимус, где неуспех лечения тесно связан с отторжением органа, и коррекцию дозы необходимо проводить безопасным способом. Следующие факторы, снижающие вероятность клинического успеха состава для введения один раз в сутки при трансплантации органа, включают высокую частоту осложнений в желудочно-кишечном тракте, влияющих на параметры желудочно-кишечного тракта, включающие время прохождения, pH, бактериальный состав и другие функции пищеварительной системы. Эти осложнения включают тошноту, рвоту и очень часто диарею.
Таким образом, авторы настоящего изобретения неожиданно обнаружили, что лекарственная форма, которая высвобождает такролимус в течение значительно пролонгированного и контролируемого периода времени, способна доставлять такролимус in vivo таким образом, чтобы такролимус в то же время достаточно всасывался, чтобы было понятно, что такролимус не утрачивается в нижнем отделе желудочно-кишечного тракта, причем высвобождение является достаточно медленным для обеспечения очень низкой скорости всасывания, в результате чего максимальная концентрация контролируется на более низком уровне, а минимальная концентрация возрастает, обеспечивая эффективность лечения в течение полного интервала между введением доз, составляющим 24 часа. Очень важно, что минимальная концентрация, достигаемая через 24 часа после введения состава с пролонгированным высвобождением по настоящему изобретению, является высоко предсказуемой, и, таким образом, ее можно использовать в качестве маркера общей биодоступности, поскольку достигается высокая корреляция между минимальной концентрацией и фактической биодоступностью, наблюдаемой в предыдущие 24 часа перед измерением минимальной концентрации. Таким образом, минимальную концентрацию можно безопасно использовать в качестве инструмента для дозирования и коррекции в процессе лечения.
Полагают, что общепринятые способы растворения in vitro коррелируют с истинным модифицированным профилем высвобождения in vivo у человека или по меньшей мере отражают его. Таким образом, ожидается, что отличие в скорости высвобождения in vitro между двумя протестированными составами в одних и тех же условиях отражает отличие в скорости высвобождения in vivo. Однако могут существовать исключения, если, например, один состав имеет зависимое от pH высвобождение, а другой имеет независимое от pH высвобождение, и истинные значения pH для тестирования не выбраны для выявления таких отличий. Понятным примером является случай тестирования покрытого желудочно-резистентным покрытием состава при высоких pH: он обеспечивает немедленное высвобождение in vitro и замедленное высвобождение in vivo. Кроме того, при сравнении двух пролонгированных составов с различными механизмами высвобождения, например, механизмом осмотического высвобождения относительно зависимого от деградации механизма высвобождения, одинаковые профили высвобождения in vitro для двух продуктов теоретически могут привести к отличающимся профилям in vitro, однако снижение или повышение скорости растворения может отражаться in vivo для каждого продукта. Таким образом, пока не доказано обратное и предоставленные способы проводят согласно предписанию фармакопей, общепринятые способы растворения являются пригодными инструментами для дифференциации между составами и соответствующими свойствами in vivo. В соответствии с этим, настоящее изобретение относится, в его первом аспекте, к пролонгированной лекарственной форме, содержащей в качестве активного вещества такролимус или его фармацевтически активный аналог для иммуносупрессивного лечения раз в сутки пациента, нуждающегося в этом, которая высвобождает активное вещество в течение значительно пролонгированного периода времени. В следующем аспекте высвобождение характеризуется высвобождением по существу нулевого порядка для основной части высвобождения.
Общепринятые способы растворения in vitro включают способы, описанные в The United States Pharmacopeia (USP), официальном общедоступном устанавливающем стандарты авторитетном источнике для всех прописываемых и продаваемых без рецепта лекарственных средств в США, и в сходных фармакопеях Европы и Японии. Предпочтительные способы включают способ растворения I USP (корзина) и способ II (лопасть) при 50 об/мин, с использованием HPC для предотвращения прилипания лекарственного средства к оборудованию и при pH 4,5 из соображений стабильности. Поскольку такролимус не протонирован, pH не влияет на растворимость этого лекарственного средства, однако изменение pH может иметь значение в случае, когда в составе используют чувствительные к pH неактивные эксципиенты, поскольку pH 4,5 не является pH, обычно имеющемся в желудочно-кишечном тракте. Таким образом, может быть актуальным описание степени пролонгирования высвобождения с помощью альтернативных способов растворения. Кроме того, пролонгированный состав можно соответственно далее охарактеризовывать дополнительными способами растворения, среди прочих, способами с различными скоростями вращения, различными величинами pH, использованием сред для растворения, имитирующих условия желудочно-кишечного тракта (например, имитация состояния натощак и состояния сытости, среды FaSSIP и FeSSIP), применение добавок в среду для растворения, таких как SLS, для повышения смачиваемости или растворимости такролимуса, в результате чего общее измеренное время растворения снижается (скорость растворения возрастает).
Авторы изобретения открыли, что биодоступность такролимуса значительно возрастает, и фармакокинетические параметры по существу улучшаются, когда такролимус вводят млекопитающему в композиции с пролонгированным высвобождением, где высвобождение и время высвобождения активного ингредиента, т.е. профиль высвобождения in vitro и in vivo, являются пролонгированными до более чем 15 часов при измерении общепринятыми способами растворения, используемыми для лекарственных форм такролимуса, и при измерении in vivo с помощью фармакокинетических параметров, имеющих клиническое значение и значение для подтверждения пролонгирования высвобождения in vivo. Эти фармакокинетические параметры включают: значительно пролонгированное время до достижения максимальной концентрации; низкие максимальные концентрации; высокие минимальные концентрации, пролонгированное среднее время нахождения и в то же время сохранение удивительно высокой биодоступности и превосходной корреляции между минимальными концентрациями и биодоступностью.
Пролонгированное высвобождение определяют по высвобождению самое большее 63,5% содержимого активного вещества в момент времени через 12 часов, определенному по растворению in vitro и при тестировании в соответствии с тестом растворения USP II (лопасть) или тестом растворения USP I (корзина) в среде, имеющей pH 4,5 и содержащей 0,005% гидроксипропилцеллюлозы, и при вращении 50 об/мин. В другом аспекте высвобождение самое большее 63,5% активного вещества в момент времени через 12 часов сочетается с высвобождением по меньшей мере 8% через 4 часа и/или по меньшей мере 15% через 8 часов для обеспечения непрерывного высвобождения на протяжении интервала дозирования. Если на протяжении нескольких часов после введения высвобождения не происходит, пациент имеет риск, что концентрация такролимуса в крови продолжит снижаться до величины ниже желаемого терапевтического нижнего предела на несколько часов из 24-часового интервала дозирования.
В других аспектах изобретение относится к применению композиции с пролонгированным высвобождением для более безопасного иммуносупрессивного лечения вследствие улучшенного фармакокинетического профиля, достигнутого у здоровых субъектов и пациентов и продемонстрированного несколькими фармакокинетическими испытаниями однократных доз и фармакокинетических испытаний стационарного состояния по сравнению с общепринятыми коммерчески доступными лекарственными формами. Безопасное иммуносупрессивное лечение по изобретению также относится к конкретному режиму дозирования для перехода с лечения Prograf® два раза в сутки, где переход осуществляют с помощью дозировки в соотношении 1:0,66-0,80 (согласно наиболее близкой доступной дозировке таблетки). Такой режим дозирования приводит к сравнимым средним концентрациями в крови в течение интервала дозирования при измерении до и после перехода, а также к сходной с Prograf® биоэквивалентной экспозиции, исходя из других параметров, таких как AUC и минимальная концентрация.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
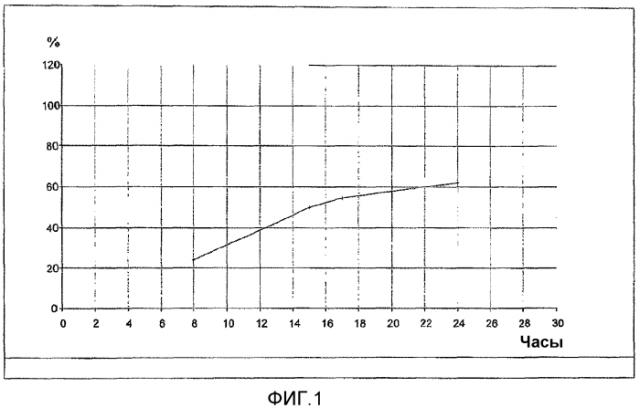
На фиг.1 представлено растворение состава с пролонгированным высвобождением по изобретению, тестированное способом в соответствии с тестом растворения USP II (лопасть) в среде, имеющей pH 4,5 содержащей 0,005% гидроксипропилцеллюлозы, и при вращении 50 об/мин.
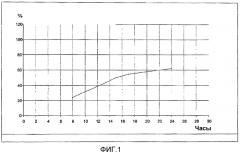
На фиг.2 представлена сцинтиграфическая оценка области высвобождения при использовании состава с пролонгированным высвобождением согласно параметрам исследования 003. На фигуре показано, что высвобождение in vivo состава в соответствии с настоящим изобретением является пролонгированным до той степени, что всасывание происходит в толстом кишечнике субъекта.
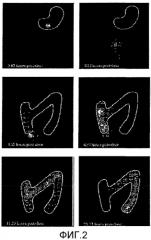
На фиг.3 представлены концентрации в крови такролимуса в исследовании однократной дозы натощак у здоровых добровольцев. Закрашенные треугольники обозначают концентрацию для 5-мг состава по настоящему изобретению, звездочками обозначен 5-мг состав Prograf®; незакрашенными кругами обозначен 2-мг состав по настоящему изобретению; закрашенными прямоугольниками обозначено введение 2×2 мг в соответствии с настоящим изобретением; закрашенными ромбами обозначено введение 4×1 мг Prograf®; вертикальная линия обозначает введение 2×1 мг Prograf®. Исследование описано в таблице A настоящего документа в качестве исследования 002.
На фиг.4 представлено растворение предпочтительного состава по изобретению, имеющего композицию, сходную с композицией, описанной в примере 20. Треугольниками изображено введение 1-мг состава, прямоугольниками обозначено введение 2-мг состава. Кроме того, представлено растворение коммерческого продукта Advagraf®, используемого для сравнения в примере 20, где звездочки относятся к 0,5 мг, кресты относится к 1 мг, а круги относится к 5 мг продукта Advagraf®. Высвобождение измеряют в процентах растворенного продукта с течением времени, указанного в часах. Используемый способ растворения представляет собой способ тестирования растворения USP II (лопасть) в среде, доведенной до pH 4,5, содержащей 0,005% гидроксипропилцеллюлозы, и при вращении 50 об/мин.
На фиг.5 представлены профили в крови в стационарном состоянии, полученные до перехода (Prograf®, стационарное состояние на 7 сутки) и после перехода на 14 сутки и 21 сутки на состав с пролонгированным высвобождением в соответствии с настоящим изобретением у пациентов со стабильной печенью. Квадратами обозначен Prograf® два раза в сутки на 7 сутки, кругами обозначен LCP-Tacro раз в сутки на 17 сутки, и ромбами обозначен LCP-tacro один раз в сутки на 21 сутки. Подробное описание исследования приведено в настоящем документе в примере 19. Профили демонстрируют истинные профили после перехода на более низкую дозу состава по изобретению.
На фиг.6 представлены скорректированные по дозе профили устойчивого состояния, показанные на фиг.5.
На фиг.7 представлен PK-профиль таблеток LCP-Tacro по сравнению с капсулами Advagraf® в стационарном состоянии натощак.
На фиг.8 представлены концентрации в плазме крови после введения одной и той же единичной дозировки такролимуса в качестве 2×1-мг капсул Advagraf®, обозначенных незакрашенными кругами, и в качестве 2-мг таблеток LCT-Tacro по настоящему изобретению. Исследование описано в примере 20.
На фиг.9 описаны профили в крови в стационарном состоянии, полученные до перехода (Prograf®, стационарное состояние на 7 сутки) и после перехода на 14 сутки и 21 сутки на состав с пролонгированным высвобождением в соответствии с настоящим изобретением у пациентов со стабильной печенью. Квадратами обозначен Prograf® два раза в сутки на 7 сутки, кругами обозначен LCP-Tacro раз в сутки на 17 сутки, и ромбами обозначен LCP-tacro один раз в сутки на 21 сутки. Подробное описание исследования приведено в настоящем документе в примере 19. Профили соответствуют истинным профилям после перехода на более низкую дозу состава по изобретению.
На фиг.10 представлены скорректированные по дозе профили стационарного состояния, показанные на фиг.9.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Как используют в настоящем документе, термин "активный ингредиент" или "активный фармацевтический ингредиент" означает любой компонент, который предназначен для обеспечения фармакологической активности или другого прямого эффекта при диагностике, устранении, смягчении, лечении или профилактике заболевания, или для влияния на структуру или любую функцию организма человека или других животных. Термин включает компоненты, которые могут претерпевать химическое изменение при изготовлении лекарственного продукта, и они присутствуют в лекарственном продукте в модифицированной форме, предназначенной для обеспечения определенной активности или эффекта.
В контексте настоящего изобретения термин "гидрофильный" описывает, что что-либо "любит воду", т.е. гидрофильная молекула или часть молекулы представляет собой молекулу, которая, как правило, является электрически поляризованной и способна образовывать водородные связи с молекулами воды, что позволяет ей растворяться более легко в воде, чем в масле или других "неполярных" растворителях.
В контексте настоящего изобретения термин "амфифильный" обозначает молекулу (такую как молекула поверхностно-активного вещества), имеющую полярную растворимую в воде группу, связанную с нерастворимой в воде углеводородной цепью. Таким образом, один конец молекулы является гидрофильным (полярным), а другой конец является гидрофобным (неполярным).
В контексте настоящего изобретения термин "гидрофобный" обозначает соединение, имеющее тенденцию к тому, чтобы быть электрически нейтральным или неполярным, и, таким образом, предпочитающее другие нейтральные и неполярные растворители или молекулярное окружение.
Как используют в настоящем документе, термин "носитель" означает любую жидкость растворителя или носителя в фармацевтическом продукте, которая не имеет фармакологической роли. Например, вода представляет собой носитель для ксилокаина, и пропиленгликоль является носителем для многих антибиотиков.
В контексте настоящего изобретения термин "твердая дисперсия" обозначает лекарственное средство или активный ингредиент или вещество, диспергированное до уровня частиц в инертном наполнителе, носителе, разбавителе или матрице в твердом состоянии, т.е. обычно дисперсию мелких частиц.
В контексте настоящего изобретения термин "твердый раствор" обозначает лекарственное средство или активный ингредиент или вещество, растворенное на молекулярном уровне в инертном наполнителе, носителе, разбавителе или матрице в твердом состоянии.
Как используют в настоящем документе, термин "аналог" обозначает химическое соединение, которое структурно напоминает другое химическое соединение.
Термин "лекарственное средство" означает соединение, предназначеное для применения в диагностике, устранении, смягчении, лечении или профилактике заболевания у человека или других животных.
В этом контексте термин "лекарственная форма" означает форму, в которой лекарственное средство доставляют пациенту. Она может представлять собой парентеральную форму, местную форму, таблетку, пероральную форму (жидкость или растворенный порошок), суппозиторий, ингаляционную форму, трансдермальную форму и т.д.
Как используют в настоящем документе, термин "биодоступность" означает степень, с которой лекарственное средство или другие вещества становятся доступными ткани-мишени после введения.
Как используют в настоящем документе, термин "биоэквивалентность" обозначает научную основу для сравнения дженериков и зарегистрированных лекарственных средств друг с другом. Например, лекарственные средства являются биоэквивалентными, если они проникают в кровоток с одинаковой скоростью при введении в сходных дозах в сходных условиях. Параметры, часто используемые в исследованиях биоэквивалентности, представляют собой Tmax, Cmax, AUC0-∞, AUC0-t. Другими важными параметрами могут быть W50, W75 и/или MRT. Таким образом, по меньшей мере один из этих параметров можно использовать при определении существования биоэквивалентности. Более того, в контексте настоящего изобретения две композиции считают биоэквивалентными, если значение используемого параметра составляет 80-125% от значения для Prograf® или сходного коммерчески доступного содержащего такролимус продукта, используемого в тесте.
В контексте настоящего изобретения Tmax обозначает время до достижения максимальной концентрации в плазме (Cmax) после введения; AUC0-∞ обозначает площадь под кривой концентрации в плазме по отношению ко времени от 0 момента времени до бесконечности; AUC0-t обозначает площадь под кривой концентрации в плазме по отношению ко времени от 0 момента времени до момента времени t; W50 обозначает время, когда концентрация в плазме составляет 50% или более от Cmax; W75 обозначает время, когда концентрация в плазме составляет 75% или более от Cmax; и MRT обозначает среднее время нахождения для такролимуса (и/или его аналога). Максимальное отклонение обозначает (Cmax-Cmin)/Cmin, и флуктуация обозначает (Cmax-Cmin)/Cсредняя. Флуктуация пригодна для сравнения лекарственных форм, обеспечивающих различную биодоступность.
В этом контексте термин "лекарственное вещество" означает соединение, используемое для лечения заболевания, повреждения или боли. Лекарственные вещества справедливо разделяют на "профилактические", т.е. для сохранения здоровья, и "терапевтические", т.е. для восстановления здоровья.
В контексте настоящего изобретения подразумевают, что термины "контролируемое высвобождение" и "модифицированное высвобождение" являются эквивалентными терминами, охватывающими любой тип высвобождения такролимуса из композиции по изобретению, который пригоден для достижения конкретного терапевтического или профилактического ответа после введения субъекту. Специалисту в данной области известно, как контролируемое высвобождение/модифицированное высвобождение отличается от высвобождения обычных таблеток или капсул. Термины "высвобождение контролируемым образом" или "высвобождение модифицированным образом" имеют то же значение, которое указано выше. Термины включают замедленное высвобождение (которое приводит к более низкой Cmax и более позднему Tmax, однако t1/2 не меняется), пролонгированное высвобождение (которое приводит к более низкой Cmax, более позднему Tmax, но кажущееся t1/2 продлевается), отсроченное высвобождение (которое приводит к неизмененной Cmax, однако лаг-период и, таким образом, Tmax замедляются, и t1/2 не меняется), а также периодическое высвобождение, импульсное высвобождение, непрерывное высвобождение, длительное высвобождение, оптимизированное по времени высвобождение, быстрое (для получения усиленного начала действия) и т.д. В эти термины также включено применение конкретных условий в организме, например, различных ферментов или изменения pH для контроля высвобождения лекарственного вещества. Термин "пролонгированное высвобождение" выбран, поскольку этот термин, как полагают, наиболее правильно охватывает высвобождение продукта in vivo.
В этом контексте термин "деградация" или "деградирующий" означает постепенное разрушение поверхности материала или структуры, например, таблетки или покрытия таблетки. Этот термин, как используют в настоящем документе, как правило, обозначает растворение полимера, ответственного за пролонгирование высвобождения, являющееся более быстрым, чем растворение активного вещества, в результате чего полимер деградирует быстрее, чем активное вещество растворяется. Иными словами высвобождение, главным образом, контролируется деградацией, а не растворением активного вещества в системе полимерной матрицы.
Настоящее изобретение относится к фармацевтическим продуктам для улучшения лечения состояний, которые отвечают на лечение такролимусом, особенно для лечения, где является желательным иммуносупрессивный эффект.
Активным ингредиентом в композициях по изобретению предпочтительно является такролимус или любой аналог или производное такролимуса, который проявляет либо фармакологическую, либо терапевтическую активность, которая по меньшей мере эквивалентна активности такролимуса (FK-506 или FR-900506). Однако в объем настоящего изобретения входит такролимус в любой физической форме (кристаллы, аморфный порошок, любые возможные полиморфы, любые возможные сольваты, включая гидраты, ангидраты, их комплексы и т.д.). Также включен любой аналог, производное или активный метаболит такролимуса, их фармацевтически приемлемые соли, сольваты, комплексы и пролекарства. Однако считают, что частицы меньших размеров в микро- и нано-диапазоне и предпочтительно молекулярный раствор могут обеспечить предсказуемое и постоянное высвобождение такролимуса in vivo.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к пероральной лекарственной форме с пролонгированным высвобождением, содержащей в качестве активного вещества такролимус или его фармацевтически активный аналог, для иммуносупрессивного лечения один раз в сутки пациента, нуждающегося в этом, причем эта лекарственная форма высвобождает активное вещество в течение пролонгированного периода времени, определяемого высвобождением самое большее 63,5% содержимого активного вещества в момент времени через 12 часов, определенному по растворению in vitro и при тестировании в соответствии с тестом растворения USP II (лопасть) или тестом растворения USP I (корзина) в среде, имеющей pH 4,5 и содержащей 0,005% гидроксипропилцеллюлозы, и при вращении 50 об/мин. Общепризнано, что устройство для растворения с корзиной может быть более пригодным для капсул, а устройство для растворения с лопастью является более пригодным для дезинтеграции таблеток. Однако наиболее пригодное устройство для растворения можно легко определить путем тестирования того, достигается ли наиболее высокое соответствие с помощью одного или другого устройства.
В следующем варианте осуществления самое большее 63,5% активного вещества высвобождается в момент времени через 13 часов, более предпочтительно в момент времени через 14 часов, например, в момент времени через 15 часов. В предпочтительном варианте осуществления высвобождение in vitro происходит с постоянной скоростью, в результате чего можно достигать по существу профиля высвобождения нулевого порядка в течение пролонгированного периода времени. Поскольку требуется достаточное высвобождение в момент времени, когда лекарственная форма может достигнуть толстого кишечника, такой соответствующий период, когда является желательным высвобождение нулевого порядка, можно определять по высвобождению от 8 до 15 часов при тестировании в соответствии с тестом растворения USP II (лопасть) или тестом растворения USP I (корзина) в среде, имеющей pH 4,5 и содержащей 0,005% гидроксипропилцеллюлозы, и при вращении 50 об/мин. Поскольку твердая лекарственная форма может выходить из желудка вскоре после проглатывания или может задерживаться там на несколько часов перед тем, как достигнуть желудочно-кишечного тракта, также желательно, чтобы лучше контролировалось начальное высвобождение при измерении по высвобождению in vitro, которое представляет собой по существу профиль высвобождения нулевого порядка в течение пролонги