Способ прогнозирования риска развития хронической истинной экземы у лиц мужского пола
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для прогнозирования риска возникновения хронической истинной экземы (ХИЭ) у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации. Осуществляют выделение геномной ДНК из периферической венозной крови и анализ локусов методом полимеразной цепной реакции. При наличии аллеля -308А TNFα или генотипа -308GА TNFα, или аллеля +1663G TNFR2 или генотипа +1663GG TNFR2, или сочетания +250G Ltα с +36А TNFR1, или -308А TNFα с +36А TNFR1, или +250G Ltα с +1663G TNFR2, или -308G TNFα с +1663G TNFR2, или -308А TNFα с +250G Ltα, или -308G TNFα с +250G Ltα с +1663G TNFR2, или -308А TNFα с +250G Ltα с +36А TNFR1, или -308А TNFα с +250G Ltα с +1663G TNFR2 прогнозируют повышенный риск развития ХИЭ; при наличии генотипа -308GG TNFα, или генотипа +1663АА TNFR2, или сочетания аллеля +250А Ltα с генотипом +1663АА TNFR2, или сочетания -308GG TNFα с +250А Ltα, или -308GG TNFα с +1663А TNFR2, или +36G TNFR1 с +1663А TNFR2 прогнозируют пониженный риск развития ХИЭ. Изобретение обеспечивает получение новых критериев оценки риска развития ХИЭ. 5 ил., 18 пр.
Реферат
Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования риска развития хронической истинной экземы у лиц мужского пола.
Истинная экзема - повсеместно встречающееся, рецидивирующее заболевание кожи, которое характеризуется полиморфизмом морфологических элементов и возникает в любом возрасте [Клиническая дерматовенерология: руководство для врачей: в 2-х т. /под ред. Ю.К. Скрипкина, Ю.С. Бутова. - Москва: ГЭОТАР-Медиа, 2009. - Т. 2. - 921 с.]. Название данного заболевания можно объяснить свойством везикул быстро вскрываться, подобно пузырькам кипящей воды (по-гречески eczeo - вскипать). Важный признак острой экземы - наличие сгруппированных, многочисленных и быстро вскрывающихся мелких пузырьков, образующих серозные «колодцы», сходных с пузырьками на поверхности кипящей воды [Оспанова С.А. Совершенствование терапии экземы с учетом эндогенной интоксикации: соавтореф. дис. … канд. мед. наук: 14.00.11 /С.А. Оспанова; Казах. науч.-исслед. кож.-венерол. ин-т М-ва здравоохранения Респ. Казахстан. - Алматы, 2008. - 21 с.].
Этиологический и патогенетический аспекты развития экземы, освещенные в современной литературе, носят противоречивый характер. На разных этапах развития учений об экземе важное значение в этиологии и патогенезе экземы придавали неврогенной и аллергической теориям, роли эндокринной системы, наследственным факторам. Следует отметить, что этиология и патогенез экземы чрезвычайно сложны и во многих своих аспектах остаются неизученными [Кошелева И.В. Эффективность комплексного лечения больных экземой при использовании различных методик озонотерапии/И.В. Кошелева, А.Г. Куликов //Вопросы курортологии, физиотерапии и лечебной физической культуры. - 2001. - №5. - С. 40-42].
Значительную роль в патогенезе экземы играют изменения состояния простагландинов и циклических нуклеотидов, занимающих основное место во внутриклеточных регуляторных механизмах. Они опосредуют нейроэндокринную информацию, превращают ее в специфический ответ клетки и реализуют нормальные и патологические реакции организма [Арушанян Э.Б. Лечебные возможности мелатонина и его влияние на иммунологические показатели у больных экземой /Э.Б. Арушанян и Дж. М. Альи Абси, В.В. Чеботарев//Экспериментальная и клиническая фармакология. - 2003. - Т. 66, №3. - С. 59-61].
Простагландины Е1 и F201, циклические аденозинмонофосфат и гуанозинмонофосфат оказывают регулирующее влияние на развитие аллергических и воспалительных реакций, функциональную деятельность иммунной системы организма. Между простагландинами E1 (ПГЕ1, циклическим аденозинмонофосфатом (цАМФ) и простагландинами F2а циклическим гуанозинмонофосфатом (цГМФ) существуют антагонистические отношения. ПГЕ1 стимулирует синтез цАМФ, который подавляет продукцию гистамина, серотонина и других медиаторов аллергических реакций. ПФГ2а стимулирует синтез цГМФ, активирующего продукцию медиаторов аллергии, тем самым способствуя развитию аллергических и воспалительных реакций [Бурова С.А. Иммуномодуляторы в практике дерматолога /С.А. Бурова, Г.Н. Макова //Актуальные вопросы терапии инфекций, передаваемых половым путем, и хронических дерматозов, Екатеринбург, 30-31 мая 2002 г.: тез. докл. науч.-практ. конф. - Екатеринбург, 2002. - С. 39]. У больных экземой установлено повышение концентрации ПГЕ1 и ПГФ2а в плазме крови, однако более значительно повышение ПГФа, что приводит к изменению соотношения ПГЕ1/ПГФ2 (преобладает ПГФ2а) и образованию своеобразного дефицита ПГЕ1 [Дегтяр Ю.С. Особенность гормонального статуса у больных экземой и другими дерматозами в условиях Севера /Ю.С. Дегтяр, Л.К. Добродеева //Вестник дерматологии и венерологии. - 2000. - №5. - С. 50-53].
Установленные биохимические и иммунные нарушения позволили разработать новую концепцию патогенеза экземы. У индивидуумов c наследственной предрасположенностью, которая подтверждается положительной ассоциацией антигенов системы гистосовместимости (В22 и Cw1), усиливается синтез простагландина F2a, что вызывает стимуляцию выработки циклического гуанозинмонофосфата, активирующего синтез серотонина, гистамина и других медиаторов аллергии, что способствует развитию воспалительных и аллергических реакций и повышает проницаемость сосудов [Дегтяр Ю.С. Состояние иммунного статуса у больных экземой на Европейском Севере России /Ю.С. Дегтяр, Л.К. Добродеева//Вестник дерматологии и венерологии. - 2001. - №1. - С. 44-46].
Одновременно с увеличением образования простагландина F2a повышается синтез простагландина E1, но его концентрация значительно снижена по отношению к увеличивающейся концентрации простагландина F201. Недостаток содержания простагландина Е1, нарушение его соотношения с содержанием простагландина F2a приводит к недостаточной стимуляции синтеза циклического аденозинмонофосфата, подавляющего формирование аллергических и воспалительных реакций, выработку медиаторов аллергии [Дикова О.В. Состояние эндотоксикоза у больных экземой /О.В. Дикова, С.В. Селиванова, Е.Ю. Кочеткова //Вестник последипломного медицинского образования. - 2001. - №1. - С. 31].
Таким образом, у больных экземой в результате повышения содержания F2a и нарушения соотношения ПГЕ1/ПГФ2а и цАМФ/цГМФ происходит преобладание простагландина F2a и циклического гуанозинмонофосфата, что является одной из причин развития заболевания [Мазитова Л.П. Современные аспекты патогенеза излечения аллергодерматозов у детей /Л.П. Мазитова //Русский медицинский журнал. - 2001. - Т. 9, №11. - С. 457-460].
В тромбоцитах периферической крови больных экземой установлено усиление синтеза и экскреции серотонина в кровяное русло. Реакция высвобождения тромбоцитов, в результате которой серотонин поступает в кровь, регулируется простагландинами. Простагландин Е1 ее подавляет, а простагландин F2a провоцирует [Кожные и венерические болезни: справ. семейного врача /под ред. К.Н. Монахова. - Москва; Санкт-Петербург: ДИЛЯ, 2005. - 159 с.]. Преобладание простагландина F2a обусловливает повышение содержания в крови серотонина, что усугубляет аллергические реакции. Гормон щитовидной железы тиреокальцитонин стимулирует активность аденилатциклазы - фермента, катализирующего синтез циклического аденозинмонофосфата из АТФ. Повышение содержания тиреокальцитонина у больных экземой, возможно, и есть проявление защитных реакций организма.
Простагландины и циклические нуклеотиды являются факторами системы регуляции иммунного ответа. Их повышенный синтез приводит к изменениям иммунологической реактивности и вызывает глубокие иммунологические расстройства, которые проявляются в подавлении клеточного иммунитета (снижается содержание Т-РОК, количественных и функциональных показателей Т-хелперов и Т-супрессоров, подавляется супрессорная активность Т-лимфоцитов) и неспецифических факторов защиты (снижается количество комплементарных и спонтанных нейтрофилов, содержание цитоплазматических гранул нейтрофильных лейкоцитов, процента фагоцитоза) [Страчунский Л.С. Фармакoэпидeмиoлoгия: oснoвныe пoнятия и практ. примeнeниe /Л.С. Страчунский, С.Н. Кoзлoв, С.А. Рачина //Клиничeская фармакoлoгия и тeрапия. - 2001. - Т. 10, №4. - С. 48-53]. Изменения иммунного статуса повышают аллергическую реактивность и наряду с циклическими нуклеотидами и простагландинами приводят к формированию экземы. Выраженность нарушений дисбаланса простагландинов, циклических нуклеотидов и иммунологической реактивности отражается на тяжести течения процесса и клинических проявлениях.
По современным представлениям, в развитии экземы главную роль играют Т-лимфоциты, которые несут на своей поверхности специфические рецепторы к антигену и выделяют ряд провоспалительных цитокинов: ИЛ-1, ИЛ-2, ФНО-α [Павлова О.В. Экзема: этиология, патогенез, клиника, диагностика и лечение /О.В. Павлова. - Москва: URSS Либроком, 2010. - 61 с.].
Выброс биологически активных веществ вызывает развитие тканевых реакций воспаления, что клинически проявляется аллергической реакцией в виде отека, гиперемии, зуда. Антигенная стимуляция Th1 приводит к синтезу ИЛ-2, причем ИЛ-2, продуцирующая способность CD4-клеток, у больных выше, чем у здоровых людей.
Провоспалительные цитокины вызывают индукцию экспрессии молекул адгезии на эндотелиальных клетках и лейкоцитах, вследствие чего путем трансэндотелиальной миграции усиливается приток в очаг воспаления лейкоцитов из сосудистого русла [Intеrlеukin-16 stimulatеs thе еxprеssiоn and prоductiоn оf prо-inflammatоry cytоkinеs by human mоnоcytеs /N. L. Mathy, W. Schеuеr, M. Lanzеndörfеr [еt al.] //Immunоlоgy. - 2000. - Vоl. 100, №1. - P. 63-69]. Дальнейшее накопление и продвижение иммунокомпетентных клеток в очаге воспаления контролируют хемокины, которые продуцируются эндотелиальными клетками и макрофагами. Клеточный инфильтрат в очаге воспаления, состоящий из макрофагов, нейтрофилов и эозинофилов, способствует развитию аллергического воспаления. Полиморфный инфильтрат в коже при экземе - результат действия образовавшихся провоспалительных цитокинов, в том числе ФНО-α.
Таким образом, в аллергических реакциях замедленного типа, лежащих в основе формирования истинной экземы, участвуют Th1- лимфоциты, макрофаги, эндотелиальные клетки и секретируемые ими цитокины.
По мнению большинства исследователей, экзему следует относить к мультифакториальным заболеваниям с полигенным типом наследования с пороговым эффектом. При сочетании определенных генетических дефектов и средовых факторов достигается пороговое значение, при котором и появляется клиническая картина заболевания. Существует большое количество фенотипически здоровых людей с высоким риском формирования аллергических заболеваний в неблагоприятных условиях внешней среды.
Для оценки сложившейся патентной ситуации был выполнен поиск по охранным документам за период с 1990 по 2013 гг. Анализ документов производился по направлению: способ прогнозирования риска развития хронической истинной экземы у индивидуумов мужского пола на основе молекулярно генетических данных в зависимости от полиморфных маркеров генов. Аналогичных патентов не выявлено.
Немецкие ученые исследовали влияние полиморфизмов -238G/A TNFα и -308G/A TNFα на развитие дерматита кистей. Результаты работы показали, что у больных дерматитом кистей установлена максимальная концентрация генотипа -308GA TNFα (31,20%), что статистически достоверно выше показателей контроля (24,60%, OR=1,33 95%, CI 1,05-1,74). Данный молекулярно-генетический маркер является фактором риска развития дерматита кистей. Протективным фактором развития дерматита кистей служит генетический вариант -238GA TNFα (5,60%) у больных по сравнению с контролем (8,5%, OR=0,57 95%, CI 0,34-0,97).
За прототип выбрана выявленная в научно-медицинской литературе статья, в которой описан способ прогнозирования риска развития хронической истинной экземы (далее ХИЭ) у индивидуумов мужского пола на основе данных о генетическом полиморфизме+250А/G Ltα [Ассоциация полиморфизма лимфотоксина α (+250 A/G Ltα) с формированием хронической истинной экземы [Электронный ресурс] / Я.Е. Денисова, М.И. Чурносов // Современные проблемы науки и образования. - 2014. - №3. - Режим доступа: http://www.science-education.ru/117-13677]. Способ включает забор венозной крови, выделение геномной ДНК из периферической крови и анализ локуса +250 A/G Ltα методом полимеразной цепной реакции (далее ПЦР) синтеза ДНК. Генотип+250GG Ltα является фактором риска развития этого заболевания у мужчин, а протективным фактором - аллель +250А Ltα.
Недостатком прототипа является то, что не учитывается влияние на развитие ХИЭ других генетических полиморфизмов и их сочетаний.
Задачей настоящего исследования является расширение арсенала способов диагностики, а именно создание способа прогнозирования риска развития ХИЭ у индивидуумов мужского пола по данным о генетических полиморфизмах и их сочетаний.
Технический результат использования изобретения - получение критериев оценки риска развития хронической истинной экземы у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации, по данным о генетических полиморфизмах -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1 и +1663A/G TNFR2 и их сочетаний.
В соответствии с поставленной задачей был разработан способ прогнозирования ХИЭ, включающий:
- забор венозной крови,
- выделение геномной ДНК из периферической крови,
- анализ локуса +250А/G Ltα методом полимеразной цепной реакции синтеза ДНК,
в который внесены следующие новые признаки:
- анализ полиморфизмов генов фактора некроза опухоли α (-308G/A TNFα), рецептора фактора некроза опухоли 1 типа (+36A/G TNFR1) и рецептора фактора некроза опухоли 2 типа (+1663A/G TNFR2);
- прогнозируют повышенный риск развития ХИЭ у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации, при наличии аллеля -308А TNFα или генотипа -308GA TNFα, или аллеля +1663G TNFR2 или генотипа +1663GG TNFR2, или сочетания аллелей +250G Ltα c +36А TNFR1, или сочетания аллелей -308А TNFα c +36A TNFR1, или сочетания аллелей +250G Ltα c +1663G TNFR2, или сочетания аллелей -308G TNFα c+1663G TNFR2, или сочетания аллелей -308A TNFα с +250G Ltα, или сочетания аллелей -308G TNFα с+250G Ltα с+1663 G TNFR2, или сочетания аллелей -308А TNFα с+250G Ltα с+36А TNFR1, или сочетания аллелей -308А TNFα с +250G Ltα с+1663G TNFR2;
- прогнозируют пониженный риск развития ХИЭ у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации, при наличии генотипа -308GG TNFα, или генотипа+1663АА TNFR2, или сочетания аллеля +250А Ltα с+генотипом 1663АА TNFR2, или сочетания генотипа -308GG TNFα с аллелем +250А Ltα, или сочетания генотипа -308GG TNFα с аллелем +1663А TNFR2, или сочетания аллелей +36G TNFR1 с +1663А TNFR2.
Новизна и изобретательский уровень заключается в том, что впервые установлена вовлеченность генетических полиморфизмов фактора некроза опухоли α (-308 G/A TNFα), рецептора фактора некроза опухоли 1-го типа (+36 А/G ТNFR1) и рецептoра фактoра некроза опухоли 2-го типа (+1663А/G ТNFR2) и их сочетаний, в том числе с лимфотоксином α (+250A/G Ltα), в формирование хронической истинной экземы у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации, что позволит повысить достоверность прогноза.
Изобретение характеризуется:
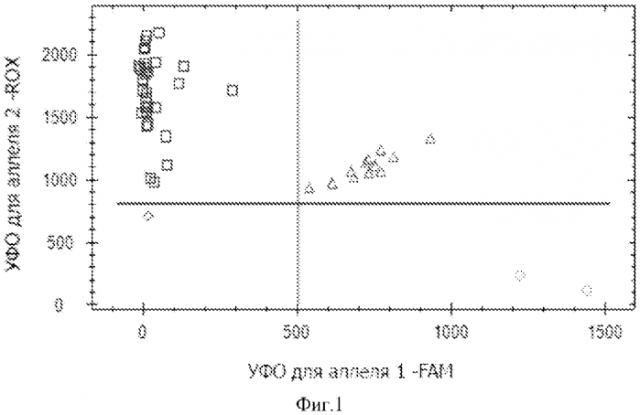
Фиг.1. Дискриминации аллелей методом детекции TaqMan зондов по данным величин уровня относительной флуоресценции (далее УОФ) каждого зонда на амплификаторе IQ5 c детектирующей системой в режиме реального времени локуса -308 G/A TNFα, где - 308АА TNFα, - 308GG TNFα, - 308GA TNFα, ♦ - контрольный образец.
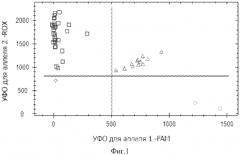
Фиг.2. Дискриминации аллелей методом детекции TaqMan зондов по данным величин УОФ каждого зонда на амплификаторе IQ5 c детектирующей системой в режиме реального времени локуса +250 A/G Ltα, где - +250GG Ltα, - +250AA Ltα, - +250AG Ltα, ♦ - контрольный образец.
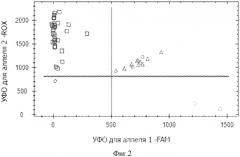
Фиг.3. Дискриминации аллелей методом детекции TaqMan зондов по данным величин УОФ каждого зонда на амплификаторе IQ5 c детектирующей системой в режиме реального времени локуса +36 A/G TNFR1, где - +36AA TNFR1, - +36GG TNFR1, - +36AG TNFR1, ♦ - контрольный образец.
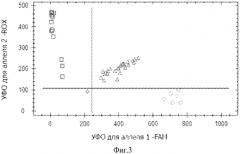
Фиг.4. Дискриминации аллелей методом детекции TaqMan зондов по данным величин УОФ каждого зонда на амплификаторе IQ5 c детектирующей системой в режиме реального времени локуса+1663A/G TNFR2, где - +1663GG TNFR2, - +1663AA TNFR2, - +1663AG TNFR2, ♦ - контрольный образец.
Фиг. 5, на которой в таблице представлена распространенность сочетаний некоторых аллелей/генотипов генов цитокинов у больных ХИЭ и индивидуумов контрольной группы мужского пола.
На фигурах 1-4 две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием уровня относительной флуоресценции для одного флуорофора на оси x, относительно УОФ для другого флуорофора на оси y на диаграмме дискриминации аллелей. Зонд с флуоресцентным красителем ROX соответствует аллелю A, зонд с красителем FAM - аллелю G.
• Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (GA).
• Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю A (УОФ аллеля A отложены по оси y).
• Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю G (УОФ аллеля G отложены по оси x).
• Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно: в данном случае неопределенный образец - отрицательный контроль.
Способ осуществляют следующим образом:
Выделение геномной ДНК осуществляют стандартным методом фенольно-хлороформной экстракции. 1-ый этап: к 4 мл крови добавляют 25 мл лизирующего буфера, который содержит 320 мМ сахарозы, 1% тритон Х -100, 5 мМ МgСl2 и 10 мМ трис-НCl (pH=7,6) [Мathew С.С., 1984]. Полученную смесь при 4ºС, 4000 об/мин в течение 20 минут перемешивают и центрифугируют. После центрифугирования сливают надосадочную жидкость, к полученному осадку добавляют 4 мл раствора, с 25 мM ЭДTA (рН=7,8) и 75 мМ NаСl, затем ресуспензируют. После этого прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы K (10 мг/мл) и в течение 16 часов при 37ºС инкубируют образец.
На 2-м этапе в течение 10 минут при 4000 об/мин из полученного лизата последовательно экстрактируют ДНК равными частями фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием. Производят отбор водной фазы после каждого центрифугирования. Из раствора 2-мя объемами охлажденного 96% этанола осаждают ДНК. Полученную ДНК растворяют в деионизованной, бидистиллированной воде и хранят при t=-20 °С. Выделенную ДНК используют для полимеразной цепной реакции (ПЦР) синтеза ДНК.
Анализ -308G/А TNFα,+250G/A Ltα,+36A/G TNFR1,+1663A/G TNFR2 осуществляют методами ПЦР синтеза ДНК на CFX 96 с системой ПЦР в режиме real time. Используют ДНК-полимеразу Thermus aquaticus (производитель фирма «Силекс-М») и олигонуклеотидные праймеры и зонды (синтезированные фирмой «Синтол»).
Реакционная смесь (объем 25 мкл) включает: 67 мМ трис-НCl (pН=8,8), 2,5 мМ МgCl2, 0,1 мкг геномной ДHK, по 10 пM каждого праймера, по 5 пkмoль каждого зонда, по 200 мkM dАТР, dGТР, dСТР, dТТР и 1 единицу активной Тaq-полимеразы. Для каждой пары праймеров рассчитывают оптимальный температурный и временной режим отжига и подбирают соответствующую концентрацию MgCl2.
Генотипирование производят по методу Tag Man зондов на основании данных значений уровня относительной флуоресценции (далее УОФ) для каждого зонда при проведении ПЦP в амплификаторе IQ5.
Возможность использования предложенного способа для оценки риска развития хронической истинной экземы подтверждает анализ результатов обследования 205 мужчин: 84 больных ХИЭ и 121 индивидуум контрольной группы.
В исследуемые группы включались лица русской национальности, которые являлись уроженцами Центрального Черноземья Российской Федерации и не имели родства между собой. Клиническое и клинико-лабораторное обследование больных проводили на базе поликлинического отделения ОГБУЗ «Кожно-венерологический диспансер».
Средний возраст больных хронической истинной экземой составил 45,91±2,68 (варьировал от 18 лет до 86 лет), контрольной выборки - 43,62±3,46 (варьировал от 20 до 76 лет) (р>0,05). Следовательно, группа больных не отличалась от группы контроля по возрасту, месту рождения и национальности.
С целью решения проблемы множественных сравнений, связанной с получением ложноположительных результатов (ошибка 1-го рода), вводят поправку Бонферрони, т.е. производят перерасчет уровня значимости р для множественных парных сравнений по формуле: рcor=р·n, где р - полученный уровень статистической значимости, n - количество парных сравнений. За статистически значимый уровень принимали рcor≤0,05. Анализ ассоциаций сочетаний генетических вариантов с ХИЭ проводят с помощью программного обеспечения АРSampler (http://sources.redhat.com/cygwin/), использующий метод Монте-Карло марковских цепей и байесовскую непараметрическую статистику. Уровень р, полученный после пермутационного теста рреrm ≤0,05 (выполнено 100 пермутаций), принимают за статистически значимый.
В результате проведенного исследования в группе мужчин концентрация генотипа -308GG TNFα (62,03%) - ниже, чем в контрольной группе, где этот показатель составил 79,83% (χ2=6,72, р=0,01, рcor=0,03, OR=0,41 95% CI 0,21-0,82).
Также выявлено, что среди больных ХИЭ частота генотипа +1663АА TNFR2 (19,18%) ниже, чем в контрольной группе, где этот показатель составил 39,17% (χ2=7,49, р=0,007, рcor=0,021, OR=0,37 95% CI 0,17-0,77).
Таким образом, полученные данные свидетельствуют, что протективное значение имеют генотипы -308GG TNFα (OR=0,41) или +1663АА TNFR2 (OR=0,37).
В результате проведенного комплексного анализа носительства сочетаний аллелей и генотипов исследуемых локусов факторов некроза опухолей и их рецепторов выявлен целый ряд достоверных различий между 84 мужчинами больными ХИЭ и 121 мужчинами контрольной группы (таблица на фигуре 5). Все четыре рассмотренных генетических полиморфизма -308G/А TNFα, +250А/G Ltα, +36А/G TNFR1, +1663А/G TNFR2 участвуют в формировании 12 значимых сочетаний генетических вариантов, отличающих мужчин, больных ХИЭ, от мужчин контрольной группы.
При этом следует отметить, что протективную направленность с формированием хронической истинной экземы имеют 4 ассоциации сочетаний (ОR=0,32-0,45):
- сочетание аллеля +250А Ltα с генотипом +1663АА TNFR2 (сочетание А в таблице на фиг. 5) (ОR=0,32 95% CI 0,16-0,66). У 14,29% больных ХИЭ наблюдается эта комбинация генетических маркеров, тогда как в контрольной группе она выявлена у 38,02%.
- сочетание генотипа -308GG TNFα с аллелем +250А Ltα (сочетание В), которое наблюдается у 52,38% больных и 77,69% популяционного контроля. Уровень статистической значимости различий в частотах комбинаций данных генетических маркеров между больными и контролем также достаточно высок (рperm=0,002). Отношение шансов для сочетания В составляет 0,34 (95% CI 0,18-0,65).
- сочетание генотипа -308GG TNFα с аллелем +1663А TNFR2 (сочетание С). Отношение шансов для этой комбинации полиморфных вариантов равно 0,35 при 95% доверительном интервале 0,19-0,65 (рperm=0,002). Сочетание С встречается у 64,46% мужчин контрольной группы и лишь у 34,52% мужчин, больных ХИЭ.
- сочетание аллеля +36G TNFR1 с аллелем +1663А TNFR2 (сочетание D). Отношение шансов для этой комбинации полиморфных вариантов равно 0,45 при 95% доверительном интервале 0,25-0,81 (рperm=0,002). Сочетание D встречается у 63,64% мужчин контрольной группы и 38,09% мужчин, больных ХИЭ.
В результате проведенного исследования в группе мужчин выявлены различия в распределении молекулярно-генетических маркеров по локусам -308G/А TNFα и +1663А/G TNFR2 между контролем и больными хронической истинной экземой. Так, среди больных ХИЭ частоты аллеля -308А TNFα (19,62%) и генотипа -308GА TNFα (36,71%) были выше, чем в контрольной группе, где эти показатели составили 10,50% (χ2=5,77, р=0,02, OR=2,08 95% CI 1,13-3,83) и 19,33% (χ2=6,54, р=0,01, рcor=0,03, OR=2,42 95% CI 1,21-4,86) соответственно. Также выявлено, что среди больных ХИЭ концентрации генетических вариантов +1663G TNFR2 (59,59%) и +1663GG TNFR2 (38,35%)- были выше, чем в контрольной группе, где эти показатели составили 40,83% (χ2=12,06, р=0,001, OR=2,14 95% CI 1,38-3,32) и 20,83% (χ2=6,14, р=0,01, рcor=0,03, OR=2,36 95% CI 0,18-4,75) соответственно.
Таким образом, полученные данные свидетельствуют о вовлеченности генетических маркеров -308G/А TNFα и+1663А/G TNFR2 в формирование подверженности хронической истинной экземы у мужчин. Факторами повышенного риска развития ХИЭ у мужчин являются -308А TNFα (OR=2,08), или -308GА TNFα (OR=2,42), или +1663G TNFR2 (OR=2,14), или +1663GG TNFR2 (OR=2,36).
При этом следует отметить, что 8 сочетаний являются факторами риска развития ХИЭ у мужчин (ОR=2,18-3,89).
Выявлены достоверные различия в концентрациях сочетаний генотипов +250G Ltα с+36А TNFR1 (сочетание Е) между мужчинами, больными ХИЭ (46,43%), и мужчинами контроля (31,40%). Данное сочетание является фактором риска развития ХИЭ (рperm=0,02, ОR=2,18, 95%CI 1,21-3,93). Также зарегистрированы различия в распределении сочетаний двух генетических маркеров -308А TNFα с+36А TNFR1 (сочетание F) между мужчинами, больными ХИЭ (30,95%), и мужчинами контрольной группы (15,70%). Данное сочетание полиморфных вариантов генов тоже является фактором риска развития хронической истинной экземы (рperm=0,01, ОR=2,68, 95% CI 1,36-5,30).
Установлены различия в частоте сочетаний аллелей +250G Ltα с+1663G TNFR2 (сочетание G) между мужчинами, больными ХИЭ, и мужчинами контроля. Концентрация этого сочетания генетических вариантов в контрольной группе составляет 23,97%, тогда как среди больных мужчин данный показатель равен 40,48% (рperm=0,002, OR=2,81 95% CI 1,51-5,24).
Комбинация генетических маркеров, которая наблюдается у 69,05% мужчин больных ХИЭ и 59,50% мужчин контрольной группы, включает сочетание двух генетических маркеров: -308G TNFα с +1663G TNFR2 (сочетание Н) (рperm=0,01). Данное сочетание является фактором риска развития ХИЭ (ОR=2,85, 95% CI 1,41-5,77).
Сочетание I, которое наблюдается у 33,33% больных мужчин и 15,70% мужчин контрольной группы, включает сочетания двух генетических факторов: -308А TNFα с +250G Ltα. Уровень статистической значимости различий в частотах сочетаний данных генетических маркеров между больными мужчинами и контролем также достаточно высок (рperm=0,01). Отношение шансов для сочетания I составляет 2,95 (95% CI 1,50-5,78).
Факторами риска развития ХИЭ являются сочетания генетических факторов J, K и L. Сочетание J, представленное сочетанием аллелей -308G TNFα с +250G Ltα с+1663G TNFR2, встречается у мужчин контроля (23,14%) в 1,75 раз реже, чем среди больных ХИЭ (40,48%, рperm=0,001), отношение шансов - 3,04 (при 95% CI 1,61-5,71).
Также у мужчин контрольной группы значительно реже (в 1,36 и 1,25 раза, соответственно) встречаются сочетания K и L по сравнению с больными ХИЭ. Концентрации этих сочетаний генетических вариантов у мужчин контроля составляют 12,40% и 9,09% соответственно, тогда как среди больных мужчин данные показатели равны 29,76% (рperm=0,002) и 23,81% (рperm=0,002) соответственно. Отношения шансов для этих сочетаний равны 3,40 и 3,89.
Таким образом, подводя итог полученным результатам, можно сделать вывод, что у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации сочетания всех четырех анализируемых генетических полиморфизмов цитокинов -308G/А TNFα, +250А/G Ltα, +36А/G TNFR1 и +1663А/G TNFR2 определяют предрасположенность к возникновению ХИЭ. Они формируют 12 значимых сочетаний генетических вариантов факторов некроза опухолей и их рецепторов, ассоциированных с развитием ХИЭ. Причем 4 сочетания имеют протективную направленность (ОR=0,32-0,45), а 8 сочетаний являются факторами риска развития ХИЭ (ОR=2,18-3,89).
Примеры, подтверждающие осуществимость предложенного изобретения.
1. У пациента А. мужского пола выявлен аллель -308А TNFα. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
2. У пациента В. мужского пола выявлен генотип -308GА TNFα. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
3. У пациента У. мужского пола выявлен аллель +1663G TNFR2. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
4. У пациента К. мужского пола выявлен генотип +1663GG TNFR2. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
5. У пациента Н. мужского пола выявлено сочетание +250G Ltα с +36А TNFR1. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
6. У пациента Д. мужского пола выявлено сочетание -308А TNFα с +36А TNFR1. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
7.У пациента Ш. мужского пола выявлена комбинация +250G Ltα с +1663G TNFR2. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
8. У пациента О. мужского пола выявлена комбинация -308G TNFα с +1663G TNFR2. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
9. У пациента Б. мужского пола выявлена комбинация -308 А TNFα с +250G Ltα. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
10. У пациента Э. мужского пола выявлено сочетание -308G TNFα,+250G Ltα с +1663G TNFR2. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
11. У пациента Л. мужского пола выявлено сочетание -308А TNF ,+250G Ltα с +36А TNFR1. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
12. У пациента П. мужского пола выявлено сочетание -308А TNFα,+250G Ltα с +1663G TNFR2. При дальнейшем наблюдении у данного пациента возникла хроническая истинная экзема.
13. У пациента И. мужского пола обнаружен генотип -308GG TNFα. При дальнейшем наблюдении данного пациента возникновения хронической истинной экземы не выявлено.
14. У пациента Ф. мужского пола обнаружен генотип +1663АА TNFR2. При дальнейшем наблюдении данного пациента возникновения хронической истинной экземы не выявлено.
15. У пациента Ж. мужского пола обнаружено сочетание +250А Ltα с +1663АА TNFR2. При дальнейшем наблюдении данного пациента возникновения хронической истинной экземы не выявлено.
16. У пациента Н. мужского пола обнаружено сочетание -308GG TNFα с +250А Ltα. При дальнейшем наблюдении данного пациента возникновения хронической истинной экземы не выявлено.
17. У пациента Ц. мужского пола обнаружено сочетание -308GG TNFα с +1663А TNFR2. При дальнейшем наблюдении данного пациента возникновения хронической истинной экземы не выявлено.
18. У пациента Ч. мужского пола обнаружено сочетание +36G TNFR1 с+1663А TNFR2. При дальнейшем наблюдении данного пациента возникновения хронической истинной экземы не выявлено.
Применение данного способа позволит своевременно реализовывать среди индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации, входящих в группу риска, необходимые лечебно-профилактические мероприятия по предупреждению развития хронической истинной экземы: исключение слишком частого мытья рук, контакта с раздражающими моюще-чистящими средствами, использование деликатного мыла и увлажнение кожи.
Способ прогнозирования риска возникновения хронической истинной экземы у индивидуумов мужского пола русской национальности, уроженцев Центрального Черноземья Российской Федерации, включающий выделение геномной ДНК из периферической крови и анализ локуса +250А/G Ltα методом полимеразной цепной реакции синтеза ДНК, отличающийся тем, что дополнительно проводят анализ генетических полиморфизмов -308G/A TNFα, +36А/G TNFR1, +1663A/G TNFR2 и их сочетаний, прогнозируют повышенный риск развития ХИЭ при наличии аллеля -308А TNFα или генотипа -308GA TNFα, или аллеля +1663G TNFR2 или генотипа +1663GG TNFR2, или сочетания аллелей +250G Ltα c +36А TNFR1, или сочетания аллелей -308А TNFα c +36А TNFR1, или сочетания аллелей +250G Ltα c +1663G TNFR2, или сочетания аллелей -308G TNFα c +1663G TNFR2, или сочетания аллелей -308A TNFα с +250G Ltα, или сочетания аллелей -308G TNFα c +250G Ltα с +1663G TNFR2, или сочетания аллелей -308А TNFα c +250G Ltα с +36А TNFR1, или сочетания аллелей -308А TNFα с +250G Ltα с +1663G TNFR2; прогнозируют пониженный риск развития ХИЭ при наличии генотипа -308GG TNFα, или генотипа +1663АА TNFR2, или сочетания аллеля +250А Ltα с генотипом +1663АА TNFR2, или сочетания генотипа -308GG TNFα с аллелем +250А Ltα, или сочетания генотипа -308GG TNFα с аллелем +1663А TNFR2, или сочетания аллеля +36G TNFR1 с аллелем +1663А TNFR2.