Способ получения бис-(1,5,3-дитиазепан-3-ил)циклогексанов
Иллюстрации
Показать всеИзобретение относится к способу получения бис-(1,5,3-дитиазепан-3-ил)циклогексанов, Сущность способа заключается во взаимодействии тетракис(метоксиметил)диаминоциклогексанов, таких как (тетракис(метоксиметил)-1,2-диаминоциклогексан, или тетракис(метоксиметил)-1,4-диаминоциклогексан, или тетракис(метоксиметил)-1,3-диаминодиметилциклогексан) с 1,2-этандитиолом в присутствии катализатора SmCl3·6H2O при мольном соотношении тетракис(метоксиметил)диаминоциклогексан : 1,2-этандитиол : SmCl3·6H2O = 1:2:(0.03-0.07) в среде растворителей метанол-хлороформ при комнатной (~20°C) температуре в течение 2.5-3.5 ч. Выход бис-(1,5,3-дитиазепан-3-ил)циклогексанов (1) составляет 67-82%. Соединения могут найти применение в качестве противомикробных, антигрибковых и противовоспалительных агентов. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к органической химии, конкретно к способу селективного получения бис-(1,5,3-дитиазепан-3-ил)циклогексанов общей формулы (1):
S,N-Содержащие гетероциклы известны как противомикробные (Bialy Serry А.А., Abdelal А.М., El-Shorbagi A., Kheira Samy М.М. Archiv der Pharmazie, 2005, 338, 1, 38-43), антигрибковые (Е.Б. Рахимова, Р.А. Исмагилов, Р.А. Зайнуллин, Н.Ф. Галимзянова, А.Г. Ибрагимов. Журнал прикладной химии, 2013, 86, 10, 1547-1551) и противовоспалительные агенты (Akhmetova V.R., Khairallina R.R., Parfenova T.I., Sufiyarova R.Sh., Bashkatov S.A., Kunakova R.V. Pharmaceutical Chemistry Journal, 2011, 44, 10, 534-535).
Известен способ (Е.Б. Рахимова, И.В. Васильева, Л.М. Халилов, А.Г. Ибрагимов, У.М. Джемилев. Химия гетероциклических соединений, 2012, 7, 1132-1139) получения 3,3′-фенилен-бис-1,5,3-дитиазепанов (2) реакцией о- и n-фенилендиаминов с N-трет-бутил-1,5,3-дитиазепаном или 1-окса-3,6-дитиациклогептаном под действием 5 мол. % Sm(NO3)3·6H2O.
Известный способ не позволяет получить бис(1,5,3-дитиазепан-3-ил)циклогексаны общей формулы (1).
Известен способ (Е.Б. Рахимова, Р.А. Исмагилов, Р.А. Зайнуллин, А.Г. Ибрагимов, У.М. Джемилев. Химия гетероциклических соединений, 2013, 8, 1325-1330) получения бис-(1,5,3-дитиазепан-3-ил)алканов (3) реакцией алифатических α,ω-диаминов с 2,5-дитиагексан-1,6-диамином под действием 5 мол. % SmCl3·6H2O.
Известный способ не позволяет получить бис-(1,5,3-дитиазепан-3-ил)циклогексаны общей формулы (1).
Таким образом, в литературе отсутствуют сведения о получении бис-(1,5,3-дитиазепан-3-ил)циклогексанов общей формулы (1).
Предлагается новый способ получения бис-(1,5,3-дитиазепан-3-ил)циклогексанов общей формулы (1).
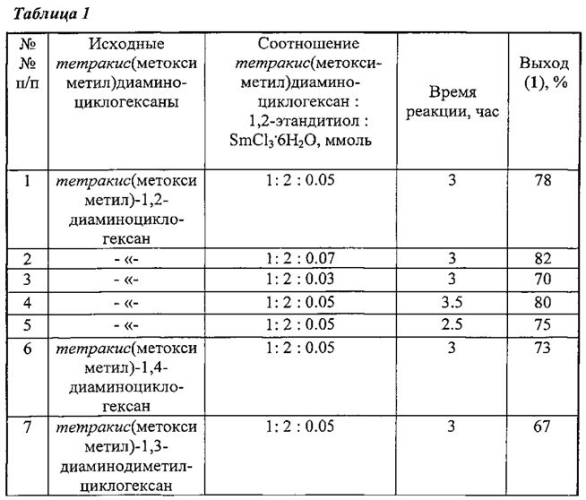
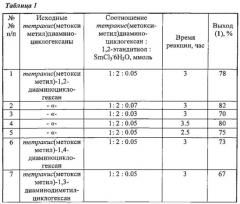
Сущность способа заключается во взаимодействии тетракис(метоксиметил)диаминоциклогексанов, таких как (тетракис(метоксиметил)-1,2-диаминоциклогексан, или тетракис(метоксиметил)-1,4-диаминоциклогексан, или тетракис(метоксиметил)-1,3-диаминодиметилциклогексан) с 1,2-этандитиолом в присутствии катализатора SmCl3·6H2O, взятыми в мольном соотношении тетракис(метоксиметил)диаминоциклогексан : 1,2-этандитиол : SmCl3·6H2O=1:2:(0.03-0.07), предпочтительно 1:2:0.05, при комнатной температуре (~20°C) и атмосферном давлении в среде растворителей метанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч. Выход бис-(1,5,3-дитиазепан-3-ил)циклогексанов (1) составляет 67-82%. Реакция протекает по схеме:
Бис-(1,5,3-дитиазепан-3-ил)циклогексаны (1) образуются только лишь с участием тетракис(метоксиметил)диаминоциклогексанов и 1,2-этандитиола, взятых в мольном соотношении 1:2 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1). Без катализатора реакция идет с выходом, не превышающим 20%. Проведение указанной реакции в присутствии катализатора SmCl3·6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора SmCl3·6H2O менее 3 мол. % снижает выход бис-(1,5,3-дитиазепан-3-ил)циклогексанов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°C. При температуре выше 20°C (например, 60°C) увеличиваются энергозатраты, а при температуре ниже 20°C (например, 0°C) снижается скорость реакции.
Существенные отличия предлагаемого способа
В известном способе реакция идет с участием в качестве исходных реагентов алифатических α,ω-диаминов и 2,5-дитиагексан-1,6-диамина под действием 5 мол. % SmCl3·6H2O с получением бис-(1,5,3-дитиазепан-3-ил)алканов (3). Известный способ не позволяет получать индивидуальные бис-(1,5,3-дитиазепан-3-ил)циклогексаны (1).
В предлагаемом способе реакция идет с участием в качестве исходных реагентов тетракис(метоксиметил)диаминоциклогексанов и 1,2-этандитиола под действием катализатора SmCl3·6H2O. В отличие от известного, предлагаемый способ позволяет получать индивидуальные бис-(1,5,3-дитиазепан-3-ил)циклогексаны (1), синтез которых в литературе не описан.
Способ поясняется примерами.
Пример 1. В сосуд Шленка, установленный на магнитной мешалке, помещают 1 ммоль тетракис(метоксиметил)-1,2-диаминоциклогексана в 5 мл МеОН и 18 мг (0.05 ммоль) SmCl3·6H2O, затем добавляют 0.17 мл (2 ммоль) 1,2-этандитиола в 5 мл CHCl3. Реакционную смесь перемешивают при температуре ~20°C в течение 3 ч, колоночной хроматографией на SiO2 выделяют 1,2-бис-(1,5,3-дитиазепан-3-ил)циклогексан с выходом 78%.
Другие примеры, подтверждающие способ, приведены в таблице 1.
Все опыты проводили при комнатной температуре (~20°C) в среде растворителей метанол-хлороформ (1:1, объемное соотношение), т.к. в них растворяются исходные и целевые продукты.
Спектральные характеристики1 (1 Спектры ЯМР (1Н, 13С) сняты на спектрометре Bruker Avance 400 (100.62 МГц для 13С и 400.13 МГц для 1Н) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3. Масс спектры получены на приборе MALDI TOF/TOF AUTOFLEX III фирмы Bruker.)
1,2-бис-(1,5,3-дитиазепан-3-ил)циклогексана:
Спектр ЯМР 1Н (δ, м.д., J, CDCl3): 1.18-1.27 м (4Н, СН2, На - 10, 11, 12, 13); 1.81 уш. с (2Н, СН2, Hb - 11, 12); 2.11 д (2Н, СН2, Hb - 10, 13, J 10 Гц); 2.37 уш. с (2Н, СН, Н - 8, 9); 2.95-3.01 м (8Н, СН2, Н - 6, 6′, 7, 7′), 4.36 уш. с (8Н, СН2, Н - 2, 2′, 4, 4′).
Спектр ЯМР 13С (δ, м.д.): 24.07 (С - 11, 12); 28.16 (С - 10, 13); 37.11 (С - 6, 6′, 7, 7′); 56.78 (С - 2, 2′, 4, 4′), 66.54 (С - 8, 9).
Масс-спектр, m/z (Iотн, %): 351 [М+Н]+ (50%), 349 [М-Н]+ (100%).
Спектральные характеристики
1,4-бис-(1,5,3-дитиазепан-3-ил)циклогексана:
Спектр ЯМР 1Н (δ, м.д., J, CDCl3): 1.30 т (4Н, СН2, На - 9, 10, 12, 13, J 24 и 12 Гц); 2.08 д (4Н, СН2, Hb - 9, 10, 12, 13, J 8 Гц); 2.81 уш. с (2Н, СН, Н - 8, 11); 3.06 уш. с (8Н, СН2, H - 6, 6′, 7, 7′); 4.30 уш. с (8Н, СН2, H - 2, 2′, 4, 4′).
Спектр ЯМР 13С (δ, м.д.): 29.02 (С - 9, 10, 12, 13); 36.33 (С - 6, 6′,7, 7′); 56.88 (С - 2, 2′, 4, 4′); 57.02 (С - 8, 11).
Масс-спектр, m/z (Iотн, %): 351 [М+Н]+ (90%), 349 [М-Н]+ (100%).
Спектральные характеристики
1,3-бис-[(1,5,3-дитиазепан-3-ил)метил]циклогексана:
Спектр ЯМР 1Н (δ, м.д, J, CDCl3): 0.44-0.53 м (1Н, СН2, На - 2), 0.74-0.84 м (2Н, СН2, На - 4, 6), 1.22-1.25 м (1Н, СН2, На - 5), 1.39-1.45 м (2Н, СН, Н - 1, 3), 1.77 уш. с (3Н, СН2, Hb - 4, 5, 6), 1.81-1.88 м (1Н, СН2, Hb - 2), 2.49 т (4Н, СН2, Н-1′, 3′, J 6.8 Гц), 3.04 уш. с (8Н, СН2, Н - 6′, 6′′, 7′, 7′′), 4.13 уш. с (8Н, СН2, Н - 2′, 2′′, 4′, 4′′).
Спектр ЯМР 13С (δ, м.д.): 26.62 (С-5), 31.68 (С - 4, 6), 34.98 (С - 1, 3), 35.85 (С - 6′, 6′′, 7′, 7′′), 36.54 (С - 2), 57.79 (С - 1′, 3′), 60.09 (С - 2′, 2′′, 4′, 4′′).
Масс-спектр, m/z (Iотн, %): 379 [М+Н]+ (20), 377 [М-Н]+ (100).
Способ получения бис-(1,5,3-дитиазепан-3-ил)циклогексанов общей формулы (1): отличающийся тем, что тетракис(метоксиметил)диаминоциклогексаны, такие как (тетракис(метоксиметил)-1,2-диаминоциклогексан, или тетракис(метоксиметил)-1,4-диаминоциклогексан, или тетракис(метоксиметил)-1,3-диаминодиметилциклогексан) подвергают взаимодействию с 1,2-этандитиолом в присутствии катализатора SmCl3·6H2O при мольном соотношении тетракис(метоксиметил)диаминоциклогексан : 1,2-этандитиол : SmCl3·6H2O=1 : 2 : (0.03-0.07) в среде растворителей метанол-хлороформ при комнатной (~20ºC) температуре в течение 2.5-3.5 ч.