Способы определения изотипа антител против лекарственных препаратов
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа определения наличия или уровня по меньшей мере одного изотипа аутоантител к препарату против TNFα в образце, который включает контактирование меченого препарата против TNFα с образцом для формирования меченых комплексов между меченым препаратом против TNFα и каждым изотипом аутоантител; подвергание меченых комплексов эксклюзионной хроматографии для разделения меченых комплексов; и детектирование меченых комплексов. Группа изобретений также касается способа определения наличия или уровня по меньшей мере одного изотипа аутоантител к препарату против TNFα в образце, который включает контактирование меченого препарата против TNFα и одного или нескольких меченых антител против Ig, специфичных к различным изотипам антител, с образцом. Группа изобретений обеспечивает устранение потребности в операциях отмывки, удаляющих HACA и HAHA с низким сродством; уменьшение фона и помех со стороны сыворотки, снижение вероятности любых изменений эпитопа при прикреплении к твердой поверхности типа планшетов для ELISA. 2 н. и 28 з.п. ф-лы, 9 пр., 31 ил., 6 табл.
Реферат
Перекрестная ссылка на родственную заявку
Настоящая заявка претендует на приоритет по Предварительной заявке США №61/394,269, поданной 18 октября 2010 г., содержание которой включено путем ссылки во всей полноте на все случаи.
Уровень техники
Аутоиммунные заболевания являются существенной и широко распространенной медицинской проблемой. Например, аутоиммунным заболеванием является ревматоидный артрит (RA), которым страдают более двух миллионов человек в США. RA вызывает хроническое воспаление суставов и обычно является прогрессирующим заболеванием, которое способно вызвать разрушение суставов и функциональную инвалидность. Причина ревматоидного артрита неизвестна, хотя в этиологию заболевания входят и генетическая предрасположенность, и возбудители инфекции, и факторы окружающей среды. При активном RA симптомы могут включать усталость, отсутствие аппетита, повышенную температуру, мышечные и суставные боли и ригидность. Также во время обострения болезни суставы часто краснеют, опухают, становятся болезненными из-за воспаления синовиальной оболочки. Кроме того, поскольку RA является системным заболеванием, то воспаление может поражать и другие органы и участки тела, помимо суставов, включая железы глаз и ротовой полости, выстилку легких, перикард и кровеносные сосуды.
Традиционными средствами для лечения RA и других аутоиммунных заболеваний являются быстродействующие "препараты первого ряда" и более медленные "препараты второго ряда". Препараты первого ряда уменьшают боль и воспаление. Примеры таких препаратов первого ряда включают аспирин, напроксен, ибупрофен, этодолак и другие нестероидные противовоспалительные средства (NSAIDs), а также кортикостероиды, принимаемые внутрь или вводимые непосредственно в ткани и суставы. Препараты второго ряда способствуют ремиссии заболевания и предотвращают прогрессирующее разрушение суставов, поэтому их также называют модифицирующими заболевание антиревматоидными препаратами или DMARDs. Примеры препаратов второго ряда включают золото, гидрохлорохин, азульфидин и иммуносупрессирующие средства, такие как метотрексат, азатиоприн, циклофосфамид, хлорамбуцил и циклоспорин. Однако многие из этих препаратов могут иметь вредные побочные эффекты. Таким образом, имеется потребность в дополнительных средствах терапии для ревматоидного артрита и других аутоиммунных заболеваний.
α-Фактор некроза опухолей (TNFα) представляет собой цитокин, вырабатываемый многими типами клеток, включая моноциты и макрофаги, который первоначально был идентифицирован по его способности индуцировать некроз некоторых опухолей у мышей. После этого было показано, что фактор, именуемый кахектином и связанный с кахексией, идентичен TNFα. TNFα вовлечен в патофизиологию различных других заболеваний у человека, включая шок, сепсис, инфекции, аутоиммунные заболевания, RA, болезнь Крона, отторжение трансплантата и реакцию трансплантат против хозяина.
Из-за вредной роли TNFα человека (hTNFα) в различных заболеваниях у человека были разработаны терапевтические стратегии для ингибирования или противодействия активности hTNFα. В частности, в качестве средства для ингибирования активности hTNFα потребовались антитела, связывающие и нейтрализующие hTNFα. Одними из самых первых таких антител были мышиные моноклональные антитела (mAbs), секретируемые гибридомами, полученными из лимфоцитов мышей, иммунизированных hTNFα (например, см. U.S. Pat. No.5,231,024). Хотя эти мышиные антитела против hTNFα часто проявляли высокое сродство к hTNFα и были способны нейтрализовать активность hTNFα, однако их применение in vivo было ограниченным из-за проблем, связанных с введением мышиных антител человеку, таких как короткое время жизни в сыворотке, неспособность запускать определенные эффекторные функции у человека и возбуждение нежелательного иммунного ответа против мышиных антител у человека (реакция "антитела человека против мышиных антител" (HAMA)).
Совсем недавно стали применять биологические средства для лечения таких аутоиммунных заболеваний, как ревматоидный артрит. Например, для лечения ревматоидного артрита были одобрены FDA четыре ингибитора TNFα: REMICADE™ (инфликсимаб) - химерное mAb против TNFα, ENBREL™ (этанерцепт) - слитый белок TNFR-Fc Ig, HUMIRA™ (адалимумаб) - mAb человека против TNFα и CIMZIA® (цертолизумаб-пегол) - ПЭГилированный Fab-фрагмент. CIMZIA® также применяется для лечения умеренной или тяжелой болезни Крона (CD). Хотя такие биологические средства и оказались успешными при лечении ревматоидного артрита и других аутоиммунных заболеваний типа CD, однако не все проходившие лечение пациенты поддавались или хорошо поддавались такому лечению.
Кроме того, введение ингибиторов TNFα может индуцировать иммунный ответ к препарату и привести к образованию антител против препарата (ADA), как-то человеческих против химерных антител (HACA), человеческих против гуманизированных антител (HAHA) и человеческих против мышиных антител (HAMA). Такие иммунные ответы типа НАСА, HAHA или HAMA могут быть связаны с реакциями гиперчувствительности и резкими изменениями фармакокинетики и биораспределения иммунотерапевтического ингибитора TNFα, которые воспрепятствуют дальнейшему лечению этим препаратом. Кроме того, присутствие определенных изотипов HACA, HAHA или HAMA связано с различными клиническими результатами у субъектов, получающих лечение против TNFα.
Соответственно, существует потребность в способах выявления наличия или уровня определенного изотипа ADA или определенной комбинации изотипов ADA в образце. Также существует потребность в способах выбора соответствующего курса лечения против TNFα для мониторинга терапии против TNFα и/или для принятия решений по лечению. Настоящее изобретение удовлетворяет эти потребности, а также обеспечивает связанные с этим преимущества.
Сущность изобретения
Настоящим изобретением предусмотрены способы анализа для определения одного или нескольких изотипов антител против лекарственных препаратов (ADA) в образце. В качестве неограничивающего примера способы настоящего изобретения особенно применимы для определения различных изотипов ADA в образцах от ADA-положительных пациентов, получающих препараты против TNFα типа REMICADE™ (инфликсимаб) или HUMIRA™ (адалимумаб). Настоящим изобретением также предусмотрены способы для оптимизации терапии и/или снижения токсичности у субъектов, получающих ингибиторы TNFα для лечения опосредованных TNFα заболеваний.
В одном аспекте настоящим изобретением предусмотрен способ определения наличия (или отсутствия) либо уровня по меньшей мере одного изотипа (например, нескольких изотипов) аутоантител к препарату против TNFα в образце, который включает:
(a) контактирование меченого препарата против TNFα с образцом, содержащим или предположительно содержащим по меньшей мере один изотип аутоантител к препарату против TNFα, для формирования меченых комплексов между меченым препаратом против TNFα и каждым изотипом аутоантител;
(b) подвергание меченых комплексов эксклюзионной хроматографии для разделения меченых комплексов, содержащих различные изотипы аутоантител, друг от друга и/или от свободного меченого препарата против TNFα; и
(c) детектирование меченых комплексов, тем самым определяется наличие (или отсутствие) либо уровень по меньшей мере одного изотипа аутоантител к препарату против TNFα.
В некоторых воплощениях препарат против TNFα выбирают из группы, состоящей из REMICADE™ (инфликсимаб), HUMIRA™ (адалимумаб), ENBREL™ (этанерцепт), CIMZIA® (пертолизумаб-пегол) и их комбинаций. В других воплощениях аутоантитело к препарату против TNFα (например, антитело против препарата, т.е. "ADA") выбирают из группы, состоящей из человеческих против химерных антител (НАСА), человеческих против гуманизированных антител (HAHA), человеческих против мышиных антител (HAMA) и их комбинаций.
В некоторых воплощениях по меньшей мере один изотип содержит несколько из по меньшей мере двух, трех, четырех, пяти или больше изотипов. В других воплощениях по меньшей мере один изотип выбран из группы, состоящей из изотипов IgA, IgD, IgE, IgG и IgM, их подклассов или их комбинаций. В некоторых случаях образец представлен цельной кровью, сывороткой или плазмой.
В некоторых воплощениях аутоантитело к препарату против TNFα представляет собой HACA, а образец взят у субъекта, проходящего лечение препаратом REMICADE™ (инфликсимаб). В некоторых других воплощениях аутоантитело к препарату против TNFα представляет собой HAHA, а образец взят у субъекта, проходящего лечение препаратом HUMIRA™ (адалимумаб).
В некоторых случаях меченый препарат против TNFα представлен препаратом против TNFα, помеченным флуорофором. В определенных воплощениях меченые комплексы выявляются с помощью флуоресцентной метки. В некоторых воплощениях каждый изотип аутоантитела характеризуется или идентифицируется или выявляется по времени удержания. В других воплощениях эксклюзионная хроматография представлена эксклюзионной высокоэффективной жидкостной хроматографией (SE-HPLC).
В одном родственном аспекте настоящим изобретением предусмотрен способ определения наличия (или отсутствия) либо уровня по меньшей мере одного изотипа (например, нескольких изотипов) аутоантител к препарату против TNFα в образце, который включает:
(a) контактирование меченого препарата против TNFα и одного или нескольких меченых антител против Ig, специфичных к различным изотипам антител, с образцом, содержащим или предположительно содержащим по меньшей мере один изотип аутоантител к препарату против TNFα, для формирования меченых комплексов между меченым препаратом против TNFα, мечеными антителами против Ig и каждым изотипом аутоантител, причем меченый препарат против TNFα и меченые антитела против Ig содержат разные метки;
(b) подвергание меченых комплексов эксклюзионной хроматографии для разделения меченых комплексов, содержащих различные изотипы аутоантител, друг от друга, от свободного меченого препарата против TNFα и/или от свободных меченых антител против Ig; и
(c) детектирование меченых комплексов, тем самым определяется наличие (или отсутствие) либо уровень по меньшей мере одного изотипа аутоантител к препарату против TNFα.
В некоторых воплощениях препарат против TNFα выбирают из группы, состоящей из REMICADE™ (инфликсимаб), HUMIRA™ (адалимумаб), ENBREL™ (этанерцепт), CIMZIA® (цертолизумаб-пегол) и их комбинаций. В других воплощениях аутоантитело к препарату против TNFα (например, антитело против препарата, т.е. "ADA") выбирают из группы, состоящей из человеческих против химерных антител (HACA), человеческих против гуманизированных антител (HAHA), человеческих против мышиных антител (HAMA) и их комбинаций.
В определенных воплощениях меченый препарат против TNFα и одно или несколько меченых антител против Ig связываются с различными эпитопами по меньшей мере одного изотипа. В качестве неограничивающего примера меченый препарат против TNFα и меченое антитело против Ig, специфичное к изотипу, связываются с различными эпитопами определенного изотипа аутоантител.
В некоторых воплощениях по меньшей мере один изотип включает несколько из по меньшей мере двух, трех, четырех, пяти или больше изотипов. В других воплощениях по меньшей мере один изотип выбран из группы, состоящей из изотипов IgA, IgD, IgE, IgG и IgM, их подклассов и их комбинаций.
В некоторых воплощениях несколько меченых антител против Ig включают по меньшей мере два, три, четыре, пять или больше меченых антител против Ig, специфичных к различным изотипам антител. В других воплощениях одно или несколько меченых антител против Ig выбраны из группы, состоящей из антител, специфичных к одному или нескольким изотипам IgA, IgD, IgE, IgG и IgM, их подклассам или их комбинациям. В некоторых случаях образец представлен цельной кровью, сывороткой или плазмой.
В некоторых воплощениях аутоантитело к препарату против TNFα представляет собой HACA, а образец взят у субъекта, проходящего лечение препаратом REMICADE™ (инфликсимаб). В некоторых других воплощениях аутоантитело к препарату против TNFα представляет собой HAHA, а образец взят у субъекта, проходящего лечение препаратом HUMIRA™ (адалимумаб).
В некоторых случаях меченый препарат против TNFα представлен препаратом против TNFα, меченным флуорофором. В некоторых других случаях меченые антитела против Ig представлены антителами против Ig, меченными флуорофором. Несколько меченых антител против Ig, специфичных к различными изотипам антител, могут все содержать одну и ту же метку или разные метки. В одном неограничивающем примере несколько меченых антител против Ig, специфичных к изотипу, все помечены Alexa-532, a меченый препарат против TNFα помечен Alexa-488.
В некоторых воплощениях меченые комплексы детектируются с помощью флуоресцентной метки. В определенных воплощениях меченые комплексы детектируются по сигналу, который генерируется при близко расположенном связывании меченого препарата против TNFα и меченых антител против Ig с изотипом аутоантител. В некоторых случаях сигнал составляет флуоресцентный сигнал, который детектируется методом резонансного переноса энергии флуоресценции (FRET). В других воплощениях эксклюзионная хроматография представлена эксклюзионной высокоэффективной жидкостной хроматографией (SE-HPLC). В некоторых воплощениях каждый изотип аутоантител характеризуется или идентифицируется или детектируется по времени удержания.
В следующем аспекте настоящим изобретением предусмотрен способ оптимизации терапии и/или уменьшения токсичности у субъекта, проходящего курс терапии для лечения опосредованного TNFα заболевания, который включает:
(a) анализ образца, взятого у субъекта, для определения наличия, уровня или генотипа одного или нескольких маркеров в образце;
(b) применение статистического алгоритма к наличию, уровню или генотипу одного или нескольких маркеров, определенных на стадии (a); и
(c) определение последующей дозы курса терапии для субъекта или же того, что следует назначить другой курс терапии для субъекта на основании статистического алгоритма, примененного на стадии (b).
В качестве неограничивающего примера можно выявлять, измерять или определять наличие, уровень или генотип одного, двух, трех, четырех, пяти или всех шести из следующих классов биохимических маркеров, серологических маркеров и/или генетических маркеров в образцах пациентов (например, образцах сыворотки пациентов, проходящих терапию препаратом против TNF):
(1) уровень препарата против TNF (например, уровень свободного лечебного антитела против TNFα);
(2) уровень антител против препарата (ADA) (например, уровень аутоантител к препарату против TNF);
(3) уровень TNFα;
(4) уровень одного, двух, трех, четыре, пяти, шести, семи или больше дополнительных цитокинов (например, IL-6, IL-1β, IFN-γ, IL-10 и т.д.) и/или маркеров для других механизмов воспаления (например, таких маркеров воспаления, как CRP, SAA, ICAM-1 и/или VCAM-1);
(5) наличие или отсутствие одной или нескольких мутаций у одного или нескольких генетических маркеров типа генов воспалительного пути, например, наличие или отсутствие вариантов аллелей (например, SNPs) у одного или нескольких маркеров воспаления, таких, например, как NOD2/CARD15 (например, SNP 8, SNP 12 и/или SNP 13, описанных в патенте США No.7,592,437), ATG16L1 (например, SNP rs2241880 (T300A), описанного в Lakatos et al., Digestive and Liver Disease, 40 (2008) 867-873), SNP IL23R (например, rs11209026 (R381Q), описанного в Lakatos et al.), генов антигенов лейкоцитов человека (HLA) и/или генов цитокинов, описанных, например, в Gasche et al. (Eur. J. Gastroenterology & Hepatology, (2003) 15:599-606), и генов DLG5 и/или OCTN из локуса IBD5;
(6) уровень одного или нескольких биохимических маркеров и/или серологических маркеров в различные моменты времени (например, через 28 недель, 60 недель и т.д.); и
(7) их комбинации.
В определенных воплощениях можно затем применить один статистический алгоритм или комбинацию из двух или нескольких статистических алгоритмов к наличию, уровню (уровню концентрации) или генотипу одного или нескольких (например, комбинации из двух, трех, четырех, пяти, шести, семи или больше) маркеров, выявленных, измеренных или определенных в образце, чтобы тем самым оптимизировать терапию, уменьшить токсичность и/или проконтролировать эффективность терапевтического лечения препаратом против TNF. При этом способы настоящего изобретения найдут применение при определении лечения пациента путем определения иммунного статуса пациента.
Способы выявления препаратов против TNF (например, антител против TNFα) и антител к препаратам (ADA), таких как HACA и HAHA, дополнительно описаны в публикации РСТ No. WO 2011/056590, содержание которого включено сюда путем ссылки во всей полноте на все случаи.
Другие цели, особенности и преимущества настоящего изобретения станут понятны специалистам в данной области из следующего подробного описания и фигур.
Краткое описание фигур
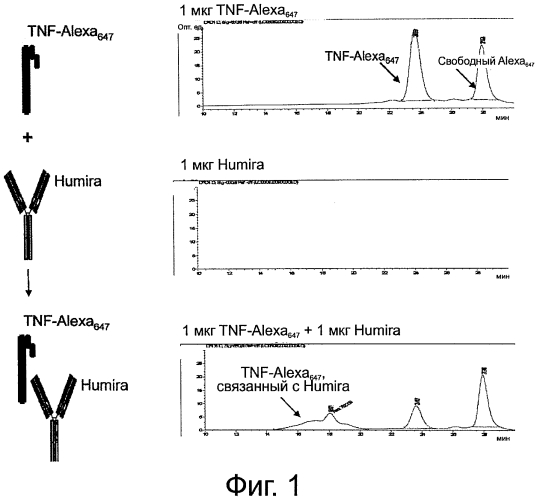
На фиг.1 представлено типичное воплощение способов настоящего изобретения, в котором для определения связывания между TNFα-Alexa647 и HUMIRA™ применяется эксклюзионная HPLC.
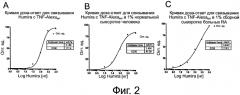
На фиг.2 представлены кривые доза-ответ для связывания HUMIRA™ с TNFα-А1еха647.
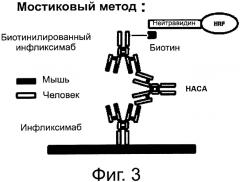
На фиг.3 представлен современный метод на основе ELISA для измерения уровня HACA, известный как мостиковый метод (bridging assay).
На фиг.4 представлена типичная схема способов выявления аутоантител по настоящему изобретению для измерения концентрации HACA/HAHA, образовавшихся против REMICADE™.
На фиг.5 представлен анализ типа доза-ответ для связывания антител против IgG человека с REMICADE™-Alexa647.
На фиг.6 представлен второй анализ доза-ответ для связывания антител против IgG человека с REMICADE™-Alexa647.
На фиг.7 представлены кривые доза-ответ для связывания антител против IgG человека с REMICADE™-Alexa647.
На фиг.8 представлено образование иммунокомплекса REMICADE™-Alexa647 в нормальной сыворотке человека и HACA-положительной сыворотке.
На фиг.9 приведена сводка по измерению HACA в образцах сыворотки от 20 пациентов, которые проводились с использованием мостикового метода или анализом изменения подвижности по настоящему изобретению.
На фиг.10 приведена сводка и сравнение текущих способов измерения концентрации HACA в сыворотке и нового способа анализа HACA по настоящему изобретению.
На фиг.11 представлены профили SE-HPLC меченного флуорофором (F1) IFX при инкубации с нормальной (NHS) или HACA-положительной (HPS) сывороткой. При добавлении в инкубационную смесь возрастающих количеств HACA-положительной сыворотки пик IFX-F1 смещается дозозависимым образом к более высокомолекулярным положениям элюции С1 и С2.
На фиг.12 представлены кривые доза-ответ связанного и свободного IFX-F1, образовавшегося при возрастающих разведениях HACA-положительной сыворотки, при определении анализом изменения подвижности. (А) Возрастающие разведения HACA-положительной сыворотки инкубировали с 37,5 нг IFX-F1. Чем больше разведение (меньше HACA), тем больше свободного IFX-F1 обнаруживается при SE-HPLC. (В) Возрастающие разведения HACA-положительной сыворотки инкубировали с 37,5 нг IFX-F1. Чем больше разведение (меньше HACA), тем меньше связанного с НАСА IFX-F1 обнаруживается при SE-HPLC.
На фиг.13 представлены профили SE-HPLC для TNFα-F1 при инкубации с нормальной (NHS) или сывороткой с добавлением IFX. При добавлении в инкубационную смесь возрастающих количеств сыворотки дополненной IFX, пик флуоресценции TNFα сдвигается дозозависимым образом к более высокомолекулярным положениям элюции.
На фиг.14 представлено кривые доза-ответ связанного и свободного TNFα, полученные при возрастающих разведениях сыворотки с IFX, при определении анализом изменения подвижности. При повышении концентрации IFX в инкубационной смеси снижается процент свободного TNFα, а процент связанного TNFα увеличивается.
На фиг.15 представлено измерение относительного уровня HACA и концентрации IFX у пациентов IBD, получавших IFX, в различные моменты времени анализом изменения подвижности.
На фиг.16 представлено лечение пациентов - измерение уровня HACA и концентрации IFX в сыворотке пациентов IBD, получавших IFX, в различные моменты времени.
На фиг.17 представлены типичные воплощения способов анализа по настоящему изобретению для выявления наличия (A) не нейтрализующих или (B) нейтрализующих аутоантител типа HACA.
На фиг.18 представлено альтернативное воплощение способов анализа по настоящему изобретению для выявления наличия (A) не нейтрализующих или (B) нейтрализующих аутоантител типа HACA.
На фиг.19 представлены профили изменения подвижности у F1-меченных ADL при инкубации с нормальной сывороткой человека (NHS) в присутствии различных количеств антител против IgG человека. При добавлении в инкубационную смесь возрастающих количеств антител против IgG человека пик свободного F1-ADL (FA) дозозависимым образом смещается к более высокомолекулярным положениям элюции С1 и С2, тогда как внутренний контроль (IC) не изменяется.
На фиг.20 представлена кривая доза-ответ антител против IgG человека на смещение свободного F1-ADL. Возрастающие количества антител против IgG человека инкубировали с 37,5 нг F1-ADL и внутреннего контроля. Чем больше антител добавляли в реакционную смесь, тем меньше было соотношение свободного F1-ADL к внутреннему контролю.
На фиг.21 представлены профили изменения подвижности у F1-меченного TNF-α при инкубации с нормальной сывороткой человека (NHS) в присутствии различных количеств ADL. Ex=494 нм; Em=519 нм. При добавлении в инкубационную смесь возрастающих количеств ADL пик свободного TNF-F1 (FT) дозозависимым образом смещается к более высокомолекулярным положениям элюции, тогда как пик внутреннего контроля (IC) не изменяется.
На фиг.22 представлена кривая доза-ответ ADL на смещение свободного TNF-α-F1. Возрастающие количества ADL инкубировали с 100 нг TNF-α-F1 и внутреннего контроля. Чем больше антител ADL добавляли в реакционную смесь, тем меньше было отношение свободного TNF-α-F1 к внутреннему контролю.
На фиг.23 представлено время элюирования различных изотипов ADA в HACA-положительной сыворотке пациентов.
На фиг.24 представлен усредненный график для 100 контрольных образцов, использовавшихся в исследовании, описанном в Примере 8.
На фиг.25 представлено усредненный график для 100 HACA-положительных образцов, использовавшихся в исследовании, описанном в Примере 8.
На фиг.26 представлено параллельное сравнение сигналов главного пика (т.е. соответствующих интенсивности сигнала меченого Remicade) для 100 контрольных образцов и 100 HACA-положительных образцов, использовавшихся в исследовании, описанном в Примере 8.
На фиг.27 представлена характеристическая кривая обнаружения (ROC) для данных по главному пику из фиг.26. Площадь под кривой (AUC) составила 0,986.
На фиг.28 представлен график второстепенных пиков на оси X (что соответствует сумме пиков IgG, IgA и IgM) относительно главного пика на оси Y для 100 HACA-положительных образцов, использовавшихся в исследовании, описанном в Примере 8.
На фиг.29 представлен график пиков IgG относительно IgA и IgM для всех 200 образцов, использовавшихся в исследовании, описанном в примере 8.
На фиг.30 представлена схема формата определения изотипа аутоантител методом резонансного переноса энергии флуоресценции (FRET).
На фиг.31 представлены результаты определения изотипа аутоантител на основе FRET по настоящему изобретению.
Раскрытие сущности изобретения
Введение
TNFα участвует в воспалительных заболеваниях, аутоиммунных заболеваниях, вирусных, бактериальных и паразитических инфекциях, злокачественных опухолях и/или нейродегенеративных заболеваниях и является полезной мишенью для специфической биологической терапии при таких заболеваниях, как ревматоидный артрит (RA) и болезнь Крона (CD). Ингибиторы TNFα, как-то антитела против TNFα, представляют собой важный класс терапевтических препаратов. Однако введение ингибиторов TNFα может вызвать иммунный ответ к препарату и привести к образованию антител против препарата (ADA), тем самым исключая дальнейшее лечение препаратом. Кроме того, присутствие определенных изотипов ADA может быть связано с различными клиническими результатами у субъектов, получающих терапию против TNFα.
Настоящее изобретение частично основывается на открытии того, что метод гомогенного изменения подвижности при помощи эксклюзионной хроматографии особенно предпочтителен для измерения наличия или уровня одного или нескольких изотипов ADA в образце. В качестве неограничивающего примера: способы настоящего изобретения особенно применимы для определения различных изотипов ADA в образцах от ADA-положительных пациентов, получающих препарат против TNFα типа REMICADE™ (инфликсимаб) или HUMIRA™ (адалимумаб).
В частности, настоящим изобретением предусмотрены способы определения изотипа ADA типа "смешать и измерить", которые не требуют никаких стадий отмывки. При этом образовавшие комплексы и некомплексированные реагенты легко отделяются друг от друга. Кроме того, при использовании способов настоящего изобретения сводятся к минимуму любые возможные помехи со стороны свободного препарата против TNFα. Напротив, типичный метод ELISA для измерения уровня аутоантител невозможно выполнять, пока ингибитор TNFα не будет удален из организма, что может занять до 3 месяцев. Более того, настоящее изобретение в общем приложимо к широкому спектру препаратов против TNFα наряду с антителами против TNFα. Способы настоящего изобретения также дают преимущество в том, что они не требуют прикрепления антигенов к твердой поверхности, устраняют неспецифическое связывание посторонних IgG, детектируют антитела со слабым сродством и проявляют повышенную чувствительность и специфичность перед доступными в настоящее время методами детектирования типа ферментного иммуноанализа.
Важность измерения концентрации биопрепаратов против TNFα (например, антител против TNFα) в сыворотке, а также аутоантител, вырабатываемых против них (например, изотипов ADA), иллюстрируется тем, что FDA требует проводить фармакокинетические исследования и исследования на толерантность (например, иммунный ответ) во время клинических испытаний. Настоящее изобретение также находит применение при мониторинге пациентов, получающих эти лекарства, чтобы удостовериться, что они получают правильную дозу, что препарат не выводится из организма слишком быстро и что у них не развивается иммунный ответ против препарата. Более того, настоящее изобретение применимо для назначения перехода на другие лекарства вследствие несостоятельности первоначального препарата.
Настоящим изобретением также предусмотрены способы оптимизации терапии и/или уменьшения токсичности у субъектов, получающих ингибиторы TNFα для лечения опосредованных TNFα заболеваний. Кроме того, настоящее изобретение особенно предпочтительно тем, что оно направлено на и преодолевает существующие ограничения, связанные с применением таких препаратов против TNF, как инфликсимаб или адалимумаб, в частности, оно обеспечивает информацию, полезную для принятия решений по лечению для тех пациентов, которые получают или будут получать лечение препаратом против TNF,
Определения
В настоящем изобретении следующие термины имеют приданные им значения, если не указано иначе.
Термин "TNFα" в настоящем изобретении служит для обозначения цитокина человека, существующего в виде секретируемой формы в 17 кД и мембраносвязанной формы в 26 кД, биологически активная форма которого состоит из тримера нековалентно связанных молекул в 17 кД. Структура TNFα описана более подробно, к примеру, в Jones et al. (1989) Nature, 338:225-228. Термин TNFα охватывает TNFα, рекомбинантный TNFα человека (rhTNFα) или полипептид, идентичный примерно на 80% белку TNFα человека. TNFα человека состоит из цитоплазматического домена из 35 аминокислот (а.к.), трансмембранного сегмента из 21 а.к. и внеклеточного домена из 177 а.к. (ECD) (Pennica et а1. (1984) Nature 312:724). В пределах ECD аминокислотная последовательность TNFα человека на 97% идентична TNFα макаки резус и на 71-92% TNFα быка, собаки, хлопкового хомяка, лошади, кошки, мыши, свиньи и крысы. TNFα можно получить стандартными методами рекомбинантной экспрессии или приобрести коммерческим путем (например, R&D Systems, кат. №210-ТА, Minneapolis, Minn.).
Термин "ингибитор TNFα" или "препарат против TNFα" охватывает средства, в том числе белки, антитела, фрагменты антител, слитые белки (например, слитые белки Ig или слитые белки Fc), мультивалентные связывающие белки (например, DVD-Ig), небольшие молекулы-антагонисты TNFα и подобные им природные или искусственные молекулы и/или их рекомбинантные и/или сконструированные формы, которые, прямо или косвенно, ингибируют активность TNF-α, как-то ингибируют взаимодействие TNFα с рецептором TNFα на клеточной поверхности, ингибируют вырабатывание белка TNFα, ингибируют экспрессию гена TNFα, ингибируют секрецию TNFα из клеток, ингибируют сигнализацию через рецептор TNFα или любым другим образом приводят к снижению активности TNFα у субъекта. Термин "ингибитор TNFα" или "препарат против TNFα" предпочтительно охватывает средства, которые нарушают активность TNFα. Примеры препаратов против TNFα включают этанерцепт (ENBREL™, Amgen), инфликсимаб (REMICADE™, Johnson and Johnson), моноклональное антитело человека против TNF адалимумаб (D2E7/HUMIRA™, Abbott Laboratories), CDP 571 (Celltech) и CDP 870 (Celltech), а также другие соединения, ингибирующие активность TNFα таким образом, что при введении субъекту, страдающему или подвергающемуся риску возникновения заболевания, при котором активность TNFα вредна (например, RA), происходит лечение заболевания.
Термин "изотип иммуноглобулина" или "изотип антитела" охватывает любых представителей семейства родственных антител, содержащих генетические вариации и/или различия в константных областях тяжелой и/или легкой цепи. Неограничивающие примеры изотипов антител включают: (1) изотипы тяжелой цепи, как-то α (например, IgA или его подкласс типа IgA1 и/или IgA2); δ (например, IgD); γ (например, IgG или его подкласс типа IgG1, IgG2, IgG3 и/или IgG4); ε (например, IgE); µ (например, IgM); и (2) изотипы легкой цепи, как-то κ и λ.
Термин "эксклюзионная хроматография" (SEC) служит для обозначения метода хроматографии, при котором молекулы в растворе разделяются на основе их размера и/или гидродинамического объема. Он применяется к большим молекулам или макромолекулярным комплексам типа белков и их конъюгатов. Как правило, если для пропускания образца через колонку используется водный раствор, то метод называется гель-фильтрационная хроматография.
Термины "комплекс", "иммунокомплекс", "конъюгат" и "иммуноконъюгат" включают, без ограничения, TNFα, связанный (например, нековалентным образом) с препаратом против TNFα, препарат против TNFα, связанный (например, нековалентным образом) с аутоантителом к препарату против TNFα, препарат против TNFα, связанный (например, нековалентным образом) и с TNF-α, и с аутоантителом к препарату против TNFα, препарат против TNFα, связанный (например, нековалентным образом) с изотипом аутоантитела к препарату против TNFα, и препарат против TNFα и специфичное к изотипу Ig антитело, связанные (например, нековалентным образом) с изотипом аутоантитела к препарату против TNFα.
В настоящем изобретении то, что определяется термином "меченые", включает любые частицы, молекулы, белки, ферменты, антитела, фрагменты антител, цитокины и им подобные, конъюгированные с другой молекулой или химической частицей, которая поддается детектированию. Химические вещества, пригодные в качестве метки для меченых частиц, включают, без ограничения, флуоресцентные красители (например, красители Alexa Fluor® типа Alexa Fluor® 488, 532 или 647, квантовые точки, оптические красители, люминесцентные красители и радионуклиды, например, 125I.
Выражение "детектирование флуоресцентной метки" включает средство детектирования флуоресцентной метки. Средства детектирования включают, без ограничения, спектрометры, флуориметры, фотометры, детектирующие устройства, обычно встроенные в прибор для хроматографии, в том числе эксклюзионной или высокоэффективной жидкостной хроматографии, к примеру, установку Agilent-1200 HPLC System.
Термин "оптимизация терапии" или "оптимизировать терапию" включает оптимизацию дозы (например, эффективного количества или уровня) и/или типа определенной терапии. Например, оптимизация дозы препарата против TNFα включает увеличение или уменьшение количества препарата против TNFα, впоследствии вводимого пациенту. В некоторых случаях оптимизация типа препарата против TNFα включает замену одного вводимого препарата против TNFα на другой препарат (например, другой препарат против TNFα). В некоторых других случаях оптимизация терапии включает совместное введение дозы препарата против TNFα (например, в большей, меньшей или той же самой дозе, что и предыдущая доза) в комбинации с иммуносупрессорным препаратом.
Термин "курс терапии" включает любые терапевтические подходы, предпринимаемые для ослабления или предотвращения одного или нескольких симптомов, связанных с вызванным TNFα заболеванием. Термин охватывает назначение любого соединения, препарата, процедуры и/или режима, полезных для улучшения здоровья индивида с вызванным TNFα заболеванием, и включает любые описанные здесь терапевтические средства. Специалистам должно быть известно, что можно изменить сам курс лечения или дозу при текущем курсе лечения (например, увеличить или уменьшить), исходя из присутствия или уровня концентрации TNFα, препарата против TNFα и/или антител к препарату с использованием способов настоящего изобретения.
Термин "иммуносупрессорное средство" охватывает любые вещества, способные давать иммунодепрессивный эффект, например, предотвращение или уменьшение иммунного ответа, как-то при облучении или при введении таких лекарств, как антиметаболиты, антилимфоцитарная сыворотка, антитела и т.д. Примеры подходящих иммуносупрессорных средств включают, без ограничения, тиопуриновые препараты типа азатиоприна (AZA) и его метаболитов, антиметаболиты типа метотрексата (МТХ); сиролимус (рапамицин); темсиролимус; эверолимус; такролимус (FK-506); FK-778; антилимфоцитарные глобулиновые антитела, антитимоцитарные глобулиновые антитела, антитела против CD3, антитела против CD4 и конъюгаты типа антитело-токсин; циклоспорин; микофенолат; мизорибин монофосфат; скопарон; глатирамер ацетат; их метаболиты; их фармацевтически приемлемые соли; их производные; их пролекарственные формы; и их комбинации.
Термин "тиопуриновый препарат" охватывает азатиоприн (AZA), 6-меркаптопурин (6-МР) и любые их метаболиты, обладающие терапевтической эффективностью, в том числе 6-тиогуанин (6-TG), 6-метилмеркаптопурин-рибозид, 6-тиоинозиновые нуклеотиды (например, 6-тиоинозин монофосфат, 6-тиоинозин дифосфат, 6-тиоинозин трифосфат), 6-тиогуаниновые нуклеотиды (например, 6-тиогуанозин монофосфат, 6-тиогуанозин дифосфат, 6-тиогуанозин трифосфат), 6-тиоксантозиновые нуклеотиды (например, 6-тиоксантозин монофосфат, 6-тиоксантозин дифосфат, 6-тиоксантозин трифосфат), их производные, их аналоги и их комбинации.
Термин "образец" охватывает любые биологические образцы, взятые у индивида. Подходящими для применения в настоящем изобретении образцами являются, без ограничения, цельная кровь, плазма, сыворотка, слюна, моча, кал, слезы и другие жидкости организма, образцы тканей (например, биоптаты) и их клеточные экстракты (например, экстракт эритроцитов). В предпочтительном воплощении образец представлен образцом сыворотки. Специалистам должно быть известно, что образцы, как-то образцы сыворотки, можно разводить перед анализом. В некоторых случаях термин "образец" включает, без ограничения, кровь, ткань организма, сыворотку крови, лимфу, ткань лимфатических узлов, ткань селезенки, костный мозг или обогащенную иммуноглобулином фракцию из одной или нескольких этих тканей. В некоторых других случаях термин "образец" включает сыворотку крови или обогащенную иммуноглобулином фракцию, полученную из сыворотки крови или самой крови. В некоторых случаях термин "образец" включает жидкость организма.
Термин "прогнозирование восприимчивости к ингибитору TNFα" обозначает способность оценить вероятность того, что лечение субъекта ингибитором TNFα будет или не будет эффективным (например, принесет ощутимую пользу) для субъекта. В частности, такая способность оценить вероятность того, что лечение будет или не будет эффективным, как правило, применяется после того, как лечение уже началось и у субъекта наблюдался показатель эффективности (например, показатель ощутимой пользы). Особенно предпочтительными ингибиторами TNFα являются биологические пр