Процесс выделения целевого олигонуклеотида из смеси
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу выделения целевого олигонуклеотида из смеси целевого олигонуклеотида и одной или более примесей. Способ включает выделение олигонуклеотида из смеси с применением двухфазной жидкость-жидкостной хроматографической системы подвижная фаза/неподвижная фаза. Подвижная фаза содержит олигонуклеотид, а неподвижная фаза содержит вещество-обменник, которое устраняемо связывается с целевым олигонуклеотидом. Осуществляют контакт подвижной фазы с неподвижной фазой в приборе для жидкость-жидкостной хроматографии, так что олигонуклеотид становится связанным с веществом-обменником в жидкой неподвижной фазе. Олигонуклеотид вытесняют из жидкой неподвижной фазы во вторую жидкую подвижную фазу посредством вещества-вытеснителя, способного к вытеснению олигонуклеотида из неподвижной фазы во вторую подвижную фазу. Предложенное изобретение позволяет с высокой эффективностью выделить целевой олигонуклеотид из смеси целевого олигонуклеотида и одной или более примесей. 19 з.п. ф-лы, 5 ил., 1 табл., 3 пр.
Реферат
Данное изобретение относится к новому процессу, в частности к процессу отделения олигонуклеотидов от химических примесей с применением жидкостно-жидкостной хроматографии без подложки.
Олигонуклеотиды содержат относительно короткие последовательности полимерных нуклеиновых кислот, которые могут являться ДНК или РНК, как правило, с пятьюдесятью или меньшим количеством оснований, хотя в настоящее время могут быть синтезированы олигонуклеотиды с вплоть до приблизительно 200 оснований. Олигонуклеотиды применяются в терапии. Синтетический РНК олигонуклеотид, обозначенный компанией Prosensa их обозначением PR0051 и авторами данного изобретения обозначением GSK2402968, имеет последовательность 5'-uca agg aag aug gca uuu ca-3'. Этот олигонуклеотид является антисмысловым олигонуклеотидом, т.е. одиночной нитью ДНК или РНК, которая является комплементарной выбранной последовательности. Считается, что он индуцирует перескакивание экзона 51, и он проходит рассмотрение в Фазе III клинического исследования для лечения в амбулаторных условиях мальчиков с мышечной дистрофией Дюшенна (МДД).
Проблемой для таких олигонуклеотидов является их очистка от примесей. Например, вышеупомянутый GSK2402968 является 20-мером, и в течение его синтеза он может стать загрязненным примесями, включая другие олигонуклеотиды, включая короткомерные и длинномерные, например, содержащие 17, 18, 19 и 21 оснований. Другие примеси также могут присутствовать.
Желательно предоставить процесс выделения таких олигонуклеотидов, который эффективен и применим в промышленном масштабе производства. В "Therapeutic oligonucleotides: The state of the art in purification technologies". Sanghvi et. al. Current Opinion in Drug Discovery (2004), Vol. 7, No. 8 рассматриваются процессы, применяемые для очистки олигонуклеотидов. В литературе раскрыты другие процессы. Для очистки последовательностей ДНК и РНК применялись различные процессы. В WO-A-01/55160 раскрывается очистка олигонуклеотидов образованием иминовых связей с загрязняющим веществами с последующим удалением имин-связанных примесей посредством хроматографии или других технологий. "Size Fractionation of DNA Fragments Ranging from 20 to 30000 Base Pairs by Liquid/Liquid chromatography". Muller et al. Eur. J. Biochem (1982), 128-238 раскрывает применение твердой колонки из микрокристаллической целлюлозы, на которую была нанесена фаза ПЭГ/декстран для отделения нуклеотидных последовательностей. "Separation and identification oligonucleotides by hydrophilic interaction chromatography". Easter et. al. The Analyst (2010); 135(10) раскрывает выделение олигонуклеотидов с использованием варианта ВЭЖХ с применением фазы подложки из твердого силикагеля. "Fractionation of oligonucleotides of yeast soluble ribonucleic acids by countercurrent distribution". Doctor et al. Biochemistry (1965), 4(1), 49-54 раскрывает применение сухой твердой колонки, наполненной сухой ДЭАЭ-целлюлозой. "Oligonucleotide composition of a yeast lysine transfer ribonucleic acids". Madison et al; Biochemistry, 1974, 13(3) раскрывает применение твердофазной хроматографии для выделения нуклеотидных последовательностей. Статья в Википедии http://en.wikipedia.org/wiki/Hydrophilic interaction chromatography раскрывает применение хроматографии гидрофильных взаимодействий для выделения биомолекул с применением твердой силикагелевой подложки.
Жидкость-жидкостная хроматография является известным способом выделения. Жидкость-жидкостная хроматография использует двухфазную жидкостную систему, содержащую неподвижную жидкую фазу, удерживаемую в удлиненной колонке (аналогично твердой фазе, размещенной в трубчатой колонке в обычно применяемой хроматографии), и подвижную жидкую фазу, которую пропускают через колонку в контакте с неподвижной фазой. Во время такого протекания вещества будут распределяться между подвижной и неподвижной фазами образом, аналогичным обычно применяемому в твердофазной хроматографии. В технологиях жидкость-жидкостной хроматографии подвижная фаза элюирует вещества, которые нужно разделить, во фракциях аналогично обычно применяемой жидко-твердофазной хроматографии. В жидкостно-жидкостной хроматографии процесс обычно функционирует без подложки, т.е. не требуется твердая несущая матрица для поддержки жидких фаз, которые поддерживаются в контакте с другом во время процесса посредством центробежной силы внутри вращающейся колонки. "Countercurrent Chromatography - The Support-Free Liquid Stationary Phase". Billardello, В.; Berthod, A; Wilson & Wilson's Comprehensive Analytical Chemistry 38; Berthod, A., Ed.; Elsevier Science B.V.: Amsterdam (2002), pp. 177-200 предоставляет пригодное общее описание жидкость-жидкостной хроматографии.
Известны различные технологии жидкость-жидкостной хроматографии.
Одной из технологий является жидкость-жидкостная противоточная хроматография (обозначенная в данном документе "ПТХ"). В приборе для ПТХ кольцевая, например винтовая или спиральная, трубчатая колонка, как правило, постоянного диаметра вращается как вокруг ее центра вращения, так и вокруг оси вращения, перемещенной от ее центра, т.е. так называемое планетарное вращение. Это комбинированное движение создает осциллирующие поля центробежной силы в колонке, что приводит к смешанным и несмешанным зонам вдоль колонки. Типичный прибор для ПТХ раскрыт в WO-A-03/086639 (Brunei University).
Другой известной технологией является центробежная распределительная хроматография (обозначенная в данном документе "ЦРХ"). В US-A-6537452 и WO-A-2010/059715 предлагается возможность применения ЦРХ для отделения биологических молекул. "High Performance Centrifugal Partition Chromatography", 2005 (online: http://web.archive.Org/web/20050208201013/http://everseko.co.ip/p02.html) и "Applications of Liquid-Liquid Chromatography Instrumentation for Laboratory Preparative & Process Chemistry". Brown et al. Chromatography Today (Nov-Dec 2009), 16-19 являются обзорными статьями о ЦРХ. "Anion-Exchange Displacement Centrifugal Partition Chromatography". Maciuk et al., Anal. Chem. (2004) 76, 6179-6186 раскрывает процесс вытеснительной хроматографии, в котором изомеры гидроксикоричной кислоты разделяются посредством обеспечения вещества-обменника (удерживателя) в неподвижной фазе для устраняемого удерживания гидроксикоричной кислоты на неподвижной фазе, с вытеснением затем ее из неподвижной фазы с применением вещества-вытеснителя.
Коммерчески доступны многочисленные типы приборов для ЦРХ, например у Kromaton, участника Rousselet Robatel Group. Как правило, прибор для ЦРХ содержит колонку, содержащую многочисленные (иногда вплоть до 1000) маленькие полости, иногда называемые "распределительные ячейки", которые упорядочены по окружности в одну или более окружностей для вращения вокруг оси вращения, при этом эти распределительные ячейки взаимосвязаны каналами потока, так что можно вызвать протекание жидкости через них последовательно. В одном известном расположении множественные распределительные ячейки вытравлены или обработаны вокруг диска, например, изготовленного из металла, такого как нержавеющая сталь, и множественные диски уложены вдоль их центральной оси вращения для образования ротора, который может вращаться вокруг оси вращения. Такие формы прибора ЦРХ, имеющие относительно немного уложенных дисков и относительно больший объем распределительных ячеек, иногда называются центробежные распределительные экстракторы ("ЦРЭ"). Типичные приборы для ЦРХ, например, раскрыты в US-A-6537452 (Kromaton), WO-A-2004/079363 (Partus) и в другой научной и технической литературе.
В процессе ЦРХ жидкая фаза вводится в ряд распределительных ячеек и каналов, в то время как кольцо(а) распределительных ячеек вращается вокруг оси вращения. Это вращение является причиной центробежной силы, которая удерживает эту фазу, неподвижную фазу, на месте. Затем вторую жидкую фазу, подвижную фазу, можно привести к протеканию через распределительные ячейки, и вещество, растворенное в подвижной фазе, посредством этого можно привести к распределению между подвижной и неподвижной фазами образом, аналогичным способу, в котором вещество распределяется между подвижным элюентом и неподвижной твердой фазой в колоночной хроматографии.
Прибор для жидкость-жидкостной хроматографии может быть использован или в так называемом "нисходящем" или "восходящем" режиме. Когда колонка вращается, если подвижная и неподвижная фазы имеют различные плотности, центробежная сила, генерируемая вращением, вызывает то, что более плотная фаза становится радиально более наружной от оси вращения колонки, чем менее плотная фаза. Если в таком приборе подвижная фаза является более плотной, радиально более наружной фазой, то это обозначается как "нисходящий режим" функционирования. В противном случае, т.е. подвижная фаза является менее плотной, радиально более внутренней фазой, это обозначается "восходящий режим".
ЦРХ была использована для отделения различных типов веществ. Например, разделение глюкозинолатов (органические соединения, получаемые из глюкозы и аминокислоты) описано в Toribio A, Nuzillard J-M, Renault J-H; Journal of Chromatography A. 1170 (2007), 44-51. Например, очистка пептидов с применением ЦРХ раскрыта в WO-A-2011/157803.
Задача данного изобретения заключается в предоставлении процесса с применением жидкость-жидкостной хроматографии для отделения олигонуклеотидов от примесей, который как эффективен в выделении, так и пригоден для применения в масштабе промышленного производства.
В соответствии с данным изобретением способ для выделения целевого олигонуклеотида из смеси целевого олигонуклеотида и одной или более примесей содержит:
предоставление двухфазной жидкость-жидкостной хроматографической системы подвижная фаза - неподвижная фаза, содержащей первую жидкую подвижную фазу и жидкую неподвижную фазу, содержащую по меньшей мере одно вещество-обменник, которое устраняемо связывается с целевым олигонуклеотидом;
вызывание переноса первой жидкой подвижной фазой целевого олигонуклеотида в потоке относительно и в контакте с жидкой неподвижной фазой в колонке прибора для жидкость-жидкостной хроматографии, так что целевой олигонуклеотид становится связанным с веществом-обменником в жидкой неподвижной фазе;
далее вытеснение целевого олигонуклеотида из жидкой неподвижной фазы во вторую жидкую подвижную фазу, протекающую относительно и в контакте с неподвижной фазой через колонку посредством вещества-вытеснителя, способного вытеснить целевой олигонуклеотид из жидкой неподвижной фазы во вторую подвижную фазу.
Впоследствии целевой олигонуклеотид может быть выделен из второй подвижной фазы.
В одном варианте осуществления способа вызывание переноса первой жидкой подвижной фазой целевого олигонуклеотида в потоке может быть достигнуто предоставлением первой жидкой подвижной фазы, содержащей целевой олигонуклеотид, например, с целевым олигонуклеотидом, растворенным в ней.
В одном варианте осуществления способа, подходящем для ЦРХ, способ содержит этапы:
(1) предоставление первой жидкой фазы, содержащей целевой олигонуклеотид и одну или более примесей в растворе, и второй жидкой фазы, содержащей вещество-обменник, которое устраняемо связывается с целевым олигонуклеотидом, при этом первая и вторая жидкие фазы образуют две отдельные фазы при контакте друг с другом;
(2) введение второй жидкой фазы в прибор для центробежной распределительной хроматографии с неподвижной жидкой фазой в нем;
(3) введение первой жидкой фазы, содержащей целевой олигонуклеотид и одну или более примесей в растворе, в прибор для центробежной распределительной хроматографии в качестве первой подвижной фазы и вызывание протекания этой первой жидкой фазы через прибор для центробежной распределительной хроматографии в контакте со второй жидкой фазой, так что целевой олигонуклеотид становится устраняемо связанным с веществом-обменником во второй жидкости, неподвижной жидкой фазе;
(4) введение жидкой фазы, которая образует отдельную фазу при контакте со второй жидкой фазой и которая содержит в растворе по меньшей мере одно вещество-вытеснитель, способное к вытеснению целевого олигонуклеотида из второй жидкой фазы, в прибор для центробежной распределительной хроматографии в виде второй подвижной фазы и вызывание протекания этой второй подвижной фазы через прибор для центробежной распределительной хроматографии в контакте с неподвижной жидкой фазой, так что целевой олигонуклеотид становится вытесненным из неподвижной фазы и поступает в раствор во второй подвижной фазе;
(5) выделение вытесненного целевого олигонуклеотида из второй подвижной фазы.
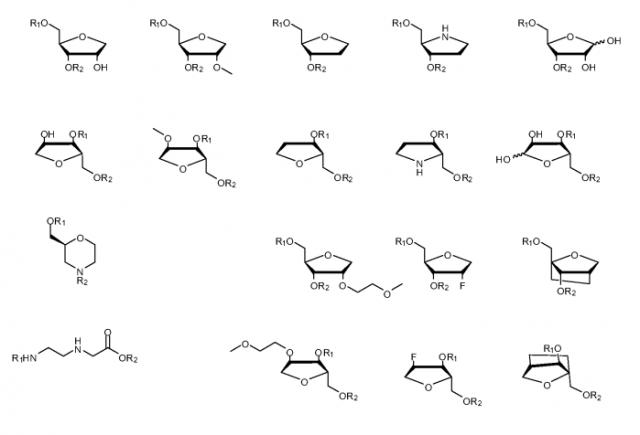
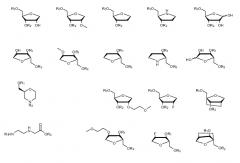
Олигонуклеотиды, как правило, содержат 50 или менее оснований, и, как упомянуто выше, олигонуклеотиды вплоть до 200 оснований могут быть легко синтезированы. Способ по данному изобретению, как оказывается, подходит для всех таких олигонуклеотидов, как для встречающихся в природе, так и для синтетических олигонуклеотидов, например олигонуклеотиды, имеющие основные модификации или модифицированные основания. Термин "олигонуклеотид" в используемом в данном документе значении содержит как ДНК (DNA), так и РНК (RNA), ЗНК (LNA) (Запертая нуклеиновая кислота, т.е. в которой группа рибозы нуклеотида ЗНК модифицирована дополнительным мостиком, соединяющим 2' атом кислорода - 4' атом углерода) последовательности, олигонуклеотиды с 2' модификациями (миРНК, siRNA), фосфодиэфиры и фосфотиоаты и содержит защищенные и незащищенные последовательности.
Данное изобретение облегчает отделение целевого олигонуклеотида от примесей, которые, например, возникают в результате синтеза или экстракции олигонуклеотида. Может происходить отделение, например, от примесей, не становящихся связанными с веществом-обменником в неподвижной фазе, так что примесь протекает через и вытекает из прибора для ЦРХ все еще растворенной в подвижной фазе. Иначе такие примеси могут стать связанными с веществом-обменником в неподвижной фазе, но в другой степени, чем целевой олигонуклеотид, и/или могут быть вытеснены из неподвижной фазы, но в другой степени, чем целевой олигонуклеотид, так что по мере того как вторая подвижная фаза протекает через ЦРХ, целевой олигонуклеотид и примесь(и) разделяется на фракции в потоке второй подвижной фазы, аналогично обычно применяемой хроматографии. Могут иметь место оба таких процесса разделения.
Процесс по изобретению, как оказывается, подходит для олигонуклеотидов типичной длины, применяемых в терапии, например 5-50 оснований, например 10-30 оснований, например 15-25 оснований. Доступные в настоящее время данные предполагают, что процесс по изобретению может быть применен к олигонуклеотидам любой последовательности оснований. Целевой олигонуклеотид может, например, быть олигонуклеотидом из 20 оснований РНК, обозначенным GSK2402968, который имеет последовательность 5'-uca agg aag aug gca uuu ca-3'. Примером олигонуклеотида из 10 оснований ДНК является 5' GGC CAA ACC T 3'. Другим примером олигонуклеотида из 20 оснований ДНК является 5' GGC CAA TCG GCT TAC CT 3'. Примером олигонуклеотида из 30 оснований ДНК является 5' GGC CAA TCG GCT TCA CTC GGC CAA ACC 3'. Примером олигонуклеотида ЗНК является 5' TTT ACG ACG ACG TTT 3'. Примером олигонуклеотида миРНК является 5'-gca cga uuc uca aga ugc cg-3'.
Олигонуклеотиды, применяемые в процессе по данному изобретению, могут также содержать пептидную нуклеиновую кислоту или ее производное.
Термин "основная модификация" или "модифицированное основание", как идентифицировано в данном документе, относится к модификации существующего основания (т.е. пиримидинового или пуринового основания) или к синтезу основания de novo. Это синтезированное de novo основание может быть квалифицировано как "модифицированное" по сравнению с существующим основанием.
Другие химические структуры и модификации олигонуклеотидов, охватываемые в данном изобретении, определены далее. Эти дополнительные химические структуры и модификации могут быть представлены в комбинации с химическими структурами уже описанных олигонуклеотидов, например наличие 5-метилциторзина, 5-метилурацила и/или 2,6-диаминопурина и олигонуклеотидов, содержащих 2'-O-метилфосфотиоат РНК.
Вдобавок к модификациям, описанным выше, олигонуклеотиды при применении в процессе по изобретению могут содержать дополнительные модификации, такие как различные типы мономеров нуклеиновой кислоты или нуклеотиды, как описано ниже. Например, олигонуклеотид может иметь по меньшей мере одну модификацию остова и/или сахара и/или по меньшей мере модификацию одного основания по сравнению с олигонуклеотидом на основе РНК.
Термин основная модификация также содержит модифицированные версии природных пуриновых и пиримидиновых оснований (например, аденин, урацил, гуанин, циторзин и тимин), такие как гипоксантин, оротовая кислота, агматидин, лизидин, 2-тиопиримидин (например, 2-тиоурацил, 2-тиотимин), G-clamp и его производные, 5-пиримидин (например, 5-метилциторзин, 5-метилурацил, 5-галоурацил, 5-пропинилурацил, 5-пропинилциторзин, 5-аминометилурацил, 5-гидроксиметилурацил, 5-аминометилциторзин, 5-гидроксиметилциторзин, Super T), 2,6-диаминопурин, 7-деазагуанин, 7-деазааденин, 7-аза-2,6-диаминопурин, 8-аза-7-деазагуанин, 8-аза-7-деазааденин, 8-аза-7-деаза-2,6-диаминопурин, Super G, Super A и N4-этилциторзин или их производные; N2-циклопентилгуанин (cPent-G), N2-циклопентил-2-аминопурин (cPent-AP) и N2-пропил-2-аминопурин (Pr-AP) или их производные; и вырожденные или универсальные основания, такие как 2,6-дифтортолуол, или отсутствующие основания, такие как абазические сайты (например, 1-дезоксирибоза, 1,2-дидезоксирибоза, 1-дезокси-2-О-метилрибоза; или пирролидиновые производные, в которых атом кислорода кольца был замещен на атом азота (азарибоза)). Примеры производных Super A, Super G и Super T приведены в US-A-6683173, который полностью включен в данный документ посредством ссылки. Было продемонстрировано, что cPent-G, cPent-AP и Pr-AP снижают иммуностимулирующие эффекты при включении в миРНК (Peacock H. et al. J. Am. Chem. Soc. (2011), 133, 9200).
Олигонуклеотиды, применяемые в данном изобретении, могут содержать абазический сайт или абазический мономер. Абазический сайт или мономер представляет собой мономер или структурный элемент, у которого отсутствует нуклеооснование, по сравнению с соответствующим мономером, содержащим нуклеооснование. Абазический мономер таким образом является частью структурного элемента олигонуклеотида, но с отсутствующим нуклеооснованием. Такой абазический мономер может являться представленным, или связанным, или прикрепленным, или конъюгированным со свободным концом олигонуклеотида. Абазический мономер может быть любого типа, известного и понятного специалисту, неограничивающие примеры которого изображены ниже:
,
где R1 и R2 представляют собой независимо H, олигонуклеотид или другой(ие) абазический(ие) сайт(ы), при условии что не оба R1 и R2 представляют собой H и не оба R1 и R2 представляют собой олигонуклеотид. Абазический(ие) мономер(ы) может быть прикреплен к любому или обоим концам олигонуклеотида, как указано выше. Необходимо отметить, что олигонуклеотид, прикрепленный к одному или двум абазическим сайтам или абазическому(им) мономеру(ам,) может содержать менее чем 10 нуклеотидов.
Олигонуклеотиды, применяемые в процессе по данному изобретению, могут содержать сахарные модификации, т.е. модифицированный вариант рибозильной группы, такой как 2'-O-модифицированная РНК, такая как 2'-O-алкил или 2'-O-(замещенный)алкил, например 2'-O-метил, 2'-O-(2-цианоэтил), 2'-O-(2-метокси)этил(2'-MOE), 2'-O-(2-тиометил)этил, 2'-O-бутирил, 2'-O-пропаргил, 2'-O-аллил, 2'-O-(3-амино)пропил, 2'-O-(3-(диметиламино)пропил), 2'-O-(2-амино)этил, 2'-O-(2-(диметиламино)этил); 2'-дезокси (ДНК); 2'-O-(галоалкокси)метил (Arai K. et al. Bioorg. Med. Chem. 2011, 21, 6285), например 2'-O-(2-хлорэтокси)метил (MCEM), 2'-O-(2,2-дихлорэтокси)метил (DCEM); 2'-O-алкоксикарбонил, например 2'-O-[2-(метоксикарбонил)этил] (MOCE), 2'-O-[2-(N-метилкарбамоил)этил] (MCE), 2'-O-[2-(N,N-диметилкарбамоил)этил] (DCME); 2'-гало, например 2'-F, FANA (2'-F арабинозил нуклеиновая кислота); карбосахарные и азасахарные модификации; 3'-O-алкил, например 3'-O-метил, 3'-O-бутирил, 3'-O-пропаргил и их производные.
Другие сахарные модификации содержат "соединенную мостиком" или "бициклическую" нуклеиновую кислоту (BNA), например запертая нуклеиновая кислота (LNA), ксило-LNA, α-L-LNA, β-D-LNA, cEt (2'-O, 4'-C затрудненная этил) LNA, cMOEt (2'-O, 4' затрудненная метоксиэтил) LNA, соединенная этиленовым мостиком нуклеиновая кислота (ЭНК, ENA), трицикло ДНК; незапертая нуклеиновая кислота (ННК, UNA); циклогексенил нуклеиновая кислота (цГНК, CeNA), алтриол нуклеиновая кислота (АНК, ANA), гексит нуклеиновая кислота (ГНК, HNA), фторированная ГНК (Ф-ГНК, F-HNA), пиранозил-РНК (п-РНК, p-RNA), 3'-дезоксипиранозил-ДНК (п-ДНК, p-DNA); морфолино (как, например, в PMO, PPMO, PMOPlus, PMO-X) и их производные.
Олигонуклеотиды, применяемые в процессе по данному изобретению, могут содержать модификацию остова, например модифицированный вариант фосфодиэфира, представленного в РНК, такого как фосфотиоат (PS), хирально чистый фосфотиоат, фосфородитиоат (PS2), фосфоноацетат (PACE), фосфоноацетамид (РАСА), тиофосфоноацетат, тиофосфоноацетамид, предшественник фосфотиоата, H-фосфонат, метилфосфонат, метилфосфонотиоат, метилфосфат, метилфосфотиоат, этилфосфат, этилфосфотиоат, боранофосфат, боранофосфотиоат, метилборанофосфат, метилборанофосфотиоат, метилборанофосфонат, метилборанофосфонотиоат и их производные. Другая модификация содержит фосфорамидит, фосфорамидат, N3'→P5' фосфорамидат, фосфородиамидат, фосфоротиодиамидат, сульфамат, диметиленсульфоксид, сульфонат, триазол, оксалил, карбамат, метиленимино (MMI) и тиоацетамидонуклеиновую кислоту (TANA) и их производные.
Олигонуклеотиды, применяемые в процессе по данному изобретению, могут содержать другие модификации, такие как нуклеиновая кислота на пептидной основе (ПНК), модифицированная кластером бора ПНК, оксипептидная нуклеиновая кислота на основе пирролидина (POPNA), нуклеиновая кислота на основе гликоля или глицерина (GNA), основанная на треозе нуклеиновая кислота (TNA), основанная на ациклическом треониноле нуклеиновая кислота (aTNA), основанный на морфолине олигонуклеотид (PMO, PPMO, PMO-X), катионные основанные на морфолине олигомеры (PMOPlus), олигонуклеотиды с интегрированными основаниями и остовами (ONIB), пирролидинамидные олигонуклеотиды (POM) и их производные. Специалист в данной области также примет во внимание, что также существует множество синтетических производных олигонуклеотидов. Модификация остова содержит модифицированный вариант фосфодиэфира, представленного в РНК, такой как фосфотиоат (PS), хирально чистый фосфотиоат, фосфородитиоат (PS2), фосфоноацетат (PACE), фосфоноацетамид (РАСА), тиофосфоноацетат, тиофосфоноацетамид, предшественник фосфотиоата, H-фосфонат, метилфосфонат, метилфосфонотиоат, метилфосфат, метилфосфотиоат, этилфосфат, этилфосфотиоат, боранофосфат, боранофосфотиоат, метилборанофосфат, метилборанофосфотиоат, метилборанофосфонат, метилборанофосфонотиоат и их производные. Другая модификация содержит фосфорамидит, фосфорамидат, N3'→P5' фосфорамидат, фосфородиамидат, фосфоротиодиамидат, сульфамат, диметиленсульфоксид, сульфонат и тиоацетамидонуклеиновую кислоту (TANA) и их производные.
Необходимо, чтобы каждый сахар, основание и/или остов не были модифицированы одинаковым образом. Несколько отдельных модифицированных сахаров, оснований и/или остовов могут быть комбинированы в одном отдельном олигонуклеотиде в олигонуклеотидах, применяемых в процессе по данному изобретению. Олигонуклеотиды, применяемые в процессе по данному изобретению, могут содержать более чем одну модификацию отдельного основания, и/или более чем одну модификацию отдельного сахара, и/или одну или более модификаций отдельного остова в указанном олигонуклеотиде.
Процесс по изобретению, как оказывается, подходит для отделения олигонуклеотида от примесей, которые не являются олигонуклеотидами.
Процесс также, как оказывается, подходит для отделения целевого олигонуклеотида от одной или более примесей, которая также является олигонуклеотидом. Например, процессом по изобретению, как оказывается, возможно отделять олигонуклеотидную примесь, которая отличается от целевого олигонуклеотида только на одно или два основания. Например, процесс по изобретению, как оказывается, подходит для отделения целевого олигонуклеотида, имеющего 20 оснований, от примесей, являющихся длиномерными и короткомерными олигонуклеотидами, имеющими 17, 18, 19 или 21 основание. Считается, что такие олигонуклеотидные примеси становятся связанными с веществом-обменником в неподвижной фазе в отличающейся от целевого олигонуклеотида степени и/или могут быть вытеснены из неподвижной фазы, но с отличающейся от целевого олигонуклеотида степенью, так что по мере того как вторая подвижная фаза протекает через ЦРХ, целевой олигонуклеотид и олигонуклеотидные примеси разделяются на фракции в потоке второй подвижной фазы.
В процессе по данному изобретению целевой олигонуклеотид может быть в виде свободного олигонуклеотида или в виде формы производного целевого олигонуклеотида, такой как форма, защищенная защитной группой. Известны многочисленные защитные группы для олигонуклеотидов. Подходящей защитной группой является диметокситритильная, и считается, что другие известные защитные группы также являются подходящими.
Первая подвижная фаза и неподвижная фаза могут содержать любые жидкости, которые образуют две отдельные фазы при контакте друг с другом и которые содержат одну подвижную фазу, которая растворяет целевой олигонуклеотид, и одну неподвижную фазу, которая растворяет вещество-обменник и целевой олигонуклеотид, при связывании с веществом-обменником. Другие желательные свойства таких жидкостей включают образование двух фаз с такой разницей в плотности, что они легко образуют две отдельные фазы и демонстрируют небольшую склонность к образованию эмульсии.
Например, такие две фазы могут содержать комбинации растворителей или воды и один или более растворителей, которые при смешивании образуют двухфазную систему, в которой вещество-обменник растворимо только или, по существу, растворимо только в одной из фаз (подвижной или неподвижной) и вещество-вытеснитель растворимо только или, по существу, растворимо только в другой (неподвижной или подвижной) фазе.
Например, неподвижная фаза может содержать смесь одной или более органических жидкостей, которые являются несмешиваемыми или частично смешиваемыми с водой, таких как C1-6 алкил C1-6 алканоатный сложный эфир, ди-C1-6 алкиловый эфир, С4-10 циклический эфир, жидкий галогенированный C1-6 алкан или жидкий C5-10 алкан; и одну или более органических жидкостей, которые являются по меньшей мере частично смешиваемыми с водой, таких как C1-8 алканол или ди-(C1-8 алкил)кетон.
Под термином "частично смешиваемый" подразумевается, что двухфазная система может быть образована на по меньшей мере части композиционного диапазона алканол-вода. Каждая из таких двух фаз содержит и алканол, и воду, но в одной фазе будет преобладать алканол и в другой фазе будет преобладать вода. Низшие, например, C1-3 алканолы обычно являются смешиваемыми с водой на всем композиционном диапазоне вода-алканол, но высшие, например, C4-8 алканолы обычно являются несмешиваемыми или только частично смешиваемыми с водой. Например, первая и вторая подвижные фазы могут содержать смесь одной или более органических жидкостей, которые являются смешиваемыми с водой, такие как C1-8 алканол или ди-(C1-8 алкил)кетон; и воду. Примеры таких органических жидкостей содержат этилацетат, метил-третбутиловый эфир, алкил-замещенные тетрагидрофураны, такие как 2-метилтетрагидрофуран, хлороформ, гексан, 1-бутанол, этанол, метанол, и высокополярные апротонные растворители, такие как диметилсульфоксид и диметилформамид.
Без сомнения, будет учтено, что в любой такой уравновешенной системе, в которой такие две фазы находятся в контакте друг с другом, может происходить некоторое взаимное перемешивание минорных долей жидких компонентов, так что жидкость неподвижной фазы может содержать минорную долю воды, растворенной из жидкости подвижной фазы, и жидкость подвижной фазы может содержать минорную долю жидкости, которая является, по существу, несмешиваемой с водой, растворенную из жидкости неподвижной фазы.
Соответствующие фазы могут быть образованы пригодным образом смешиванием двух или более таких жидкостей и позволением системе стабилизироваться в две равновесные фазы, при этом верхняя - менее плотная и нижняя - более плотная фаза, каждая из которых может быть использована в качестве неподвижной или подвижной фазы. Неподвижная и подвижная фазы могут, следовательно, содержать соответствующие две равновесные фазы жидкостной системы, содержащие такие жидкости. Следует иметь в виду, что каждая из таких фаз может содержать все из жидкостей, содержащихся в системе, но каждая такая фаза будет содержать преимущественно одну или более из жидкостей в качестве главного компонента и одну или более из жидкостей в качестве минорного компонента.
Примеры таких фаз содержат двухфазные системы (a)-(e), приведенные ниже. Относительные соотношения, в которых такие жидкости могут быть смешаны для обеспечения таких фаз, будут зависеть от жидкостей, но могут легко быть определены экспериментально. Типичные соотношения представлены.
(a) C1-6 алкил C1-6 алканоатный сложный эфир - С1-8 алканол - вода. Менее плотная фаза содержит главный компонент сложный эфир + алканол. Более плотная фаза содержит главный компонент воду + алканол. Например, этилацетат - 1-бутанол - вода (3:2:5).
(b) C4-8 алканол - вода. Менее плотная фаза содержит главный компонент алканол. Более плотная фаза содержит главный компонент воду. Например, 1-пентанол или 1-бутанол - вода.
(c) C1-8 алканол - ди-(C1-8 алкил) кетон - вода. Менее плотная фаза содержит главный компонент алканол + кетон. Более плотная фаза содержит главный компонент воду + алканол. Например, 1-бутанол - метилизобутилкетон - вода (1:3:4).
(d) ди-(C1-8 алкил) кетон - вода. Менее плотная фаза содержит главный компонент кетон. Более плотная фаза содержит главный компонент воду. Например, метилизобутилкетон - вода.
(e) ди-C1-6 алкиловый эфир или C4-10 циклический эфир - C1-8 алканол - вода. Менее плотная фаза содержит главный компонент эфир и алканол. Более плотная фаза содержит главный компонент воду. Например, метил-трет-бутиловый эфир - 1-пентанол - вода (3:1:4) или 2-метилтетрагидрофуран - 1-бутанол - вода (3:1:4).
Необходимо будет понимать, что в добавок к своим главным компонентам каждая из таких фаз в паре будет содержать минорный(ые) компонент(ы), являющийся главным компонентом других фаз в паре. В процессе по данному изобретению неподвижная фаза может быть менее плотной из таких пар фаз.
Предпочтительная первая подвижная фаза содержит смесь воды и 1-бутанола в качестве главных компонентов с неподвижной фазой, которая содержит смесь этилацетата и 1-бутанола в качестве главных компонентов. Другие предпочтительные первые подвижные фазы содержат смесь воды и 1-бутанола в качестве главных компонентов с неподвижной фазой, которая содержит смесь 2-метилтетрагидрофурана и 1-бутанола в качестве главных компонентов. Такие смеси образуют две отдельные фазы при контакте друг с другом.
Первая подвижная фаза подходящим образом может быть приведена к подходящему pH для облегчения растворения и стабилизации целевого олигонуклеотида, например присоединением основания, например неорганического основания, такого как гидроксид щелочного металла, такой как гидроксид натрия, или аммиак. Подходящее pH зависит, среди прочего, от олигонуклеотида и может зависеть от того, является ли он защищенным. Подходящий диапазон pH для первой подвижной фазы, по-видимому, составляет pH 7-14, хотя полагается, что кислотный pH <7 может являться допустимым для некоторых приложений. Подходящий диапазон pH для вышеупомянутого 20-мерного олигонуклеотида в или диметокситритил-защищенной форме, или незащищенного составляет приблизительно pH 7-12. Подходящий диапазон pH для этого олигонуклеотида в диметокситритил-защищенной форме составляет, например, pH 10-12, соответственно около pH 11. Доступные в настоящее время данные предполагают, что такие диапазоны pH могут являться подходящими для других олигонуклеотидов. Подходящая концентрация для такого основания в первой подвижной фазе для достижения такого pH может быть определена экспериментально. В экспериментах, описанных в данном документе, было обнаружено, что подходящая концентрация составляет 10 +/-5 мМ, например 10 мМ гидроксида натрия.
Подходящая концентрация целевого олигонуклеотида, такого как 20-мерный, который указан выше, может быть определена экспериментально. Концентрация в колонке 200 мг - 100 г на л, например 200 мг - 80 г на л, например 20 - 60 г на л, по-видимому, является подходящей.
Вещество-обменник (иногда в данной области альтернативно называемое "удерживатель") устраняемо связывается с целевым олигонуклеотидом в неподвижной фазе. Подходящее вещество-обменник является анионобменным веществом.
Подходящее вещество-обменник, которое связывается с целевым олигонуклеотидом, является солью органического амина с противоанионом, соответственно вторичной, третичной или четвертичной аммониевой солью. Пример такой аммониевой соли имеет общую формулу
R1R2R3R4N+X-.
В которой во вторичной, третичной и четвертичной последовательности соответственно две, три или четыре из групп R1, R2, R3 и R4 представляют собой независимо C1-20 алкил или замещенный алкил, такой как фторо- или трифторметилзамещенный алкил, или бензил, и остающиеся являются водородом, и X- представляет собой галогенид-анион, подходящим является хлорид. Подходящее вещество-обменник представляет собой смесь хлорида три-(н-октил)метиламмония и хлорида три-(н-децил)метиламмония соответственно, в которой н-октильное соединение является преобладающим. Такая смесь коммерчески доступна под названием Aliquat 336™. Другие вещества-обменники, считающиеся подходящими, содержат бромид цетилтриметиламмония, хлорид метилтриоктиламмония, хлорид бензалкония (также известный как хлорид алкилдиметилбензиламмония и ADBAC, являющийся смесью хлоридов алкилбензилдиметиламмония с различными длинами алкильных цепей), хлорид бензилтриметиламмония, хлорид тетрабутиламмония и Амберлит LA2 (высокомолекулярный жирорастворимый вторичный амин, поставляемый в виде жидкости в основной форме) в протонированной форме.
Концентрация вещества-обменника в неподвижной фазе будет зависеть среди прочего от используемого вещества, самого целевого олигонуклеотида и скорости потока подвижной фазы. Расчет может быть осуществлен на основе молярных соотношений целевого олигонуклеотида и вещества-обменника. Предполагается, что для от 10- до 30-мерного олигонуклеотида подходящий диапазон молярного соотношения вещества-обменника составляет 0,5-15, предпочтительно приблизительно 5, эквивалентов на ионный сайт, приводя к молярному соотношению вещество-обменник:целевой олигонуклеотид в диапазоне 1:5-500, предпочтительно 1:10-300, более предпочтительно 1:20-150. Концентрация вещества-обменника 5-500, например 5-100, как правило, 8-50 мМ, как оказывается, является подходящей, по меньшей мере для Aliquat 336™, и возможно для других веществ-обменников.
Подразумевается, что можно применять любой коммерчески доступный прибор для жидкость-жидкостной хроматографии, в котором используются системы неподвижной и подвижной фазы жидкость-жидкость, для выполнения способа по данному изобретению.
Примером подходящего прибора для ЦРХ является прибор для ЦРХ FCPC200™ от Kromaton. Подходящая аппаратура для ЦРХ также доступна у Armen Instrument. Нормальные условия функционирования по спецификации для такого прибора, как оказывается, являются подходящими для выполнения процесса по данному изобретению. Неподвижная фаза подходящим образом вносится в колонку в соответствии с инструкцией для нормального рабочего режима для прибора.
При типичном функционировании колонка может быть наполнена неподвижной фазой накачиванием жидкой неподвижной фазы, например второй жидкой фазы, с высокой скоростью потока в колонку с последующим началом вращения колонки при подходящей для прибора рабочей скорости.
Возможно вызвать перенос первой подвижной фазой целевого олигонуклеотида (вместе с примесями) в ее потоке различными путями.
В одном из путей, к примеру, первая подвижная фаза, содержащая растворенный целевой олигонуклеотид, может затем быть введена в колонку и может быть вызвано ее протекание через колонку относительно и в контакте с неподвижной фазой.
В другом пут