Составы внутривенных растворов позаконазола, стабилизированные посредством замещенного бета-циклодекстрина
Иллюстрации
Показать всеНастоящее изобретение относится к водным растворам, пригодным в качестве фармацевтических композиций позаконазола для внутривенного введения. Эти композиции включают растворитель, такой как модифицированный β-циклодекстрин в подкисленном растворе, а также хелатирующее средство, такое как динатрия эдетат (ЭДТА). В клинических испытаниях было обнаружено, что доза выбранной композиции, составляющая 200 мг позаконазола, позволяет достичь приемлемых фармакокинетических свойств. Полученная фармацевтическая композиция обладает физической и химической стабильностью. 4 н. и 17 з.п. ф-лы, 8 ил., 11 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к водосодержащим фармацевтическим композициям позаконазола и комплексообразователя. Такие фармацевтические композиции обеспечивают достаточную растворимость позаконазола, что приводит к увеличенному сроку хранения препарата и пониженной вероятности осаждения во время инъекции в вену или в канюлю для внутривенного капельного введения.
Изобретение также относится к способам лечения и/или профилактики микозов с применением указанных фармацевтических композиций.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
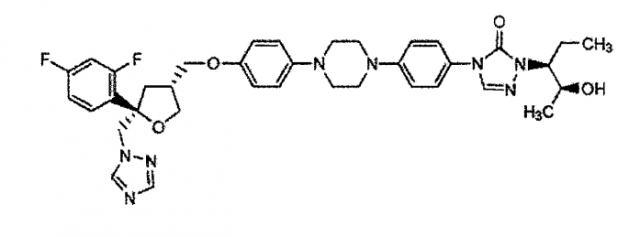
В патентах США №№ 5703079 и 5661151 (см. колонку 69, пример 24) описывают позаконазол, противогрибковое средство широкого спектра действия, структура которого проиллюстрирована ниже:
В патенте США № 6958337 описывают кристаллические формы позаконазола. В патентной заявке США 20060160823 описывают состав, содержащий инъекционную суспензию. Позаконазол в твердой лекарственной форме (капсула/таблетка) описывают в патентах США №№ 5972381 и 5834472.
Позаконазол представлен на рынке в качестве пероральной суспензии (40 мг/мл) под торговой маркой НОКСАФИЛ™ в США компанией Merck (ранее Schering Corporation, Kenilworth, Н J.). НОКСАФИЛ™ (позаконазол) показан для профилактики инвазивных инфекций Aspergillus и Candida у пациентов в возрасте 13 лет и старше, у которых имеется высокий риск развития этих инфекций вследствие сильно сниженного иммунитета, таких как реципиенты трансплантатов кроветворных стволовых клеток (HSCT) с реакцией «трансплантат против хозяина» (GVHD) или пациенты с гемобластозами с длительной нейтропенией вследствие химиотерапии. НОКСАФИЛ™ (позаконазол) также показан для лечения орофарингеального кандидоза, включающего орофарингеальный кандидоз, рефрактерный к итраконазолу и/или флуконазолу.
Позаконазол является слабоосновным и слаборастворимым в воде лекарственным средством, которое обладает плохой биодоступностью и вариабельным всасыванием. Позаконазол обладает растворимостью менее чем 1 мкг/мл в нейтральных и основных водных растворах. Хотя растворимость повышается в кислой среде (например, 3 мкг/мл при pH 3 и 0,8 мг/мл при pH 1), для достижения предполагаемой ежедневной внутривенной дозы более чем 100 мг потребовалось бы более резкое повышение растворимости.
Таким образом, было бы желательно иметь доступный пациентам состав внутривенного раствора для повышения биодоступности позаконазола. Инъекционный состав также позволил бы осуществить введение состава пациентам, которым нельзя вводить пероральные лекарственные формы, как в случае с пациентами, у которых есть трудности с глотанием или которые находятся без сознания. Несомненно, любой такой внутривенный состав должен продемонстрировать химическую и физическую стабильность на протяжении срока годности препарата.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых вариантах осуществления изобретение относится к фармацевтической композиции для внутривенного введения, содержащей:
позаконазол или его фармацевтически приемлемую соль; и модифицированный β-циклодекстрин,
в водном растворе, где pH указанной композиции находится между приблизительно 2,0 и приблизительно 3,5.
В дополнительных вариантах осуществления указанный модифицированный β-циклодекстрин включает сульфобутиловый эфир-β-циклодекстрин.
В дополнительных вариантах осуществления композиция дополнительно содержит хелатирующее средство.
В дополнительных вариантах осуществления указанная фармацевтическая композиция содержит свободное основание позаконазола, указанный модифицированный β-циклодекстрин включает сульфобутиловый эфир-β-циклодекстрин, указанное хелатирующее средство включает ЭДТА, и где указанный pH находится между приблизительно 2,3 и приблизительно 3,0.
В дополнительных вариантах осуществления концентрация свободного основания позаконазола находится между приблизительно 14 и приблизительно 22 мг/мл, концентрация сульфобутиловый эфир-β-циклодекстрина находится между приблизительно 350 и приблизительно 450 мг/мл, и концентрация ЭДТА находится между приблизительно 0,1 и приблизительно 0,3 мг/мл.
В дополнительных вариантах осуществления концентрация свободного основания позаконазола составляет приблизительно 18 мг/мл, концентрация сульфобутиловый эфир-β-циклодекстрина составляет приблизительно 400 мг/мл, и концентрация ЭДТА составляет приблизительно 0,2 мг/мл
В дополнительных вариантах осуществления в результате введения дозы указанной композиции, которая доставляет 200 мг позаконазола пациенту, Cmax находится между приблизительно 1176 и приблизительно 18375 нг/мл, и AUClast находится между приблизительно 21600 и приблизительно 33750 ч*нг/мл.
В дополнительных вариантах осуществления в результате введения дозы указанной композиции, которая доставляет 200 мг позаконазола пациенту, Cmax составляет приблизительно 1470 нг/мл, и AUClast составляет приблизительно 27000 ч*нг/мл.
В дополнительных вариантах осуществления указанная фармацевтическая композиция для внутривенного введения содержит компоненты и количества каждого из компонентов, как представлено ниже:
| Компоненты | Количество |
| Позаконазол | от приблизительно 5 до приблизительно 25 мг/мл |
| Каптизол® (сульфобутиловый эфир-β- циклодекстрин) | от приблизительно 25 мМ до приблизительно 200 мМ |
| Динатрия эдетат (ЭДТА) | от приблизительно 0,1 до приблизительно 1,0 мг/мл |
| 1Н соляная кислота | количество, достаточное для доведения до pH от приблизительно 2,0 до приблизительно 3,0 |
| 1Н гидроксид натрия | количество, достаточное для доведения до pH от приблизительно 2,0 до приблизительно 3,0 |
| Вода | в кол-ве, достаточном для 1 мл |
В дополнительных вариантах осуществления указанная фармацевтическая композиция содержит компоненты и количества каждого из компонентов, как представлено ниже:
| Компоненты | Количество |
| Позаконазол | приблизительно 18 мг/мл |
| Каптизол® (сульфобутиловый эфир-β-циклодекстрин) | приблизительно 400 мг/мл (185 мМ) |
| Динатрия эдетат (ЭДТА) | приблизительно 0,2 мг/мл |
| 1Н соляная кислота | количество, достаточное для доведения до pH приблизительно 2,6 |
| 1Н гидроксид натрия | количество, достаточное для доведения до pH приблизительно 2,6 |
| Вода | в кол-ве, достаточном для 1 мл |
В дополнительных вариантах осуществления изобретение относится к способу лечения или профилактики инфекции у животного, нуждающегося в этом, который содержит введение указанному животному эффективного количества любых фармацевтических композиций, представленных выше.
В дополнительных вариантах осуществления инфекция вызвана грибком или паразитом.
В дополнительных вариантах осуществления инфекция является одной или несколькими выбранными из группы, состоящей из: орофарингеального или эзофагеального кандидоза; рефрактерного орофарингеального и эзофагеального кандидоза; инвазивного аспергиллеза, кандидоза, фузариоза, сцедоспориоза, инфекций, вызванных диморфными грибами, зигомикоза и инвазивных инфекций, вызванных редкими плесневыми и дрожжевыми грибками; инвазивных микозов у пациентов, рефрактерных к другим видам терапии или не переносящих их, кандидоза, инвазивных плесневых инфекций у пациентов, которые перенесли интенсивную химиотерапию и/или лучевую терапию по поводу гемабластозов, подготовки к трансплантации костного мозга или периферических стволовых клеток, и у пациентов, получавших комбинированную иммуносупрессивную терапию для лечения острой или хронической реакции «трансплантат против хозяина» или ее предотвращения при трансплантации паренхиматозных органов; болезни Шагаса и лейшманиоза.
В дополнительных вариантах осуществления после впрыскивания указанной композиции в инфузионный мешок, композицию и инфузат перемешивали и получившуюся смесь оставляли отстаиваться в течение периода до 24 часов, никакого осадка позаконазола не было видно.
В дополнительных вариантах осуществления способ содержит введение указанному животному композиции по п. 1 в количестве, достаточном для доставки дозы между приблизительно 180 и приблизительно 220 мг позаконазола указанному животному.
В дополнительных вариантах осуществления способ включает введение указанному животному композиции по п. 1 в количестве, достаточном для доставки дозы, составляющей приблизительно 200 мг позаконазола, указанному животному.
В дополнительных вариантах осуществления введение проводится один раз в сутки.
В дополнительных вариантах осуществления введение проводится два раза в сутки.
В дополнительных вариантах осуществления способ дополнительно содержит введение второго активного ингредиента, выбранного из одного или нескольких из группы, состоящей из противогрибковых, антибактериальных, противовирусных, стероидных, нестероидных противовоспалительных лекарственных средств, химиотерапевтических и противорвотных препаратов.
В дополнительных вариантах осуществления противогрибковые препараты выбирают из группы, состоящей из азолов, эхинокандина, аллиламина, полиена, флюцитозина, бензойной кислоты, циклопирокса, 1,3-дигидро-5-флюоро-1-гидрокси-2,1-бензоксабората, толнафталата, ундециленовой кислоты, гризеофульвина и галопрогина.
В дополнительных вариантах осуществления изобретение относится к набору, содержащему:
маленький разрушающийся контейнер;
инфузионный мешок;
и композицию,
где указанный контейнер содержит эту композицию,
и указанный инфузионный мешок содержит разбавитель, выбранный из группы, состоящей из нормального физиологического раствора и 5% раствора декстрозы, и где указанный маленький разрушающийся контейнер помещен непосредственно внутри указанного инфузионного мешка, пригодного для того, чтобы указанная композиция была разбавлена посредством разрушения указанного маленького разрушающегося контейнера непосредственно внутри разбавителя в указанном инфузионном мешке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
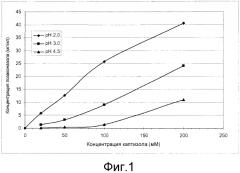
На фиг. 1 представлена растворимость позаконазола в зависимости от концентрации каптизола® при различных значениях pH.
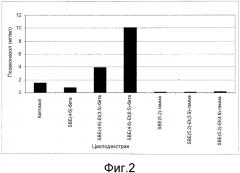
На фиг. 2 представлена гистограмма, показывающая растворимость позаконазола с различными сульфобутиловый эфир-β-циклодекстринами (SBE-CyDs) при 100 мМ и pH 4,5.
На фиг. 3 представлен процент позаконазола (10 мг/мл), сохраняющийся в растворе в динамике по времени в 200 мМ растворе каптизола® при pH 3,0.
На фиг. 4 представлен процент позаконазола (5 мг/мл), сохраняющегося в растворе в динамике по времени в 100 мМ растворе каптизола® при pH 3,0.
На фиг. 5 представлен процент позаконазола (18 мг/мл), сохраняющегося в растворе в динамике по времени в 400 мг/мл растворе каптизола® при pH 2,6,
На фиг. 6 представлена схема производственного процесса для установочных серий промышленного масштаба.
На фиг. 7 представлены профили зависимости средней (±SD) концентрации позаконазола в плазме от времени после однократной дозы введенного внутривенно 200 мг внутривенного раствора позаконазола здоровым взрослым добровольцам.
На фиг. 8 представлены обобщенные результаты наблюдаемых устойчивых концентраций позаконазола и предполагаемое распределение концентрации для внутривенного раствора позаконазола.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предпринимали различные подходы для получения стабильного раствора позаконазола, который бы подходил для внутривенного состава достаточной биодоступности и других фармацевтически желаемых характеристик.
Внутривенные растворы позаконазола
Известно, что циклодекстрины и их производные демонстрируют свойство повышения водной растворимости определенных соединений, как описано в патенте США № 5134127. Однако в этом документе не упоминают, могут ли циклодекстрины повысить растворимость в воде позаконазола или других родственных азольных соединений. Пример 32 патента США № 7635773 предполагает сообщить о стабилизации позаконазола сульфобутиловый эфир-β-циклодекстрином (SBE 66-β-CD), который подвергался однократной или двукратной обработке активированным углем.
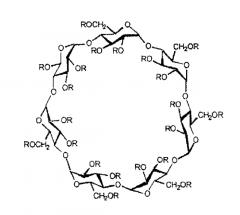
Каптизол® является торговой маркой для сульфобутиловый эфир-β-циклодекстрина, представленного ниже и поставляемого на рынок CyDex Pharmaceuticals, Inc., Lenexa, KS. Химическая структура каптизола® представлена ниже:
В таблице 1 представлена определенная релевантная информация, касающаяся каптизола®.
| Таблица 1 | |
| Названия | Сульфобутиловый эфир-β-циклодекстрины, (SBE-β-CD) натриевая соль |
| Молекулярная масса | 2163 г/моль(степень растворимости = 6,5) |
| Растворимость | >800 мг/мл в воде |
| CAS-номер | 182410-00-0 |
Это соединение применяют в качестве комплексообразователя для улучшения растворимости и/или стабильности фармацевтических соединений.
С целью оценки диапазона растворимостей позаконазола, которые могли бы быть достигнуты при допустимых pH, получали серию растворов с фиксированной концентрацией каптизола®. При применении кислого раствора 20% каптизола® (масс./об.) растворимость позаконазола увеличивалась более чем в 1000 раз, и было определено, что таргетная концентрация 5 мг/мл могла быть достигнута. В таблице 2 представлены растворимости позаконазола в 20% растворах каптизола® при различных значениях pH.
| Таблица 2 | |
| pH | Растворимость позаконазола (мг/мл) |
| 3,0 | 8,7 |
| 3,1 | 7,8* |
| 3,2 | 6,9 |
| 3,4 | 5,2 |
| 3,6 | 4,0 |
| 3,8 | 3,1 |
| *Рассчитано среднее значение измеренной растворимости при рН 3,0 и рН 3,2 |
Растворимость позаконазола также оценивали в подкисленных растворах с различными концентрациями каптизола®. Как представлено на фиг. 1, растворимость позаконазола увеличивается с pH так же, как и концентрация каптизола®. Однако на фиг. 1 также представлено, что при каждом рН увеличение растворимости позаконазола происходит нелинейно относительно каптизола®, и при pH 3,0 и 4,5 существует большее, чем линейное повышение концентрации позаконазола. Таким образом, при некоторых значениях pH, при которых концентрация каптизола® увеличивается, соотношение каптизола® и растворенного позаконазола уменьшается. Основанный на этом эффекте растворимости состав мог бы быть разработан, в результате чего для той же самой ежедневной дозировки позаконазола ежедневная доза каптизола® могла бы быть уменьшена. Например, при pH 3,1 растворимость позаконазола в 20% каптизоле® по расчетам составила 7,8 мг/мл (см. таблицу 2), тогда как в 40% каптизоле®, было определено, что растворимость составляла 22,5 мг/мл. В этом случае концентрацию каптизола® увеличивали посредством фактора 2, тогда как растворимость позаконазола увеличивали посредством фактора 2,9.
Однако если увеличивающаяся концентрация каптизола® производила больше чем линейный эффект на растворимость позаконазола, противоположный эффект также бы ожидался, т.е. разведение растворов каптизола®, содержащих позаконазол, при или при приблизительно равновесной растворимости позаконазола будет вызывать осаждение позаконазола. Этот эффект имеет значение в том отношении, что предпочтительным способом доставки состава позаконазола является разведение или нормальным физиологическим раствором или 5% декстрозой с последующей инфузией. К удивлению, однако при последующем разведении состава позаконазол/каптизол® никакого осаждения не было видно, по меньшей мере, в течение 24 часов.
В качестве окислителя в составе позаконазола применяли соляную кислоту. Однако помимо этого в отношении растворения позаконазола оценивали несколько дополнительных окислителей (т.е. лимонную, серную, малеиновую, фосфорную, уксусную, L-винную, D-винную, DL-винную, метансульфоновую, нафталинсульфоновую, p-толуолсульфоновую, молочную, L-молочную, L-аскорбиновую и яблочную кислоту, а также гидрохлорид глицина). Однако при таком же pH при применении этих окислителей не отмечали улучшения растворимости.
В целях исследования дополнительных улучшений состава рассматривали влияние различных сорастворителей и неионных поверхностно-активных веществ на растворимость позаконазола в 100 мМ растворе каптизола®. Растворы каптизола® доводили до pH 4,5 посредством HCl и к ним добавляли надлежащее количество сорастворителей.
К доведенному до нужного рН раствору циклодекстрин/сорастворитель добавляли дополнительное количество позаконазола и растворы оставляли для уравновешивания на трое суток. Содержимое пробирок центрифугировали и супернатант оценивали на предмет позаконазола.
В таблице 3 представлено влияние различных сорастворителей и нескольких поверхностно-активных веществ (0,1% 0,2% об./об. полоксамер F-68, твин 20 или твин 80) на растворимость позаконазола. Протестированные поверхностно-активные вещества не повысили растворимость позаконазола, в то время как сорастворители понизили его растворимость.
| Таблица 3 | |
| Сорастворитель | Позаконазол (мг/мл) |
| Контроль (100 мМ каптизол®) | 1,77 |
| 10% пропиленгликоль | 0,41 |
| 10% ПЭГ 400 | 1,28 |
| 10% PVP | 0,64 |
| 0,1% полоксамер F-68 | 1,63 |
| 0,1% твин 20 | 1,71 |
| 0,1% твин 80 | 1,74 |
Оценивали растворимости позаконазола в каждом из нескольких модифицированных β- и γ-циклодекстринов. Растворимость позаконазола тестировали с тремя гамма-циклодекстринами; SBE(5,2)-гамма, SBE(5,2) Et (3,9)-гамма и SBE(5,2) Et (4,9)-гамма циклодекстрин, (CyDex, Inc.). При концентрациях циклодекстрина 100 мМ и pH 4,5 самая высокая достигнутая растворимость позаконазола составляла 0,189 мг/мл, приблизительно в 8 раз меньше чем 1,51 мг/мл, достигнутая посредством каптизола®, SBE (6,5)-β-циклодекстрина, в сходных условиях (см. фиг. 2).
С другой стороны, некоторые изменения в замещениях β-циклодекстрина не привели к повышению растворимости. Применяя 100 мМ растворы циклодекстрина при pH 4,5, оценивали растворимость позаконазола в циклодекстринах SBE(4,6)-β, SBE(4,6)-Et(3,5)-β и SBE(4,6)-Et(8,5)-β относительно каптизола®. Циклодекстрины SBE (4,6)-Et(3,5)-β и SBE(4,6)-Et(8,5)-β растворяли в 2,6 и 6,6 раз больше позаконазола (соответственно), чем каптизол® (см. фиг. 2). Однако всесторонняя информация по безопасности каптизола® перевесила потенциальные преимущества большей растворимости, и по этой причине составы с другими сульфобутиловый эфир циклодекстринами далее не разрабатывали.
В заключение скрининговые исследования стабильности также продемонстрировали, что составы каптизола® с позаконазолом претерпевают изменения окраски в условиях ускоренных испытаний. Растворы 10 мг/мл позаконазола в 40% каптизоле® при pH 3,0 получали как в присутствии, так и в отсутствие 1 мг/мл ЭДТА, и как с присоединением азота, так и без него. Через 20 суток при 40°C растворы оценивали на предмет изменений окраски посредством калориметра, где изменение окраски обозначали посредством величины "b*" (растворы с величиной b*, равной 3 или выше, становятся желтыми). Как представлено в таблице 4, проявление окраски минимизировали как ЭДТА, так и подачей слоя азота. Однако в растворе, содержащем ЭДТА, не было замечено никакого дополнительного улучшения посредством включения подачи слоя азота.
| Таблица 4 | |||
| Описание | Уровень ЭДТА | N2 | b* |
| 10 мг/мл позаконазол, 200 мМ каптизол® | 0,0 мг/мл | Нет | 4,17 |
| 10 мг/мл позаконазол, 200 мМ каптизол® | 1,0 мг/мл | Нет | 1,49 |
| 10 мг/мл позаконазол, 200 мМ каптизол® | 0,0 мг/мл | Да | 2,33 |
| 10 мг/мл позаконазол, 200 мМ каптизол® | 1,0 мг/мл | Да | 1,67 |
| Условия устойчивости: 40°C/75%RH в течение 20 дней |
На основе этих исследований, а также дополнительного скрининга состава ЭДТА применяли в действующем в настоящее время составе на уровне 0,2 мг/мл, что является подходящим для парентерального введения. Кроме того, хотя позаконазол является стабильным в подкисленных растворах каптизола® при комнатной температуре и в условиях ускоренных испытаний, как описано ниже, для дополнительной минимизации проявления желтой окраски предполагают температуру хранения 5°C.
Проводили ряд испытаний для исследования стабильности растворов позаконазола для различных композиций и pH. Исследовали ускоренную стабильность 10 мг/мл позаконазола в 200 мМ растворе каптизола® при pH 3,0 в течение трех месяцев. Добавляли позаконазол к доведенному до нужного pH раствору 200 мМ каптизола® и перемешивали в течение 24 часов. Затем раствор фильтровали и помещали в стабильные условия при 4°C, 25°C/60%RH и 40°C/75%RH. Образец не содержал хелатирующее средство и его не барботировали азотом. Результаты представлены на фиг. 3. Температура оказывала минимальное влияние на деградацию позаконазола в течение трех месяцев. Однако раствор стал бледно- желтым в течение двух недель и со временем потемнел. Таким образом, заключили, что хелатирующее средство является важным для получения композиций по настоящему изобретению.
Сходное исследование во времени стабильности позаконазола (5 мг/мл) в 100 мМ растворе каптизола® при pH 3,0 проводили в течение трех месяцев. Позаконазол добавляли в доведенный до нужного рН раствор 100 мМ каптизола® и перемешивали в течение 24 часов. Затем раствор фильтровали и помещали в стабильные условия при 4°C, 25°C/60%RH и 40°C/75%RH. Образец не содержал хелатирующее средство и не был барботирован азотом. Результаты представлены на фиг. 4. Температура оказывала минимальное влияние на деградацию позаконазола на протяжении трехмесячного периода. Однако раствор принял бледно-желтую окраску в течение двух недель и со временем потемнел.
Исследование стабильности позаконазола (18 мг/мл) в 400 мг/мл растворе каптизола® при pH 3,0 также проводили в течение девятимесячного периода. Образец производили с применением наиболее современного клинического производственного процесса. ЭДТА растворяли в воде для инъекции. Затем каптизол® растворяли в растворе ЭДТА и затем раствор подкисляли с применением HCl. Затем добавляли позаконазол и растворяли. По мере необходимости к раствору добавляли дополнительную HCl для доведения до нужного pH. Раствор также барботировали азотом в течение всего процесса.
Затем полученный раствор фильтровали в стерильных условиях, наливали во флаконы и помещали в стабильные условия при различных условиях хранения. Как представлено на фиг. 5, температура оказывала минимальное влияние на деградацию позаконазола в течение девятимесячного периода.
Также оценивали несколько опытных составов, основанных или на солютоле HS 15 (макрогол® 15 гидроксистеарат Ph. Eur.) или на циклодекстринах. Выявили, что эти составы имеют достаточную физическую и химическую стабильность для поддержки их дальнейшей разработки, но, как описано ниже, токсикологическое тестирование неожиданно продемонстрировало превосходящие результаты для 40% состава каптизола®.
Получили шесть опытных составов, представленных в таблицах 5 и 6.
В таблице 5 представлена композиция трех составов, основанных на солютоле® (№№ 1-3), и в таблице 6 представлены композиции трех других составов, основанных на циклодекстрине (№№ 4-6).
Эти шесть составов были предметом токсикологического скринингового исследования с применением суспензионного состава в качестве контроля. Составы вводили крысам с применением внутривенного вливания по 15 мин в течение двухнедельного периода. Доза позаконазола для всех животных составляла 10 мг/кг. Кроме того, перед введением дозы гемолитический потенциал каждого состава тестировали in vitro.
| Таблица 5 | |||
| IV растворы позаконазола: на основе солютола | |||
| Компоненты | No.1:30% солютол(в реальных условиях - никакого разбавления) мг/мл | No.2:30% солютол (1:5 разбавление NS1)мг/мл | No.3:75% солютол(1:5 разбавление NS)мг/мл |
| Позаконазол | 10 | 10 | 10 |
| Солютол HS 15 | 300 | 300 | 750 |
| Этанол | 240 | 240 | 150 |
| Полиэтиленгликоль 200 | 220 | 220 | - |
| Молочная кислота | 50 | 50 | - |
| 0,9% физиологический раствор q.s.ad | - | - | 1 мл |
| Вода для инъекций q.s.ad | 1 мл | 1 мл | - |
| 1 нормальный физиологический раствор |
| Таблица 6 | |||
| IV растворы позаконазола: на основе циклодекстрина | |||
| Компоненты | No.4:30% HPβCD1 (1:5 разбавление D5W2) мг/мл | No.5:20% каптизол® (1:2,5 разбавление D5W) мг/мл | No.6:40% каптизол® (1:10 разбавление NS3) мг/мл |
| Позаконазол | 10 | 5 | 20 |
| Каптизол® | - | 200 | 400 |
| HPβCD | 200 | - | |
| ЭДТА | - | 0,1 | |
| Винная кислота | 9 | - | - |
| Соляная кислота | - | до pH 3 | до pH 3 |
| Гидроксид натрия | до pH 3,5 | - | - |
| Вода для инъекций q.s.ad | 1 мл | мл | мл |
| 1гидроксипропил-бета-циклодекстрин 25% декстроза 3нормальный Физиологический раствор |
Один опытный образец (состав №1) вливали непосредственно. Однако остальные составы все были разбавлены до концентрации 2 мг позаконазола/мл перед вливанием.
Результаты скринингового исследования токсичности обобщены ниже.
30% состав солютола, который инъецировали непосредственно (состав №1), вызвал гемолиз в in vitro скрининге и продемонстрировал тяжелую местную непереносимость, и гемолиз был показан in vivo. Это исследование остановили до завершения и животных умертвили.
30% состав солютола, который разводили 1:5 перед вливанием (состав №2), вызвал гемолиз in vitro, сходный с гемолизом, вызванным составом №1. На основании этого результата животным не вводили дозу.
75% состав солютола, который разводили 1:5 перед вливанием (состав №3), продемонстрировал некоторые признаки гемолиза in vitro (зависимые от времени). Кроме того, у некоторых животных были замечены клинические признаки местной непереносимости.
Сходные результаты были замечены как для 20% состава HPβCD, разведенного 1:5 перед вливанием (состав №4), так и для 20% состава каптизола®, разведенного 1:2,5 перед вливанием (состав №5). Для обоих составов тестирование гемолиза in vitro продемонстрировало отсутствие гемолиза, но были замечены слабые эффекты на клетки почечных канальцев у крыс, кроме того, исследования на животных позволили предположить, что стерильные лекарственные формы HPβCD обладают значительным токсикологическим потенциалом.
40% состав каптизола® (состав №6) разводили 1:10 перед вливанием. Этот состав не вызывал гемолиза in vitro и не демонстрировал клинических признаков токсичности или эффектов на клинические патологические параметры.
Таким образом, только 40% состав каптизола® не имел токсикологических проявлений и, интересно, что этот состав также имел преимущество перед 20% составом каптизола®. Предполагается, что причиной этого различия было то, что для получения эквивалентной дозы позаконазола требуется вдвое больше 20% состава каптизола®, чем 40% состава.
Окончательный состав на основе 40% раствора каптизола® включал модификации для обеспечения растворимости позаконазола при любых потенциальных изменениях в составе. Например, для производства необходим как таргетный pH, так и приемлемый диапазон pH, и состав должен быть стабильным во всех нормативных пределах. Чтобы отвечать этим критериям, концентрацию позаконазола немного снизили, с 20 мг/мл до 18 мг/мл, и pH снизили с 3,0 до 2,6.
Клиническая композиция внутривенного состава раствора позаконазола представлена в таблице 7.
| Таблица 7 | ||
| Компоненты | Количество | Диапазон |
| Позаконазол | 18 мг/мл | От 5 до 25 мг/мл |
| каптизол® (сульфобутиловый эфир-β-циклодекстрин) | 400 мг/мл (185 мМ) | От 25 мМ до 200 мМ |
| Эдетат натрия (ЭДТА) | 0,2 мг/мл | От 0,1 до 1,0 мг/мл |
| 1Н соляная кислота | Доведение pH (pH 2,6) | От pH 2,0 до 3,0 |
| 1Н гидроксид натрия | Доведение pH (pH 2,6) | От pH 2,0 до 3,0 |
| Вода | в кол-ве, достаточном для 1 мл | в кол-ве, достаточном для 1 мл |
Проводили несколько исследований разведения состава, как описано ниже.
Исследование разведения проводили для оценки сходства осаждения во время разведения перед введением пациенту. Десятипроцентный избыток необходимого количества позаконазола взвешивали во флаконе янтарного цвета. Раствор каптизола®, доведенный до таргетного pH с применением HCl, добавляли во флакон. Флакон запечатывали и аккуратно перемешивали при комнатной температуре в течение 24 часов. Через 24 часа тестируемые флаконы фильтровали через 0,22 микронный фильтр Millipore PVDF Millex-GV®. Порцию фильтрованного образца (10 мл) добавляли в 100 мл пикнометр. Образец разводили до отметки 100 мл с применением или 0,9% раствора хлорида натрия для инъекций USP (нормальный физиологический раствор) или 5% раствора декстрозы для инъекций USP ("D5W"). Образцы наблюдали в течение 24 часов при 4°C и температуре окружающей среды.
Результаты применения нормального физиологического раствора и D5W в качестве разбавителей обобщены в таблицах 8 и 9. Твердый осадок визуально наблюдали в следующих составах позаконазола через 24 часа после разведения нормальным физиологическим раствором: 20 мг/мл позаконазола в 200 мМ каптизоле® при pH 3, 3 мг/мл позаконазола в 100 мМ каптизоле® при pH 4 и 5 мг/мл позаконазола в 150 мМ или 200 мМ каптизоле® при pH 4. Все другие разбавленные образцы становились прозрачными через 24 часа. Твердый осадок визуально наблюдали в следующих составах позаконазола через 24 часа после разведения посредством D5W: 5 мг/мл позаконазола при pH 3, 10 мг/мл позаконазола при pH 3, 20 мг/мл позаконазола в 200 мМ каптизоле® при pH 3, 3 мг/мл позаконазола в 100 или 200 мМ каптизоле® при pH 4 и 5 мг/мл позаконазола в 150 мМ каптизоле® при pH 4. Все другие разведенные образцы были прозрачными через 24 часа. Этот эксперимент указывает на то, что возможно получать составы позаконазола, которые не выпадают в осадок при разведении для введения пациенту.
| Таблица 8 | ||||||
| Исследование разбавления в нормальном физиологическом растворе | ||||||
| Исходно | 4°С (24 часа) | Комнатная температура(24 часа) | ||||
| Образец | Органолептические свойства | % позаконазолаа | Органолептические свойства | % позаконазолаа | Органолептические свойства | % позаконазолаа |
| Позаконазол 20 мг/мл 100 мМ каптизол® при рН 2 | Прозрачный раствор | 100,00 | Прозрачный раствор | 102,52 | Прозрачный раствор | 102,59 |
| Позаконазол 20 мг/мл 200 мМ каптизол® при рН 2 | Прозрачный раствор | 100,00 | Прозрачный раствор | 102,37 | Прозрачный раствор | 99,99 |
| Позаконазол 5 мг/мл 100 мМ каптизол® при рН 3 | Прозрачный раствор | 100,00 | Прозрачный раствор | 100,29 | Прозрачный раствор | 100,26 |
| Позаконазол 10 мг/мл 200 мМ каптизол® при рН 3 | Прозрачный раствор | 100,00 | Прозрачный раствор | 103,18 | Прозрачный раствор | 102,1 |
| Позаконазол 20 мг/мл 200 мМ каптизол® при рН 3 | Прозрачный раствор | 100,00 | Твердый | 102,75 | Твердый | 101,20 |
| Позаконазол 3 мг/мл 100 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Твердый | 101,56 | Твердый | 99,33 |
| Позаконазол 3 мг/мл 200 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Прозрачный раствор | 100,93 | Прозрачный раствор | 100,27 |
| Позаконазол 5 мг/мл 150 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Твердый | 101,22 | Твердый | 99,94 |
| Позаконазол 5 мг/мл 200 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Твердый | 101,30 | Твердый | 99,59 |
| a: В сравнении с исходным значением после разбавления. |
| Таблица 9 | ||||||
| Dilution Study in D5W | ||||||
| Исходно | 4°С (24 часа) | Комнатная температура(24 часа) | ||||
| Образец | Органолептические свойства | % позаконазолаа | Органолептические свойства | % позаконазолаа | Органолептические свойства | % позаконазолаа |
| Позаконазол 20 мг/мл 100 мМ каптизол® при рН 2 | Прозрачный раствор | 100,00 | Прозрачный раствор | 99,35 | Прозрачный раствор | 101,19 |
| Позаконазол 20 мг/мл 200 мМ каптизол® при рН 2 | Прозрачный раствор | 100,00 | Прозрачный раствор | 99,01 | Прозрачный раствор | 97,21 |
| Позаконазол 5 мг/мл 100 мМ каптизол® при рН 3 | Прозрачный раствор | 100,00 | Твердый | 100,99 | Твердый | 100,05 |
| Позаконазол 10 мг/мл 200 мМ каптизол® при рН 3 | Прозрачный раствор | 100,00 | Твердый | 99,90 | Твердый | 99,05 |
| Позаконазол 20 мг/мл 200 мМ каптизол® при рН 3 | Прозрачный раствор | 100,00 | Твердый | 100,39 | Твердый | 101,05 |
| Позаконазол 3 мг/мл 100 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Твердый | 100,72 | Твердый | 99,72 |
| Позаконазол 3 мг/мл 200 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Твердый | 101,12 | Твердый | 100,69 |
| Позаконазол 5 мг/мл 150 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Твердый | 101,13 | Твердый | 100,01 |
| Позаконазол 5 мг/мл 200 мМ каптизол® при рН 4 | Прозрачный раствор | 100,00 | Прозрачный раствор | 101,63 | Прозрачный раствор | 102,53 |
| a: В сравнении с исходным значением после разбавления. |
Чтобы оценить потенциал осаждения во время инфузии разведенного раствора в вену, проводили исследование динамического осаждения с применением способа Yalkowsky et al. (J.L.H. Johnson, Y. He, S.H. Yalkowsky, Validation of an in Vitro Model for Prediction of In Vivo Phlebitis, AAPS, 2002, poster #14919) с небольшими модификациями. Скорость потока изотонического фосфатного буфера Соренсона (ISPB) была 5 мл/мин, что сравнимо со скоростью кровотока в организме человека в легкодоступных венах.
Перистальтический насос (Master Flex® модель 7518-10) обеспечивал поток водной фазы со скоростью 5 мл/мин через гибкую трубку (Cole-Parmer's L/S 14 Silicone (Platinum), который имел внутренний диаметр 1,6 мм), затем через UV проточную кювету. Водная фаза служила в качестве заменителя крови и состояла из изотонического фосфатного буфера Соренсона (ISPB) при pH 7,4. Раствор образца инъецировали в кювету через иглу, вводящую 30 см восходящий поток проточной кюветы. Для контроля скорости ввода пробы применяли шприцевый насос. Скорость ввода варьировала от 0,05 до 10 мл/мин. Появление осадка выявляли посредством спектрофотометра Beckman DU-7 при 540 нм. Это исследование проводили при комнатной температуре. Фильтрованный опытный образец разводили 1:10 нормальным физиологическим раствором или D5W перед инъекцией.
Результаты динамического исследования осаждения для образцов, инъецированных при 1,0 мл/мин, проиллюстрированы в таблице 10. Результаты динамического исследования осаждения предполагают, что различные составы можно получать и разводить без выпадения осадка. Меньшее осаждение также отмечали в образцах, введенных при скорости менее чем 1,0 мл/мин.
| Таблица 10 | |||
| pH 2 | pH 3 | pH 4 | |
| 200 мМ каптизол® | |||
| Позаконазол 20 мг/мл | Осаждениеa | Не может бытьполучен | Не может быть получен |
| Позаконазол 10 мг/мл | Прозрачныйb | Прозрачныйb | Не может быть получен |
| Позаконазол5 мг/мл | Прозрачныйb | Прозрачныйb | Прозрачныйb |
| Позаконазол3 мг/мл | Прозрачныйb | Прозрачныйb | Прозрачныйb |
| 150 мМ каптизол® | |||
| Позаконазол 20 мг/мл | Осаждениеа | Не может быть получен | Не может быть получен |
| Позаконазол 10 мг/мл | Не тестировали | Не тестировали | Не может быть получен |
| Позаконазол 5 мг/мл | Прозрачныйb | Прозрачныйb | Не может быть получен |
| Позаконазол 3 мг/мл | Прозрачныйb | Прозрачныйb | Прозрачныйb |
| 100 мМ каптизол | |||
| Позаконазол 20 мг/мл | Осаждениеа | Не может быть получен | Не может бы |