Композиции и способы, включающие алкилгликозиды, для стабилизации содержащих белки составов
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и касается водной композиции, содержащей антитело и алкилгликозид, имеющий значение СМС около 1,0 мМ или более в воде при 25°С, где алкилгликозид присутствует в концентрации, которая меньше значения СМС алкилгликозида в воде при 25°С. Заявлены также способ ингибирования агрегации антитела и способ предотвращения окисления антитела в водном растворе с использованием водной композиции. Группа изобретений обеспечивает повышение стабильности антител в терапевтически пригодных составах. 3 н. и 30 з.п. ф-лы, 16 ил., 2 табл., 3 пр.
Реферат
Родственная заявка
По данной заявке испрашивается приоритет предварительной заявки на патент США 61/358105, поданной 24 июня 2010, которая полностью включена в настоящее описание посредством ссылки.
Область техники, к которой относится изобретение
Изобретение относится к применению определенных композиций алкилгликозидов для предотвращения агрегации и окисления антител и других белков в их терапевтически пригодных составах.
Предпосылки создания изобретения
В случае, когда в белковом составе требуется стабилизатор для защиты от денатурации при встряхивании, перемешивании, фрагментации и замерзании-оттаивании или в состоянии покоя на поверхности раздела, часто используется неионный детергент (то есть поверхностно-активное вещество) (патент США 5183746). Примерами этого является применение полисорбатов во многих содержащих белки продуктах. Например, полисорбаты 20 и 80 (Tween® 20 и Tween® 80) используются в составах биотерапевтических продуктов как для предотвращения поверхностной абсорбции, так и в качестве стабилизаторов, направленных против агрегации белков (Kerwin, J. Pharm. Sci. 97(8):2924-2936 (2008)). Полисорбаты представляют собой амфипатические неионные поверхностно-активные вещества, состоящие из эфиров жирных кислот полиоксиэтилен(POE)-сорбитана, таких как полиоксиэтиленсорбитанмонолаурат для полисорбата 20 и полиоксиэтиленсорбитанмоноолеат для полисорбата 80.
Однако, к сожалению, полисорбаты могут подвергаться разложению посредством окисления или гидролиза. В случае, когда молекула полисорбата разлагается, она создает различные побочные продукты разложения, например жирные кислоты, POE-сорбитан, PEG, PEG-эфиры и алкиловые кислоты. Определенные из таких побочных продуктов разложения, включая свободные жирные кислоты, могут вызвать увеличение мутности и агрегации белков в содержащих белки составах. Следовательно, хотя полисорбаты обычно применяются в качестве стабилизаторов белков, жирные кислоты и другие побочные продукты разложения, высвобождающиеся при деградации полисорбатов с течением времени, могут неблагоприятно повлиять на защитный эффект, который полисорбаты демонстрируют в содержащих белки составах.
Белки проходят через различные степени деградации в процессе очистки и хранения, где окисление (включая вызванное светом окисление) является одним из основных путей разложения, который оказывает разрушающее влияние на стабильность и активность белков. Окислительные реакции вызывают разрушение аминокислотных остатков, гидролиз пептидных связей и, следовательно, нестабильность белка вследствие изменения третичной структуры белка и агрегации белков (Davies, J. Biol. Chem. 262: 9895-901 (1987)). Обзор окисления белковых фармацевтических препаратов приведен в работах Nguyen (Chapter 4 in Formulation and Delivery of Protein and Peptides (1994)), Hovorka, (J. Pharm Sci. 90:25369 (2001)) и Li (Biotech Bioengineering 48:490-500 (1995)).
С учетом изложенного выше, очевидно, что существует потребность в идентификации композиций, которые могут быть использованы для повышения стабильности и предотвращения агрегации и/или окисления белков в содержащих белки составах.
Сущность изобретения
Изобретение основано на обнаружении того, что определенные композиции алкилгликозидов эффективны для стабилизации и/или снижения агрегации или иммуногенности антител и других белков в терапевтически эффективных составах. Кроме того, изобретение также основано на обнаружении того, что определенные композиции алкилгликозидов эффективны для предотвращения окисления аминокислотных остатков, в частности остатков триптофана, в антителах или других белках в терапевтически эффективных составах. Более конкретно, один из аспектов изобретения направлен на способы применения алкилгликозидов, имеющих значение критической концентрации мицеллообразования (CMC), составляющее по меньшей мере 1,0 мМ, в качестве агентов, стабилизирующих белки или снижающих их агрегацию. В определенных вариантах осуществления изобретения композиция алкилгликозидов используется в составе, содержащем антитела или другие белки, в концентрации, которая ниже соответствующего значения CMC.
Соответственно в одном из аспектов изобретение относится к композиции, содержащей белок и алкилгликозид, имеющий значение CMC около 1,0 мМ или более в воде при 25°C. В определенных вариантах осуществления белок, присутствующий в композиции, представляет собой антитело, которое необязательно может представлять собой моноклональное антитело. В других вариантах осуществления алкилгликозид выбран из группы, состоящей из н-гексил-β-D-глюкопиранозида, н-гептил-β-D-глюкопиранозида, н-октил-β-D-глюкопиранозида, н-нонил-β-D-глюкопиранозида, н-децил-β-D-глюкопиранозида, 3-циклогексил-1-пропил-β-D-глюкозида, 3-циклогексил-1-бутил-β-D-глюкозида, н-гексил-β-D-мальтопиранозида, н-октил-β-D-мальтопиранозида, н-нонил-β-D-мальтопиранозида, н-децил-β-D-мальтопиранозида, циклогексилметил-β-D-мальтозида, 2-циклогексилэтил-β-D-мальтозида, 3-циклогексилпропил-β-D-мальтозида, 4-циклогексилбутил-β-D-мальтозида и 5-циклогексилпентил-β-D-мальтозида. В других вариантах осуществления композиция содержит количество алкилгликозида, ингибирующее агрегацию, вызванную перемешиванием, или препятствующее окислению. В еще одном варианте осуществления алкилгликозид присутствует в композиции в концентрации, которая меньше значения CMC алкилгликозида в воде при 25°C. Композиция может быть водной, может быть стабильной при температуре около 2-8°C в течение по меньшей мере одного года и/или может быть стабильной при температуре около 30°C в течение по меньшей мере одного месяца. Необязательно вещество композиции является нелиофилизированным и не подвергнутым предшествующей лиофилизации, или может представлять собой ресуспендированный лиофилизированный состав.
В еще одном аспекте изобретение направлено на изделие, включающее контейнер, в котором находится описанная выше композиция.
В еще одном аспекте изобретение направлено на способ изготовления фармацевтического состава, включающий приготовление описанной выше композиции и оценку физической стабильности, химической стабильности или биологической активности белка в композиции.
В еще одном аспекте изобретение направлено на способ ингибирования агрегации белка, вызванной перемешиванием, присутствующего в первом водном растворе, включающий стадию добавления к первому водному раствору количества алкилгликозида, ингибирующего агрегацию, вызванную перемешиванием, при этом алкилгликозид имеет значение CMC около 1,0 мМ или более в воде при 25°C, обеспечивая, таким образом, второй водный раствор.
В еще одном аспекте изобретение направлено на способ предотвращения окисления белка, присутствующего в первом водном растворе, включающий стадию добавления к первому водному раствору количества алкилгликозида, ингибирующего окисление, при этом алкилгликозид имеет значение CMC около 1,0 мМ или более в воде при 25°C, обеспечивая, таким образом, второй водный раствор.
Краткое описание чертежей
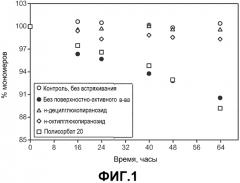
На фиг.1 показано влияние определенных поверхностно-активных веществ на агрегацию моноклонального антитела анти-MUC16 в водном растворе, вызванную перемешиванием.
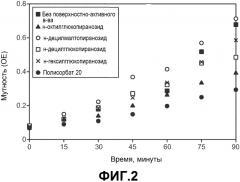
На фиг.2 показано влияние определенных поверхностно-активных веществ на агрегацию моноклонального антитела анти-MUC16 в водном растворе, вызванную перемешиванием.
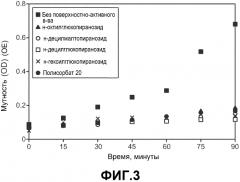
На фиг.3 показано влияние определенных поверхностно-активных веществ на агрегацию моноклонального антитела анти-MUC16 в водном растворе, вызванную перемешиванием.
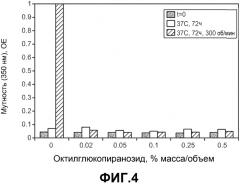
На фиг.4 показано влияние н-октил-β-D-глюкопиранозида на мутность водных растворов, содержащих моноклональное антитело анти-MUC16.
На фиг.5 показано влияние н-октил-β-D-глюкопиранозида на поддержание % мономеров моноклонального антитела анти-MUC16 в водном растворе.
На фиг.6 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на мутность водных растворов, содержащих моноклональное антитело анти-MUC16.
На фиг.7 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на мутность водных растворов, содержащих моноклональное антитело анти-IgE.
На фиг.8 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на мутность водных растворов, содержащих моноклональное антитело анти-CD11a.
На фиг.9 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на мутность водных растворов, содержащих моноклональное антитело анти-CD22.
На фиг.10 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на поддержание % мономеров моноклонального антитела анти-MUC16 в водном растворе.
На фиг.11 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на поддержание % мономеров моноклонального антитела анти-IgE в водном растворе.
На фиг.12 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на поддержание % мономеров моноклонального антитела анти-CD11a в водном растворе.
На фиг.13 показано влияние н-октил-β-D-глюкопиранозида или полисорбата 20 на поддержание % мономеров моноклонального антитела анти-CD22 в водном растворе.
На фиг.14 показано количество пероксида водорода, генерированного различными алкилгликозидами или полисорбатом 20 в растворе с течением времени.
На фиг.15 показано влияние различных алкилгликозидов или полисорбата 20 на предотвращение окисления антитела анти-CD11a в водном растворе.
На фиг.16 показано влияние различных алкилгликозидов или полисорбата 20 на предотвращение окисления антитела анти-CD22 в водном растворе.
Подробное описание предпочтительного варианта осуществления
Изобретение может быть понятно намного легче со ссылками на приведенное ниже подробное описание конкретных вариантов осуществления и примеры, приведенные в нем.
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют то же самое значение, в котором они обычно понимаются специалистом в области техники, к которой относится изобретение. Хотя произвольные способы и материалы, аналогичные или эквивалентные описанным в данном описании, могут быть использованы при практическом применении или тестировании изобретения, ниже описаны предпочтительные способы и материалы. Все публикации, приведенные в данном описании, включены в него посредством ссылки во всей своей полноте.
В данном описании диапазоны или количества, перед которыми находится термин "около" явным образом включают точный диапазон или точное численное количество.
Агрегация антител и других белков преимущественно вызывается гидрофобными взаимодействиями, которые в результате приводят к денатурации. Если гидрофобная область частично или полностью развернутого белка подвергается воздействию воды, то это создает термодинамически неблагоприятную ситуацию из-за того факта, что обычно находящаяся внутри гидрофобная область теперь взаимодействует с гидрофильной водной средой. В результате этого снижение энтропии из-за структурирования водных молекул вокруг гидрофобной области вызывает агрегацию денатурированного белка, преимущественно через взаимодействующие гидрофобные области. Таким образом, растворимость белка также может быть нарушена. В некоторых случаях может в определенных условиях произойти самоассоциация белковых субъединиц, естественных или неправильно свернутых, что приведет к осаждению и потере активности.
Факторы, которые влияют на агрегацию белков в растворе, обычно включают концентрацию белка, pH, температуру, другие эксципиенты и механическое напряжение. Некоторые факторы (например, температура) могут легче контролироваться во время очистки, составления смеси, производства, хранения и применения, чем другие (например, механическое напряжение). При исследовании составов будут выбраны соответствующие значения pH и эксципиенты, которые не вызовут агрегацию и/или фактически будут помогать в предотвращении агрегации. Концентрация белка определяется требуемой терапевтической дозой и в зависимости от значения данной концентрации будет определять, существует ли потенциал для более высоких состояний ассоциации (димеры, тетрамеры и т.д.), которые могут затем привести к агрегации в растворе. Тщательный анализ должен быть проведен в процессе разработки состава для определения того, какие факторы влияют на агрегацию белков и затем каким образом данные факторы могут быть исключены или каким образом они могут контролироваться.
Желание идентифицировать стабильные составы растворов антител или другого белка для применения при парентеральном или другом введении может привести к разработке методологии тестирования для оценки влияния различных добавок на физическую стабильность. На основании известных факторов, влияющих на агрегацию белков, и требований таких применений, физическая стабильность может оцениваться с применением механических процедур, включая перемешивание или вращение растворов белков. Методология тестирования механической нагрузки с целью идентификации способности различных добавок предотвращать агрегацию может включать проведение встряхивания или взбалтывания в горизонтальной плоскости или вращение в x см от оси колеса, вращающегося на n об/мин в вертикальной плоскости. Мутность, возникающая вследствие агрегации, обычно определяется как функция от времени посредством визуального наблюдения или анализа рассеивания света. Альтернативно снижение содержания растворимого белка вследствие осаждения может быть количественно измерено с помощью анализа ВЭЖХ как функция от времени.
Изобретение основано на обнаружении того, что определенные композиции алкилгликозидов эффективны для стабилизации или снижения агрегации и иммуногенности антител или других белков в терапевтически эффективных составах. Кроме того, изобретение также основано на обнаружении того, что определенные композиции алкилгликозидов эффективны для предотвращения или снижения окисления антител или других белков в терапевтически эффективных составах.
"Поверхностно-активные вещества" представляют собой поверхностно-активные агенты, которые могут проявлять свое действие на поверхностях типа твердое-твердое, твердое-жидкое, жидкое-жидкое и жидкое-воздух вследствие своего химического состава, имеющего как гидрофильные, так и гидрофобные группы. Данные вещества снижают концентрацию белков в разбавленных растворах на поверхностях раздела воздух-вода и/или вода-твердое, где белки могут адсорбироваться и потенциально агрегироваться. Поверхностно-активные вещества могут связываться с гидрофобными поверхностями раздела в белковых композициях. Белки на поверхности воды будут агрегироваться, особенно при перемешивании, вследствие развертывания и последующей агрегации белкового монослоя.
"Поверхностно-активные вещества" могут денатурировать белки, но также могут стабилизировать их против поверхностной денатурации. Как правило, ионные поверхностно-активные вещества могут денатурировать белки. Однако неионные поверхностно-активные вещества обычно не денатурируют белки даже при относительно высоких концентрациях (1% масса/объем). Большинство парентерально приемлемых поверхностно-активных веществ происходят из групп полисорбатов или полиэфиров. Полисорбаты 20 и 80 представляют собой современные поверхностно-активные стабилизаторы в имеющихся на рынке белковых составах. Однако другие поверхностно-активные вещества, используемые в белковых составах, включают Pluronic F-68 и членов класса "Brij". Ни одно из этих веществ не является алкилгликозидом по изобретению.
Физические события могут проявляться в подверженности химическим событиям. Химическая нестабильность белков может включать расщепление или образование ковалентных связей с первичной структурой белка. Было описано несколько реакций окисления в белках. В щелочной или нейтральной среде остатки аминокислот цистеина, гистидина, метионина, триптофана и тирозина особенно подвержены окислению. Однако в кислотных условиях чувствительным является метионин. Часто реакции окисления вызывают большую потерю биологической активности и даже иммуногенности. В данной области хорошо известно, что окисление аминокислотных остатков в белках, особенно остатков триптофана, может быть вызвано воздействием света.
Пероксиды представляют собой известные загрязняющие вещества для неионных поверхностно-активных веществ. Пероксиды в полисорбатах могут приводить к окислительному разложению белков. Составители композиций обычно изучают источники полисорбатов и других полимерных добавок в белковых составах на предмет загрязнения пероксидами и создают спецификации для использования пероксидов в качестве добавки. Альтернативно внесение антиоксиданта используют для того, чтобы способствовать снижению потенциальной опасности от неионных поверхностно-активных веществ, которые служат в качестве катализаторов окисления для чувствительных к окислению белков.
"Поверхностно-активные вещества" являются молекулами с четко определенными полярными и неполярными областями, что позволяет им агрегировать в растворе с образованием мицелл. В зависимости от природы полярной области поверхностно-активные вещества могут быть неионными, анионными, катионными и цвиттер-ионными. Неионные поверхностно-активные вещества могут быть основаны на сахарах. Основанные на сахарах поверхностно-активные вещества могут представлять собой алкилгликозиды.
Как использовано в данном описании, "алкилгликозид" относится к произвольному сахару, соединенному связью с произвольным гидрофобным алкилом, как известно в данной области. Связь между гидрофобной алкильной цепью и гидрофильным сахаридом может включать, среди прочего, гликозидную, эфирную, тиогликозидную, тиоэфирную, сложноэфирную, амидную или уреидную связь или связывание, примеры которых описаны в данном описании. Термины "алкилгликозид" и "алкилсахарид" могут использоваться в данном описании взаимозаменяемо.
Общей структурой алкилгликозидов по изобретению является R1-O-(CH2)x-R, где R может представлять собой, например, CH3, циклогексил (C6H11) или другую алкильную цепь, включая их изомеры, и R1 представляет собой сахар, обычно глюкозу или мальтозу. Конкретные алкилгликозиды включают алкилы, в которых R1 представляет собой глюкозу, R представляет собой CH3, и x равен 5 (н-гексил-β-D-глюкопиранозид), x равен 6 (н-гептил-β-D-глюкопиранозид), x равен 7 (н-октил-β-D-глюкопиранозид), x равен 8 (н-нонил-β-D-глюкопиранозид), x равен 9 (н-децил-β-D-глюкопиранозид) и x равен 11 (н-додецил-β-D-глюкопиранозид). Иногда глюкопиранозиды называют глюкозидами.
Иллюстративные алкилгликозиды дополнительно включают алкилы, в которых R1 представляет собой мальтозу, R представляет собой CH3, и x равен 5 (н-гексил-β-D-мальтопиранозид), x равен 7 (н-октил-β-D-мальтопиранозид), x равен 8 (н-нонил-β-D-мальтопиранозид), x равен 9 (н-децил-β-D-мальтопиранозид), x равен 10 (н-ундецил-β-D-мальтопиранозид), x равен 11 (н-додецил-β-D-мальтопиранозид), x равен 12 (н-тридецил-β-D-мальтопиранозид), x равен 13 (н-тетрадецил-β-D-мальтопиранозид) и x равен 15 (н-гексадецил-β-D-мальтопиранозид). Иногда мальтопиранозиды называют мальтозидами.
Иллюстративные алкилгликозиды также включают алкилы, в которых R1 представляет собой глюкозу, x равен 3, и R представляет собой циклогексил (3-циклогексил-1-пропил-β-D-глюкозид); и в которых R1 представляет собой мальтозу, x равен 4, и R представляет собой циклогексил (4-циклогексил-1-бутил-β-D-мальтозид).
В одном конкретном аспекте изобретения алкилгликозиды, используемые в изобретении, представляют собой алкилы, демонстрирующие критическую концентрацию мицеллообразования (CMC), составляющую 1,0 мМ или более в воде при температуре в диапазоне 20-25°C, предпочтительно, при 25°C. Иллюстративные алкилгликозиды, имеющие такие значения CMC, показаны в табл. 1, при этом другие алкилы хорошо известны в данной области.
| Таблица 1 | ||
| Алкилгликозид | Значение CMC (мМ) | Значение CMC (масса/объем) |
| н-гексил-β-D-глюкопиранозид | 250 мМ | 6,6% масса/объем |
| н-гептил-β-D-глюкопиранозид | 70 мМ | 1,9% масса/объем |
| н-октил-β-D-глюкопиранозид | 18 мМ | 0,53% масса/объем |
| н-нонил-β-D-глюкопиранозид | 6,5 мМ | 0,2% масса/объем |
| н-децил-β-D-глюкопиранозид | 2,2 мМ | 0,07% масса/объем |
| 3-циклогексил-1-пропил-β-D-глюкозид | 28 мМ | 0,86% масса/объем |
| 3-циклогексил-1-бутил-β-D-глюкозид | 1,8 мМ | 0,058% масса/объем |
| н-гексил-β-D-мальтопиранозид | 210 мМ | 8,9% масса/объем |
| н-октил-β-D-мальтопиранозид | 19,5 мМ | 0,89% масса/объем |
| н-нонил-β-D-мальтопиранозид | 6 мМ | 0,28% масса/объем |
| н-децил-β-D-мальтопиранозид | 1,8 мМ | 0,087% масса/объем |
| циклогексилметил-β-D-мальтозид | 340 мМ | 15% масса/объем |
| 2-циклогексилэтил-β-D-мальтозид | 120 мМ | 5,4% масса/объем |
| 3-циклогексилпропил-β-D-мальтозид | 34,5 мМ | 1,6% масса/объем |
| 4-циклогексилбутил-β-D-мальтозид | 7,6 мМ | 0,37% масса/объем |
| 5-циклогексилпентил-β-D-мальтозид | 2,4 мМ | 0,12% масса/объем |
| н-додецил-β-D-мальтопиранозид | 0,17 мМ | 0,0087 масса/объем |
| н-додецил-β-D-глюкопиранозид | 0,19 мМ | 0,0066 масса/объем |
В частности, алкилгликозид может быть использован отдельно в качестве агента, стабилизирующего антитело или другой белок (или снижающего агрегацию или окисление), или может быть использован совместно с другими алкилгликозидами. Алкилгликозиды находят применение в качестве агентов, стабилизирующих антитело или другой белок (или снижающих агрегацию или окисление) в широком диапазоне концентраций в водном растворе. В конкретных вариантах осуществления изобретения алкилгликозид (при использовании в качестве отдельного агента) или алкилгликозиды (при совместном использовании) могут присутствовать в водном содержащем антитело или белок составе в концентрации от около 0,001 мМ до около 500 мМ, предпочтительно от около 0,005 мМ до около 400 мМ, более предпочтительно от около 0,01 мМ до около 300 мМ, более предпочтительно от около 0,02 мМ до около 250 мМ, более предпочтительно от около 0,03 мМ до около 200 мМ, более предпочтительно от около 0,05 мМ до около 100 мМ, предпочтительнее от около 0,1 мМ до около 100 мМ, более предпочтительно от около 0,1 мМ до около 50 мМ.
В особенно предпочтительном варианте осуществления изобретения конкретный алкилгликозид может быть применен в качестве агента, стабилизирующего антитело или другой белок (или снижающего агрегацию или окисление), в концентрации ниже, чем его соответствующее значение CMC.
В отношении описанного выше, в данной области понимается, что химический синтез соединений, таких как алкилгликозиды, описанные в данном описании, приводит к образованию некоторой гетерогенной смеси соединений, отличной от полностью гомогенного состава. Поэтому, если в данном описании указывается, что используется конкретный алкилгликозид, следует понимать, что определение относится к большей части компонентов гетерогенной смеси, которая образуется в результате их химического синтеза.
Под "полипептидом" или "белком" понимают последовательность аминокислот, для которой длина цепи является достаточной для получения более высоких уровней третичной и/или четвертичной структуры. Таким образом, белки отличаются от "пептидов", которые также представляют собой основанные на аминокислотах молекулы, которые не имеют подобной структуры. Обычно белок, используемый для целей изобретения, будет иметь молекулярную массу по меньшей мере около 5-20 кДа, альтернативно по меньшей мере около 15-20 кДа, предпочтительно по меньшей мере около 20 кДа. Под "пептидом" понимается последовательность аминокислот, которая обычно не демонстрирует более высокий уровень третичной и/или четвертичной структуры. Пептиды обычно имеют молекулярную массу менее чем около 5 кДа.
Примеры полипептидов, охватываемых приведенным в настоящем описании определением, включают белки млекопитающих, такие как, например, ренин; гормон роста, включая человеческий гормон роста и гормон роста крупного рогатого скота; фактор, стимулирующий выделение гормона роста; паратиреоидный гормон; тиреостимулирующий гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда; факторы противосвертывания, такие как протеин С; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или активатор плазминогена человеческой мочи или тканевый активатор плазминогена (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; факторы некроза опухолей альфа и бета; энкефалиназа; RANTES (хемокин, выделяемый T-клетками при активации); человеческий макрофаговый белок воспаления (MIP-1-альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; мюллеров ингибирующий фактор; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный ассоциированный с гонадотропином пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген цитотоксических Т-лимфоцитов (CTLA), такой как CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы для гормонов или факторов роста; белок A или D; ревматоидные факторы; нейротрофический фактор, такой как выделенный из кости нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактор роста нервной ткани, такой как NGF-β; фактор роста тромбоцитов (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозговой IGF-I), белки связывания инсулиноподобных факторов роста (IGFBP); CD-белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1-IL-10; супероксид-дисмутаза; рецепторы T-клетки; поверхностные мембранные белки; фактор стимулятора гемолиза; вирусный антиген, такой как, например, часть оболочки СПИД; транспортные белки; "хоминг"-рецептор; адресины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолевый специфический антиген, такой как CA125 (антиген рака яичников) или рецептор HER2, HER3 или HER4; иммуноадгезины; и фрагменты и/или варианты любых приведенных выше белков, а также антитела, включая фрагменты антител, связывающиеся с любыми приведенными выше белками.
Белок, включаемый в композицию, предпочтительно является, по существу, чистым и желательно, по существу, гомогенным (то есть свободным от загрязняющих белков). "По существу, чистый" белок означает композицию, содержащую по меньшей мере около 90% белка по массе относительно общей массы композиции, предпочтительно по меньшей мере около 95% по массе. "По существу, гомогенный" белок означает композицию, содержащую по меньшей мере около 99% белка по массе относительно общей массы композиции.
В определенных вариантах осуществления белок представляет собой антитело. В данном описании антитело направлено на представляющий интерес "антиген". Предпочтительно антиген представляет собой биологически важный белок, и введение антитела млекопитающему, страдающему заболеванием или нарушением, может иметь терапевтический эффект для этого млекопитающего. Однако также предполагаются антитела, направленные на небелковые антигены (такие как ассоциированные с опухолью гликолипидные антигены; см. патент США 5091178). Если антиген является белком, он может представлять собой трансмембранную молекулу (например, рецептор) или лиганд, такой как фактор роста. Конкретные антигены включают белки, обсуждаемые выше. Предпочтительные молекулы-мишени для антител, охватываемые изобретением, включают CD-полипептиды, такие как CD3, CD4, CD8, CD19, CD20 и CD34; члены семейства рецепторов HER, такие как EGF-рецептор (HER1), рецептор HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Mac1, pl50,95, VLA-4, ICAM-1, VCAM и интегрин av/b3, включая его субъединицы a или b (например, антитела анти-CD11a, анти-CD18 или анти-CD 11b); факторы роста, такие как VEGF; IgE; антигены группы крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; полипептид C и т.д. Растворимые антигены или их фрагменты необязательно сопряженные с другими молекулами, могут быть использованы в качестве иммуногенов для получения антител. В случае трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецепторы) могут быть использованы в качестве иммуногена. Альтернативно, клетки, экспрессирующие трансмембранную молекулу, могут быть использованы в качестве иммуногена. Такие клетки могут быть получены из природного источника (например, раковых клеточных линий) или могут представлять собой клетки, которые были трансформированы посредством рекомбинантных технологий для экспрессии трансмембранной молекулы.
Примеры антител, предназначенных для очистки в соответствии с изобретением, включают, но не ограничиваются ими, антитела HER2, включая трастузумаб (HERCEPTIN®) (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285-4289 (1992), патент США 5725856) и пертузумаб (OMNITARG™) (WO01/00245); антитела CD20 (см. ниже); антитела IL-8 (St John et al., Chest, 103:932 (1993) и международная публикация No. WO 95/23865); антитела рецептора VEGF или VEGF, включая гуманизированные антитела VEGF и/или антитела VEGF с созреванием аффинности, такие как гуманизированное антитело VEGF huA4.6.1 бевацизумаб (AVASTIN®) и ранибизумаб (LUCENTIS®) (Kim et al., Growth Factors, 7:53-64 (1992), международная публикация No. WO96/30046 и WO 98/45331, опубликованная 15 октября 1998); антитела PSCA (WO01/40309); антитела CD11a, включая эфализумаб (RAPTIVA®) (патент США 6037454, патент США 5622700, WO 98/23761, Stoppa et al., Transplant Intl. 4:3-7 (1991), и Hourmant et al., Transplantation 58:377-380 (1994)); антитела, которые связывают IgE, включая омализумаб (XOLAIR®) (Presta et al., J. Immunol. 151:2623-2632 (1993) и международная публикация No. WO 95/19181; патент США 5714338, выданный 3 февраля 1998, или патент США 5091313, выданный 25 февраля 1992, WO 93/04173, опубликованная 4 марта 1993, или международная заявка No. PCT/US98/13410, поданная 30 июня 1998, патент США 5714338); антитела CD18 (патент США 5622700, выданный 22 апреля 1997, или как в WO 97/26912, опубликованной 31 июля 1997); антитела рецепторного антитела Apo-2 (WO 98/51793, опубликованная 19 ноября 1998); антитела тканевого фактора (TF) (европейский патент 0420937 B1, выданный 9 ноября 1994); антитела интегринов α4-α7 (WO 98/06248, опубликованная 19 февраля 1998); антитела EGFR (например, химерного или гуманизированного антитела 225, цетуксимаб, ERBUTIX®, как в WO 96/40210, опубликованной 19 декабря 1996); антитела CD3, такие как OKT3 (патент США 4515893, выданный 7 мая 1985); антитела CD25 или Tac, такие как CHI-621 (SIMULECT®) и ZENAPAX® (патент США 5693762, выданный 2 декабря 1997); антитела CD4, такие как антитело cM-7412 (Choy et al., Arthritis Rheum 39(l):52-56 (1996)); антитела CD52, такие как CAMPATH-1H (ILEX/Berlex) (Riechmann et al., Nature 332:323-337 (1988)); антитела рецептора Fc, такие как антитело M22 против FcyRI, как в работе Graziano et al., J. Immunol. 155(10):4996-5002 (1995)); антитела карциноэмбрионального антигена (CEA), такие как hMN-14 (Sharkey et al., Cancer Res. 55(23Suppl): 5935s-5945s (1995)); антитела, направленные против эпителиальных клеток груди, включая huBrE-3, hu-Mc 3 и CHL6 (Ceriani et al., Cancer Res. 55(23): 5852s-5856s (1995); и Richman et al., Cancer Res. 55(23 Supp): 5916s-5920s (1995)); антитела, которые связываются с клетками карциномы толстой кишки, такие как C242 (Litton et al., Eur J. Immunol. 26(1): 1-9 (1996)); антитела CD38, например, AT 13/5 (Ellis et al., J. Immunol. 155(2):925-937 (1995)); антитела CD33, такие как Hu M195 (Jurcic et al., Cancer Res 55(23 Suppl):5908s-5910s (1995)) и CMA-676 или CDP771; антитела EpCAM, такие как 17-1A (PANOREX®); антитела GpIIb/IIIa, такие как абциксимаб или c7E3 Fab (REOPRO®); антитела RSV, такие как MEDI-493 (SYNAGIS®); антитела CMV, такие как PROTOVIR®; антитела ВИЧ, такие как PR0542; антитела гепатита, такие как антитело Hep B OSTAVIR®; антитело CA125, включая анти-MUC16 (WO2007/001851; Yin, BWT и Lloyd, KO, J. Biol. Chem. 276:27371-27375 (2001)) и OvaRex; антитело идиотипического эпитопа GD3 BEC2; антитело ανβ3 {например, VITAXIN®; Medimmune); антитело почечно-клеточной карциномы, такое как ch-G250; ING-1; антитело против человеческого 17-1An (3622W94); антитело против человеческой колоректальной опухоли (A33); антитело против человеческой меланомы R24, направленное против ганглиозида GD3; против человеческой плоскоклеточной карциномы (SF-25); антитело антигена лейкоцитов человека (HLA), такое как Smart ID 10 и антитело анти-HLA DR Oncolym (Lym-1); антитело CD37, такое как TRU 016 (Trubion); антитело IL-21 (Zymogenetics/Novo Nordisk); антитело анти-B-клетки (Impheron); направленное на B-клетки MAb (Immunogen/Aventis); 1D09C3 (Morphosys/GPC); LymphoRad 131 (HGS); антитело Lym-1, такое как Lym-1Y-90 (USC) или анти-Lym-1 Oncolym (USC/Peregrine); LIF 226 (Enhanced Lifesci.); антитело BAFF (например, WO 03/33658); антитело рецептора BAFF (например, WO 02/24909); антитело BR3; антитело Blys, такое как белимумаб; LYMPHOSTAT-B™; ISF 154 (UCSD/Roche/Tragen); гомиликсима (Idee 152; Biogen Idee); антитело к рецептору IL-6, такое как атлизумаб (ACTEMRATM; Chugai/Roche); антитело к IL-15, такое как HuMax-I1-15 (Genmab/Amgen); антитело к рецептору хемокинов, такое как антитело к CCR2 (например, MLN1202; Millieneum); антитело к комплементу, такое как антитело к C5 (например, экулизумаб, 5G1.1; Alexion); пероральный препарат иммуноглобулина человека (например, IgPO; Protein Therapeutics); антитело к IL-12, такое как ABT-874 (CAT/Abbott); тенеликсимаб (BMS-224818); антитела CD40, включая S2C6 и его гуманизированные варианты (WO00/75348) и TNX 100 (Chiron/Tanox); антитела TNF-α, включая cA2 или инфликсимаб (REMICADE®), CDP571, MAK-195, адалимумаб (HUMIRA™), пегилированный фрагмент антитела к TNF-α, такой как CDP-870 (Celltech), D2E7 (Knoll), поликлональное антитело к анти-TNF-α (например, PassTNF; Verigen); антитела CD22, такие как LL2 или эпратузумаб (LYMPHOCIDE®; Immunomedics), включая эпратузумаб Y-90 и эпратузумаб I-131, антитело Abiogen CD22 (Abiogen, Italy), CMC 544 (Wyeth/Celltech), комботокс (UT Soutwestern), BL22 (NIH) и LympoScan Tc99 (Immunomedics).
Примеры антител CD20 включают "C2B8", которое в настоящее время называется "ритуксимаб" ("RITUXAN®") (патент США 5736137); помеченное иттрием-[90] мышиное антитело 2B8, обозначенное как "Y2B8" или "ибритутомаб тиуксетан" (ZEVALIN®), коммерчески доступное от IDEC Pharmaceuticals, Inc. (патент США 5736137; 2B8, зарегистрированное в ATCC под кодом доступа № HB11388 22 июня 1993); мышиное IgG2a "B1", также называемое "тозитумомаб", необязательно помеченное I с целью создания антитела "131I-B1" или "йод I131 - тозитумомаб" (BEXXAR™), коммерчески доступное от Corixa (патент США 5595721); мышиное моноклональное антитело "1F5" (Press et al., Blood 69(2):584-591 (1987)) и его варианты, включая 1F5 "со склеенным остовом" или гуманизированное 1F5 (WO 2003/002607, Leung, S.; регистрация в ATCC под номером HB-96450); мышиное антитело 2H7 и химерное антитело 2H7 (патент США 5677180); гуманизированное 2H7 (WO 2004/056312, Lowman et al.,); 2F2 (HuMax-CD20), полностью человеческое высокоаффинное антитело, нацеленное на молекулу CD20 в клеточной мембране B-клеток (Genmab, Denmark; например, Glennie and van de Winkel, Drug Discovery Today 8: 503-510 (2003) и Cragg et al., Blood 101: 1045-1052 (2003); WO 2004/035607; US2004/0167319); человеческие моноклональные антитела, описанные в WO 2004/035607 и US2004/0167319 (Teeling et al.); антитела, имеющие сложные соединенные N-гликозидом сахарные цепи, связанные с Fc-областью, описанной в US 2004/0093621 (Shitara et al.,); моноклональные антитела и связывающие антиген фрагменты, связывающиеся с CD20 (WO 2005/000901, Tedder et al.), такие как HB20-3, HB20-4, HB20-25, и MB20-11; связывающие CD20 молекулы, такие как серия антител AME, например, антитела AME 33, описанные в WO 2004/103404 и US2005/0025764 (Watkins et al., Eli Lilly/Applied Molecular Evolution, AME); связывающие CD20 молекулы, такие как описано в US 2005/0025764 (Watkins et al.); антитело A20 или его варианты, такие как химерное или гуманизированное антитело A20 (cA20, bA20, соответственно) или IMMU-106 (US 2003/0219433, Immunomedics); связывающие CD20 антитела, включая Leu-16, 1H4, или 2B8 с обедненным эпитопом, необязательно конъюгированные с IL-2, как в US 2005/0069545A1 и WO 2005/16969 (Carr et al.,); биспецифичное антитело, которое связывает CD22 и CD20, например, hLL2xhA20 (WO2005/14618, Chang et al.,); моноклональные антитела L27, G28-2, 93-1B3, B-C1 или NU-B2, доступные в трудах международного семинара по типированию лейкоцитарных антигенов (Valentine et al., In: Leukocyte Typing III (McMichael, Ed., p. 440, Oxford University Press (1987)); 1H4 (Haisma et al., Blood 92: 184 (1998)); анти-CD20 конъюгат ауристатина E (Seattle Genetics); анти-CD20-IL2 (EMD/Biovation/City of Hope); терапевтическое средство анти-CD20 MAb (EpiCyte); антитело анти-CD20 TRU 015 (Trubion).
Термин "антитело", как использовано в данном описании, включает моноклональные антитела (включая полноразмерные антитела, имеющие Fc-область иммуноглобулина), композиции антител со специфичностью ко многим эпитопам, мультиспецифичные антитела (например, биспецифичные антитела, диатела и одноцепочечные молекулы, а также фрагменты антител (например, Fab, F(ab')2 и Fv). Термин "иммуно