Способ получения клеток, продуцирующих панкреатические гормоны
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения панкреатических гормонпродуцирующих клеток (варианты). Представленный способ включает культивирование человеческих индуцированных плюрипотентных стволовых (iPS) клеток в среде, содержащей (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанкарбоксамид дигидрохлорид; далее культивирование полученных клеток в среде, содержащей (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii) (2′Z,3′Е)-6-броминдирубин-3′-оксим; далее культивирование полученных клеток в среде, содержащей (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii) (2′Z,3′E)-6-броминдирубин-3′-оксим и активин; далее образование клеточной массы из полученных клеток и культивирование клеточной массы в суспензионном состоянии в среде; далее культивирование полученных клеток в среде, содержащей ретиноевую кислоту, дорсоморфин, 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-придинил)-1Н-имидазол-2-ил]-бензамид и основной фактор роста фибробластов; далее культивирование полученных клеток. При осуществлении заявленного изобретения не используется питающая клетка, а среда не содержит сыворотку. Изобретение может быть использовано в клеточной терапии при лечении сахарного диабета. 2 н. и 1 з.п. ф-лы, 8 ил., 3 пр.
Реферат
Область техники
[0001]
Настоящее изобретение относится к способу получения клеток, продуцирующих панкреатические гормоны, и к лекарственному средству, содержащему клетки, продуцирующие панкреатические гормоны, полученные указанным способом, и к тому подобному.
Предпосылки изобретения
[0002]
Поджелудочная железа имеет эндокринные железы (эндокринные клетки) и экзокринные железы (экзокринные клетки) и представляет собой орган, играющий важную роль, благодаря обоим видам клеток. Экзокринные клетки главным образом играют роль секреции пищеварительных ферментов, таких как панкреатическая липаза, трипсин, эластаза, панкреатическая амилаза и тому подобные.
Эндокринные клетки играют роль секреции панкреатических гормонов, и известно, что глюкагон секретируется из панкреатических α-клеток, инсулин секретируется из панкреатических β-клеток, соматостатин секретируется из панкреатических δ-клеток, и панкреатический полипептид (иногда сокращенно именуемый в настоящем описании PP) секретируется из PP клеток. В последние годы, сообщалось, что грелин, который представляет собой гормон, секретируемый желудком, также секретируется из поджелудочной железы.
[0003]
Инсулин играет важную роль содействия утилизации глюкозы, синтезу белка и образованию и накоплению нейтральных жиров, снижению уровня глюкозы в крови и поддержанию нормальной концентрации глюкозы крови. Панкреатический глюкагон играет важную роль, наряду с инсулином, в регуляторном механизме метаболизма сахаров, в качестве гипергликемического гормона посредством печеночного гликогенолиза, действия в виде глюконеогенеза и тому подобного. Соматостатин проявляет действие связывания с рецептором соматостатина, и подавляет секрецию различных гормонов, таких как глюкагон, инсулин и тому подобное, в поджелудочной железе. PP представляет собой гормон, известный как фактор чувства насыщения, секретируемый из клеток островков Лангреганса в ответ на рацион, и снижающий потребление пищи и прибавку массы тела. Известно, что грелин стимулирует потребление пищи, и увеличивает прибавку массы тела путем снижения окисления жиров.
[0004]
Сахарный диабет представляет собой заболевание, развивающееся вследствие недостаточной секреции инсулина и утраты его функции, и после развития сахарного диабета, он трудно поддается лечению. Сахарный диабет может преимущественно классифицироваться на два типа: сахарный диабет I типа (инсулинозависимый сахарный диабет) и сахарный диабет II типа (инсулиннезависимый сахарный диабет).
Сахарный диабет II типа представляет собой хроническое заболевание, развивающееся вследствие устойчивости к инсулину, которое создает проблемы в отношении привычного образа жизни, такие как ожирение ввиду переедания и гиподинамии, стресса и т.д. Сахарный диабет II типа часто развивается у взрослых людей среднего возраста, и многие пациенты с сахарным диабетом страдают этим типом сахарного диабета.
Сахарный диабет I типа представляет собой хроническое заболевание, вызываемое деструкцией продуцирующих инсулин клеток аутоиммунными заболеваниями, вирусной инфекцией и тому подобными факторами, приводящими к прекращению секреции инсулина в организме. В качестве способа лечения, который может автоматически регулировать постоянно изменяющийся уровень глюкозы в крови в организме и снизить бремя, воздействующее на пациентов, у пациентов с сахарным диабетом I типа выполняют трансплантацию поджелудочной железы или трансплантацию панкреатических островков. Хотя этими способами можно достичь нормального уровня глюкозы в крови, техника трансплантации еще недостаточно отработана, ткани поджелудочной железы и панкреатических островков, которые могут быть трансплантированы, недостаточно. Кроме того, во избежание отторжения трансплантата, пациенты должны в течение всей жизни принимать иммунодепрессант, и еще остаются проблемы риска инфекции, побочных эффектов, вызванных иммунодепрессантом, и тому подобные.
[0005]
Одним из способов лечения, испытывавшихся по поводу сахарного диабета I типа, является способ, включающий репродукцию самих продуцирующих инсулин клеток из клеток, полученных у пациента, и трансплантацию клеток в тело пациента. В соответствии с этим способом, инсулин может вырабатываться в организме пациента. Кроме того, поскольку клетки представляют собой собственные клетки пациента, этот способ также имеет преимущества с точки зрения безопасности, поскольку может быть решена проблема отторжения и тому подобные.
[0006]
Известные способы получения продуцирующих инсулин клеток включают способ дифференцировки ES (эмбриональных стволовых) клеток, способ дифференцировки эмбриональных стволовых клеток поджелудочной железы пациента, способ выделения клеток, полученных из эпителия панкреатического протока пациента из организма и их дифференцировки и тому подобные. В частности, способ индукции дифференциации панкреатических β-клеток из человеческих ES клеток путем использования активина и ретиноевой кислоты (RA) (патентный документ 1, не патентные документы 1-4), способ индукции дифференциации продуцирующих глюкагон клеток (α-клеток) из человеческих ES клеток (не патентный документ 8), способ индукции дифференциации панкреатических β-клеток из человеческих iPS (индуцированных плюрипотентных стволовых) клеток (не патентные документы 5-7), способ эффективной индукции дифференциации продуцирующих инсулин клеток, включая введение PDX1, который, как известно, является важным фактором транскрипции, участвующим в развитии поджелудочной железы, а также ответственным за развитие и функциональную поддержку продуцирующих инсулин клеток в ES клетки, и культивирования клеток (патентный документ 2), и тому подобные.
[0007]
Однако поскольку продуцирующие инсулин клетки, полученные этими способами, проявляют значительно сниженную эффективность продукции инсулина, по сравнению с нормальными панкреатическими β-клетками, то еще требуется разработка способа эффективного получения продуцирующих инсулин клеток, которые могут быть приняты для применения клеточной терапии. Кроме того, для лечения сахарного диабета и тому подобных заболеваний желательно увеличение числа получаемых клеток до практического уровня.
Перечень документов, приведенных в качестве ссылок
Патентные документы
Патентный документ 1 - патент Японии JP-A-2009-225661
Патентный документ 2 - патент США № B-7534608
Не патентные документы
Не патентный документ 1 - E. Kroon et al., «Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo.», Nature Biotechnology (2008) Vol. 26, No.4: 443-452
Не патентный документ 2 - K. A D'Amour et al., «Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells.», Nature Biotechnology (2006) Vol. 24, No. 11: 1392-1401
Не патентный документ 3 - W. Jiang, «In vitro derivation of functional insulin-producing cells from human embryonic stem cells.», Cell Research (2007) 17: 333-344
Не патентный документ 4 - J. H. Shim et al., «Directed differentiation of human embryonic stem cells towards a pancreatic cell fate.», Diabetologia (2007) 50:1228-1238
Не патентный документ 5 - R. Maehra et al., «Generation of pluripotent stem cells from patients with type 1 diabetes.», PNAS (2009), vol. 106, No. 37: 15768-15773
Не патентный документ 6 - MC. Nostro et al., «Stage-specific signaling through TGFbeta family members и WNT regulates patterning и pancreatic specification of human pluripotent stem cells.», Development (2011), 138: 861-871
Не патентный документ 7 - A. Rezania et al., «Production of functional glucagon-secreting alpha-cells from human embryonic stem cells.», Diabetes (2011), 60: 239-247
Не патентный документ 8 - T. Thatava et al., «Indolactam V/GLP-1-mediated differentiation of human iPS cells into glucose-responsive insulin-secreting progeny.», Gene Ther (2011), 18: 283-293
Краткое изложение сущности изобретения
Проблемы, подлежащие решению изобретением
[0008]Целью настоящего изобретения является разработка способа получения панкреатических гормонпродуцирующих клеток, более подходящих для применения при клеточной терапии, лекарственного средства, содержащего гормонпродуцирующие клетки, полученные указанным способом получения, и способа скрининга терапевтического лекарственного препарата для лечения сахарного диабета с использованием указанных клеток.
Средства решения проблем
[0009]Заявители провели интенсивные исследования в связи с указанной выше проблемой и обнаружили, что панкреатические гормонпродуцирующие клетки в форме, более имитирующей панкреатогенез (форме, поддерживающей трехмерную структуру), могут быть получены из стволовой клетки путем серийного изменения вида и комбинации индукторов дифференциации и путем культивирования в суспензионном состоянии после образования клеточной массы из эндодермальных клеток и тому подобных, что привело к созданию настоящего изобретения.
[0010]Соответственно, настоящее изобретение относится к следующему.
[1] Способ получения панкреатических гормонпродуцирующих клеток, включающий подвергание стволовых клеток следующим стадиям (1)-(6):
(1) стадии культивирования стволовых клеток в среде, содержащей ингибитор Rho-киназы
(2) стадии культивирования клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3 (гликоген-синтазы киназы)
(3) стадии культивирования клеток, полученных на указанной выше стадии (2) в среде, содержащей ингибитор GSK3, и активатор подобной рецептору активина киназы-4,7
(4) стадии образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадии культивирования клеток, полученных на указанной выше стадии (4) в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток
(6) стадии культивирования клеток, полученных на указанной выше стадии (5);
[2] Способ получения по указанному выше пункту [1], где активатор подобной рецептору активина киназы-4,7 на стадии (3) представляет собой активин;
[3] Способ получения по указанному выше пункту [1] или [2], где ингибитор Rho киназы на стадии (1) представляет собой (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанкарбоксамид дигидрохлорид;
[4] Способ по любому из указанных выше пунктов [1]-[3], где ингибитор GSK3 на стадиях (2) и (3) представляет собой (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1H-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii)(2'Z,3'E)-6-броминдирубин-3'-оксим;
[5] Способ по любому из указанных выше пунктов [1]-[4], где агонист рецептора ретиноевой кислоты на стадии (5) представляет собой ретиноевую кислоту;
[6] Способ по любому из указанных выше пунктов [1]-[5], где ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6 на стадии (5) представляет собой дорсоморфин;
[7] Способ по любому из указанных выше пунктов [1]-[6], где ингибитор подобной рецептору активина киназы-4,5,7 на стадии (5) представляет собой 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-пиридинил)-1H-имидазол-2-ил]-бензамид;
[8] Способ по любому из указанных выше пунктов [1]-[7], где фактор роста клеток на стадии (5) представляет собой основной фактор роста фибробластов;
[9] Способ по любому из указанных выше пунктов [1]-[8], где на стадиях (1)-(6) по существу не используется питающая клетка;
[10] Способ по любому из указанных выше пунктов [1]-[7], где среда на стадиях (1)-(6) по существу не содержит сыворотку;
[11] Способ по любому из указанных выше пунктов [1]-[10], где стволовые клетки представляют собой индуцированные плюрипотентные стволовые клетки (iPS летки), эмбриональные стволовые клетки (ES клетки) или человеческие соматические стволовые клетки;
[12] Способ по любому из указанных выше пунктов [1]-[11], где панкреатические гормонпродуцирующие клетки представляют собой любые гормонпродуцирующие клетки, выбранные из группы, состоящей из клеток, продуцирующих инсулин, клеток, продуцирующих глюкагон, клеток, продуцирующих соматостатин, клеток, продуцирующих панкреатический полипептид (PP), и клеток, продуцирующих грелин;
[13] Способ получения панкреатических гормонпродуцирующих клеток, включающий подвергание эндодермальных клеток следующим стадиям (4') и (5'):
(4') стадии образования клеточной массы из эндодермальных клеток и культивирования клеточной массы в суспензионном состоянии в среде
(5') стадии культивирования клеток, полученных на указанной выше стадии (4') в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток;
[14] Лекарственное средство, содержащее панкреатические гормонпродуцирующие клетки, полученные способом получения по любому из указанных выше пунктов [1]-[13];
[15] Способ скрининга лекарственного препарата для лечения сахарного диабета, включающий использование клеток, полученных одной или более стадий, выбранных из группы, состоящей из следующих стадий (1)-(6):
(1) стадии культивирования стволовых клеток в среде, содержащей ингибитор Rho-киназы
(2) стадии культивирования клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3
(3) стадии культивирования клеток, полученных на указанной выше стадии (2) в среде, содержащей ингибитор GSK3, и активатор подобной рецептору активина киназы-4,7
(4) стадии образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадии культивирования клеток, полученных на указанной выше стадии (4) в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток
(6) стадии культивирования клеток, полученных на указанной выше стадии (5).
Эффект изобретения
[0011]В соответствии со способом получения по настоящему изобретению, панкреатические гормонпродуцирующие клетки в форме, более имитирующей панкреатогенез, могут быть получены из стволовых клеток. Кроме того, клетки, полученные на одном или более видов указанных выше стадий (1)-(6), могут использоваться для скрининга соединения, полезного для профилактики и/или лечения заболеваний, вызванных патологической продукцией и/или секрецией панкреатических гормонов, таких как сахарный диабет и тому подобные. Кроме того, поскольку клетки по настоящему изобретению могут использоваться для клеточной терапии для лечения таких заболеваний, и они сохраняют трехмерную структуру, это больше подходит для применения к клеточной терапии, даже по сравнению с панкреатическими гормонпродуцирующими клетками, полученными в соответствии с обычным способом получения.
Краткое описание чертежей
[0012]
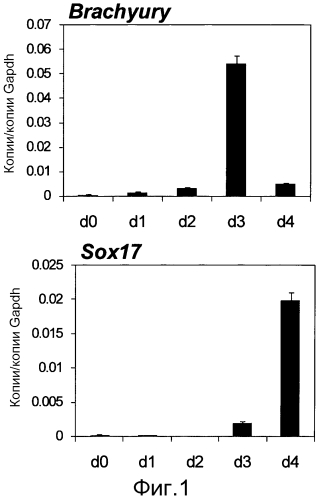
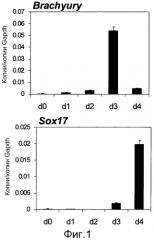
На фиг. 1 показаны результаты, полученные инициацией индукции дифференциации из человеческих iPS клеток путем использования различных факторов и ежедневного измерения экспрессии примитивного штрихового маркера (гена Brachyury) и эндодермального маркера (SOX17) в течение первых 4 дней количественной RT-PCR (полимеразной цепной реакции в реальном масштабе времени). Уровни экспрессии соответствующих генов показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. На 3-й день культивирования, уровень экспрессии гена Brachyury транзиторно увеличивался, а уровень экспрессии SOX17 заметно увеличивался на 4-й день.
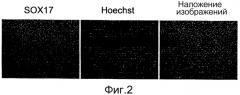
На фиг. 2 показаны результаты иммунофлуоресцентного окрашивания с использованием антитела к человеческому SOX17 клеток, полученных индукцией дифференциации человеческих iPS клеток в течение 4 дней с использованием активина A и CHIR99021, пересева клеток на 96-луночный планшет, покрытый фибронектином, и культивирования клеток в течение суток. Ядра SOX17-положительных клеток окрашивались в зеленый цвет Alexa 488 (SOX17 на фиг.), а ядра клеток окрашивались в синий цвет Hoechst 33342 (Hoechst на фиг.). Кроме того, оба окрашенных изображения комбинировали, и они показаны в виде наложения изображений. Наблюдалось, что большинство клеток экспрессируют белок SOX17.
На фиг. 3 показаны результаты экспрессии SOX17 человеческими iPS клетками, которые культивировали в среде, содержащей CHIR99021, в течение 2 дней и затем культивировали с использованием активина A и CHIR99021, а также активина A и BIO, по данным ежедневного измерения количественной RT-PCR. Уровни экспрессии гена показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. При использовании или CHIR99021, или BIO, экспрессия SOX17 со временем увеличивалась с 4-го дня культивирования, и проявляла одинаковый тип экспрессии. В контроле с добавлением только DMSO (диметилсульфоксида), экспрессия SOX17 не увеличивалась.
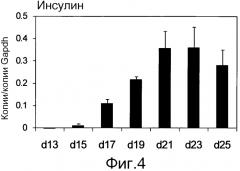
На фиг. 4 показаны результаты анализа экспрессии инсулина клетками, полученными индукцией дифференциации человеческих iPS клеток с использованием активина A и CHIR99021 в течение 4 дней, высеванием клеток на 96-луночный сфероидный планшет, культивированием клеток в течение суток, культивированием клеток в течение 8 дней в усовершенствованной среде MEM Zinc Option, содержащей 1% B27, и с добавлением дорсоморфина, ретиноевой кислоты, SB431542 и bFGF, затем заменой среды на усовершенствованную среду MEM Zinc Option, содержащую 1% B27, и далее непрерывным культивированием клеток (Инсулин на фиг.). Уровни экспрессии гена показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. Экспрессия инсулина увеличивалась с 13-го дня культивирования в усовершенствованной среде MEM Zinc Option, содержащей 1% B27, и увеличивалась со временем до 23-го дня культивирования.
На фиг. 5 показаны результаты анализа экспрессии инсулина клетками на 19-й день культивирования, причем клетки были получены индукцией дифференциации человеческих iPS клеток с использованием активина A и CHIR99021 в течение 4 дней, высеванием клеток на 96-луночный сфероидный планшет, культивированием клеток в течение 1 дня, культивированием клеток в течение 8 дней с использованием комбинации дорсоморфина, ретиноевой кислоты, SB431542 и bFGF или комбинации дорсоморфина, ретиноевой кислоты и SB431542, и затем культивированием в усовершенствованной среде Improved MEM Zinc Option, содержащей 1% B27 (Инсулин на фиг.). Уровни экспрессии гена показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. Уровень экспрессии инсулина был выше на 19-й день культивирования при использовании комбинации дорсоморфина, ретиноевой кислоты, SB431542 и bFGF, чем комбинации дорсоморфина, ретиноевой кислоты и SB431542.
На фиг. 6 показаны результаты иммунофлуоресцентного окрашивания с использованием антитела к инсулину и антитела к глюкагону замороженного среза, полученного из клеточной массы (сферы), на 21-й день культивирования клеток, полученных индукцией дифференциации таким же образом, как в способе, показанном на фиг. 4. Инсулин-положительные клетки окрашивались в красный цвет Alexa 568 (Инсулин на фиг.), глюкагон-положительные клетки окрашивались в зеленый цвет Alexa 488 (Глюкагон на фиг.), а ядра клеток окрашивались в синий цвет Hoechst 33342 (Hoechst на фиг.). Кроме того, все окрашенные изображения комбинировали, и они показаны в виде наложения изображений. Много клеток, экспрессирующих инсулин, обнаруживали внутри клеточной массы (сферы), а часть клеток экспрессировала глюкагон.
На фиг. 7 показаны результаты анализа экспрессии различных маркеров дифференциации в клетках, полученных индукцией человеческих iPS клеток с использованием матригеля BD или фибронектина в качестве подложки и введения активина A и CHIR99021 в эндодерму для образования клеточной массы (сферы), и затем дополнительной индукцией дифференциации в клетки-предшественники панкреатических гормонпродуцирующих клеток и затем панкреатические гормонпродуцирующие клетки. Уровни экспрессии соответствующих генов были показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. Экспрессия SOX17 заметно уменьшалась при дифференциации, а уровни экспрессии PDX1 и NGN3 постепенно увеличивались до 17-го дня культивирования. Экспрессия инсулина резко увеличивалась с 17-го дня культивирования. Изменение экспрессии этих различных маркеров дифференциации с течением времени было почти одинаковым, пока эндодермальные клетки индуцировали с использованием матригеля BD или фибронектина в качестве подложки.
На фиг. 8 показана общая схема способа получения панкреатической гормонпродуцирующей клетки, который включает стадию индукции дифференциации путем образования клеточной массы (сферы) из эндодермы [стадия (4)], и в котором не используется питающая клетка или сыворотка.
Подробное описание изобретения
[0013]
Настоящее изобретение объясняется в следующем описании. Пока нет конкретных определений, термины, используемые в настоящем описании, означают те, которые в целом используются в данной области.
[0014]
В настоящем изобретении, термин «панкреатические гормонпродуцирующие клетки» означает клетки, обладающие способностью продуцировать панкреатический гормон. Панкреатические гормонпродуцирующие клетки не должны постоянно продуцировать панкреатический гормон, но должны только быть способны продуцировать панкреатический гормон. Поэтому, подлежащее выработке количество панкреатического гормона конкретно не ограничивается. Примеры панкреатического гормона включают инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Примеры панкреатических гормонпродуцирующих клеток включают клетки, продуцирующие инсулин (синонимичные панкреатическим β-клеткам), клетки, продуцирующие глюкагон (синонимичные панкреатическим α-клеткам), клетки, продуцирующие соматостатин (синонимичные панкреатическим δ-клеткам), клетки, продуцирующие панкреатический полипептид (PP), и клетки, продуцирующие грелин. Конечно, предпочтительны клетки, продуцирующие инсулин.
[0015]
В настоящем изобретении термин «стволовые клетки» означает клетки, которые могут культивироваться in vitro, и могут дифференцироваться во множественные линии дифференцировки, составляющие организм. В частности, можно указать эмбриональные стволовые клетки (ES клетки), плюрипотентные стволовые клетки, происходящие из примордиальных зародышевых клеток эмбриона (EG клетки: Proc Natl Acad Sci USA. 1998, 95:13726-31), происходящие из семенников плюрипотентные стволовые клетки (GS клетки: Nature. 2008, 456: 344-9), происходящие из соматических клеток индуцированные плюрипотентные стволовые клетки (индуцированные плюрипотентные стволовые клетки; iPS клетки) и человеческие соматические стволовые клетки (тканевые стволовые клетки). Предпочтительными являются iPS клетки, ES клетки и человеческие соматические стволовые клетки, а более предпочтительными являются iPS клетки.
[0016]
В качестве ES клеток, могут использоваться ES клетки, происходящие из любого теплокровного животного, предпочтительно, млекопитающего. Примеры млекопитающего включают мышь, крысу, морскую свинку, хомячка, кролика, кошку, собаку, овцу, свинью, корову, лошадь, козу, обезьяну и человека. Предпочтительны примеры клеток, происходящих от человека.
Конкретные примеры ES клеток включают ES клетки млекопитающего и тому подобного, которые основываются культивированием раннего эмбриона перед имплантацией, ES клетки, которые основываются культивированием раннего эмбриона, полученного ядерной трансплантацией ядер соматических клеток, и ES клетки, полученные изменением гена на хромосоме таких ES клеток генетической инженерией. Каждая ES клетка может быть получена способом, в целом выполняемым в данной области, в соответствии с известным документом.
ES клетки мыши были основаны в 1981 г. Evans et al. (Evans et al., 1981, Nature 292: 154-6) и Martin et al. (Martin GR. et al., 1981, Proc Natl Acad Sci 78: 7634-8) и могут быть закуплены, например, у компании Dainippon Sumitomo Pharma Co., Ltd. (Osaka, Japan).
ES клетки человека были основаны в 1998 г. Thomson et al. (Thomson et al., Science, 1998, 282:1145-7), и могут быть получены в институте WiCell Research Institute (сайт интернета: http://www.wicell.org/, Madison, Wisconsin, USA), в институте National Institute of Health, Kyoto University и тому подобных и, например, могут быть закуплены у компании Cellartis AB (сайт интернета: http://www.cellartis.com/, Sweden).
[0017]
В качестве клеток iPS, могут использоваться iPS клетки, полученные у любого теплокровного животного, предпочтительно, млекопитающего. Примеры млекопитающего включают мышь, крысу, морскую свинку, хомячка, кролика, кошку, собаку, овцу, свинью, корову, лошадь, козу, обезьяну и человека. Предпочтительные примеры включают клетки, полученные у человека.
Конкретные примеры iPS клеток включают клетки, которые приобрели мультипотентность, подобную мультипотентности ES клеток, и были получены введением множественных генов в соматические клетки, такие как клетки кожи и тому подобные (например, iPS клетки, полученные введением гена Oct3/4, гена Klf4, гена c-Myc и гена Sox2 (Nat Biotechnol 2008; 26: 101-106)). Кроме этого, можно указать способ, при котором дополнительно редуцируются трансгены (Nature. 2008 Jul 31; 454(7204):646-50), способ с использованием соединений с низкой молекулярной массой (Cell Stem Cell. 2009 Jan 9; 4(1):16-9, Cell Stem Cell. 2009 Nov 6; 5(5):491-503), способ с использованием белков как транскрипционных факторов вместо гена (Cell Stem Cell. 2009 May 8; 4(5):381-4) и тому подобное. Хотя в способы получения iPS клеток интенсивно вносились технические усовершенствования, основное свойство полученных iPS клеток, то есть, то, что они обладают мультипотентностью, является эквивалентным, независимо от способов получения, и поэтому, все такие способы могут использоваться для способа получения по настоящему изобретению.
[0018]
В качестве соматических стволовых клеток могут использоваться клетки, полученные у человека. В настоящем описании, термин «соматические стволовые клетки» относится к клеткам, способным к дифференциации в панкреатические гормонпродуцирующие клетки, например, стволовые клетки, присутствующие в мезенхимальных стволовых клетках, происходящих из костного мозга, и жировые и стволовые клетки, присутствующие в поджелудочной железе.
[0019]С использованием способа по настоящему изобретению, панкреатические гормонпродуцирующие клетки могут быть получены из различных линий стволовых клеток, таких как линия человеческих iPS клеток, которые варьируются по способам получения.
[0020]
1. Способ получения панкреатических гормонпродуцирующих клеток
Способ получения по настоящему изобретению включает способ получения панкреатических гормонпродуцирующих клеток из стволовых клеток. Способ получения по настоящему изобретению также включает способ индукции дифференциации клеток в менее дифференцированном состоянии (стволовые клетки) в более дифференцированное состояние (панкреатические гормонпродуцирующие клетки).
[0021]
Способ получения по настоящему изобретению включает следующие стадии (1)-(6).
(1) стадию культивирования стволовых клеток в среде, содержащей ингибитор Rho киназы
(2) стадию культивирования стволовых клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3
(3) стадию культивирования стволовых клеток, полученных на указанной выше стадии (2) в среде, содержащей ингибитор GSK3, и активатор подобной рецептору активина киназы-4,7
(4) стадию образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадию культивирования клеток, полученных на указанной выше стадии (4), в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор активируемой АМФ протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток
(6) стадию культивирования клеток, полученных на указанной выше стадии (5)
[0022]
Стадия (1): стадия культивирования стволовых клеток в среде, содержащей ингибитор Rho киназы
Эта стадия соответствует предварительной стадии перед указанной ниже стадией (2), инициирующей индукцию дифференциации стволовых клеток в панкреатические гормонпродуцирующие клетки, то есть, стадии прекультивирования (посева) стволовых клеток.
[0023]
Стволовые клетки на этой стадии могут быть получены совместным культивированием с питающими клетками или экстрактом питающих клеток. В настоящем описании, питающая клетка означает клетку, которая обеспечивает путем совместного культивирования среду, в которой могут расти другие виды клеток.
Хотя стволовые клетки на этой стадии могут представлять собой любые из диспергированных клеток и не диспергированных клеток, желательны диспергированные клетки.
Примеры диспергированных клеток включают отделившиеся клетки и клетки, образующие массу, состоящую из нескольких клеток (обычно примерно 2-500, 20-200 или 50-100 клеток [как объясняется в указанной ниже стадии (4), клеточная масса означает состояние образования массы сцеплением множества клеток друг с другом и тому подобное]), которая желательно представляет собой клеточную массу на этой стадии.
Диспергированная клетка может быть получена по существу известным способом. Примеры такого способа включают обработку хелатирующим агентом (например, EDTA (этилендиаминтетрауксусной кислотой)), ферментом (например, трипсином, коллагеназой) и тому подобными, и такими операциями как механическая дисперсия (например, пипетирование) и тому подобные.
Диспергированные клетки могут представлять собой не прикрепленные клетки [не прикрепленные клетки означают клетки в состоянии, свободном от прикрепления к культуральному сосуду или подложке], или прикрепленные клетки [прикрепленные клетки означают клетки в состоянии прикрепления к культуральному сосуду или подложке].
На этой стадии желательно после удаления питающих клеток или экстракта питающих клеток (например, удаления помещением в центрифужную пробирку, отстоя в течение 2-10 мин и затем удаления супернатанта), культивировать клетки в указанной ниже среде, содержащей ингибитор Rho киназы (то есть, инициировать индукцию дифференциации без использования питающих клеток при посеве и в последующем).
[0024]
Ингибитор Rho киназы означает вещество, которое ингибирует активность Rho киназы.
Rho киназа представляет собой один вид малого ГТФ-связывающего белка (малого G белка), содержащегося в категории ГТФазы, которая представляет собой фермент, разрушающий ГТФ (гуанозинтрифосфат), и имеет домен серин/треонинкиназы на амино конце, свернутую спиралью область в центральной части и взаимодействующий с Rho домен на карбокси конце (Amano et al., Exp. Cell. Res., 261, 44-51 (2000)).
Примеры ингибитора Rho киназы, подлежащего использованию на этой стадии, включают 1-(5-изохинолинсульфонил)-2-метилпиперазин (H-7), 1-(5-изохинолинсульфонил)-3-метилпиперазин (изоH-7), N-2-(метиламино)этил-5-изохинолинсульфонамид дигидрохлорид (H-8), N-(2-аминоэтил)-5-изохинолинсульфонамид дигидрохлорид (H-9), N-[2-п-бромциннамиламино)этил]-5-изохинолинсульфонамид дигидрохлорид (H-89), N-(2-гуанидинэтил)-5-изохинолинсульфонамид гидрохлорид (HA-1004), 1-(5-изохинолинсульфонил)гомопиперазин дигидрохлорид (фазудил/HA-1077), (S)-(+)-2-метил-4-глицил-1-(4-метилизохинолинил-5-сульфонил)гомопиперидин дигидрохлорид (H-1152), и (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанамид дигидрохлорид (Y-27632).
Все эти соединения имеются в продаже и выпускаются компаниями SIGMA и Wako Pure Chemical Industries, Ltd.). Из них особенно предпочтителен Y-27632.
На этой стадии может использоваться один и любая комбинация ингибиторов Rho киназы.
[0025]
На этой стадии стволовая клетка культивируется в среде, содержащей ингибитор Rho киназы.
Хотя концентрация ингибитора Rho киназы в среде конкретно не ограничивается, пока может быть достигнут желательный эффект, такой как повышение частоты выживания стволовых клеток и тому подобный, она в целом составляет от 0,01 до 1000 мкМ, предпочтительно, от 0,1 до 100 мкМ, особенно предпочтительно, от 1,0 до 50 мкМ. Когда Y-27632 используется в качестве ингибитора Rho киназы, то предпочтительно используемая концентрация составляет от примерно 1,0 до примерно 30 мкМ, предпочтительнее, от примерно 2,0 до примерно 20 мкМ. Когда фазудил/HA1077 используется в качестве ингибитора Rho киназы, то концентрация может быть примерно в 2 раза выше, по сравнению с указанной выше концентрацией Y-27632.
Когда множественные виды ингибитора Rho киназы используются в комбинации, то каждый ингибитор используется в концентрации, соответствующим образом увеличенной или уменьшенной на основании указанного выше диапазона концентрации.
[0026]
Время культивирования в среде, содержащей ингибитор Rho киназы, конкретно не ограничивается, пока может быть достигнут желательный эффект, такой как повышение частоты выживания стволовых клеток и тому подобный. Например, когда стволовая клетка представляет собой человеческую iPS клетку, то человеческие iPS клетки диспергируются и культивируются в среде, содержащей ингибитор Rho киназы в течение примерно 12 ч или дольше (например, 12-72 ч), посредством чего может быть в достаточной степени получен желательный эффект.
Плотность стволовых клеток в среде, содержащей ингибитор Rho киназы, конкретно не ограничивается, пока может быть достигнут желательный эффект, такой как повышение частоты выживания стволовых клеток и тому подобный. Она предпочтительно составляет примерно от 1,0×101 до 1,0×107 клеток/мл, предпочтительнее, примерно от 1,0×102 до 1,0×107 клеток/мл, еще предпочтительнее, примерно от 1,0×103 до 1,0×107 клеток/мл, наиболее предпочтительно, примерно от 3,0×104 до 1,0×106 клеток/мл.
[0027]
Среда, подлежащая использованию на этой стадии, конкретно не ограничивается, пока она содержит ингибитор Rho киназы, и в целом представляет собой среду, используемую для культивирования стволовых клеток с добавлением ингибитора Rho киназы (далее в настоящем описании также для удобства именуемую основной средой).
В качестве основной среды, подлежащей использованию на этой стадии, может использоваться среда для клеток ES/iPS приматов (среда ReproCELL), среда BME, среда BGJb, среда CMRL 1066, среда Glasgow MEM, среда Improved MEM Zinc Option, среда IMDM, среда Medium 199, среда Eagle MEM, среда αMEM, среда DMEM, среда Хэма, среда RPMI 1640, среда Фишера, смесь двух или более видов сред, необязательно, выбранных из этих сред, и тому подобных. Среда конкретно не ограничивается, пока она может использоваться для культивирования клеток животных. На этой стадии особенно желательно использование среды для ES клеток приматов (среды ReproCELL).
Эти среды могут быть закуплены у компаний ReproCELL Inc., Invitrogen, SIGMA, COSMO BIO Co., Ltd. и тому подобных.
[0028]
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая сыворотку и/или сывороточный экстракт, а предпочтительнее бессывороточная среда.
В настоящем описании, по существу не содержащая сыворотку означает, что содержание сыворотки составляет менее чем примерно 1 об.%, предпочтительно, менее чем примерно 0,1 об.%, предпочтительнее, менее чем примерно 0,01 об.%. Бессывороточная среда означает основную среду, не содержащую неприспособленную или неочищенную сыворотку, и считается, что среда, смешанная с очищенным, полученным из крови компонентом, или компонентом, полученным из ткани животного (например, фактор роста), подпадает под определение бессывороточной среды.
[0029]
Среда, подлежащая использованию на этой стадии, может также содержать заменители сыворотки. Примеры заменителя сыворотки включают альбумин (например, альбумин, обогащенный липидами), трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27, добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин или их эквиваленты. Заменитель сыворотки от нокаутных животных может быть закуплен у компании Invitrogen. Другие заменители сыворотки могут быть закуплены у компаний Invitrogen, SIGMA, Wako Pure Chemical Industries, Ltd., Dainippon Sumitomo Pharma Co., Ltd. и тому подобных.
Концентрация в среде добавки B-27 при ее использовании составляет от 0,01 до 10 масс.%, предпочтительно, от 0,1 до 2 масс.%.
[0030]
На этой стадии предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток. То есть, среда, подлежащая использованию на этой стадии, предпочтительно представляет собой среду, по существу не содержащую питающие клетки и/или экстракт питающих клеток, предпочтительнее, среду, полностью свободную от питающих клеток и/или экстракта питающих клеток.
В настоящем описании, по существу не содержащая питающие клетки и/или экстракт питающих клеток означает, что содержание питающих клеток и/или экстракта питающих клеток в среде составляет менее чем примерно 5 об.%, предпоч