Антиангиогенная терапия для лечения ранее подвергавшегося лечению рака молочной железы
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для лечения больного с диагнозом ранее подвергавшегося лечению тройного негативного метастатического рака молочной железы. Предложен способ, включающий получение больным схемы лечения, сочетающей химиотерапию с введением эффективного количества антитела против VEGF, где схема лечения с помощью химиотерапии включает введение, по меньшей мере, одного химиотерапевтического средства, выбранного из группы, включающей таксаны, капецитабин, гемцитабин и винорелбин. Изобретение обеспечивает повышение выживания без прогрессирования заболевания за счет лечения индивидуума антителом против VEGF, в частности бевацизумабом, в сочетании с химиотерапией. 6 з.п. ф-лы, 4 ил., 7 табл., 1 пр.
Реферат
Родственная заявка
По настоящей заявке испрашивается приоритет предварительной заявки Соединенных Штатов № 61/266343, зарегистрированной 3 декабря 2009 г., и предварительной заявки Соединенных Штатов № 61/234281, зарегистрированной 15 августа 2009 г., описания которых включены в настоящий документ в их полном объеме.
Область техники, к которой относится изобретение
Это изобретение в целом относится к лечению заболеваний и патологических состояний человека. Более конкретно, изобретение относится к антиангиогенной терапии, либо самой по себе, либо в сочетании с другими видами противораковой терапии для лечения ранее подвергавшегося лечению рака молочной железы.
Известный уровень техники
Рак остается одной из наиболее смертельных угроз здоровью человека. В США рак поражает около 1,3 миллиона новых больных каждый год и является второй ведущей причиной смерти после заболевания сердца, являясь причиной приблизительно 1 из 4 смертей. Предсказывается также, что рак может превысить сердечнососудистые заболевания, став причиной номер один смерти в пределах 5 лет. За большинство из этих смертей ответственны солидные опухоли. Хотя достигнуты существенные успехи в медицинском лечении определенных типов рака, в целом 5-летний коэффициент выживаемости для всех типов рака улучшен только приблизительно на 10% в последние 20 лет. Типы рака или злокачественные опухоли неконтролируемым образом быстро метастазируют и растут, делая крайне трудным своевременное выявление и лечение.
Рак молочной железы представляет собой заболевание, которое каждый год убивает много женщин в Соединенных Штатах. По данным американского ракового общества приблизительно 40000 женщин умрет от этого заболевания в 2008 г. Более 180000 новых случаев рака молочной железы диагностируется ежегодно, и подсчитано, что у одной из восьми женщин возникнет рак молочной железы. Эти цифры указывают на то, что рак молочной железы является одним из наиболее опасных заболеваний, с которым сталкиваются женщины в настоящее время. Метастатический рак молочной железы является обычно неизлечимым, и только у небольшого количества больных достигается долгосрочная выживаемость после стандартной химиотерапии. Greenberg et al., J. Clin. Oncol. 14:2197-2205 (1996).
Знания основ биологии рака молочной железы экспоненциально развиваются в течение трех последних десятилетий, причем некоторые вносят вклад в его лечение. На фазе II многонационального отрытого клинического испытания на 222 женщинах с метастатическим раком молочной железы, гиперэкспрессирующим HER2, выявлен показатель ответной реакции, составляющий 15%, с шестью подтвержденными полными ответами при использовании рекомбинантного гуманизированного моноклонального антитела (трастузумаба, также известного как герцептин®, Genentech, South San Francisco), направленного против HER2 (Cobleigh et al., Proc. Am. Soc. Clin. Oncol. 17:97 (1998)). На фазе III рандомизированного испытания оценены безопасность и эффективность добавления герцептина к первой линии химиотерапии либо паклитакселом, либо сочетанием доксорубицина и циклофосфамида. Суммарный показатель ответной реакции и время до прогрессирования заболевания существенно улучшались при добавлении герцептина к химиотерапии по сравнению только с химиотерапией (Slamon et al., Proc. Am. Soc. Clin. Oncol. 17:98 (1998)). Добавление герцептина пролонгировало выживание в целом (Norton et al., Proc. Am. Soc. Clin. Oncol. 18:127a (1999)).
Хотя трастузумаб является первым новым биологически обоснованным терапевтическим агентом, одобренным для лечения субпопуляции больных раком молочной железы, имеющих типы рака с гиперэкспрессией HER2, продемонстрированы перспективы некоторых других подходов и их введения в клинику. Однако подсчитано, что у 75 процентов женщин с недавно диагностированным метастатическим раком молочной железы он является HER2-негативным. Соединения, которые ингибируют ангиогенез, вызывают особый интерес в плане охвата дополнительных популяций больных раком молочной железы и являлись и являются предметом клинических испытаний, как в США, так и в других странах.
Так как рак все еще является одной из наиболее смертельных угроз, необходимы дополнительные способы лечения рака у больных. Изобретение направлено на эти и другие потребности, как будет ясно из рассмотрения последующего раскрытия.
Краткое изложение сущности изобретения
Предлагаются варианты применения антитела против VEGF для эффективного лечения больных раком молочной железы, ранее подвергавшихся лечению метастатического рака молочной железы. В частности в изобретении предоставлены данные по фазе III рандомизированного клинического испытания бевацизумаба (AVASTIN®) в сочетании со схемами химиотерапии индивидуумов, ранее подвергавшихся лечению метастатического рака молочной железы у индивидуумов человека. Такие схемы химиотерапии включают лечение таксанами (например, паклитакселом каждые 3 недели или еженедельно, частицами паклитаксела, связанного с белком (например, Abraxane®) или доцетакселом), гемцитабином, винорелбином или лечение капецитабином. Успех испытания показывает, что добавление антитела против VEGF к химиотерапии обеспечивает статистически значимые и клинически показательные преимущества в качестве терапии второй линии для больных, ранее подвергавшихся лечению рака молочной железы.
Результаты, полученные в клинических исследованиях по использованию бевацизумаба у индивидуумов человека с метастатическим раком молочной железы, показывают, что при оценке по выживаемости без прогрессирования заболевания (PFS) эффективность была положительной особенно при сравнении с данными по PFS при лечении только химиотерапевтическими агентами. Индивидуумы, которые в клинических испытаниях получали бевацизумаб в сочетании с химиотерапией (терапия таксанами, капецитабином, гемицитабином или винорелбином) имели повышенное выживание без прогрессирования заболевания по сравнению с индивидуумами, которых лечили только с помощью химиотерапии. Различие было статистически значимым.
Соответственно, в изобретении предлагается способ лечения больного с диагнозом ранее подвергавшегося лечению метастатического рака молочной железы, включающий получение больным схемы лечения, сочетающей химиотерапию с введением эффективного количества антитела против VEGF. Схема лечения, сочетающая химиотерапию с введением антитела против VEGF, эффективно увеличивает выживание без прогрессирования заболевания (PFS) у больного.
В определенных вариантах осуществления PFS увеличивается приблизительно на 0,5 месяца, 1 месяц, 1,2 месяца, 2 месяца, 2,1 месяца, 2,2 месяца, 2,8 месяца, 3 месяца и т.д. В одном варианте осуществления PFS увеличивается приблизительно на 2,1 месяца. В одном варианте осуществления PFS увеличивается приблизительно на 2,2 месяца. В одном варианте осуществления PFS увеличивается приблизительно на 2,8 месяца.
Любой химиотерапевтический агент, проявляющий противораковую активность, может быть использован по изобретению. В определенных вариантах осуществления химиотерапевтический агент выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и родственных ингибиторов, алкалоидов барвинка, эпидофиллотоксинов, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов с платиной, замещенной антрацендионом мочевины, производных метилгидразина, суппрессорного агента для коры надпочечников, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-рилизинг гормона. В определенных вариантах осуществления химиотерапевтический агент представляет собой, например, капецитабин, таксан, паклитаксел, доцетаксел, частицы паклитаксела, связанного с белком (например, Abraxane®), гемцитабин, винорелбин или их сочетания. В определенных вариантах осуществления химиотерапевтический агент представляет собой, например, капецитабин, таксан, паклитаксел, доцетаксел, частицы паклитаксела, связанного с белком (например, Abraxane®), гемцитабин или их сочетания. В определенных вариантах осуществления химиотерапевтический агент представляет собой, например, капецитабин, таксан, паклитаксел, доцетаксел, частицы паклитаксела, связанного с белком (например, Abraxane®), или их сочетания. Два или более химиотерапевтических агента могут быть использованы в смеси, предназначенной для введения в сочетании с антителом против VEGF.
Клинические преимущества способов лечения по изобретению могут быть измерены, например, по продолжительности выживания без прогрессирования заболевания (PFS), времени до несостоятельности лечения, объективному показателю ответной реакции и продолжительности ответа.
Соответственно в изобретении представлен способ инструктирования индивидуума-человека, ранее подвергавшегося лечению рака, например, молочной железы, путем предоставления инструкций по получению лечения антителом против VEGF, с тем, чтобы повысить выживание индивидуума без прогрессирования заболевания, снизить риск рецидива рака у индивидуума или повысить вероятность выживания у индивидуума. В некоторых вариантах осуществления способ дополнительно включает предоставление инструкций по получению лечения, по меньшей мере, с одним химиотерапевтическим агентом. Лечение антителом против VEGF может проводиться одновременно с лечением химиотерапевтическим агентом или последовательно по отношению к нему. В определенных вариантах осуществления индивидуума лечат, как предписывается способом инструктирования.
В изобретении представлен также способ продвижения, включающий продвижение введения антитела против VEGF для лечения индивидуума-человека, ранее подвергнутого лечению рака, например, молочной железы. В некоторых вариантах осуществления метод дополнительно включает продвижение введения, по меньшей мере, одного химиотерапевтического агента. Введение антитела против VEGF может проводиться одновременно с введением химиотерапевтического агента или последовательно по отношению к нему. Продвижение может проводиться любым из доступных средств. В некоторых вариантах осуществления продвижение осуществляется с помощью рекламного вкладыша в упаковку, сопровождающего продаваемый состав антитела против VEGF. Продвижение также может осуществляться с помощью рекламного вкладыша в упаковку, сопровождающего продаваемый состав химиотерапевтического агента. Продвижение может быть в виде письменной или устной информации врачу или работнику здравоохранения. В некоторых вариантах осуществления продвижение осуществляется с помощью рекламного вкладыша в упаковку, где в рекламном вкладыше предоставляются инструкции по получению лечения антителом против VEGF. В некоторых вариантах осуществления за продвижением следует лечение индивидуума антителом против VEGF с химиотерапевтическим агентом или без него.
В изобретении предлагается способ ведения бизнеса, включающий маркетинг антитела против VEGF для лечения индивидуума-человека, ранее подвергавшегося лечению рака, например, молочной железы, с тем, чтобы повысить период выживания индивидуума без прогрессирования заболевания или снизить вероятность рецидива рака у индивидуума, или повысить вероятность выживания у индивидуума. В некоторых вариантах осуществления способ дополнительно включает маркетинг химиотерапевтического агента для использования в сочетании с антителом против VEGF. В некоторых вариантах осуществления за маркетингом следует лечение индивидуума антителом против VEGF с химиотерапевтическим агентом или без него.
Предлагается также способ ведения бизнеса, включающий маркетинг химиотерапевтического агента в сочетании с антителом против VEGF для лечения индивидуума-человека, ранее подвергавшегося лечению рака, например, молочной железы, с тем, чтобы повысить период выживания индивидуума без прогрессирования заболевания или снизить вероятность рецидива рака у индивидуума, или повысить вероятность выживания у индивидуума. В некоторых вариантах осуществления за маркетингом следует лечение индивидуума сочетанием химиотерапевтического агента и антитела против VEGF.
В каждом из способов по изобретению антитело против VEGF может быть заменено специфическим антагонистом VEGF, например, молекулой рецептора VEGF или молекулой гибридного рецептора VEGF, как описано ниже. В определенных вариантах осуществления способов по изобретению антитело против VEGF представляет собой бевацизумаб. Антитело против VEGF или его антигенсвязывающий фрагмент может представлять собой моноклональное антитело, гибридное антитело, антитело полностью от человека или гуманизированное антитело. Примеры антител, пригодных для способов по изобретению, включают бевацизумаб (AVASTIN®), антитело G6, антитело B20 и их фрагменты. В определенных вариантах осуществления антитело против VEGF имеет вариабельную область тяжелой цепи, включающую следующую аминокислотную последовательность:
EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS (SEQ ID NO:1)
и вариабельную область легкой цепи, включающую следующую аминокислотную последовательность:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ GTKVEIKR (SEQ ID NO:2).
Антитело или его антигенсвязывающий фрагмент может также представлять собой антитело, в котором отсутствует часть Fc, структура F(ab')2, Fab или Fv.
В одном варианте осуществления лечение представляет собой сочетание специфичного для VEGF антагониста, например, антитела против VEGF, и, по меньшей мере, одного химиотерапевтического агента.
Каждый из способов по изобретению может быть осуществлен на практике в отношении лечения типов рака, включая, но, не ограничиваясь этим, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких типов рака включают рак молочной железы, плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, сквамозную карциному легкого, рак брюшины, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак простаты, почечный рак, рак вульвы, рак щитовидной железы, карциному печени, рак желудка, меланому и различные типы рака головы и шеи. В некоторых вариантах осуществления индивидуум страдает HER2-негативным метастатическим, ранее подвергавшимся лечению, раком молочной железы.
Каждый из указанных выше аспектов может дополнительно включать контролирование состояния индивидуума на предмет рецидива рака. Контролирование может осуществляться, например, с помощью оценки продолжительности выживания без прогрессирования заболевания (PFS), или общего выживания (OS), или объективного показателя ответной реакции (ORR). В одном варианте осуществления PFS, или OS, или ORR оценивается после начала лечения.
В зависимости от типа и тяжести заболевания в настоящем документе описываются предпочтительные дозировки антитела против VEGF, например, бевацизумаба, и они могут находиться в диапазоне от приблизительно 1 мкг/кг до приблизительно 50 мг/кг, наиболее предпочтительно от приблизительно 5 мг/кг до приблизительно 15 мг/кг, включая, но, не ограничиваясь этим, 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Частота введения должна варьироваться в зависимости от типа и тяжести заболевания. Для повторных введений в течение нескольких дней или более в зависимости от состояния лечение поддерживают до тех пор, пока рак лечится или достигается желаемый терапевтический эффект при измерении методами, описанными в настоящем документе или известными в данной области техники. В одном примере антитело против VEGF по изобретению вводят один раз каждую неделю, каждые две недели или каждые три недели в диапазоне доз от приблизительно 5 мг/кг до приблизительно 15 мг/кг, включая, но, не ограничиваясь этим, 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Однако могут быть использованы другие схемы дозирования. Ход терапии по изобретению легко прослеживается с помощью общепринятых методов и тестов.
В дополнительных вариантах осуществления каждого из указанных выше аспектов специфичный для VEGF антагонист, например, антитело против VEGF, вводят местно или системно (например, перорально или внутривенно). В других вариантах осуществления одним аспектом лечения является лечение специфичным для VEGF антагонистом в виде лечения с пролонгированной фазой или поддерживающей терапии, как оценивается врачом или описывается в настоящем документе.
В других вариантах осуществления лечение специфичным для VEGF антагонистом ранее подвергавшегося лечению метастатического рака молочной железы осуществляется в сочетании с дополнительной противораковой терапией, включая, но, не ограничиваясь этим, хирургическое вмешательство, лучевую терапию, химиотерапию, дифференцированную терапию, биотерапию, иммунную терапию, лечение ингибитором ангиогенеза, цитотоксическим агентом и антипролиферативным соединением. Лечение специфичным для VEGF антагонистом может также включать любое сочетание указанных выше типов терапевтических схем. В некоторых вариантах осуществления химиотерапевтический агент и специфичный для VEGF антагонист вводят совместно.
В вариантах осуществления, которые включают дополнительную противораковую терапию, индивидуума можно добавочно лечить дополнительной противораковой терапией до, в течение (например, одновременно) или после введения специфичного для VEGF антагониста. В одном варианте осуществления специфичный для VEGF антагонист, вводимый либо одиночно, либо с противораковой терапией, можно вводить в виде поддерживающей терапии.
Другие особенности и преимущества изобретения будут ясны из последующего подробного описания, фигур и формулы изобретения.
Краткое описание фигур
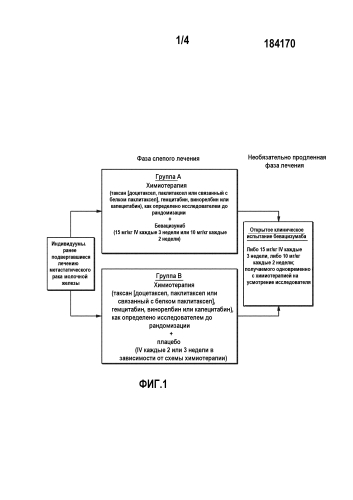
На фиг.1 представлен исследовательский дизайн испытания при лечении ранее подвергавшегося лечению метастатического рака молочной железы с использованием бевацизумаба (группа A) или плацебо (группа B) с различными вариантами химиотерапии.
На фиг.2 изображен анализ основного конечного показателя PFS в исследовании, представленном на фиг.1.
На фиг.3 изображены анализы PFS в исследовании, представленном на фиг.1, специфичные для когорт больных.
На фиг.4 изображен объективный показатель ответной реакции в исследовании, представленном на фиг.1.
Подробное описание
1. Определения
Термин «VEGF» или «VEGF-A» используется для обозначения 165-аминокислотного фактора роста эндотелиальных клеток сосудов человека и родственных 121-, 145- 189- и 206-аминокислотных факторов роста эндотелиальных клеток сосудов человека, как описано, например, Leung et al. Science, 246:1306 (1989) и Houck et al. Mol. Endocrin., 5:1806 (1991), вместе с их природными аллельными формами и формами их процессинга. VEGF-A является частью семейства генов, включающего VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и P1GF. VEGF-A в первую очередь связывается с двумя высокоаффинными рецепторными тирозинкиназами, VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1/KDR), причем последняя является основным фактором передачи митогенных сигналов VEGF-A в эндотелиальных клетках сосудов. Кроме того, нейропилин-1 был идентифицирован как рецептор изоформ VEGF-A, связанных с гепарином, и он может играть роль в развитии сосудов. Термин «VEGF» или «VEGF-A» также относится к VEGFs от видов, не относящихся к человеку, таких как мышь, крыса или примат. Иногда VEGF от конкретных видов указывается с помощью таких терминов как hVEGF для VEGF человека или mVEGF для мышиного VEGF. Термин «VEGF» также используется для обозначения укороченных форм или фрагментов полипептида, включающих аминокислоты с 8 по 109 или с 1 по 109 из 165-аминокислотного фактора роста эндотелиальных клеток сосудов человека. Ссылка на любую из таких форм VEGF может быть идентифицирована в заявке, например, как «VEGF (8-109)», «VEGF (1-109)» или «VEGF165». Положения аминокислот у нативного «укороченного» VEGF нумеруются, как указано в нативной последовательности VEGF. Например, аминокислота в 17 положении (метионин) в укороченном нативном VEGF занимает 17 положение (метионин) также в нативном VEGF. Укороченный нативный VEGF обладает связывающим сродством к рецепторам KDR и Flt-1, сопоставимым с нативным VEGF.
«Антитело против VEGF» представляет собой антитело, которое связывается с VEGF с достаточным сродством и специфичностью. Выбранное антитело должно обычно иметь связывающее сродство к VEGF, например, антитело может связывать hVEGF с величиной Kd между 100 нМ - 1 пМ. Величины сродства антитела могут быть определены, например, с помощью анализа на основе поверхностного плазмонного резонанса (такого как анализ на BIAcore, как описано в опубликованной заявке PCT № WO2005/012359); иммуноферментного анализа (ELISA); и тестов на основе конкурентного анализа (например, РИА). В определенных вариантах осуществления антитело против VEGF по изобретению может быть использовано в качестве терапевтического агента для направленного действия и вмешательства в заболевания или состояния, в которые вовлечена активность VEGF. Антитело может быть также подвергнуто тестам на другие типы биологической активности, например, для оценки его эффективности в качестве терапевтического агента. Такие тесты известны в данной области техники и зависят от антигена-мишени и планируемого использования антитела. Примеры включают, но не ограничиваются этим, тест ингибирования HUVEC; тесты ингибирования роста опухолевых клеток (как описано, например, в патенте WO89/06692). Антитело против VEGF обычно не связывается ни с другими гомологами VEGF, такими как VEGF-B или VEGF-C, ни с другими факторами роста, такими как P1GF, PDGF или bFGF.
«Антагонист VEGF» обозначает молекулу, способную нейтрализовать, блокировать, ингибировать, отменять, снижать или препятствовать активности VEGF, включая его связывание с одним или более рецепторов VEGF. Антагонисты VEGF включают антитела против VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые специфически связываются с VEGF, тем самым отделяя его от связывания с одним или более рецепторами, антитела против рецепторов VEGF и антагонисты рецепторов VEGF, такие как низкомолекулярные ингибиторы тирозинкиназ VEGFR.
Полипептид с «нативной последовательностью» включает полипептид, имеющий ту же самую аминокислотную последовательность, что и полипептид из природного источника. Таким образом, нативная последовательность полипептида может иметь аминокислотную последовательность природного полипептида от любого млекопитающего. Такой полипептид с нативной последовательностью может быть выделен из природного источника или может быть получен с помощью рекомбинантных методов или методов синтеза. Термин полипептид с «нативной последовательностью» конкретно охватывает существующие в природе укороченные или секретируемые формы полипептида (например, последовательность внеклеточного домена), существующие в природе варианты форм (например, формы альтернативного сплайсинга) и существующие в природе аллельные варианты полипептида.
«Вариант» полипептида обозначает биологически активный полипептид, имеющий, по меньшей мере, приблизительно 80% идентичность аминокислотной последовательности с природной последовательностью полипептида. Такие варианты включают, например, полипептиды, в которых один или более аминокислотных остатков добавлены или удалены на N- или С-конце полипептида. Обычно вариант должен иметь, по меньшей мере, приблизительно 80% идентичность аминокислотной последовательности, более предпочтительно, по меньшей мере, приблизительно 90% идентичность аминокислотной последовательности и даже более предпочтительно, по меньшей мере, приблизительно 95% идентичность аминокислотной последовательности с природной последовательностью полипептида.
Термин «антитело» используется в самом широком смысле и включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител (см. ниже), до тех пор, пока они проявляют желаемую биологическую активность.
Во всем описании и формуле изобретения нумерация остатков в тяжелой цепи иммуноглобулина осуществляется по индексу EU, как раскрыто в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), специально включенной в настоящее описание в качестве ссылки. «Индекс EU по Kabat» обозначает EU-нумерацию остатков антитела IgG1 человека.
«Kd» или «величина Kd» по настоящему изобретению в одном варианте осуществления измеряется с помощью анализа связывания радиоактивно меченного VEGF (РИА), выполняемого с Fab вариантом антитела и молекулой VEGF, как описано в следующем методе, в котором в растворе измеряют связывающее сродство Fabs к VEGF путем уравновешивания Fab с минимальной концентрацией (125I)-меченного VEGF(109) в присутствии серий титрования немеченого VEGF, с последующим захватом связанного VEGF на планшете, покрытом антителами против Fab (Chen, et al., (1999) J. Mol. Biol. 293:865-881). В одном примере для определения условий метода планшеты для микротитрования (Dynex) покрывают в течение ночи 5 мкг/мл захватывающим антителом против Fab (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6) и затем блокируют 2% (масс./об.) бычьим сывороточным альбумином в PBS в течение от двух до пяти часов при комнатной температуре (приблизительно 23°С). В неадсорбирующем планшете (Nunc #269620), 100 пМ или 26 пМ [125I]VEGF(109) смешивают с серийными разведениями интересующего Fab, например, Fab-12 (Presta et al., (1997) Cancer Res. 57:4593-4599). Интересующий Fab затем инкубируют в течение ночи; однако инкубация может продолжаться в течение 65 часов для уверенности в достижении равновесия. После этого смесь переносят на захватывающий планшет для инкубации при комнатной температуре в течение одного часа. Раствор затем удаляют, и планшет промывают восемь раз 0,1% твином-20 в PBS. Когда планшеты высохнут, добавляют 150 мкл/лунка сцинтиллятора (MicroScint-20; Packard), и проводят подсчет на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают связывание, меньшее или равное 20% от максимального, выбирают для использования в анализах конкурентного связывания. В соответствии с другим вариантом осуществления Kd или величину Kd измеряют с применением методов поверхностного плазмонного резонанса, используя BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с иммобилизованными чипами hVEGF (8-109) CM5 при ~10 единиц ответа (RU). Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. VEGF человека разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) перед введением при скорости тока 5 мкл/минута для достижения приблизительно 10 единиц ответа (RU) присоединенного белка. После введения VEGF человека вводят 1 М этаноламина для блокирования непрореагировавших групп. Для измерений кинетики двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводят в PBS с 0,05% твином 20 (PBST) при 25°C при скорости тока приблизительно 25 мкл/минута. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания Ленгмюра один к одному (BIAcore Evaluation Software version 3.2) с помощью одновременной подгонки сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol. Biol. 293:865-881. Если скорость ассоциации превышает 106 М-1S-1 по указанному выше методу поверхностного плазмонного резонанса, то скорость ассоциации может быть определена с использованием метода гашения флуоресценции, в котором измеряется повышение или понижение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25°C 20 нМ антитела против VEGF (в форме Fab) в PBS, рН 7,2, в присутствии повышающихся концентраций короткой формы VEGF человека (8-109) или мышиного VEGF при измерении на спектрометре, таком как спектрофотометр, оборудованный системой остановки потока (Aviv Instruments) или спектрофотометр 8000-серий SLM-Aminco (ThermoSpectronic) с перемешиваемой кюветой. «Kd» или «величину Kd» по настоящему изобретению в одном варианте осуществления измеряют с помощью методов, известных в данной области техники.
«Блокирующее» антитело или антитело-«антагонист» представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Например, специфичное для VEGF антитело-антагонист связывает VEGF и ингибирует способность VEGF индуцировать пролиферацию клеток эндотелия сосудов или индуцировать проницаемость сосудов. Предпочтительные блокирующие антитела или антитела-антагонисты полностью ингибируют биологическую активность антигена.
Если не указано иначе, выражение «мультивалентное антитело» используется в этом описании для обозначения антитела, включающего три или более антигенсвязывающих сайта. Например, мультивалентное антитело конструируется как содержащее три или более антигенсвязывающих сайта и обычно не является нативной последовательностью антитела IgM или IgA.
«Фрагменты антитела» включают только часть интактного антитела, обычно включая антигенсвязывающий сайт интактного антитела и, следовательно, сохраняя способность связывать антиген. Примеры фрагментов антитела, охватываемых настоящим изобретением, включают: (i) Fab фрагмент, имеющий домены VL, CL, VH и CH1; (ii) Fab' фрагмент, который представляет собой Fab фрагмент, имеющий один или более цистеиновых остатков на C-конце домена CH1; (iii) Fd фрагмент, имеющий домены VH и CH1; (iv) Fd' фрагмент, имеющий домены VH и CH1 и один или более цистеиновых остатков на C-конце домена CH1; (v) Fv имеющий домены VL и VH одного плеча антитела; (vi) dAb фрагмент (Ward et al., Nature 341, 544-546 (1989)), который состоит из домена VH; (vii) выделенные области CDR; (viii) F(ab')2 фрагменты, двухвалентный фрагмент, включающий два Fab' фрагмента, соединенные дисульфидным мостиком в шарнирной области; (ix) молекулы одноцепочечных антител (например, одноцепочечный Fv; scFv) (Bird et al., Science 242:423-426 (1988); и Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) «диатела» с двумя антигенсвязывающими сайтами, включающие вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одну и ту же полипептидную цепь (см., например, патенты EP 404097; WO93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); (xi) «линейные антитела», включающие пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с полипептидами комплементарных легких цепей образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8(10):1057-1062 (1995); и патент США № 5641870).
Применяемый в настоящем описании термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против единственного антигена. Более того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единичной детерминанты на антигене. Определение «моноклональное» не истолковывается как требующее получения антитела с помощью какого-либо конкретного метода. Например, моноклональные антитела для использования по изобретению могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature 256:495 (1975), или могут быть получены методами рекомбинантной ДНК (см., например, патент США № 4816567). «Моноклональные антитела» могут быть также выделены из фаговых библиотек антител с использованием методов, описанных, например, в Clackson et al., Nature 352:624-628 (1991) или Marks et al., J. Mol. Biol. 222:581-597 (1991).
Фрагмент «Fv» представляет собой фрагмент антитела, который содержит полный сайт, узнающий и связывающий антиген. Эта область состоит из димера вариабельного домена одной тяжелой и одной легкой цепи, находящихся в прочной связи, которая может быть ковалентной природы, например, в scFv. Именно в этой конфигурации три CDRs каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности димера VH-VL. Совместно шесть CDRs или их подгруппа придают антителу специфичность связывания антигена. Однако даже единственный вариабельный домен (или половина Fv, включающая только три CDRs, специфичная для антигена) обладает способностью узнавать и связывать антиген, хотя обычно с более низким сродством, чем полный связывающий сайт.
Применяемый в настоящем описании термин «вариабельный домен антитела» относится к частям легких и тяжелых цепей молекул антитела, которые включают аминокислотные последовательности областей, определяющих комплементарность (CDRs; т.е. CDR1, CDR2 и CDR3), и области каркаса (FRs). VH обозначает вариабельный домен тяжелой цепи. VL обозначает вариабельный домен легкой цепи. В соответствии с методами, используемыми в настоящем изобретении, положения аминокислот, установленные для CDRs и FRs, могут быть определены по Кабату (Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1987 and 1991)). Нумерация аминокислот антител или антигенсвязывающих фрагментов также соответствует нумерации по Кабату.
Применяемый в настоящем описании термин «области, определяющие комплементарность» (CDRs; т.е. CDR1, CDR2 и CDR3), относится к аминокислотным остаткам вариабельного домена антитела, присутствие которых необходимо для связывания антигена. Каждый вариабельный домен обычно имеет три области CDR, идентифицированные как CDR1, CDR2 и CDR3. Каждая область, определяющая комплементарность, может включать аминокислотные остатки из «области, определяющей комплементарность», как определено Кабатом (т.е. приблизительно остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или те остатки из «гипервариабельной петли» (т.е. приблизительно остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). В некоторых случаях область, определяющая комплементарность, может включать аминокислоты как из области CDR, определенной по Кабату, так и из гипервариабельной петли. Например, CDRH1 тяжелой цепи антитела 4D5 включает аминокислоты с 26 по 35.
«Области каркаса» (в настоящем описании далее FR) представляют собой те остатки вариабельных доменов, которые отличаются от остатков CDR. Каждый вариабельный домен обычно имеет четыре FRs, идентифицированные как FR1, FR2, FR3 и FR4. Если CDRs определяются по Кабату, остатки FR легкой цепи расположены приблизительно как остатки 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), и остатки FR тяжелой цепи расположены приблизительно как остатки 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103-113 (HCFR4) в остатках тяжелой цепи. Если CDRs включают аминокислотные остатки из гипервариабельных петель, остатки FR легкой цепи расположены приблизительно как остатки 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4) в легкой цепи и остатки FR тяжелой цепи расположены приблизительно как остатки 1-25 (HCFR1), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4) в остатках тяжелой цепи. В некоторых случаях, когда CDR включает аминокислоты как из CDR, определенной по Кабату, так и аминокислоты из гипервариабельной петли, остатки FR должны быть соответственно подогнаны. Например, когда CDRH1 включает аминокислоты H26-H35, остатки тяжелой цепи FR1 находятся в положениях 1-25, и остатки FR2 находятся в положениях 36-49.
«Fab» фрагмент содержит вариабельный и константный домен легкой цепи и вариабельный домен, и первый константный домен (CH1) тяжелой цепи. F(ab')2 фрагменты антитела включают пару Fab фрагментов, которые обычно ковалентно соединены в области их карбоксильных концов с помощью цистеинов шарнира между ними. Другие химические соединения фрагментов антител также известны в данной области техники.
«Одноцепочечные Fv» или «scFv» фрагменты антитела включают домены VH и VL антитела, где эти домены присутствуют в единой полипептидной