Способы и композиции для нанесения моксифлоксацина в ухо
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к оториноларингологии, и может быть использована для лечения среднего отита путем введения текучей композиции моксифлоксацина с вязкостью 100,000 спз при температуре 25°C в ухо. Способ позволяет повысить эффективность лечения отита за счет локализации композиции на барабанной перепонке.2 н. и 25 з.п. ф-лы, 22 ил.,10 табл., 22 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка заявляет приоритет в отношении Предварительной заявки США с порядковым номером 61/293019, поданной 7 января 2010 года. Описание этой предварительной заявки считается частью (и включено посредством ссылки) описания этой заявки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Это изобретение относится к способам и материалам для нанесения моксифлоксацина в ухо. Более конкретно, это изобретение описывает способы и материалы для нанесения моксифлоксацина на наружную, эпидермальную поверхность барабанной перепонки для лечения нарушений среднего уха.
УРОВЕНЬ ТЕХНИКИ
Средний отит (OM), воспаление среднего уха, является очень частым, особенно у детей. ОМ часто начинается с вирусной инфекции верхних дыхательных путей, которая изменяет микроокружение верхних дыхательных путей, евстахиевой трубы, и среднего уха, так что бактерии, обитающие в носоглотке, проникают и заселяют среднее ухо. Эта инвазия может вызывать воспаление и блокировать евстахиеву трубу, препятствуя вентиляции среднего уха, уравновешиванию давления и дренажу. Жидкости накапливаются и давление увеличивается в обычно заполненном воздухом пространстве среднего уха, вызывая сильную боль. В тяжелых случаях ОМ могут повреждаться структуры восприятия звука. Хронический или рецидивирующий ОМ может вызываться бактериями, которые пробуждаются из состояния покоя в среднем ухе, которые были защищены от антибиотиков слизистой биопленкой.
В настоящее время ОМ лечат с использованием антибиотиков и/или вставлением тимпаностомической трубки через хирургический разрез в барабанной перепонке для дренирования и снижения давления полости среднего уха. Эффективность лечения антибиотиками ограничена способом доставки. Антибиотики могут доставляться системно, но часто требуется высокая доза для достижения терапевтических уровней (т.е. выше минимальной ингибирующей концентрации) в среднем ухе, и такие уровни часто достигаются после значительного лаг-периода. Антибиотики могут также доставляться с использованием лаважа или посредством капель в наружный слуховой проход. Такие способы доставки могут обнаруживать трудное контролирование и часто не являются эффективными в достижении пролонгированных терапевтических уровней антибиотика в среднем ухе. Антибиотики могут также доставляться инъекцией в среднее ухо или введением импрегнированных антибиотиком материалов в среднее ухо, но такие способы включают в себя прокалывание или разрезание барабанной перепонки, которое требует общей анестезии и может повреждать барабанную перепонку. Хирургическое вставление трубок для тимпаностомии также несет риски, включающие в себя тимпаносклероз (т.е. кальцификацию барабанной перепонки и тканей среднего уха), потерю слуха, хроническую оторею (т.е. выделение гноя из трубки) и инфекцию.
National Institute on Deafness and Other Communication Disorders (NIDCD), часть Национальных институтов здравоохранения, недавно выделил средства в размере 2000000 долларов для поддержки развития альтернативных стратегий и новых подходов для предотвращения и лечения ОМ. В его требовании к заявкам на получение этих средств (RFA-DC-02-002), NIDCD указывает на то, что: (1) OM вызывает значительную заболеваемость у детей и увеличивающимся образом влияет на общее здоровье населения; (2) OM является главной причиной посещений кабинетов неотложной помощи; (3) ОМ является второй главной причиной для посещений кабинета врача (4) OM является главной причиной прописывания антибиотиков детям, ответственной за более 40% всех прописываний антибиотиков амбулаторным пациентам; (5) ОМ является главной причиной потери слуха детей; и (6) ОМ является главной причиной общей анестезии у детей. Кроме того, NIDCD порицает применение антибиотиков широкого спектра для лечения ОМ за пугающее появление множественных устойчивых к антибиотикам бактерий в трех из родов, которые могут вызывать ОМ (Streptococcus pneumoniae, нетипичный Haemophilus influenzae и Moraxella catarrhalis). В результате, многие антибиотики первого поколения и второго поколения становятся все менее и менее эффективными против ОМ и других заболеваний, в том числе пневмонии и менингита. NIDCD сделал вывод, что «развитие новых подходов для исследования, лечения и предупреждения ОМ является крайне необходимым для 1) уменьшения заболеваемости ОМ и связанных с этим расходов; и 2) сохранения эффективности антибиотиков, используемых для лечения ОМ и других обычных серьезных заболеваний”.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Это изобретение основано, отчасти, на открытии, что композиции, содержащие моксифлоксацин, могут быть изготовлены таким образом, что он может доставляться к наружной, эпидермальной поверхности барабанной перепонки в подобной жидкости форме, затем, после доставки, превращаться в подобные твердому веществу гелевое состояние, так что эта композиция остается локализованной на барабанной перепонке. Доставка таких композиций к барабанной перепонке может обеспечивать более эффективные способы для лечения нарушений среднего и внутреннего уха (лабиринта) (например, ОМ).
В одном аспекте, обеспечен способ введения моксифлоксацина в млекопитающее (например, в грызуна или человека). Этот способ включает в себя нанесение композиции на эпидермальную поверхность барабанной перепонки этого млекопитающего, где эта композиция включает в себя вискогенный (загущающий) агент и моксифлоксацин, где эта композиция имеет вязкость менее 100,000 сП, и где эта композиция, после нанесения на барабанную перепонку, имеет предел текучести (напряжение пластического течения), достаточный для удерживания этой композиции на барабанной перепонке. Этим вискогенным (загущающим) агентом может быть геллан, N-изопропилакриламид с акрилатом натрия и н-N-алкилакриламидом, полиакриловая кислота с полиэтиленгликолем, полиметакриловая кислота с полиэтиленгликолем, CARBOPOL® (полиакриловая кислота) с гидроксипропилметилцеллюлозой, ацетат-целлюлозный гидрофталатный латекс, альгинат натрия или обратимый термоосаждающийся гель, такой как полоксамер или полоксамин. Моксифлоксацин может проходить через барабанную перепонку в пространство среднего уха. Этот по меньшей мере один фармакологический агент может включать в себя антибиотик, и эта композиция может, кроме того, включать в себя противовоспалительный агент, анестетик, способствующий адгезии агент, усилитель проницаемости или проникновения, биоадгезив, гигроскопический агент, размягчитель ушной серы или консервант.
В другом аспекте, используется набор, который включает в себя композицию и инструкции, указывающие на то, что эта композиция должна наноситься на барабанную перепонку. Такая композиция включает в себя вискогенный (загущающий) агент и моксифлоксацин, где эта композиция имеет вязкость менее 100,000 сП и где эта композиция имеет предел текучести (напряжение пластического течения), достаточный для удерживания этой композиции на барабанной перепонке.
Обеспечен также грызун (например, шиншилла), который включает в себя композицию, нанесенную на эпидермальную поверхность его барабанной перепонки, где эта композиция включает в себя вискогенный (загущающий) агент и моксифлоксацин, где эта композиция имеет вязкость менее 100,000 сП и где эта композиция имеет предел текучести (напряжение пластического течения), достаточный для удерживания этой композиции на барабанной перепонке.
Если нет других указаний, все технические и научные термины, используемые здесь, имеют значение, обычно понимаемое специалистом с обычной квалификацией в области, к которой относится это изобретение. Хотя способы и материалы, подобные или эквивалентные описанным здесь способам и материалам, могут быть использованы в практике этого изобретения, ниже описаны подходящие способы и материалы. Все публикации, заявки на патент, патенты и другие ссылки, упоминаемые здесь, включены посредством ссылки в их полном виде. В случае противоречия, контролем будет это описание, в том числе определения, приводимые в нем. Кроме того, эти материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Другие признаки и преимущества эти будут очевидными из следующего подробного описания и из формулы изобретения.
ОПИСАНИЕ ФИГУР
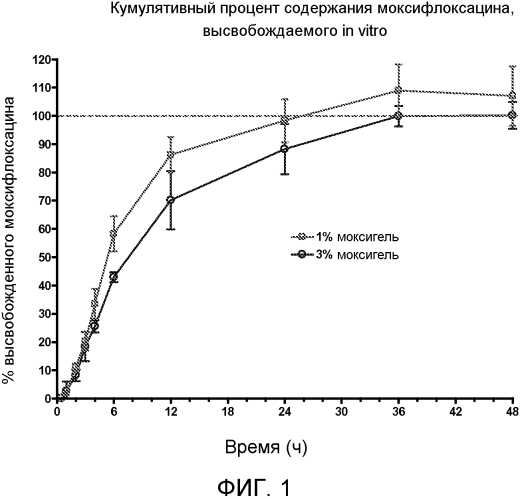
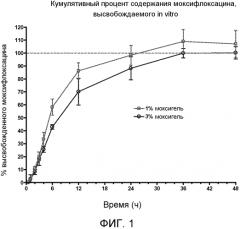
ФИГ. 1 является графиком, показывающим кумулятивный процент содержания моксифлоксацина, высвобождающегося in vitro.
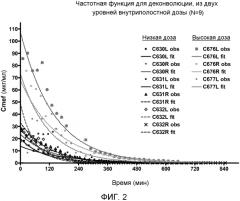
ФИГ. 2 является графиком, показывающим функцию реакции для деконволюции из двух уровней внутрипузырных доз (N=9).
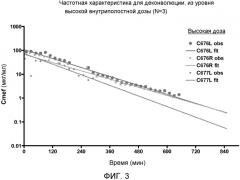
ФИГ. 3 является графиком, показывающим частотную характеристику для деконволюции из высокого уровня внутриполостной дозы (N=3).
ФИГ. 4 являются графиками, показывающими концентрации моксифлоксацина в MEF после введения в наружное ухо 1% моксигеля для когорты 1 и когорты 2.
ФИГ. 4В являются графиками, показывающими концентрации моксифлоксацина в MEF после введения в наружное ухо 1% моксигеля для когорты 3 и когорты 4.
ФИГ. 5 являются графиками, показывающими концентрацию моксифлоксацина (среднее, SD) в MEF после введения в наружное ухо 1% моксигеля (N=23).
ФИГ. 6 являются графиками, показывающими концентрации моксифлоксацина в MEF после введения в наружное ухо 3% моксигеля для когорты 1 и когорты 2.
ФИГ. 7 являются графиками, показывающими концентрации моксифлоксацина (среднее, SD) в MEF после введения в наружное ухо 3% моксигеля (N=13).
ФИГ. 8 являются графиками, показывающими концентрации моксифлоксацина (среднее, SD) в MEF после введения в наружное ухо 1% и 3% моксигеля (N=13).
ФИГ. 9 являются графиками, показывающими Cmax и Tmax для 1% и 3% моксигеля.
ФИГ. 10 является графиком, показывающим кумулятивное количество, доставленное в MEF, после введения в наружное ухо 1% моксигеля (N=23).
ФИГ. 11A являются графиками, показывающими скорость вхождения в MEF после введения в наружное ухо 1% моксигеля. 1-я когорта, N=6; 2-я когорта, N=6.
ФИГ. 11В являются графиками, показывающими скорость вхождения в MEF после введения в наружное ухо 1% моксигеля. 3-я когорта, N=6; 4-я когорта, N=5.
ФИГ. 12 является графиком, показывающим кумулятивное количество, доставленное в MEF после введения в наружное ухо 3% моксигеля (N=13).
ФИГ. 13 являются графиками, показывающими скорость вхождения в MEF после введения в наружное ухо 3% моксигеля. 1-я когорта, N=6; 2-я когорта, N=7.
ФИГ. 14 является графиком, показывающим скорость вхождения в MEF после введения в наружное ухо 1% и 3% моксигеля.
ФИГ. 15 являются графиками, показывающими время для достижения и продолжительность выше концентрации-мишени в жидкости среднего уха после введения в наружное ухо 1% моксигеля.
ФИГ. 16 являются графиками, показывающими время для достижения и продолжительности выше концентрации-мишени в жидкости среднего уха после введения в наружное ухо 3% моксигеля.
ФИГ. 17 является графиком, показывающим AUIC в MEF на протяжении 3 дней после введения в наружное ухо.
ФИГ. 18 является графиком, показывающим Cmax/MIC в MEF после введения в наружное ухо.
ФИГ. 19A является графиком, показывающим концентрации моксифлоксацина MEF (Среднее, SEM) после лечения 50% IPM (N=9);
ФИГ. 19B показывает те же самые данные в логарифмической форме.
ПОДРОБНОЕ ОПИСАНИЕ
В общих чертах, это изобретение обеспечивает способы нанесения моксифлоксацина на ухо с использованием композиций, содержащих моксифлоксацин и один или несколько вискогенных агентов. Композиции конкретно готовят таким образом, что они могут доставляться к наружной эпидермальной поверхности барабанной перепонки в подобном жидкости состоянии, например, в текучей форме. Однако после введения эта композиция превращается в подобное твердому веществу состояние, так что эта композиция остается в контакте с барабанной перепонкой. В результате эта композиция остается локализованной на этой барабанной перепонке, например, в пространстве среднего уха, обеспечивая более эффективный способ лечения нарушений среднего и внутреннего уха (например, ОМ). Подходящие композиции могут также содержать другие компоненты, например, для облегчения адгезии этой композиции к барабанной перепонке и/или увеличения проницаемости барабанной перепонки для увеличения посредством этого проникновения моксифлоксацина.
Обычные патогены, ассоциированные со средним отитом (воспалением среднего уха), включают в себя Streptococcus pneumoniae, Haemophilus influenza и Moraxella catarrhalis. Эти организмы являются чувствительными к моксифлоксацину; имеющими величины MIC90 0,13, 0,06 и 0,06 мкг/мл, соответственно. Как понятно квалифицированным в данной области специалистам, MIC90 называют Минимальную Ингибирующую Концентрацию, необходимую для ингибирования 90% роста этого организма. Терапевтической задачей использования описанной здесь доставки моксифлоксацина через барабанную перепонку является описанное здесь достижение моксифлоксацином уровней жидкости среднего уха, которые являются в >10 раз более высокими, чем величины MIC90 (например, более высокими, чем приблизительно 0,6 мкг/мл; между приблизительно 0,6 и приблизительно 1,3 мкг/мл) и сохранение этого уровня в течение >24 часов. Эти концентрации-мишени были достигнуты с описанными здесь гелевыми композициями моксифлоксацина с применением одного нанесения.
Композиции этого изобретения имеют вязкость менее 100,000 сантипуазов (сП) при 25оС. Вязкостью называют устойчивость композиции к течению. Композиции, имеющие объем 0,5 мл, которые могут проходить через иглу 19-го калибра, прикрепленную к туберкулиновому шприцу за время менее 1 минуты при 25оС, с приемлемым усилием и без помощи механических устройств, обычно имели вязкость менее 100,000 сП. Вязкость композиции может быть определена с использованием вискозиметра (например, из Brookfield), калиброванного коммерчески доступными стандартами вязкости.
Композиции этого изобретения имеют также минимальный предел текучести, который является достаточным для сохранения композиции на барабанной перепонке. Пределом текучести называют количество усилия, которое при применении к твердому материалу заставляет этот твердый материал проявлять подобное жидкости поведение, в котором он продолжает деформироваться без дополнительного увеличения предела текучести (напряжения пластического течения). Минимальный предел текучести композиций этого изобретения зависит от толщины наносимого геля и температуры окружения. В данном контексте минимальным пределом текучести в ссылке на нанесенный гель является гель, который имеет толщину 4 мм и плотность 1 г/л. Предел текучести (δ0) представлен как δ=pgh, где p обозначает плотность, g обозначает ускорение вследствие силы тяжести и h обозначает толщину слоя. Обычно, минимальный предел текучести равен приблизительно 39 паскалям (Па). Описанные здесь способы могут быть также использованы для оценивания, имеет ли композиция достаточный предел текучести, чтобы быть сохраненной на барабанной перепонке. Например, тест-композиция может быть введена в ухо животного, такого как шиншилла, и ухо этого животного может быть подвергнуто мониторингу для определения, превращается ли эта композиция в более подобное твердому веществу состояние и удерживается ли на барабанной перепонке. См., например, раздел примеров здесь.
Вискогенные (загущающие) агенты
В данном контексте, вискогенным агентом называют полимер или другую химическую часть молекулы, которая увеличивает вязкость жидкости. Подходящие вискогенные агенты, при включении в композицию этого изобретения, позволяют этой композиции превращаться из подобного жидкости состояния (например, текучего состояния) при 25°С в подобное твердому веществу состояние (например, гель) после контактирования с барабанной перепонкой, и могут быть не-биодеградируемыми, т.е. не разрушаемыми химикалиями или ферментами, природно присутствующими в млекопитающем, или биодеградируемыми. Композиции включают в себя количество вискогенного агента, эффективного для создания вязкости этой композиции менее 100,000 сП (например, менее 90,000, 60,000, 30,000, 20,000 или 10,000 сП) и, обычно, минимального предела текучести 39 Па после нанесения на барабанную перепонку. Обычно, композиция включает в себя 0,05-50% вискогенного агента (например, 0,15-25, 5-45, 10-40, 12-37, 15-35, 17-33 или 20-30% вискогенного агента).
Примерные вискогенные агенты включают в себя геллан (GELRITE® или KELCOGEN®), CARBOPOL® 940 (полиакриловую кислоту) с гидроксипропилметилцеллюлозой (HPMC), N-изопропилакриламид (NiPAAm) с акрилатом натрия и н-N-алкилакриламидом, полиакриловую кислоту с полиэтиленгликолем (PEG) или полиметакриловую кислоту с PEG, ацетат-целлюлозный гидрофталатный латекс, (CAP), альгинат натрия и неионогенные поверхностно-активные вещества, такие как обратимые зависимые от температуры системы гелеобразования полоксамеры (PLURONIC®) и полиоксиамин (TETRONIC®). Геллан является природным полимером, анионогенным дезацетилированным экзоклеточным полисахаридом, секретируемым Pseudomonas elodea. Это тетрасахаридное повторяющееся звено состоит из одной альфа-L-рамнозы, одной бета-D-глюкуроновой кислоты и двух бета-D-глюкозных частей молекулы. Механизм гелеобразования in situ геллана является катион-индуцируемым (например, требует присутствия ионов кальция) и температура-зависимым (например, требует физиологической температуры). Образование геля является термически обратимым. CARBOPOL® 940 с HPMC образует гели in situ рН-зависимым способом. CARBOPOL® является гелеобразующим агентм и HPMC используется для увеличения вязкости этого геля. NiPAAm с акрилатом натрия и n-N-алкилакриламидом является терполимерным гидрогелем, который может подвергаться обратимому гель-золь-превращению на основе температуры. Акрилат натрия и н-N-алкилакриламид используются для модификации свойств гидрогеля, в частности, температуры фазового перехода. Считается, что полиакриловая кислота с PEG или полиметакриловая кислота с PEG образуют гель на основе образования водородных связей. Полиакриловая кислота может растворяться в водно-спиртовом растворе и после подвергания инъекции этот спирт диффундирует, заставляя полимеры осаждаться и вызывая гелеобразование раствора. CAP является состоящей из наночастиц системой, которая образует гель рН-зависимым способом. Активное соединение (моксифлоксацин) может адсорбироваться частично на поверхность этих полимерных частиц. Альгинат натрия образует гель в присутствии кальция или других поливалентных ионов.
Неионогенные поверхностно-активные вещества, такие как полоксамеры и полоксамины являются особенно предпочтительными. Полоксамеры хорошо известны в фармацевтических областях и описаны, например, Irving R. Schmolka, Poloxamers in the Pharmaceutical Industry, in Polymers for Controlled Drug Delivery, Chapter 10 (Peter J. Tarcha ed., 1990). Полоксамеры являются триблок-сополимерами, так как они состоят из двух различных полимерных блоков (т.е. гидрофильных поли(оксиэтилен)-блоков и гидрофобных поли(оксипропилен)-блоков), сконструированных в виде триблока поли(оксиэтилен)-поли(оксипропилен)-поли(оксиэтилен). Полоксамеры являются одним классом блок-сополимерных поверхностно-активных веществ, имеющих гидрофобный пропиленоксидный блок и гидрофильный этиленоксидный блок. Полоксамеры являются коммерчески доступными (например, полиолы PLURONIC® доступны из BASF Corporation). Альтернативно, полоксамеры могут быть синтезированы известными способами.
Ранее считали, что полоксамеры не имеют применения для введения фармакологических агентов, вследствие их не-биодеградируемости, их водорастворимости и их относительно быстрой кинетики высвобождения (см., например, Патент США № 6201072). Тем не менее, как описано здесь, полоксамеры имеет общее свойство, которое является выгодным для нанесения композиций на барабанную перепонку: водные композиции полоксамеров проявляют обратимое термическое гелеобразование, или обратимое термоотверждение. При нагревании водной композиции полоксамера выше его температуры гелеобразования, его вязкость увеличивается и он превращается в гель. При охлаждении композиции водного полоксамера ниже его температуры гелеобразования, его вязкость уменьшается и он превращается в жидкость. Этот переход между гелем и жидкостью не включает в себя изменение в химическом составе этой композиции и является обратимым и повторяемым. Температура перехода гель-жидкость водной композиции полоксамера может корректироваться специалистом со средней квалификацией в этой области с использованием рутинного экспериментирования (например, манипулированием концентрации полоксамера, рН и присутствия других ингредиентов в этой композиции). В некоторых вариантах осуществления, композиции имеют температуру гелеобразования, которая является большей, чем температура окружающей среды, и меньшей, чем температура барабанной перепонки, или равной температуре барабанной перепонки. Такие композиции могут быть удобным образом нанесены через наружный слуховой проход в виде жидкости и затем могут быть превращены в гель на барабанной перепонке, поддерживая посредством этого моксифлоксацин в композиции в тесной близости относительно барабанной перепонки.
Моксифлоксацин
Описанная здесь композиция содержит также моксифлоксацин или его соль. Моксифлоксацин является синтетическим фторхинолоном четвертого поколения, имеющим химическую формулу C21H24F3O4. Моксифлоксацин связывается с бактериальными ферментами ДНК-гиразой (топоизомеразой II) и топоизомеразой IV и ингибирует их, приводя к ингибированию репликации и репарации ДНК и в конечном счете к смерти клеток в чувствительных видах бактерий. Количество моксифлоксацина или его соли в описанной здесь композиции может находиться в диапазоне от приблизительно 0,1% до приблизительно 50% (например, приблизительно 0,25% - приблизительно 45%; приблизительно 0,5% - приблизительно 25%; приблизительно 0,75% - приблизительно 10%; приблизительно 1% - приблизительно 5%; или приблизительно 1% - приблизительно 3%). Соли моксифлоксацина включают в себя, например, без ограничения, хлористоводородную кислоту, серную кислоту, уксусную кислоту, молочную кислоту, гидроксид натрия и гидроксид калия.
Другие компоненты композиций моксигеля
В некоторых вариантах осуществления, описанные здесь композиции включают в себя одно или несколько соединений, наряду с вискогенным (загущающим) агентом и моксифлоксацином. Например, композиция может включать в себя один или несколько фармакологических агентов, включающих в себя, например, адренокортикоид (например, кортикостероид, стероид), аналгетик, аналгезирующий адъювант, аналгетик-анестетик, анестетик, антибиотик, другой чем моксифлоксацин, антибактериальный агент, противоинфекционное средство, адъювант для антибиотической терапии, антидот, противорвотное средство, противогрибковое средство, противовоспалительное средство, средство против головокружения, антивирусный агент, модификатор биологической реакции, цитотоксическое, диагностическое вспомогательное средство, иммунизирующий агент, иммуномодулятор, белки, пептиды и другие агенты, которые могут быть применимы в лечении ушных нарушений. Кроме моксифлоксацина, описанная здесь композиция может включать в себя один или множество фармакологических агентов. Например, для борьбы с бактериальной инфекцией, для уменьшения воспаления ткани и для ослабления раздражения композиция может содержать моксифлоксацин, противовоспалительное средство и анестетик или аналгетик. Специалисты с квалификацией в данной области могут идентифицировать фармакологические агенты и объединять их в случае необходимости для достижения желаемого действия. Следующее описание просто обеспечивает репрезентативный перечень возможных фармакологических агентов.
Примерные адренокортикоиды включают в себя бетаметазон, кортизон, дексаметазон, гидрокортизон, метилпреднизолон, параметазон, преднизолон, преднизон и триамцинолон. Примерные аналгезирующие средства включают в себя ацетаминофен, аспирин, бупренорфин, буталбитал, буторфанол, кодеин, дезоцин, дифлуризал, дигидрокодеин, этодолак, фенопрефен, фентанил, флоктафенин, гидрокодон, гидроморфон, ибупрофен, кетопрофен, кеторолак, леворфанол, салицилат магния, меклофенамат, мефенамовую кислоту, меперидин, мепробамат, метадон, метотримепразин, морфин, налбуфин, напроксен, опиум, оксикодон, оксиморфон, пентазоцин, фенобарбитал, пропоксифен, салсалат и салицилат натрия. Одним примером аналгезирующего адъюванта является кофеин. Примерные анестетики включают в себя артикаин-эпинефрин, бупивакаин, хлоропрокаин, этидокаин, кетамин, лидокаин, мепивакаин, метогекситал, прилокаин, пропофол, пропоксикаин, тетракаин и тиопентал. Одним примерным аналгетиком-анестетиком является антипирин-бензокаин.
Примеры антибиотиков (других чем моксифлоксацин), антибактериальных и противоинфекционных агентов включают в себя сульфонамиды (например, сульфаниламид, сульфадиазин, сульфаметоксазол, сульфизоксазол, пара-аминобензойную кислоту или сульфацетамид), триметоприм-сульфаметоприм-сульфаметоксазол, хинолоны (например, ципрофлоксацин, офлоксацин или налидиксиновую кислоту), бета-лактамные антибиотики, такие как пенициллины или цефалоспорины, аминогликозиды (например, канамицин, тобромицин, гентамицин C, амикацин, неомицин, нетилмицин, стрептомицин или ванкомицин), тетрациклины, хлорамфеникол и макролиды (например, эритромицин, кларитромицин или азитромицин). Не ограничивающие примеры подходящих пенициллинов включают в себя пенициллин G, пенициллин V, метициллин, оксациллин, нафциллин, ампициллин и амоксициллин. Не ограничивающие примеры подходящих цефалоспоринов включают в себя цефалотин, цефдинир, цефазолин, цефалексин, цефадроксал, цефамандол, цефокситин, цефаклор, цефоницид, цефолетан, цефотаксим, цефтизоксим, цефтриаксон, цефдиторен и цефепим. Примеры антибиотиков, применимых для лечения ОМ, включают в себя пенициллины, такие как амоксициллин и амоксициллин-клавуланат (AUGMENTIN®); комбинации на основе sulfa-, такие как эритромицин-сульфизоксазол (Pediazole), триметоприм-сульфаметоксазол (BACTRIM®, SEPTRA®); макролиды/азалиды, такие как азитромицин (ZITHROMAX®) или кларитромицин (BIAXIN®); цефалоспорины второго поколения, такие как цефаклор (CECLOR®), цефпрозил (CEFZIL®), цефуроксим аксетил (CEFTIN®) или лоракарбеф (LORABID®); и цефалоспорины третьего поколения, такие как цефдинир (OMNICEF®), цефиксим (SUPRAX®), цефподоксим проксетил (VANTIN®), цефтибутен (CEDAX®), цефдиторен (SPECTRACEF™) и цефтриаксон (ROCEPHIN®).
Подходящие противорвотные средства включают в себя буклизин, хлорпромазин, циклизин, дименгидринат, дифенгидрамин, дифенидол, домперидон, дронабинол, галоперидол, гидроксизин, меклизин, метоклопрамин, набилон, ондансетрон, перфеназин, прохлорперазин, прометазин, скополамин, триэтилперазин, трифлупромазин и триметобензамин. Примеры противогрибковых средств включают в себя амфотерицин B, клиохинол, клотримазол, флуконазол, флуцитозин, гризеофулвин, кетоконазол, миконазол и иодид калия. Примеры противовоспалительных агентов включают в себя ацетат алюминия, аспирин, бетаметазон, буфексамак, целекоксиб, дексаметазон, диклофенак, этодолак, флурбипрофен, гидрокортизон, индометацин, салицилат магния, напроксен, преднизолон, рофекоксиб, салсалат, сулиндак и триамцинолон. Примеры подходящих агентов против головокружения включают в себя белладонну, дименгидринат, дифенгидрамин, дифенидол, меклизин, прометазин и скополамин. Примеры подходящих антивирусных агентов включают в себя ацикловир, амантадин, делавирдин, диданозин, эфавиренц, фоскарнет, ганцикловир, индинавир, нелфинавир, рибавирин, ритонавир, залцитабин и зидовудин. Примеры модификаторов биологических реакций включают в себя алдеслейкин, интерферон α-2а, интерферон α-2b, интерферон α-n1, интерферон α-n3, интерферон γ и левамизол. Примеры цитотоксических вгентов включают в себя подофилокс и подофиллум. Примеры иммунизирующих агентов включают в себя вакцину вируса гриппа, пневмококковую поливалентную вакцину и иммуноглобулин. Примерным иммуномодулятором является интерферон γ. Другие фармакологические агенты, подходящие для этого изобретения, включают в себя бетагистин (например, для лечения тошноты, головокружения и звона в ушах, которые встречаются в случае болезни Меньера), прохлорперазин и гиосцин.
Альтернативно или дополнительно, композиция может включать в себя один или несколько из следующих соединений: растворитель или разбавитель, такой как солевой раствор, биоадгезив, усилитель проницаемости или проникновения, гигроскопический агент, размягчитель ушной серы, консервант (например, антиоксидант) или другие вспомогательные вещества. Такие соединения могут быть представлены в этой композиции в количествах в диапазоне от 0,01% до 99% (например, 0,01-1, 0,01-10, 0,01-40, 0,01-60, 0,01-80, 0,5-10, 0,5-40, 0,5-60, 0,5-80, 1-10, 1-40, 1-60, 1-80, 5-10, 5-40, 5-60, 5-80, 10-20, 10-40, 10-60, 10-80, 20-30, 30-40, 40-50, 50-60, 60-70 или 70-80%). Например, композиция может включать в себя один или несколько вискогенных агентов (например, PLURONIC® F-127 и CARBOPOL®), моксифлоксацин и один или несколько усилителей проницаемости или проникновения (например, витамин Е). В других вариантах осуществления, композиция может включать в себя один или несколько вискогенных агентов, моксифлоксацин и один или несколько размягчителей ушной серы. Композиции могут также содержать один или несколько вискогенных агентов, моксифлоксацин, один или несколько гигроскопических агентов и один или несколько консервантов. Отмечается, что некоторые агенты могут выполнять различные роли в этой композиции. Например, CARBOPOL® может функционировать в качестве вискогенного агента или в качестве биоадгезива, в зависимости от его концентрации. Витамин Е может функционировать в качестве усилителя проницаемости и проникновения, консерванта и антиоксиданта.
Биоадгезив способствует адгезии композиции с барабанной перепонкой. Подходящие биоадгезивы включают в себя гидроколлоиды, такие как: аравийская камедь; агар-агар; альгинаты (например, альгиновая кислота и альгинат натрия); CABOPOL®; натрий-карбоксиметилцеллюлоза; кальций-карбоксиметилцеллюлоза; декстран; желатин; гуаровая камедь; гепарин; гиалуроновая кислота; гидроксиэтилцеллюлоза; камедь карайи; метилцеллюлоза; пектин; полиакриловая кислота; полиэтиленгликоль; поли-N-винил-2-пирролидон и трагакант.
Усилители проницаемости или проникновения увеличивают проницаемость барабанной мембраны, чтобы сделать ее более проницаемой для моксифлоксацина. Примеры усилителей проницаемости и проникновения включают в себя: спирты (например, этанол и изопропанол); полиолы (например, н-алканолы, лимонен, терпены, диоксалан, пропиленгликоль, этиленгликоль и глицерин); сульфоксиды (например, диметилсульфоксид, диметилформамид, метилдодецилсульфоксид и диметилацетамид); сложные эфиры (например, изопропилмиристат/пальмитат, этилацетат, бутилацетат, метилпропионат и каприновые/каприловые триглицериды); кетоны; амиды (например, ацетамиды); олеаты (например, триолеин); поверхностно-активные вещества (например, лаурилсульфат натрия); алкановые кислоты (например, каприловую кислоту); лактамы (например, азон); алканолы (например, олеиловый спирт); диалкиламиноацетаты; полиненасыщенные жирные кислоты (например, линолевую, альфа-линоленовую и арахидоновую кислоту); олеиновую кислоту; жир печени трески; производные ментола (например, 1-ментол); Сквален; простые моноэфиры глицерина, полученные из линейных, насыщенных жирных спиртов; флавоны (например, апигенин ромашки лекарственной, лютеолин и 7-О-бета-глюкозид апигенина; витамин Е (α-токоферол и его сложные эфиры и аналоги; и экстракт простого эфира Senkyu (Ligustici Chuanxiong Rhizome).
Гигроскопические агенты, такие как фруктоза, фталевая кислота и сорбит, облегчают перенос жидкости из среднего уха через барабанную перепонку в гелевый матрикс. Гигроскопические агенты могут способствовать ослаблению боли, ассоциированной с накапливанием жидкости и повышением давления среднего уха, и могут концентрировать моксифлоксацин в меньшем объеме жидкости в среднем ухе.
Размягчители ушной серы (например, докузат, оливковое масло, бикарбонат натрия, мочевина или пероксид водорода) способствуют контакту между барабанной перепонкой и композицией. Антиоксидант, такой как аскорбиновая кислота и бензойная кислота или другие консерванты, могут быть использованы для удлинения срока годности композиции во время хранения.
Способы нанесения композиции на барабанную перепонку
Композиция этого изобретения может быть нанесена на эпидермальную поверхность барабанной перепонки через наружный слуховой канал, например, для лечения нарушения среднего или внутреннего уха (например, ОМ). Композиции этого изобретения могут также наноситься профилактически (например, для предупреждения развития нарушения среднего или внутреннего уха). Композиция может быть нацелена на любую часть барабанной перепонки, включающую в себя pars tensa (натянутую часть), нижнюю часть барабанной перепонки или pars flaccida (ненатянутую часть) барабанной перепонки, верхнюю часть барабанной перепонки. У взрослых людей барабанная перепонка имеет диаметр приблизительно девять - десять мм и имеет толщину в диапазоне от 30 до 230 мкм (приблизительно 100 мкм в среднем). Ненатянутая часть (pars flaccida) составляет менее 3% площади барабанной перепонки у людей и животных, таких как кошки, морские свинки и шиншиллы. У других животных (например, песчанок, кроликов, крыс и мышей) ненатянутая часть (pars flaccida) составляет до 10%-25% площади барабанной перепонки. Тонкий эпидермальный слой (с толщиной приблизительно 15-30 мкм) покрывает барабанную оболочку человека, тогда как толстый эпидермальный слой (с толщиной приблизительно 75-150 мкм) покрывает другие площади тела человека. Пять - десять слоев клеток покрывают pars flaccida, тогда как три - пять слоев клеток покрывают pars tensa. Таким образом, pars tensa часто является более тонкой, чем другие части барабанной перепонки, и может быть более проницаемой для моксифлоксацина или другого фармакологического агента. Квалифицированным в данной области специалистам будет понятно, что центральная часть pars tensa обеспечивает активную вибрирующую зону в ответ на звук.
Любой способ, известный в данной области, может быть использован для нанесения композиции этого изобретения на барабанную перепонку. Например, композиция может быть нанесена на барабанную перепонку с использованием распределяющего жидкость устройства. Это распределяющее устройство имеет резервуар, сопряженный с проводящей трубкой, которая прямо или опосредованно получает текучую композицию из этого резервуара и проводит эту композицию к выпускному отверстию. Специалист со средней квалификацией может изготовить распределяющее устройство рутинным образом из шприца, соединенного с гибкой трубкой. Распределяющее устройство может быть также изготовлено заменой иглы устройства для прокалывания барабанной перепонки, такого как CDT® Speculum (Walls Precision Instruments LLC, Casper, WY, USA), проводящей жидкость трубкой. Это распределяющее устройство может быть также присоединено к головке пневматического или диагностического отоскопа (например, из Welch Allyn®, Skaneateles Falls, NY, USA) для создания точной платформы для нанесения композиции на барабанную перепонку.
В зависимости от композиции и нарушения среднего или внутреннего уха, может быть желательным удаление этой композиции из уха после переноса моксифлоксацина через барабанную перепонку. Это может выполняться мануально с использованием ватного тампона или пинцета. Шприц или груша могут быть также использованы для инжекции воды, солевого раствора или других биосовместимых водных растворов для размягчения, растворения и/или вымывания композиции. В других вариантах осуществления, композиции могут просто отделяться от барабанной перепонки после некоторого периода времени и выпадать из уха (например, во время физического упражнения или приема ванны). Альтернативно, биодеградируемые композиции могут не требовать удаления из уха.
Изделия
Композиции, описанные здесь, могут быть объединены с упаковочным материалом и могут продаваться в виде изделий или наборов. Компоненты и способы для получения изделий хорошо известны. Изделия могут объединять одну или несколько описанных здесь композиций. Кроме того, эти изделия могут дополнительно включать в себя один или несколько фармакологических агентов, стерильную воду или солевой