Способ получения пиримидиновых производных
Иллюстрации
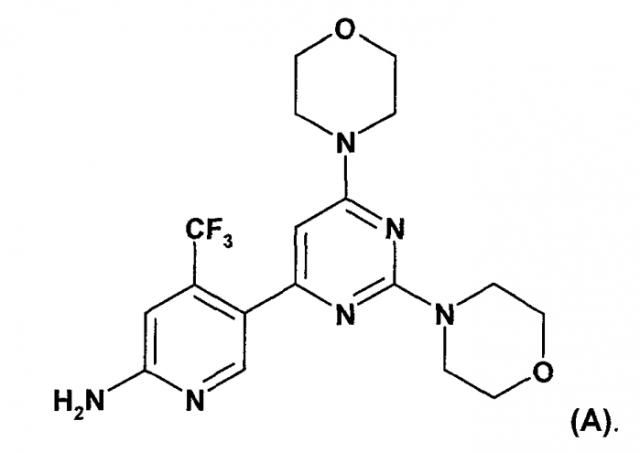
Показать всеИзобретение относится к кристаллической форме моногидрохлоридной соли соединения формулы А
в полиморфной форме А, где указанная моногидрохлоридная соль имеет при дифракции рентгеновских лучей пик при угле дифракции 2θ 9,9±0,3° и 20,0±0,3°. Указанная кристаллическая форма имеет низкое влагопоглощение по сравнению со свободным основанием и моногидратом моногидрохлоридом, что позволяет обеспечивать стабильность состава при минимальном риске химического разрушения. 3 з.п. ф-лы, 10 табл., 14 ил., 16 пр.
Реферат
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к новым способам получения пиримидиновых производных, к их промежуточным соединениям и к получению промежуточных соединений. Настоящее изобретение также относится к новому способу получения конкретных твердых форм пиримидинового производного, 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина (соединение A, смотри ниже), его гидратов, его солей и гидратов и сольватов его солей, к его указанным конкретным твердым формам, к фармацевтическим композициям, содержащим указанные твердые формы, к способам получения фармацевтических композиций, содержащих указанные твердые формы, к способам применения указанных твердых форм и к фармацевтическим композициям для терапевтического лечения теплокровных животных, в частности людей.
Уровень техники настоящего изобретения
WO 2007/084786 (дата приоритета: 20 января 2006) описывает определенные пиримидиновые производные, обладающие PI3K ингибирующими свойствами, их применение в качестве фармацевтических средств и способы их получения. Одно пиримидиновое производное, описанное в WO 2007/084786, представляет собой селективный ингибитор форсфатидилиназитол 3-киназы, соединение 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амин, называемое в настоящем изобретение далее "соединение A" или "соединение формулы A".
Соединение A описано в WO 2007/084786 в свободной форме и в виде соли хлористоводородной кислоты. Способ получения соединения A описан в примере 10 данного документа. Способы получения, описанные в настоящем документе, хотя и являются пригодными, рассматриваются как непригодные для промышленного получения.
Благодаря высокой активности пиримидиновых производных, в частности PI3K ингибиторов, существует необходимость в улучшенных способах получения данных соединений. В частности, существует необходимость в обеспечении способами, которые соответствуют одному или более из следующих критериев: маштабируемость, безопасность; простота; более высокие выходы и более экономичные по сравнению с известными способами.
Также остается необходимость в новых твердых формах для лечения рака.
Сущность настоящего изобретения
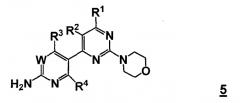
Таким образом, соответственно, настоящее изобретение относится к улучшенным способам получения пиримидиновых производных формулы 5, новых промежуточных соединений, пригодных в данных способах, и способам получения данных промежуточных соединений.
Таким образом, в одном аспекте, настоящее изобретение относится к способу получения соединения формулы
или его стереоизомера, таутомера или соли, где
W представляет собой CRw или N, где Rw выбран из группы, состоящей из (1) водорода, (2) циано, (3) галогена, (4) метила, (5) трифторметила, (6) сульфамидо;
R1 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного или незамещенного алкила, (6) замещенного или незамещенного алкенила, (7) замещенного или незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного или незамещенного гетероарила, (10) замещенного или незамещенного гетероциклила, (11) замещенного или незамещенного циклоалкила, (12) -COR1a, (13) -CO2R1a, (14) -CONR1aR1b, (15) -NR1aR1b, (17) -NR1aSO2R1b, (18) -OCOR1a, (19) -OR1a, (21) -SOR1a, где R1a и R1b независимо выбраны из группы, состоящей из (a) водорода, (b) замещенного или незамещенного алкила, (c) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (e) замещенного или незамещенного гетероциклила и (f) замещенного или незамещенного циклоалкила;
R2 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) гидрокси, (6) амино, (7) замещенного или незамещенного алкила, (8) -COR2a и (9) -NR2aCOR2b, где R2a и R2b независимо выбраны из группы, состоящей из (a) водорода и (b) замещенного или незамещенного алкила;
R3 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного или незамещенного алкила, (6) замещенного или незамещенного алкенила, (7) замещенного или незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного или незамещенного гетероарила, (10) замещенного или незамещенного гетероциклила, 11) замещенного или незамещенного циклоалкила, (12) -COR3a, (13) -NR3aR3b, (14) -NR3aCOR3b, (15) -NR3aSO2R3b, (16) -OR3a, (17) -SR3a, (18) -SOR3a, (19) -SO2R3a, и где R3a и R3b независимо выбраны из группы, состоящей из (a) водорода, (b) замещенного или незамещенного алкила, (c) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (e) замещенного или незамещенного гетероциклила и (f) замещенного или незамещенного циклоалкила; и
R4 выбран из группы, состоящей из (1) водорода и (2) галогена.
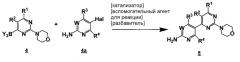
Данный способ («стадия c способа») включает стадию реакции соединения формулы 4
,
где Y2B- представляет собой ациклическую бороновую кислоту, ациклический бороновый эфир или циклический бороновый эфир, предпочтительно ациклический или циклический бороновый эфир, R1 и R2 представляют собой, как определено для формулы 5, с соединением формулы 4a
,
где Hal представляет собой галоген, W, R3 и R4 представляют собой, как определено для соединения формулы 5.
Необязательно, за стадией с) способа может следовать одна или более реакций образования соли (т.е. стадия d) способа). Таким образом, стадию с) способа можно комбинировать со стадией d) способа, как описано ниже. Альтернативно или дополнительно, стадию c) способа можно комбинировать со стадией b) способа или стадиями a) и b) способа. Таким образом, настоящее изобретение относится к способам получения соединения формулы 5, включающим стадию c) способа или стадии b) и c) способа или стадии a) b) и c) способа, в каждом случае необязательно с последующей стадией d) способа. Под комбинированием способов подразумевают, что исходное вещество получают применением предшествующего способа, например, как показано на фигуре. 1. Данное исходное вещество можно применять непосредственно (т.е., без выделения и/или очистки) или после подходящих стадий обработки. Все данные альтернативные варианты включены в настоящее изобретение.
Было обнаружено, что способ, как описано в настоящем изобретении (также включающий конкретные стадии способа), соответствует одному или более из следующих критериев: безопасность; простота; большие выходы и большая экономичность по сравнению с известными способами получения соединений формулы 5. Кроме того, способ, описанный в настоящем изобретении, считают масштабируемым, что делает его подходящим для промышленного получения.
В другом аспекте, настоящее изобретение относится к способу получения соединения формулы 4
,
где
Y2B- представляет собой бороновый эфир;
R1 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного или незамещенного алкила, (6) замещенного или незамещенного алкенила, (7) замещенного или незамещенного алкинила, (8) замещенного или незамещенного арила, (9) замещенного или незамещенного гетероарила, (10) замещенного или незамещенного гетероциклила, (11) замещенного или незамещенного циклоалкила, (12) -COR1a, (13) -CO2R1a, (14) - CONR1aR1b, (15) -NR1aR1b, (17) -NR1aSO2R1b, (18) -OCOR1a, (19) -OR1a, (21) -SOR1a, где R1a и R1b независимо выбраны из группы, состоящей из (a) водорода, (b) замещенного или незамещенного алкила, (c) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (e) замещенного или незамещенного гетероциклила и (f) замещенного или незамещенного циклоалкила;
R2 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) гидрокси, (6) амино, (7) замещенного или незамещенного алкила, (8) -COR2a и (9) -NR2aCOR2b, где R2a и R2b независимо выбраны из группы, состоящей из (a) водорода и (b) замещенного или незамещенного алкила.
Данный способ ("стадия b способа") включает стадию реакции соединения формулы 3
,
где
R1 представляет собой, как определено для соединения формулы 5,
R2 представляет собой, как определено для соединения формулы 5, и
Hal представляет собой галоген,
с бороновым эфир или его производным формулы 6
,
где
Y2B представляет собой бороновый эфир,
X представляет собой водород, гидроксил, C1-C4 алкокси или Y2B, предпочтительно Y2B,
необязательно в присутствии катализатора, такого как Pd2(dba)3/PCy3, необязательно в присутствии разбавителя, необязательно в присутствии вспомогательного агента для реакции, получая соединение формулы 4.
В еще другом аспекте, настоящее изобретение относится к способу получения соединения формулы 3
,
где
R1 представляет собой замещенный или незамещенный гетероцикл,
R2 представляет собой, как определено для соединения формулы 5,
Hal представляет собой галоген.
Данный способ ("стадия a способа") включает стадию реакции соединения формулы 1
,
где
R2 представляет собой, как определено для соединения формулы 5,
Hal представляет собой галоген,
с соединением формулы 2 или смесью различных соединений формулы 2
,
где R1 представляет собой замещенный или незамещенный гетероциклил или их смесь, в двухфазных условиях, необязательно в присутствии вспомогательного агента для реакции, необязательно в присутствии разбавителя, необязательно с последующими стадиями обработки и/или выделения.
В еще другом аспекте, настоящее изобретение относится к соединению формулы 4
или его стереоизомеру, таутомеру или соли, где
R1 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного или незамещенного алкила, (6) замещенного или незамещенного алкенила, (7) замещенного или незамещенного алкинила, (8) замещенного или незамещенного арила, (9) замещенного или незамещенного гетероарила, (10) замещенного или незамещенного гетероциклила, (11) замещенного или незамещенного циклоалкила, (12) -COR1a, (13) -CO2R1a, (14) -CONR1aR1b, (15) -NR1aR1b, (17) -NR1aSO2R1b, (18) -OCOR1a, (19) -OR1a, (21) -SOR1a, где R1a и R1b независимо выбраны из группы, состоящей из (a) водорода, (b) замещенного или незамещенного алкила, (c) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (e) замещенного или незамещенного гетероциклила и (f) замещенного или незамещенного циклоалкила;
R2 выбран из группы, состоящей из (1) водорода, (2) циано, (3) нитро, (4) галогена, (5) гидрокси, (6) амино, (7) замещенного или незамещенного алкила, (8) -COR2a и (9) -NR2aCOR2b, где R2a и R2b независимо выбраны из группы, состоящей из (a) водорода и (b) замещенного или незамещенного алкила;
Y2B представляет собой бороновый эфир.
В другом аспекте, настоящее изобретение относится к реакции образования соли для получения соединения формулы 5a:
где
W, R1, R2, R3 и R4 представляют собой, как определено для соединения формулы 5, и
HX представляет собой кислое соединение для образования аддитивной соли кислоты.
В одном аспекте, настоящее изобретение относится к другому способу получения соединения формулы 5
или его стереоизомера, таутомера, или соли, где
W, R1, R2, R3 и R4 представляют собой, как определено выше для соединения формулы 5;
включающему стадию реакции соединения формулы 3
,
где Hal представляет собой галоген, и R1 и R2 представляют собой, как определено для соединения формулы 5; с соединением формулы B3
,
где -BY2 представляет собой бороновую кислоту, ациклический бороновый эфир, циклический бороновый эфир или трифторборатную соль, и
W, R3 и R4 представляют собой, как определено для соединения формулы 5; и
где R5 выбран из группы, состоящей из (1) водорода, (2) замещенного или незамещенного алкила, (3) замещенного или незамещенного алкилокси, (4) замещенного или незамещенного арила, (5) замещенного или незамещенного арилокси, (6) замещенного или незамещенного арилалкилокси; в условиях реакции Сузуки, и с последующим удалением R5C(O)- группы, давая соединение формулы 5;
необязательно с последующей реакцией образования соли.
В другом аспекте, настоящее изобретение также относится к соединению формулы B3
или его стереоизомеру, таутомеру или соли, где W, R3, R4 и R5 представляют собой, как определено выше, и BY2 представляет собой бороновую кислоту, ациклический бороновый эфир, циклический бороновый эфир или трифторборатную соль.
В еще другом аспекте, настоящее изобретение также относится к способу получения соединения формулы 5,
или его стереоизомера, таутомера или соли, включающему одну или более из следующих стадий:
Стадия A: контакт соединения формулы B1
с реакционной смесью, содержащей растворитель и ангидрид кислоты (R5C=O)2O, так чтобы получить соединение формулы B2
Стадия B: i) контакт соединения формулы B2 с реакционной смесью, содержащей первый растворитель, первое основание и необязательно спиртовую добавку, ii) контакт смеси стадии (i) со вторым растворителем и вторым основанием, iii) контакт смеси стадии (ii) с производным борной кислоты, iv) необязательно контакт смеси стадии (iii) с третьим растворителем и третьим основанием, и затем контакт полученной в результате смеси с производным борной кислоты, и v) необязательно контакт смеси стадии (iii) или стадии (iv) с водой и кислотой, так что получают соединение формулы B3:
Стадия C: контакт соединения формулы B3 с реакционной смесью, содержащей растворитель, основание, катализатор и соединение формулы 3
так что получают соединение формулы B5
Стадия D: контакт соединения формулы B5 с реакционной смесью, содержащей растворитель и агент для удаления R5C(=O)- группы, так что получают соединение формулы 5; необязательно с последующей реакцией образования соли;
где W, R1, R2, R3, R4 и R5 представляют собой, как определено выше;
где Hal представляет собой галоген; и
где -BY2 представляет собой бороновую кислоту, ациклический бороновый эфир, циклический бороновый эфир или трифторборатную соль.
В еще других аспектах, настоящее изобретение относится к конкретным твердым, предпочтительно кристаллическим, формам соединения формулы A, его гидратов, его солей и гидратов и сольватов его солей, и способам получения данных конкретных твердых, предпочтительно кристаллических форм. Твердые формы соединения A настоящего изобретения определяют как полиморфная форма HA и безводная полиморфная форма A, и твердые формы моногидрохлоридной соли соединения A настоящего изобретения определяют как полиморфная форма Ha, полиморфная форма A, полиморфная форма B, полиморфная форма SA, полиморфная форма SB, полиморфная форма Sc, полиморфная форма SD и полиморфная форма SE.
В другом аспекте, настоящее изобретение относится к способу лечения состояний, расстройств или заболеваний, опосредованных активацией PI3K, таких как указанные выше, у нуждающегося в данном лечении субъекта, где способ включает введение указанному субъекту эффективного количества твердой, предпочтительно кристаллической, формы соединения формулы A или его моногидрохлоридной соли (например, полиморфная форма HA, безводный полиморф A, полиморфная форма Ha, полиморфная форма A, полиморфная форма B, полиморфная форма SA, полиморфная форма SB, полиморфная форма Sc, полиморфная форма SD и полиморфная форма SE).
Краткое описание чертежей
Приведенные выше аспекты и многие из сопутствующих преимуществ настоящего изобретения станут более ясны, когда они будут лучше поняты со ссылкой на следующее подробное описание, в сочетании с прилагаемыми чертежами, где:
ФИГУРА 1 показывает общий способ получения соединения формулы 5;
ФИГУРА 2 показывает способ согласно настоящему изобретению для конкретного соединения, 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина.
ФИГУРА 3 показывает известный способ для того же соединения, 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметил-пиридин-2-амина.
На рентгенограммах, обсуждаемых ниже, угол дифракции 2-тета откладывают на горизонтальной оси (x-ось) и относительную интенсивность линии (необработанная интенсивность пика) откладывают на вертикальной оси (y-ось).
ФИГУРА 4 показывает порошковую рентгеновскую дифрактограмму полиморфной формы HA гемигидрата 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 5 показывает порошковую рентгеновскую дифрактограмму полиморфной формы A безводной 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 6 показывает порошковую рентгеновскую дифрактограмму полиморфной формы Ha моногидрата моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 7 показывает порошковую рентгеновскую дифрактограмму полиморфной формы A моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина (гидрохлоридная полиморфная форма A). Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 8 показывает порошковую рентгеновскую дифрактограмму полиморфной формы B моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 9 показывает порошковую рентгеновскую дифрактограмму полиморфной формы SA сольвата моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 10 показывает порошковую рентгеновскую дифрактограмму полиморфной формы SB сольвата моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 11 показывает порошковую рентгеновскую дифрактограмму полиморфной формы Sc сольвата моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 12 показывает порошковую рентгеновскую дифрактограмму полиморфной формы SD сольвата моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 13 показывает порошковую рентгеновскую дифрактограмму полиморфной формы SE сольвата моногидрохлорида 5-(2,6-ди-4-морфолинил-4-пиримидинил)-4-трифторметилпиридин-2-амина. Данные порошковой рентгеновской дифракции получали с помощью Bruker AXS Discover D8 прибора (Madison, WI, USA) с Cu K альфа источником излучения, шаг 0,02°, время цикла 2 минуты, 2 шаг, диапазон 2,00-40,00 (градусы тета) (все 2-тета величины приведены +/- 0,3).
ФИГУРА 14 показывает способ получения соединения 5.
Подробное описание
Известно, что соединения, описанные в настоящем изобретении, обладают PI3K ингибирующими свойствами. Соответственно, данные соединения являются ценными для лечения различных заболеваний, в частности для профилактики или лечения пролиферативных заболеваний. Таким образом, существует большая необходимость в обеспечении улучшенных способов получения данных соединений.
Настоящее изобретение будет более понятно, и цели, отличные от целей, приведенных выше, станут ясны при рассмотрении следующего его подробного описания, включая следующий словарь терминов, заключительные примеры и фигуры. Следующие общие определения следует применять в настоящем описании, если не указано особо:
"Галоген" обозначает фтор, бром, хлор или йод, в особенности бром или хлор. Замещенные галогеном группы и группировки, такие как алкил, замещенный галогеном (галогеналкил), могут быть моно-, поли- или пергалогенированными.
Гетероатомы представляют собой атомы, отличные от углерода и водорода, предпочтительно азот (N), кислород (O) или серу (S), в особенности азот.
Группы, группировки и молекулы, содержащие углерод, содержат 1-12, предпочтительно 1-6, более предпочтительно 1-4, самое предпочтительное 1 или 2, атомов углерода. Любая нециклическая группа или группировка, содержащая углерод, с более чем 1 атом углерода является нормальной или разветвленной.
Приставка "низший" или "C1-C7" обозначает радикал, содержащий вплоть до и включая максимум 7, особенно вплоть до и включая максимум 4 атома углерода, причем рассматриваемые радикалы являются или линейными или разветвленными с одним или несколькими разветвлениями.
"Алкил" относится к алкильным группам, которые не содержат гетероатомов. Таким образом, данная фраза включает нормальные алкильные группы, такие как метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил и подобные. Данная фраза также включает разветвленные изомеры нормальных алкильных групп, включая, но не ограничиваясь, следующие, которые приводятся в качестве примеров: -CH(CH3)2, -CH(CH3)(CH2CH3), -CH(CH2CH3)2, -C(CH3)3, -C(CH2CH3)3, -CH2CH(CH3)2, -CH2CH(CH3)(CH2CH3), -CH2CH(CH2CH3)2, -CH2C(CH3)3, -CH2C(CH2CH3)3, -CH(CH3)-CH(CH3)(CH2CH3), -CH2CH2CH(CH3)2, -CH2CH2CH(CH3)(CH2CH3), -CH2CH2CH(CH2CH3)2, -CH2CH2C(CH3)2, -CH2CH2C(CH2CH3)3, -CH(CH3)CH2.CH(CH3)2, -CH(CH3)CH(CH3)CH(CH3)2, -CH(CH2CH3)CH(CH3)CH(CH3)(CH2CH3) и другие. Таким образом, фраза "алкильные группы" включает первичные алкильные группы, вторичные алкильные группы и третичные алкильные группы. Предпочтительные алкильные группы включают нормальные и разветвленные алкильные группы, содержащие 1-12 атомов углерода или 1-6 атомов углерода.
"Алкилен" относится к тем же самым остаткам, как указано выше для "алкила", но содержащим два положения присоединения. Примерные алкиленовые группы включают этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), диметилпропилен (-CH2C(CH3)2CH2-) и циклогексилпропилен (-CH2CH2CH(C6H13)-).
"Алкенил" относится к нормальным, разветвленным или циклическим группам с от 2 до приблизительно 20 атомами углерода, таким как группы, описанные относительно алкильных групп, как определено выше, за исключением того, что они содержат одну или более углерод-углерод двойных связей. Примеры включают, но не ограничиваются, винил, -CH=C(H)(CH3), -CH=C(CH3)2, -C(CH3)=C(H)2) -C(CH3)=C(H)(CH3), -C(CH2CH3)=CH2, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил и гексадиенил среди других. Предпочтительные алкенильные группы включают нормальные и разветвленные алкенильные группы и циклические алкенильные группы, содержащие 2-12 атомов углерода или 2-6 атомов углерода.
"Алкинил" относится к нормальным, разветвленным или циклическим группам от 2 до приблизительно 20 атомов углерода, таким как группы, описанные относительно алкильных групп, как определено выше, за исключением того, что они содержат одну или более углерод-углерод тройных связей. Примеры включают, но не ограничиваются -C≡C(H), -C≡C(CH3), -C≡C(CH2CH3), -C(H2)C≡C(H), -C(H)2C≡C(CH3) и -C(H)2C≡C(CH2CH3) среди других. Предпочтительные алкинильные групп включают нормальные и разветвленные алкинильные группы, содержащие 2-12 атомов углерода или 2-6 атомов углерода.
Алкильные, алкиленовые, алкенильные и алкинильные группы могут быть замещенными. "Замещенный алкил" относится к алкильной группе, как определено выше, в которой одна или более связей с углеродом (углеродами) или водородом (водородами) заменены связью с атомом, не являющимся водородом или углеродом, таким как, но не ограничиваясь, атом галогена, такой как F, CI, Br и I; атом кислорода в группах, таких как гидроксильные группы, алкокси группы, арилокси группы и эфирные группы; атом серы в группах, таких как тиольные группы, алкил и арилсульфидные группы, сульфоновые группы, сульфонильные группы и сульфоксидные группы; атом азота в группах, таких как амины, амиды, алкиламины, диалкиламины, ариламины, алкилариламины, диариламины, N-оксиды, имиды и енамины; атом кремния в группах, таких как в триалкилсилильные группы, диалкиларилсилильные группы, алкилдиарилсилильные группы и триарилсилильные группы; и другие гетероатомы в различных других группах. Замещенные алкильные группы также включают группы, в которых одна или более связей с атомом углерода (атомами углерода) или водорода (атомами водорода) заменена связью большего порядка (например, двойной или тройной связью) с гетероатомом, таким как кислород в оксо, карбониле, карбоксиле и эфирных группах; азот в группах, таких как имины, оксимы, гидразоны и нитрилы. Замещенные алкильные группы дополнительно включают алкильные группы, в которых одна или более связей с атомом углерода (атомами углерода) или водорода (атомами водорода) заменена связью с арильной, гетероарильной, гетероциклильной или циклоалкильной группой. Предпочтительные замещенные алкильные группы включают, среди других, алкильные группы, в которых одна или более связей с атомом углерода или водорода заменена (заменены) одной или более связями со фтором, хлором или бром. Другой предпочтительной замещенной алкильной группой является трифторметильная группа и другие алкильные группы, которые содержат трифторметильную группу. Другие предпочтительные замещенные алкильные группы включают группы, в которых одна или более связей с атомом углерода или водорода заменена связью с атомом кислорода, так что замещенная алкильная группа содержит гидроксильную, алкокси или арилокси группу. Другие предпочтительные замещенные алкильные группы включают алкильные группы, которые содержат аминовую, или замещенную или незамещенную алкиламиновую, диалкиламиновую, ариламиновую, (алкил)(арил)аминовую, диариламиновую, гетероциклиламиновую, дигетероциклиламиновую, (алкил)(гетероциклил)аминовую или (арил)(гетероциклил)аминовую группу. Еще другие предпочтительные замещенные алкильные группы включают группы, в которых одна или более связей с атомами углерода или водорода заменена связью с арильной, гетероарильной, гетероциклильной или циклоалкильной группой. Примерами замещенного алкила являются: -(CH2)3NH2, -(CH2)3NH(CH3), -(CH2)3NH(CH3)2-CH2C(=CH2)CH2NH2, -CH2C(=O)CH2NH2, -CH2S(=O)2CH3, -CH2OCH2NH2, -CO2H, -CH2OH, -OH, -OCH3, -OC2H5, -OCF3, -OC(=O)CH3, -OC(=O)NH2), -OC(=O)N(CH3)2, -CN, -NO2, -C(=O)CH3, -CO2H, -CO2CH3, -CONH2, -NH2, -N(CH3)2, -NHSO2CH3, -NHCOCH3, -NHC(=O)OCH3, -NHSO2CH3, -SO2CH3, -SO2NH2, галоген.
"Замещенный алкенил" имеет то же значение относительно алкенильных групп, которое замещенные алкильные группы имели относительно незамещенных алкильных групп. Замещенная алкенильная группа включает алкенильные группы, в которых атом, не являющийся углеродом или водородом, соединен с углеродом, соединенным двойной связью с другим углеродом, и группы, в которых один из атомов, не являющихся углеродом или водородом, соединен с углеродом, не включенным в двойную связь с другим углеродом.
"Замещенный алкинил" имеет то же значение относительно алкинильных групп, которое замещенные алкильные группы имели относительно незамещенных алкильных групп. Замещенная алкинильная группа включает алкинильные группы, в которых атом, не являющийся углеродом или водородом, соединен с углеродом, соединенным тройной связью с другим углеродом и группы, в которых один из атомов, не являющихся углеродом или водородом, соединен с углеродом, не включенным в тройную связь с другим углеродом.
"Алкокси" относится к RO-, где R представляет собой алкил. Типичные примеры алкокси групп включают метокси, этокси, трет-бутокси, трифторметокси и подобные.
"Амино" относится в настоящем изобретении к группе -NH2. Термин "алкиламино" относится в настоящем изобретении к группе -NRR', где R представляет собой алкил, и R' представляет собой водород или алкил. Термин "ариламино" относится в настоящем изобретении к группе -NRR', где R представляет собой арил, и R' представляет собой водород, алкил или арил. Термин "аралкиламино" относится в настоящем изобретении к группе -NRR', где R представляет собой аралкил, и R' представляет собой водород, алкил, арил или аралкил.
"Алкоксиалкил" относится к группе -алкил-O-алкил2, где алкил представляет собой алкил или алкенил, и алкил2 представляет собой алкил или алкенил. Термин "арилоксиалкил" относится к группе -алкил-O-арил. Термин "аралкоксиалкил" относится к группе -алкиленил-O-аралкил.
"Алкоксиалкиламино" относится в настоящем изобретении к группе -NR-(алкоксиалкил), где R обычно представляет собой водород, аралкил или алкил.
"Аминокарбонил" относится в настоящем изобретении к группе -C(O)-NH2. "Замещенный аминокарбонил" относится в настоящем изобретении к группе -C(O)-NRR', где R представляет собой алкил, и R1 представляет собой водород или алкил. Термин "ариламинокарбонил" относится в настоящем изобретении к группе -C(O)-NRR', где R представляет собой арил, и R' представляет собой водород, алкил или арил. "Аралкиламинокарбонил" относится в настоящем изобретении к группе -C(O)-NRR1, где R представляет собой аралкил, и R1 представляет собой водород, алкил, арил или аралкил.
"Аминосульфонил" относится в настоящем изобретении к группе -S(O)2-NH2. "Замещенный аминосульфонил" относится в настоящем изобретении к группе -S(O)2-NRR', где R представляет собой алкил, и R' представляет собой водород или алкил. Термин "аралкиламиносульфониларил" относится в настоящем изобретении к группе -арил-S(O)2-NH-аралкил.
"Карбонил" относится к двухвалентной группе -C(O)-.
"Карбонилокси" относится в общем к группе -C(O)-O. Данные группы включают эфиры, -C(O)-O-R, где R представляет собой алкил, циклоалкил, арил или аралкил. Термин "карбонилоксициклоалкил" относится в общем в настоящем изобретении и к "карбонилоксикарбоциклоалкилу" и к "карбонилоксигетероциклоалкилу", т.е., где R представляет собой карбоциклоалкил или гетероциклоалкил, соответственно. Термин "арилкарбонилокси" относится в настоящем изобретении к группе -C(O)-O-арил, где арил представляет собой моно- или полициклический, карбоциклоарил или гетероциклоарил. Термин "аралкилкарбонилокси" относится в настоящем изобретении к группе -C(O)-O-аралкил.
"Сульфонил" относится в настоящем изобретении к группе -SO2-. "Алкилсульфонил" относится к замещенному сульфонилу структуры -SO2R-, в котором R представляет собой алкил. Алкилсульфонильные группы, применяемые в соединениях настоящего изобретения, обычно представляют собой алкилсульфонильные группы, содержащие от 1 до 6 атомов углерода в структуре его остова. Таким образом, типичные алкилсульфонильные группы, применяемые в соединениях настоящего изобретения, включают, например, метилсульфонил (т.е., где R представляет собой метил), этилсульфонил (т.е., где R представляет собой этил), пропилсульфонил (т.е., где R представляет собой пропил) и подобные. Термин "арилсульфонил" относится в настоящем изобретении к группе -SO2-арил. Термин "аралкилсульфонил" относится в настоящем изобретении к группе -SO2-аралкил. Термин "сульфамидо" относится в настоящем изобретении к -SO2NH2.
"Карбониламино" относится к двухвалентной группе -NH-C(O)-, в которой атом водорода амидного азота карбониламиногруппы можно замещать алкильной, арильной или аралкильной группой. Данные группы включают группировки, такие как карбаматные эфиры (-NH-C(O)-O-R) и амиды -NH-C(О)-R, где R представляет собой нормальный или разветвленный алкил, циклоалкил или арил или аралкил. Термин "алкилкарбониламино" относится к алкилкарбониламино, где R представляет собой алкил, содержащий от 1 до приблизительно 6 атомов углерода в структуре его остова. Термин "арилкарбониламино" относится к группе -NH-C(O)-R, где R представляет собой арил. Аналогично, термин "аралкилкарбониламино" относится к карбониламино, где R представляет собой аралкил.
"Гуанидино" или "гуанидил" относится к группировкам, полученным из гуанидина, H2N-C(=NH)-NH2. Данные группировки включают группировки, присоединенные через атом азота, несущий формальную двойную связь ("2"-положение гуанидина, например, диаминометиленамино, (H2N)2C=NH-)) и группировки, присоединенные через один из двух атомов азота, несущих формальную одинарную связь (1 и/или "3"-положения гуанидина, например, H2N-C=NH)-NH-)). Атомы водорода при любом из азотов могут быть заменены подходящим заместителем, таким как алкил, арил или аралкил.
"Амидино" относится к группировкам R-C(=N)-NR'- (причем радикал находится при "N1" азоте) и R(NR')C=N- (радикал находится при "N2" азоте), где R и R' могут представлять собой водород, алкил, арил или аралкил.
"Циклоалкил" относится к моно- или полициклическому, гетероциклическому или