Конденсированные гетероциклические производные в качестве модуляторов s1p
Иллюстрации
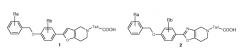
Показать всеИзобретение относится к конденсированному гетероциклическому производному формулы (I), выбранной из структур А, В, С, D и Е, где R1 выбран из (1-4С)алкила; (3-6С)циклоалкила; инданила, необязательно замещенного галогеном; фенила, необязательно замещенного одним - тремя заместителями, независимо выбранными из галогена, циано, (1-4С)алкила, необязательно замещенного одним или несколькими атомами фтора, (1-4С)алкокси, необязательно замещенного одним или несколькими атомами фтора; пиридила, необязательно замещенного одним атомом галогена; Z представляет собой линкерную группу -W-(Cn-алкилен)-Т-, где W связан с R1 и выбран из связи, -О-, -S-, -SO2-, -NH-, -СН=СН-, -С≡С- и транс-циклопропилена; n представляет собой целое число от 0 до 2; Т связан с фрагментом фенилена и выбран из связи, -О-, -S-, -SO2-, -NH-, -СО-, -С=С-, -С≡С- и транс-циклопропилена; R2 представляет собой Н или один или два заместителя, независимо выбранных из галогена, (1-4С)алкила, необязательно замещенного одним - тремя атомами галогена, или (1-4С)алкокси; X выбран из С или N; если X представляет собой С, R3 выбран из Н и (1-4С)алкила, в ином случае R3 отсутствует; Y выбран из NH, О и S; R4 представляет собой (1-4С)алкилен-R5, где один или несколько атомов углерода в алкиленовой группе может быть независимо замещен одним или двумя атомами галогена или (СН2)2, образуя циклопропильную часть, R5 представляет собой -СООН. Также изобретение относится к фармацевтически приемлемым солям соединений формулы (I), фармацевтической композиции, содержащей соединения формулы (I), и применению соединений формулы (I) для изготовления лекарственного средства. Технический результат - соединения формулы (I), проявляющие свойства агонистов рецептора S1P (рецептор сфингозин-1-фосфата). 10 н. и 14 з.п. ф-лы, 1 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым конденсированным гетероциклическим производным, обладающим аффинностью к рецепторам S1P, к фармацевтической композиции, содержащей указанные соединения, а также к применению указанных соединений для получения лекарственного средства для лечения, смягчения или предупреждения заболеваний и состояний, в которые вовлечен любой из рецепторов S1P или в которые вовлечено модулирование эндогенной системы передачи сигнала S1P через любой из рецепторов S1P.
Уровень техники, к которому относится изобретение
Сфингозин-1-фосфат (S1P) является биоактивным сфинголипидом, который опосредует широкое множество клеточных ответов, таких как пролиферация, организация и миграция цитоскелета, сборка адгезионных соединений и прочных контактов и морфогенез. S1P может связываться с представителями семейства генов дифференцировки эндотелиальных клеток (рецепторы EDG), включающего локализованные на плазматической мембране сопряженные с G-белком рецепторы. На сегодняшний день пять представителей этого семейства идентифицировано в качестве рецепторов S1P в различных типах клеток, S1P1 (EDG-1), S1P2 (EDG-5), S1P3 (EDG-3), S1P4 (EDG-6) и S1P5 (EDG-8). S1P может вызывать перестройку цитоскелета во многих типах клеток для регуляции транспорта иммунных клеток, гомеостаза сосудов и сообщения клеток в центральной нервной системе (ЦНС) и в периферических системах органов.
Известно, что S1P секретируется эндотелием сосудов и присутствует в крови в концентрации 200-900 наномоль и связан с альбумином и другими белками плазмы. Это обеспечивает как стабильный резервуар во внутриклеточных жидкостях, так и эффективную доставку к высокоаффинным рецепторам клеточной поверхности. S1P связывается с низкой наномолярной аффинностью с пятью рецепторами S1P1-5. Кроме того, тромбоциты также содержат S1P, и он может локально высвобождаться, вызывая, например, сужение сосудов. Подтипы рецепторов S1P1, S1P2 и S1P3 широко экспрессируются и представляют собой преобладающие рецепторы в сердечно-сосудистой системе. Кроме того, S1P1 также является рецептором на лимфоцитах. Рецепторы S1P4 расположены практически исключительно в гемопоэтической и лимфоидной системах. S1P5 в основном (хотя и не исключительно) экспрессируется в центральной нервной системе. Экспрессия S1P5, по-видимому, ограничивается олигодендроцитами у мышей, миелинизирующими клетками головного мозга, в то время как у крыс и человека была выявлена экспрессия на уровне астроцитов и эндотелиальных клеток, но не на олигодендроцитах.
Модуляторы рецепторов S1P представляют собой соединения, которые передают сигнал в качестве (ант)агонистов на один или несколько рецепторов S1P. Настоящее изобретение относится к модуляторам рецептора S1P5, в частности, к агонистам, и предпочтительно к агонистам с селективностью в отношении рецепторов S1P1 и/или S1P3, ввиду нежелательных сердечно-сосудистых/или иммуномодулирующих эффектов. В настоящее время установлено, что агонисты S1P5 можно использовать для лечения когнитивных нарушений, в частности, связанного со старением снижения когнитивной способности.
Хотя продолжаются исследования по разработке лекарственных средств, которые можно использовать для лечения связанного со старением снижения когнитивной способности и деменции, это еще не привело к множеству успешных кандидатов. Таким образом, существует потребность в новых терапевтических средствах с желаемыми свойствами.
Описание изобретения
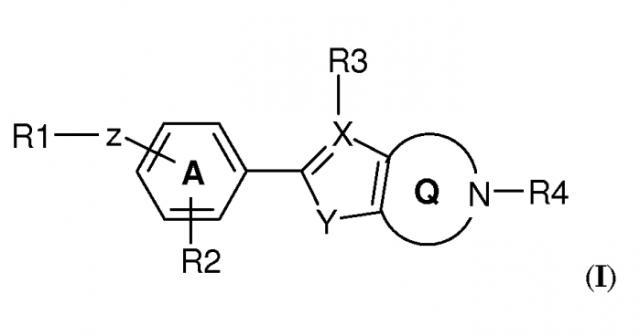
В рамках изобретения было выявлено, что конденсированные гетероциклические производные формулы (I):
Конденсированное гетероциклическое производное формулы (I)
,
где
R1 выбран из
циано,
(2-4C)алкенила, (2-4C)алкинила, (1-4C)алкила, каждый из которых необязательно замещен CN или одним или несколькими атомами фтора,
(3-6C)циклоалкила, (4-6C)циклоалкенила или (8-10C)бициклической группы, каждый из которых необязательно замещен галогеном или (1-4C)алкилом, необязательно замещенным одним или несколькими атомами фтора,
фенила, бифенила, нафтила, каждый из которых необязательно замещен одним или несколькими заместителями, независимо выбранными из галогена, циано, (1-4C)алкила, необязательно замещенного одним или несколькими атомами фтора, (1-4C)алкокси, необязательно замещенного одним или несколькими атомами фтора, амино, диметиламино, и (3-6C)циклоалкила, необязательно замещенного фенилом, который может быть замещен (1-4C)алкилом или галогеном, и
фенила, замещенного фенокси, бензила, бензилокси, фенилэтила или моноциклического гетероцикла, каждый из которых необязательно замещен (1-4C)алкилом,
Z представляет собой линкерную группу-W-(Cn-алкилен)-T-, где
W связан с R1 и выбран из связи, -O-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, -C(CF3)=CH-, -C≡C-, -CH2-O-, -O-CO-, -CO-O-, -CO-NH-, -NH-CO- и транс-циклопропилена;
n представляет собой целое число от 0 до 10; и
T связан с частью фенилена/пиридила и выбран из связи, -O-, -S-, -SO-, -SO2-, -NH-, -CO-, -C=C-, -C≡C- и транс-циклопропилена;
R2 представляет собой H или один или несколько заместителей, независимо выбранных из циано, галогена, (1-4C)алкила, необязательно замещенного одним или несколькими атомами галогена, или (1-4C)алкокси, необязательно замещенного одним или несколькими атомами галогена;
кольцевая структура A может содержать один атом азота;
X выбран из C или N; если X представляет собой C, R3 выбран из H и (1-4C)алкила, в ином случае R3 отсутствует;
Y выбран из NH, O и S;
структура Q представляет собой 5-, 6- или 7-членный циклический амин;
и
R4 представляет собой (1-4C)алкилен-R5, где один или несколько атомов углерода в алкиленовой группе могут быть независимо замещены одним или несколькими атомами галогена или (CH2)2, образуя циклопропильную часть, или R4 представляет собой (3-6C)циклоалкилен-R5, -CH2-(3-6C)циклоалкилен-R5, (3-6C)циклоалкилен-CH2-R5 или -CO-CH2-R5, где R5 представляет собой -OH, -PO3H2, -OPO3H2, -COOH, -COO(1-4C)алкил или тетразол-5-ил;
или его фармацевтически приемлемая соль, сольват или гидрат, или один или несколько их N-оксидов, проявляют аффинность к рецепторам S1P. В частности, соединения по изобретению демонстрируют селективную аффинность к рецептору S1P5 относительно рецептора(ов) S1P1 и/или S1P3.
В WO 2008/012010 некоторые из описанных соединений имеют некоторое структурное сходство с соединениями по настоящему изобретению; однако они описаны в качестве лигандов H3-рецепторов гистамина.
Соединения по изобретению являются модуляторами рецептора S1P, в частности, рецептора S1P5. Более конкретно, соединения по изобретению представляют собой агонисты рецептора S1P5. Соединения по изобретению пригодны для лечения, смягчения и профилактики заболеваний и состояний, в которые вовлечены (любые) рецептор(ы) S1P, в частности S1P5, или в которые вовлечено модулирование эндогенной системы передачи сигнала S1P через любой из рецепторов S1P. В частности, соединения по настоящему изобретению можно использовать для лечения, смягчения или профилактики нарушений ЦНС (центральная нервная система), таких как нейродегенеративные нарушения, в частности, но не ограничиваясь ими, когнитивные нарушения (в частности, связанное со старением снижение когнитивной способности) и родственные состояния, болезнь Альцгеймера, (сосудистая) деменция, болезнь Ниманна-Пика, и нарушение когнитивной способности при шизофрении, обсессивно-компульсивное поведение, большая депрессия и аутизм, рассеянный склероз, боль и т.д. Предпочтительно, соединения по настоящему изобретению можно использовать для лечения, смягчения или профилактики когнитивных нарушений (в частности, связанного со старением снижения когнитивной способности) и родственных состояний.
В предпочтительном варианте осуществления изобретения, соединения имеют формулу (I), где
R1 выбран из
(3-6C)циклоалкила или (8-10C)бициклической группы, необязательно замещенных галогеном, (1-4C)алкила, и
фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из галогена, циано, (1-4C)алкила, (1-4C)алкокси, трифторметила и трифторметокси;
W выбран из связи, -O-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, -C≡C- и транс-циклопропилена; и
n представляет собой целое число от 0 до 4; и предпочтительно n выбран из 0, 1 и 2; и
R2 представляет собой H или один или несколько заместителей, независимо выбранных из галогена, (1-4C)алкила, необязательно замещенного одним или несколькими атомами фтора, или (1-4C)алкокси, необязательно замещенного одним или несколькими атомами фтора;
и где определение других групп/символов является таким, как определено выше.
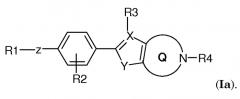
В другом варианте осуществления соединение по изобретению имеет структуру (Ia)
.
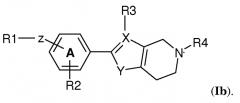
В одном варианте осуществления изобретения кольцевая структура Q представляет собой 6-членное кольцо. В частности, соединение по изобретению имеет структуру (Ib)
В следующем варианте осуществления изобретения R4 выбран из -(CH2)2-OH, -CH2-COOH, -(CH2)2-COOH, -(CH2)3-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH, -CO-CH2-COOH, , 1,3-циклобутилен-COOH, -(CH2)2-PO3H2, -(CH2)3-PO3H2, -(CH2)2-OPO3H2, -(CH2)3-OPO3H2, -CH2-тетразол-5-ила, -(CH2)2-тетразол-5-ила и -(CH2)3-тетразол-5-ила. Предпочтительные группы R4 выбраны из -(CH2)2-COOH, -(CH2)3-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH. Высоко предпочтительными являются -(CH2)2-COOH, -CHCH3-CH2-COOH, -CH2-CHCH3-COOH и 1,3-циклобутилен-COOH. Особенно предпочтительным является -CH2-CHCH3-COOH.
В другом предпочтительном варианте осуществления соединения имеют формулу (I), где Y представляет собой O.
Кроме того, в предпочтительном варианте осуществления изобретения, X представляет собой N.
В предпочтительных вариантах осуществления изобретения R1 представляет собой инданил, необязательно замещенный галогеном, (1-4C)алкилом, или более предпочтительный R1 представляет собой необязательно замещенный фенил, где необязательные заместители выбраны из любого из ранее определенных заместителей, однако, в частности, необязательные заместители представляют собой один или несколько заместителей, независимо выбранных из галогена, циано, (1-4C)алкила, (1-4C)алкокси, трифторметила и трифторметокси. В высоко предпочтительных вариантах осуществления R1 представляет собой 4Cl-фенил или 4CF3-фенил.
В одном из вариантов осуществления изобретения R2 представляет собой H или один или несколько заместителей, независимо выбранных из метила, метокси, хлора или фтора. В предпочтительном варианте осуществления R2 представляет собой H, или R2 представляет собой один метил, один метокси, один атом хлора, один атом хлора, или один или два атома фтора.
В вариантах осуществления изобретения, где X представляет собой CR3, R3 представляет собой предпочтительно H или метил, и, в частности, R3 представляет собой H.
Кроме того, в одном варианте осуществления изобретения Z представляет собой линкерную группу -W-(CH2)n-T-, значение которой выбрано из связи, -O-, -CO-, -S-, -SO2-, -NH-, -CH2-, -(CH2)2-, -CCH3-O-, -CH=CH-, -C≡C-, -CH2-O-, -O-CH2-, -CH2-S-, -S-CH2-, -CH2-SO2-, -SO2-CH2-, -CH2-NH-, -NH-CH2- и транс-циклопропилена. В предпочтительных вариантах осуществления Z представляет собой -O-, -CH2-O- или транс-циклопропилен. В частности, Z представляет собой -CH2-O-.
Термин галоген относится к фтору, хлору, брому или йоду. Предпочтительными галогенами являются фтор и хлор, и в частности хлор.
Термин (1-4C)алкил означает разветвленную или неразветвленную алкильную группу, имеющую 1-4 атомов углерода, например, метил, этил, пропил, изопропил и бутил. Предпочтительной алкильной группой является метил.
Термин (1-4C)алкокси означает алкоксигруппу, имеющую 1-4 атомов углерода, где алкильная часть является такой, как определено выше. Предпочтительной алкоксигруппой является метокси.
Термины (1-4C)алкилен и (Cn-алкилен) означают разветвленную или неразветвленную алкиленовую группу, имеющую 1-4 или n атомов углерода, соответственно, например, метилен, -CHCH3-, -C(CH3)2-, -CHCH3CH2- и т.п. В определении R4, который представляет собой (1-4C)алкилен-R5, один или несколько атомов углерода в алкиленовой группе (среди прочих) может быть независимо замещен (CH2)2, образуя циклопропильную часть, т.е. образуя группу R4, такую как .
Термин (2-4C)алкинил означает разветвленную или неразветвленную алкинильную группу, имеющую 2-4 атома углерода, где тройная связь может присутствовать в различных положениях в группе, например, этинил, пропаргил, 1-бутинил, 2-бутинил и т.д.
Термин (3-6C)циклоалкил означает циклическую группу, имеющую 3-6 атомов углерода, соответственно, циклопропил, циклобутил, циклопентил или циклогексил. Предпочтительными являются циклопентил и циклогексил.
Термин (4-6C)циклоалкенил означает циклическую алкенильную группу, имеющую 4-6 атомов углерода и содержащую одну или две двойных связи, например, циклогексенил.
Термин (3-6C)циклоалкилен означает циклическую алкильную группу, имеющую две точки присоединения. Предпочтительным является 1,3-циклобутилен, имеющий структуру
.
Термин (8-10C)бициклическая группа означает конденсированную кольцевую систему из двух групп, выбранную из ароматических и неароматических кольцевых структур, имеющих вместе 8-10 атомов углерода, например, индановую группу.
Что касается заместителей, термин "независимо" означает, что заместители могут быть одинаковыми или могут отличаться друг от друга в одной и той же молекуле.
Соединения по изобретению можно пригодным образом получать способами, доступными в данной области, и как проиллюстрировано в экспериментальном разделе этого описания.
Соединения по настоящему изобретению могут содержать один или несколько асимметричных центров и, таким образом, могут встречаться в качестве рацематов и рацемических смесей, единичных энантиомеров, диастереомерных смесей и отдельных диастереомеров. Могут присутствовать дополнительные центры асимметрии, в зависимости от природы различных заместителей на молекуле. Каждый такой центр асимметрии независимо обеспечивает два оптических изомера, и подразумевается, что в объем этого изобретения входят все возможные изомеры и диастереомеры в смесях и в качестве чистых или частично очищенных соединений. Подразумевается, что настоящее изобретение охватывает все такие изомерные формы этих соединений. Можно осуществлять независимый синтез диастереомеров или их хроматографическое разделение, как известно в данной области, путем соответствующей модификации методологии, описанной в настоящем описании. Их абсолютную стехиометрию можно определять с помощью рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных соединений, которые являются преобразованными, при необходимости, реагентом, содержащим центр асимметрии с известной абсолютной конфигурацией. Если желательно, можно разделять рацемические смеси соединений, так чтобы выделять отдельные энантиомеры. Разделение можно проводить способами, хорошо известными в данной области, такими как присоединение соединений в рацемической смеси к энантиомерно чистому соединению с образованием диастереомерной смеси, с последующим разделением отдельных диастереомеров стандартными способами, такими как фракционная кристаллизация или хроматография.
Соединения могут существовать в качестве полиморфов, и подразумевается, что они как таковые включены в настоящее изобретение. Кроме того, соединения могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и подразумевается, что такие сольваты также охватываются объемом настоящего изобретения.
Также в объем изобретения входят изотопно меченное соединение формулы (I) или его фармацевтически приемлемые соли, включая соединения формулы (I), изотопно меченные, чтобы они поддавались детекции с помощью PET или SPECT. То же самое справедливо для соединений формулы (I), меченных [13C]-, [14C]-, [3H]-, [18F]-, [125I]- или другими изотопно обогащенными атомами, пригодными для исследований связывания рецепторов или метаболизма.
Термин "фармацевтически приемлемая соль" относится к солям, которые, по мнению медицинского специалиста, пригодны для применения в контакте с тканями человека и низших животных без чрезмерной токсичности, раздражения, аллергического ответа и т.п., и имеют приемлемое соотношение польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Их можно получать in situ при выделении и очистке соединений по изобретению, или отдельно путем их реакции с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты.
Соединения по изобретению можно вводить энтерально или парентерально. Точная доза и режим для этих соединений и их композиций будут зависеть от биологической активности самого соединения, возраста, массы тела и пола пациента, потребности отдельного индивидуума, которому вводят лекарственное средства, степени тяжести или потребности, и мнения практикующего медицинского специалиста. Как правило, парентеральное введение требует более низких дозировок, чем другие способы введения, которые более зависят от всасывания. Однако дозировки для человека предпочтительно составляют 0,001-10 мг на кг массы тела. Как правило, энтеральные и парентеральные дозировки находятся в диапазоне от 0,1 до 1000 мг всех активных ингредиентов в сутки.
Смешанные с фармацевтически приемлемыми добавками, например, как описано в стандартном справочнике “Remington, The Science и Practice of Pharmacy” (21st edition, Lippincott Williams & Wilkins, 2005, см. особенно, Part 5: Pharmaceutical Manufacturing), соединения можно прессовать в твердые дозированные единицы, такие как пилюли или таблетки, или их можно преобразовывать в капсулы или суппозитории. С помощью фармацевтически приемлемых жидкостей соединения также можно применять в форме раствора, суспензии или эмульсии.
Для получения дозированных единиц, например таблеток, предусмотрено использование общепринятых добавок, таких как наполнители, красители, полимерные связующие агенты и т.п. Как правило, можно использовать любую фармацевтически приемлемую добавку, которая не препятствует функции активных соединений.
Пригодные носители, с которым можно вводить соединения по изобретению, включают, например, лактозу, крахмал, производные целлюлозы и т.п., или их смеси, используемые в подходящих количествах. Композиции для внутривенного введения могут представлять собой, например, растворы соединений по изобретению в стерильном изотоническом водном буфере. Когда это необходимо, внутривенные композиции могут включать, например, солюбилизирующие агенты, стабилизаторы и/или местный анестетик для облегчения боли в области инъекции.
Фармацевтические композиции по изобретению можно изготавливать для любого пути введения, и они содержат по меньшей мере одно соединение по настоящему изобретению и его фармацевтически приемлемые соли с любым фармацевтически приемлемым ингредиентом, эксципиентом, носителем, адъювантом или наполнителем.
Под "фармацевтически приемлемым" понимают, что носитель, разбавитель или эксципиент должны быть совместимы с другими ингредиентами состава и не должны быть вредоносными для их реципиента.
В одном варианте осуществления изобретения предусмотрена фармацевтическая упаковка или набор, содержащие один или несколько контейнеров, заполненных одной или несколькими фармацевтическими композициями по изобретению. К такому контейнеру(ам) могут прилагаться различные письменные материалы, такие как инструкции по применению, или указание в форме, предписанной правительственным учреждением, регулирующим изготовление, применение или продажу фармацевтических продуктов, которое отражает одобрение учреждением изготовления, применения или продажи для введения человеку или ветеринарного введения.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится это изобретение. Хотя при применении на практике или исследовании настоящего изобретения можно использовать способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем описании, пригодные способы и материалы описаны в настоящем описании.
ПЕРЕВОД НАДПИСЕЙ НА ЧЕРТЕЖАХ:
Фиг. 1. Процентное изменение у молодых и пожилых самцов мышей C57BL/6J в T-лабиринте либо в случае носителя (контрольные группы), либо в случае соединения по изобретению (доза мг/кг; п. о.)
Представленные ниже примеры предназначены для дальнейшей более подробной иллюстрации изобретения.
Любое новое промежуточное соединение, описанное в настоящем описании, является дополнительным вариантом осуществления настоящего изобретения.
ПРИМЕРЫ
§1. АНАЛИТИЧЕСКИЕ СПОСОБЫ
Спектры ядерного магнитного резонанса (1H-ЯМР и 13C-ЯМР, APT) определяли в указанном растворителе с использованием Bruker ARX 400 (1H: 400 МГц, 13C: 100 МГц) при 300 K, если нет иных указаний. Эксперименты 19F-ЯМР и 13C-ЯМР проводили на спектрометре Varian Inova 500 при 11,74 T (499,9 МГц для 1H; 125,7 МГц для 13C; 50,7 МГц, 470,4 МГЦ для 19F) с использованием 5-мм зонда SW. Спектры определяли в дейтерированном хлороформе или DCM, полученных от Cambridge Isotope Laboratories Ltd. Химический сдвиг (δ) приведен в м.д. в сторону слабого поля относительно тетраметилсилана (1H, 13C) или CCl3F (19F). Константы взаимодействия J приведены в Гц. Формы пиков в спектрах ЯМР обозначены с помощью символов “кв” (квартет), “дкв” (двойной квартет), “т” (триплет), “дт” (двойной триплет), “д” (дублет), “дд” (двойной дублет), “с” (синглет), “уширенный спектр” (уш.с) и “м” (мультиплет). Сигналы NH и OH идентифицировали после смешения образца с каплей D2O.
Флэш-хроматография относится к очистке с использованием указанного элюента и силикагеля (силикагель либо Acros: 0,030-0,075 мм, либо Merck 60: 0,040-0,063 мм).
Колоночную хроматографию проводили с использованием силикагеля 60 (0,063-0,200 мм, Merck).
Мониторинг реакций проводили с использованием тонкослойной хроматографии (TLC) на покрытых диоксидом кремния пластмассовых листах (предварительно покрытый силикагель 60 F254, Merck) с указанным элюентом. Пятна визуализировали с помощью УФ-света (254 нм) или I2.
Температуры плавления регистрировали на устройстве для определения температуры плавления Büchi B-545.
Жидкостная хроматография-масс-спектрометрия (LC-MS):
- Способ A.
Система LC-MS состоит из µ-насоса Waters 1525. Насос соединен с автоматическим пробоотборником Waters 2777.
Способ LC представляет собой:
| стадия | общее время | поток (мкл/мин) | A(%) | B(%) |
| 0 | 0,2 | 1600 | 90 | 10 |
| 1 | 2,5 | 1600 | 0 | 100 |
| 2 | 2,8 | 1600 | 0 | 100 |
| 3 | 2,9 | 1600 | 90 | 10 |
| 4 | 3,10 | 1600 | 90 | 10 |
| 5 | 3,11 | 500 | 90 | 10 |
| A=100% вода с 0,2% HCOOHB=100% ACN с 0,2% HCOOH |
Автоматический пробоотборник имеет 10-мкл инжекционную петлю; объем инжекции составляет 10 мкл. Автоматический пробоотборник соединен с колонкой Waters Sunfire C18, 30*4,6 мм, с 2,5-мкм частицами. Колонка термостатируется при комнатной температуре +/- 23°C.
Колонка соединена с Waters 2996 PDA. Сканирование длины волны происходит от 240 до 320 нм. Разрешение составляет 1,2 нм и частота взятия образца составляет 20 Гц. После PDA поток разделяется 1:1 и соединяется с Waters 2424 ELSD.
ELSD имеет следующие параметры:
Давление газа: 40 фунт/кв. дюйм
Скорость передачи данных: 20 точек/с
Усиление: 500
Константа времени: 0,2 с
Режим распылителя: охлаждение
Пролетная трубка: 50°C
Образцы также исследовали с помощью детектора масс Waters ZQ.
Масс-спектрометр имеет следующие параметры:
Диапазон сканирования: 117-900 а.е.м.
Полярность: положительная
Формат данных: центроидный
Время на сканирование: 0,500 с
Время между сканированиями: 0,05 с
Капилляры: 2,5 кВ
Конус: 25 В
Экстрактор: 2 В
RF-линза: 0,5 В
Температура источника: 125°C
Температура десольватации: 400°C
Газ в конусе: 100 л/ч
Газ десольватации: 800 л/ч
Разрешение LM 1: 15
Разрешение HM 1: 15
Энергия ионов: 0,5
Усилитель: 500 В
Вся система контролируется Masslynx 4.1.
- Способ B.
Система LC-MS состоит из 2 микронасосов Perkin Elmer серии 200. Насосы соединены друг с другом с помощью 50-мкл T-образного смесителя. Смеситель соединен с автоматическим пробоотборником Gilson 215.
Способ LC представляет собой:
| Стадия | общее время | поток (мкл/мин) | A (%) | B (%) |
| 0 | 0 | 1800 | 95 | 5 |
| 1 | 1,8 | 1800 | 0 | 100 |
| 2 | 2,6 | 1800 | 0 | 100 |
| 3 | 2,8 | 1800 | 95 | 5 |
| 4 | 3,0 | 1800 | 95 | 5 |
| A=100% вода с 0,1% HCOOHB=100% ацетонитрил с 0,1% HCOOH |
Автоматический пробоотборник имеет 2-мкл инжекционную петлю. Автоматический пробоотборник соединен с колонкой Waters Sunfire C18, 30*4,6 мм, с 2,5-мкм частицами. Колонка термостатируется в термостате колонки Perkin Elmer серии 200 при 23°C. Колонка соединена с измерительным устройством Perkin Elmer 785 UV/VIS meter с 2,7-мкл проточной ячейкой. Длина волны установлена на 254 нм. Измерительное устройство в УФ-диапазоне соединено с масс-спектрометром Sciex API 150EX. Масс-спектрометр имеет следующие параметры:
Диапазон сканирования: 100-900 а.е.м.
Полярность: положительная
Режим сканирования: профильный
Разрешение Q1: единицы
Размер шага: 0,10 а.е.м.
Время на сканирование: 0,500 с
NEB: 10
CUR: 10
IS: 5200
TEM: 325
DF: 30
FP: 225
EP: 10
Детектор рассеяния света соединен с Sciex API 150. Детектор рассеяния света представляет собой Polymer Labs PL-ELS 2100, действующий при 70°C и давлении N2 1,7 бар.
Вся система контролируется компьютером Dell precision GX370, работающем на Windows 2000.
Описанное время удержания в таблице 1 (Rt) приведено для пика на хроматограмме общего ионного тока (TIC), которая показывала массу для [M+H]+ с точностью в пределах 0,5 а.е.м. от вычисленной точной ММ и имела ассоциированный пик в хроматограмме испарительного рассеяния света (ELS) с относительной площадью % (чистотой) >85%.
§2. СОКРАЩЕНИЯ
| ACE-Cl | 1-хлорэтилхлорформиат |
| 9-BBN | 9-борабицикло[3.3.1]нонан димер |
| CHCl3 | Хлороформ |
| CH2Cl2 | Дихлорметан |
| CH3CN | Ацетонитрил |
| CuBr2 | Бромид меди(II) |
| DBU | 1,8-Диазабицикло[5.4.0]ундец-7-ен |
| DIAD | Диизопропилазодикарбоксилат |
| DIPEA | N,N-диизопропилэтиламин |
| DMF | N,N-диметилформамид |
| ДМСО | Диметилсульфоксид |
| Et3N | Триэтиламин |
| Et2O | Диэтиловый эфир |
| EtOH | Этанол |
| EtOAc | Этилацетат |
| HCl | Хлористоводородная кислота |
| K2CO3 | Карбонат калия |
| KHCO3 | Бикарбонат калия |
| KI | Йодид калия |
| KOH | Гидроксид калия |
| KOtBu | Трет-бутоксид калия |
| MeOH | Метанол |
| NaBH4 | Боргидрид натрия |
| NaHCO3 | Бикарбонат натрия |
| NaI | Йодид натрия |
| NaOH | Гидроксид натрия |
| NaOtBu | Трет-бутоксид натрия |
| Na2SO4 | Сульфат натрия |
| NBS | N-бромсукцинимид |
| iPr2O | Диизопропиловый эфир |
| к.т. | Комнатная температура |
| SiO2 | Силикагель |
| TFA | Трифторуксусная кислота |
| THF | Тетрагидрофуран |
| TMSCl | Хлортриметилсилан |
| TMSOTf | Триметилсилилтрифторметансульфонат |
§3. ОСНОВНЫЕ АСПЕКТЫ СИНТЕЗА
Пригодные способы синтеза заявленных соединений описаны ниже.
Для синтеза соединений 1 описаны два пути, соответственно, на схемах 2 и 3. Оба пути начинаются с соединения 6, синтез которого представлен на схеме 1. Альфа-алкилирование пирролидин-енамина 4 альфа-бром-ацетофенонами (3), тем самым, вводящее Rb-группу в молекулу, дает соединение 5. Последующие замыкание кольца 5 в кислотных условиях дало соединение 6 с достаточным выходом.
Схема 1. Синтез ключевого промежуточного соединения 6
Путь A (см. схему 2) начинается алкилированием пиперидиновой части в 6 путем либо стандартного алкилирования, либо восстановительного алкилирования, либо реакции присоединения Майкла, с получением соединений 7 с защищенной карбоновой кислотой. Часть бензилового простого эфира может быть введена двумя путями. Во-первых, бром в 7 можно прямо превращать в производное бензилового эфира 9 с помощью катализируемой палладием реакции. Кроме того, бромид 7 можно конвертировать в производное фенола 8 через опосредуемую палладием реакцию. Соединение 8 можно конвертировать в желаемые производные бензилового эфира 9 в условиях фазового переноса с бензилбромидами или через реакцию Мицунобу с бензиловыми спиртами. Наконец, из соединений 9 можно удалять защитную группу с получением конечных продуктов 1.
Схема 2. Путь A к соединениям 1
Альтернативно, для синтеза соединений 1 можно следовать пути B (см. схему 3). Пиперидин в соединении 6 защищали группой BOC. После этого, сначала часть бензилового простого эфира вводили либо путем прямой опосредуемой палладием реакции брома в 10 с 12, либо через преобразование брома в фенольное производное 11, которое можно было конвертировать в 12 в условиях алкилирования или Мицунобу. Наконец, соединение 12 можно было конвертировать в 9 удалением кислотой группы BOC и последующим введением защищенных концевых частей карбоновых кислот.
Схема 3. Путь B к соединениям 1
Для синтеза оксазолопроизводных 2 было разработано три пути. Синтез ключевого промежуточного соединения 20 представлен на схеме 4. Ацилирование коммерчески доступного 14 надлежащим образом защищенным бензоилхлоридом (15) дало 16, которое затем подвергали замыканию кольца до 17 с использованием трифенилфосфина и гексахлорэтана. Метилирование пиридина в 17 в четвертичную соль 18 и последующее восстановление 18 боргидридом натрия дали соединение 19. Соединение 19 деметилировали 1-хлорэтилхлорформиатом с получением ключевого промежуточного соединения 20.
Схема 4. Синтез соединений 20
Первый путь (путь C) к соединениям 2 представлен на схеме 5, и он начинается с соединения 20. Аналогично тому, как описано для синтеза соединений 7 в фуранильной серии, в 20 можно вводить концевые части в виде защищенных трет-бутилом карбоновых кислот с получением 21. Начиная с 21, производные бензилового эфира 23 можно получать либо путем прямой опосредуемой палладием реакции сочетания (от 21 к 23) с бензиловыми спиртами, либо путем первоначального преобразования бромида в 21 в фенол 22 и последующего бензилирования 22 (до 23) в условиях фазового перехода или Мицунобу. Наконец удаление защитной группы кислотой из карбоновой кислоты в 23 давало соединения 2.
Схема 5. Путь к соединениям 2
Альтернативно, можно следовать пути D, как представлено на схеме 6. Соединения 25 можно получать, начиная с 14 и надлежащим образом замещенного производного 4-бензилоксибензойной кислоты (24) под действием трифенилфосфина и трихлорацетонитрила. Соединение 25 можно конвертировать в бензилоксипроизводные 23 аналогично тому, как описано выше на схемах 4 и 5 для синтеза соединений 21. Таким образом, метилирование 25 и последующее восстановление NaBH4 дали 26, которое деметилировали с помощью ACE-Cl с получением 27. Наконец, в 27 вводили концевые части с получением соединения 23. После этого, трет-бутильную группу в 23 можно было удалить в кислотных условиях с получением соединения 2. С другой стороны, бензил в 23 можно удалять гидрогенизацией с получением фенольных производных 22.
Схема 6. Путь D к соединениям 2
И, наконец, третий путь (путь E) к соединениям 2 представлен на схеме 7. Соединение 20 защищали трет-бутилоксикарбонильной группой с получением 28, которое можно было конвертировать в соответствующий фенол (29) в стандартных условиях с палладием. Алкилирование 29 в условиях фазового переноса или Мицунобу дало 30. С другой стороны, соединение 30 также можно было получить непосредственно из бромида 28 в условиях присутствия химического реагента с палладием. Удаление кислотой группы BOC в 30 привело к образованию соединения 27, которое можно было алкилировать в 23, как описано на схеме 5.
Схема 7. Путь E для синтеза соединений 2
Схема 8
Тиазолопроизводные 508 и 520 синтезировали, как описано на схеме 8 и 9. Корректирование R-групп в реагентах приводит к введению Ra, Rb и Rc.
Схема 9
Путь синтеза в направлении ряда альтернативных концевых частей и линкеров представлен на схеме 10.
Схема 10
Для специалистов в данной области очевидно, что выбор определенного пути может быть основан на доступности реагентов. Кроме того, пути B, D и E в высокой степени подходят для внесения разнообразия в Rc-концевую часть соединений 1 и 2. В путях A и C введение части Ra-Bn происходит в последней части синтеза, что делает их более подходящими для исследования разнообразия в этой части молекулы.
§4. СИНТЕЗ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Общая методика синтеза соединений 5. К раствору трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты в толуоле (2 мл/ммоль) добавляли каталитическое количество пара-толуолсульфоновой кислоты моногидрата (0,1 экв.) и пирролидин (4 г. э.). Смесь нагревали до температуры кипения с обратным холодильником в условиях Дина-Старка в течение 18 часов. Смесь концентрировали при пониженном давлении, и осадок перерастворяли в толуоле. К этому раствору медленно добавляли (в течение 25 минут) раствор надлежащим образом замещенного 2-бром-1-(4-бром-фенил)этанона (1,05 экв.) в толуоле/DCM (2 мл/ммоль, ½, об./об.). Смесь перемешивали в течение ночи при комнатной температуре и полученную белую взвесь выливали в воду. Водный слой экстрагировали DCM (3 раза), и объединенные органические слои сушили (MgSO4), а затем концентрировали при пониженном давлении. Полученное масло очищали хроматографией на силикагеле с получением соединения 5 с выходом 50-90%.
Общая методика синтеза соединений 6. Соединение 5 суспендировали в концентрированной хлористоводородной кислоте (10 экв., 12 Н). Смесь нагревали (с шагом 10°C в 30 минут) до 80°C. Смесь начинает интенсивно пениться, следовательно, следует обеспечить достаточно объема в исходной реакционной емкости. Через 45 минут смесь охлаждали до 0°C и нейтрализовывали 50 масс. % раствором NaOH (экзотермическая реакция). После перемешивания в течение ночи при комнатной температуре полученный твердый материал собирали фильтрацией и промывали 0,1 M NaOH. Светло-коричневый материал очищали путем экстракции с помощью Soxhlet в EtOAc с получением 6 в виде бежевого твердого вещества, которое использовали на следующей стадии без дальнейшей очистки.
Общая методика введения концевых частей в виде защищенных карбоновых кислот (7).
a) Введение трет-бутилового эфира пропионовой кислоты. Со