Способ получения рекомбинантного полипептида
Иллюстрации
Показать всеПредложен способ получения рекомбинантного полипептида. Способ включает культивирование клеток CHO в среде с общим содержанием аминокислот от около 40 до примерно 100 мМ при условиях, включающих в себя, по крайней мере, один температурный сдвиг и, по крайней мере, один сдвиг pH, и экспрессирование рекомбинантного полипептида. При этом выращивание клеток осуществляют при температуре от 33°C до 38°C в течение, по крайней мере, 3 дней, с последующим изменением температуры до 30°C-37°C. Выращивание клеток осуществляют при pH 6,8-7,5, по крайней мере, 2 дня, и pH с последующим изменением значений рН до 6,0-7,1. Причем клетки поддерживают при 30°C-37°C в течение, по крайней мере, еще 2 дней, а при рН 6,0-7,1 - по крайней мере, 1 день. Изобретение обеспечивает уменьшение гибели клеток, увеличение выхода целевого продукта и улучшения его качества. 13 з.п. ф-лы, 9 ил., 3 табл., 3 пр.
Реферат
Техническая область изобретения
Изобретение относится к основной области биотехнологии, в частности к культивированию клеток и их применению для получения полипептидов в промышленных масштабах.
Настоящее изобретение предоставляет способы культивирования клеток, характеризующиеся, по крайней мере, одним температурным сдвигом и, по крайней мере, одним сдвигом pH. Эти способы пригодны для культивирования клеток с высокой клеточной жизнеспособностью, предпочтительно клеток млекопитающих, таких как клетки СНО. Способы культивирования клеток в соответствии с настоящим изобретением также позволяют получить высокие продуктивности полипептидов при использовании для получения полипептида, в частности, путем рекомбинантной экспрессии полипептидов в системах культур клеток млекопитающих, особенно в промышленных масштабах.
Технические предпосылки изобретения
В течение последних двух десятилетий подготовка полипептидов с помощью рекомбинантной технологии разработана до стандартной процедуры. Возможность получения рекомбинантных полипептидов путем клонирования генов, кодирующих соответствующие полипептиды, с последующей трансформацией экспрессируемым геном подходящих для экспрессии хозяев и конечными продуцированием и очисткой полученного рекомбинантного полипептидного продукта обеспечила доступ к совершенно новому классу биологически разработанных и полученых терапевтических средств.
В фармацевтической промышленности фармацевтически активные соединения подготавливали в возрастающих количествах с использованием технологии рекомбинантных ДНК, с последующими способами получения, разработанными в области биоинженерии.
Такие биологические продукты включают моноклональные антитела, которые были разработаны в важных вариантах лечения в различных областях медицины, включая аутоиммунные заболевания, воспалительные заболевания, иммунодепрессию, онкологию и тому подобное.
Развитие таких лечебных препаратов биологического происхождения требует получения в промышленном масштабе, что обеспечивает доступ к большим количествам рекомбинантного полипептида. Предпочтительными системами экспрессии являются культуры клеток млекопитающих, которые превосходят большинство других эукариотических систем, основанных на клетках насекомых, дрожжей или подобных, или даже традиционные прокариотические системы экспрессии.
Однако культура клеток млекопитающих несет в себе огромные проблемы, особенно в промышленном масштабе. Производственные мощности для культивирования клеток млекопитающих требуют тщательной оптимизации многих условий способа.
В частности, способы культивирования клеток для получения полипептидов в клетках млекопитающих требуют постоянной оптимизации условий культивирования и их адаптации к конкретным клеточным линиям или продуктам, в целях достижения высокого волюметрического выхода продукции в сочетании с оптимальным качеством продукции.
Много предварительных усилий было сконцентрировано на основных параметрах среды для культивирования клеток, включая их состав, касающихся, в частности, видов и концентраций ионов, аминокислот, витаминов и микроэлементов или осмолярности среды. Дополнительные важные параметры, которые были в фокусе исследований, например, представляют собой питательную композицию или графики подпитки для достижения оптимального роста клеток.
Кроме того, температура и pH в качестве основных физиологических параметров, как известно, оказывают существенное влияние на культивирование клеток млекопитающих. Температура в целом существенно влияет на состояние роста и жизнеспособность клеток. В дополнение к этому, можно также, впрочем, более специфически воздействовать на полипептидный продукт и его характеристики путем изменения, например, гликозилирования (US 2003/0190710 A1; EP 1373547 A1; US 2004/0214289 A1).
pH, при котором поддерживаются среда рост и клетки, также может оказывать влияние и изменять рост клеток и продукцию полипептидов специфическим способом, который зависит от конкретной линии клеток и продукта (Sauer et al. Biotechnology and Bioengineering 2000, Vol 67, pg. 586-597; Yoon et al., Biotechnology and Bioengineering 2004, Vol 89, pg. 346-356; Kuwae et al., Journal of Bioscience and Bioengineering 2005, Vol 100, pg. 502-510).
За время культивирования требования к клеткам могут изменяться. Если вначале выгодно оптимизировать условия, направленные на усиление клеточного роста, то на более поздних стадиях становится важным повышение выживаемости клеток и поддержание плотности жизнеспособных клеток в связи с получением высоких титров продукта. В этой связи было предложено введение одной или нескольких температурных стадий во время клеточного культивирования (Chen et al., J Biosci Bioeng. 2004, 97 (4):239-43). Для этого клетки млекопитающих культивируют, по крайней мере, при двух различных температурах, где первая, более высокая температура оптимизирована для роста клеток, в то время как вторую или третью, пониженную температуру выбирают в целях повышения продуктивности клеток (например, Weidemann et al., Cytotechnology. 1994; 15(1-3); 111-6; WO 00/36092; EP 0764719 A2, US 2005/019859, EP 1575998, US 2008/081356). Другие документы описывают применение температурных стадий в сочетании с дополнительными специфическими свойствами среды. Например, EP 1757700 A2 раскрывает температурную стадию в сочетании с присутствием бутиратных солей в качестве компонента среды, а EP 1789571 A1 описывает температурную стадию в сочетании с определенным содержанием аминокислот.
Также были изменены другие условия клеточного культивирования. US 5856179 внедрил способ продуцирования полипептидов в клеточной культуре с подпиткой, где во время культивирования осмолярность среды значительно изменялась в пределах 280-330 мОсм в основной фазе роста примерно до 400-600 мОсм в продуктивной стадии.
В WO 02/101019 рассматривалось много специфичных компонентов сред, таких как концентрации глутамина и глюкозы, в том числе изменения температуры и pH. При этом было установлено, что изменение рН у среды с высокой глюкозой оказывает негативное воздействие на культуру и что не рекомендуется снижение рН во время роста или стадии продуцирования.
WO 2006/026445 раскрывает способ получения полипептидов, где условия культивирования клеток меняют от одного набора условий культивирования на второй набор и где эти изменения сочетаются с конкретными особенностями среды, связанными с содержанием определенных аминокислот. Изменение условий, в частности, относится к изменениям в температуре. Другие изменения в условиях, таких как pH или осмолярность, обычно упоминаются в качестве дополнительных опций, однако конкретные установки параметров не указываются.
Учитывая вышеуказанные проблемы и имеющиеся недостатки, в области промышленной биотехнологии существует постоянная потребность в усовершенствовании способов культивирования, которые позволяют получать рекомбинантные полипептиды в промышленных масштабах с еще более высокими выходами, т.е. с улучшенной специфической продуктивностью и продуктивностью в целом, и повышенным качеством продукции.
Конкретной технической целью способов получения полипептидов является поддержание высокой жизнеспособности клеток и максимальное увеличение конечного выхода полипептида путем оптимизации параметров общего способа культивирования клеток.
Краткое описание изобретения
Настоящее изобретение относится к комбинированию сдвигов температуры и pH в способе получения рекомбинантных полипептидов. Адаптированные к потребностям рекомбинантных клеток, в частности клеток СНО, определенные комбинации этих двух параметров приводят к повышению продуктивности клеток, а также к повышению качества продукции полученных рекомбинантно полипептидов. В частности, в настоящем изобретении найден положительный эффект на основе конкретных расчетов времени и графиков сдвигов температуры и pH в абсолютном и относительном выражении, а также в отношении конкретной величины сдвигов.
В соответствии с одним аспектом изобретения, раскрывается способ получения рекомбинантного полипептида, включающий культивирование клеток СНО в среде и экспрессирование рекомбинантного полипептида, где температура и рН изменяются во время способа.
В частности, способ в соответствии с настоящим изобретением включает, по крайней мере, один температурный сдвиг и, по крайней мере, один сдвиг pH. В одном варианте осуществления настоящего изобретения сдвиг от первой более высокой ко второй более низкой температуре осуществляется после того, как клетки сначала выращивают и поддерживают в течение, по крайней мере, 3 дней, альтернативно, по крайней мере, 4 дней, или, по крайней мере, 5 дней при первой температуре. Вторая более низкая температура ниже, чем первая температура, на величину от 1 до около 8°C. В другом альтернативном варианте осуществления настоящего изобретения изменение температуры составляет, например, от около 2 до около 5°C, в частности, около 4°C или около 3,5°C. Вторая температура затем поддерживается, по крайней мере, два дня. Вторая температура может поддерживаться до сбора клеток, выросших в культуре.
В соответствии с одним из вариантов осуществления настоящего изобретения первая температура предпочтительно находится в диапазоне от примерно 33°C до около 38°C, а вторая температуры предпочтительно находится в диапазоне от примерно 30°C до около 37°C.
В дополнение к сдвигу температуры изменяется также и рН от первого ко второму pH. Таким образом, способы в соответствии с настоящим изобретением включают, по крайней мере, один сдвиг pH. В частности, клетки выращиваются при первом значении рН в течение, по крайней мере, 2 дней, и затем переводятся на второе значение рН, которое ниже первого значение рН на величину от около 0,05 до около 1 единицы рН, и клетки выращивают при указанном втором значении pH в течение, по крайней мере, 1 дня, альтернативно, в течение, по крайней мере, 2 дней. В некоторых вариантах осуществления второй pH будет сохраняться вплоть до сбора клеток, выросших в культуре.
Первое значение рН предпочтительно находится в диапазоне от примерно pH 6,8 до примерно pH 7,5. Второе значение рН предпочтительно находится в диапазоне от примерно pH 6,0 до примерно pH 7,1.
Таким образом, один вариант осуществления настоящего изобретения представляет собой способ получения рекомбинантного полипептида, включающий культивирование клеток СНО в среде при условиях, включающих, по крайней мере, один температурный сдвиг и, по крайней мере, один сдвиг pH, и экспрессирование рекомбинантного полипептида,
где
- выращивание клеток осуществляют при первой температуре в течение, по крайней мере, 3 дней, с последующим изменением температуры до второй температуры, которая на 1 - около 8°С ниже, чем первая температура, причем клетки поддерживают при указанной второй температуре в течение, по крайней мере, еще 2 дней;
- выращивание клеток осуществляют при первом значении pH в течение, по крайней мере, 2 дней, с последующим изменением рН до второго значения рН, которое на 0,05 - около 1 единицы рН ниже, чем первое значение рН, причем выращивание клеток осуществляют при указанном втором значении pH в течение, по крайней мере, 1 дня.
Способ в соответствии с настоящим изобретением может необязательно включать второй сдвиг pH, который следует за первым сдвигом рН через, по крайней мере, 1 день. Если за первым сдвигом pH следовал второй сдвиг pH через, по крайней мере, 1 день, то третье значение pH превышает второе значение рН на около 0,05 единиц рН - около 1 единицы pH. Третье значение pH может поддерживаться до сбора клеток, выросших в культуре.
Способ клеточного культивирования в соответствии с настоящим изобретением включает активные и/или пассивные сдвиги pH, т.е. pH изменяется «активно» путем изменения заданного значения рН на новое значение, и/или «пассивно» путем предоставления возможности изменения рН среды при помощи накопления продуктов метаболизма, следуя, таким образом, конкретному метаболическому профилю pH клеточной культуры в пределах заранее определенного диапазона pH. В предпочтительном варианте осуществления изобретения активный сдвиг индуцируют путем добавления соответствующего, известного специалистам в рассматриваемой области агента(ов), изменяющего и регулирующего рН, такого как кислота, например, HCl, или основание, например NaOH. В дополнительном предпочтительном варианте осуществления способа это достигается путем определения одного заданного значения pH и зоны нечувствительности, где pH позволено изменяться. В отличие от активного сдвига пассивный сдвиг или изменение pH не индуцируется путем добавления соответствующего, изменяющего рН агента(ов).
В дополнительном аспекте способ по изобретению осуществляют с помощью среды, которая не содержит белков и сыворотки. Предпочтительно, среда характеризуется общим содержанием аминокислот приблизительно от 40 мМ до около 100 мМ, в качестве альтернативы, приблизительно от 50 до около 100 мМ.
Предпочтительный способ, как определено выше, осуществляется способом подпитываемой культуры, включающий подпитку, по крайней мере, двумя питательными растворами, которые добавляются к культуре. В таком способе, например, один из питательных растворов, добавляемых к культуральной среде, представляет собой подпитку, содержащую дипептид цистин и аминокислоту тирозин. Кроме того, предпочтительно, чтобы эта подпитка включала дипептид цистина и аминокислоту тирозин в соответствующих концентрациях в диапазоне от около 6,5 г/л до около 8,0 г/л, и в диапазоне от около 9 г/л и до 11 г/л в водном растворе с щелочным рН выше 10. В частности, концентрации могут составлять около 7,25 г/л для цистина и около 10,06 г/л для тирозина. В предпочитаемом варианте осуществления питательный раствор, содержащий цистеин и тирозин, добавляют к культуральной среде в диапазоне от около 0,2 до около 0,8% мас. от исходной массы культуральной среды в день или, альтернативно, около 0,4% мас. от исходной массы клеточной культуральной среды в день.
Способ в соответствии с изобретением используется преимущественно для получения рекомбинантного полипептида, который является гликозилированным. В соответствии с конкретными вариантами осуществления, полипептид представляет собой антитело или фрагмент антитела.
Краткое описание чертежей
В изобретении будет проще разобраться на основе следующих примеров и фигур. Примеры, однако, не предназначены для ограничения сферы действия изобретения.
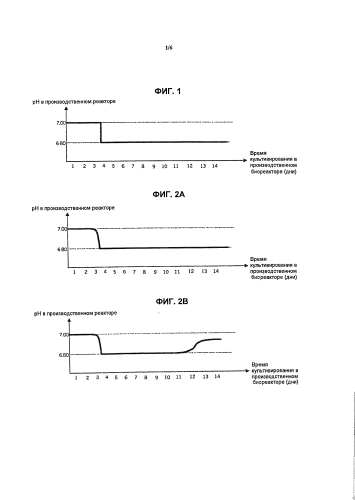
Фиг.1 представляет собой иллюстрацию осуществления пошаговых изменений активного сдвига pH со сдвигом от pH 7,00 до 6,80.
Фиг.2а показывает профиль рН, полученный путем осуществления пассивного сдвига pH. Изменение pH от 7,00 до 6,80 в производственном биореакторе было достигнуто путем установки заданного значения 6,90 и определения зоны нечувствительности 0,10. После первого сдвига pH до 6,80 рН активно поддерживается при 6,80 до окончания культивирования.
Фиг.2B показывает профиль рН со вторым сдвигом pH. В этом примере верхний (предыдущий) предел pH не достигается.
Фиг.2C показывает профиль рН со вторым сдвигом pH, но здесь рН снова достигает верхнего предела pH и поддерживается там.
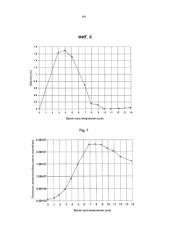
Фиг.3 показывает эффект постоянной температуры в сравнении с температурным сдвигом на плотность жизнеспособных клеток клона клеток СНО, продуцирующих mAb1, как функцию времени культивирования при культивировании во встряхиваемых колбах (смотри пример 1).
Фиг.4 показывает эффект постоянной температуры и температурного сдвига на жизнеспособность клона клеток СНО, продуцирующих mAb1 (смотри пример 1).
Фиг.5 показывает титр продукта как функцию времени при культивировании во встряхиваемых колбах клона клеток СНО, продуцирующих mAb1, с температурным сдвигом и без него (смотри пример 1).
Фиг.6 показывает концентрацию лактата в течение времени культивирования mAb2-продуцирующего клона (смотри пример 2).
Фиг.7 показывает плотность жизнеспособных клеток как функцию от времени культивирования в 300-л биореакторе с клоном клеток СНО. Условия культивирования включали температурную стадию (день 5) и два сдвига рН вследствие регулирования pH заданным значением и зоной нечувствительности (также смотри пример 2).
Фиг.8 показывает титр продукта как функцию от времени культивирования в 300-л биореакторе с клоном клеток СНО. В этом способе комбинируется температурный сдвиг и сдвиг pH (смотри также Фиг.7 и пример 2).
Фиг.9 демонстрирует для трех независимых экспериментов концентрацию mAb3, полученного при помощи способа с подпиткой с культурами клеток СНО, культивируемых в стеклянном биореакторе, как функцию интеграла жизнеспособных клеток. Условия культивирования включали идентичный температурный сдвиг для всех трех экспериментов и дополнительный сдвиг pH только в одном эксперименте.
Подробное описание изобретения
В соответствии с настоящим изобретением способ подготовки рекомбинантных полипептидов включает культивирование клеток СНО и экспрессирование рекомбинантного полипептида, где температуру и рН изменяют во время способа. Настоящее изобретение стремится улучшить способ крупномасштабного получения полипептидов в культуре клеток СНО путем динамической адаптации условий клеточного культивирования в течение времени культивирования, включая сдвиги температуры и pH.
Термин «крупномасштабное получение» полипептидов относится к количествам, как правило, требуемым для промышленного получения рекомбинантных полипептидов, которые используются для подготовки терапевтически активных биофармацевтических препаратов. Клеточные культуры с объемом культуральной клеточной среды, по меньшей мере, 500 л, или, по крайней мере, 1000 л, или же, по крайней мере, 5000 л или даже с большими объемами, как правило, представляют собой крупномасштабные производственные приложения.
Термин «культуральная клеточная среда», используемый в настоящем документе, относится к водному раствору питательных веществ, которые можно использовать для культивирования клеток в течение длительного периода времени. Как правило, культуральная клеточная среда включает в себя следующие компоненты: источник энергии, который, как правило, представляет собой углеводное соединение, предпочтительно глюкозу, аминокислоты, предпочтительно основной набор аминокислот, в том числе все незаменимые аминокислоты, витамины и/или другие органические соединения, которые необходимы при низких концентрациях, свободные жирные кислоты и неорганические соединения, в том числе микроэлементы, минеральные соли, забуферивающие соединения и нуклеозиды и основания.
Применение культуральной клеточной среды в области фармацевтической промышленности, например, для получения терапевтически активных рекомбинантных полипептидов, как правило, не позволяет использовать любые материалы биологического происхождения из-за обеспечения безопасности и проблем загрязнения. Таким образом, культуральная клеточная среда в соответствии с настоящим изобретением предпочтительно является средой, не содержащей сыворотки крови и/или белков. Термин «среда, не содержащая сыворотку и/или белки» представляет среду полностью определенного химического состава, не содержащую добавок животного происхождения наподобие гидролизата ткани, например, фетальная бычья сыворотка или подобное. Далее, белки, особенно факторы роста, такие как инсулин, трансферрин или подобное, также, предпочтительно, не добавляют к клеточной культуре в соответствии с настоящим изобретением. Предпочтительно, в культуральную клеточную среду в соответствии с настоящим изобретением также не добавляют гидролизованный источник белка, как, например, соевый, пшеничный или рисовый пептон, или дрожжевой гидролизат, или подобное.
Термин «температурный сдвиг» при использовании в настоящем документе, относится к изменению температуры культуры в биореакторе/емкости для культивирования путем активного изменения заданного значения температуры до меньшего значения. Температуру сначала контролируют и стабилизируют на определенной температуре в течение определенного периода времени и после изменения заданного значения температуры затем стабилизируют на другой определенной температуре в течение определенного периода времени. Температурная стадия не относится к мелким спонтанным колебаниям температуры в культуре.
Термин «сдвиг рН» при использовании в настоящем документе относится к изменению pH культуры в биореакторе/емкости для культивирования путем активного изменения значения рН до более низкого или более высокого значения или путем обеспечения прохождения сдвига рН от верхнего к нижнему пределу pH.
В зависимости от размера емкости для культивирования/биореактора и объема культуры сдвиг в соответствующем параметре, как определяется в среде, может занять от нескольких минут до нескольких часов.
pH можно изменять двумя разными способами с помощью активного и/или пассивного подхода, как описано более подробно ниже.
Термин «активный сдвиг» в рН определяется путем изменения заданного значения рН на новое значение. В предпочитаемом варианте осуществления изобретения активный сдвиг индуцируют путем добавления соответствующего изменяющего и регулирующего рН среды агента (ов), известного специалисту в рассматриваемой области.
Термин «пассивный сдвиг» указывает, что во время пассивного сдвига pH клетки сами предоставляют возможность изменения рН среды путем накопления продуктов метаболизма, обеспечивая таким образом специфический профиль pH метаболизма культуры клеток в пределах заранее определенного диапазона pH. В одном варианте осуществления способа это достигается путем определения одного заданного значения pH и зоны нечувствительности, где pH разрешено изменять. В отличие от активного сдвига, пассивный сдвиг или изменение pH не индуцируется путем добавления соответствующего, изменяющего рН среды агента(ов).
Регулирующие pH агенты добавляют к культурам в целях поддержания pH при определенном заданном значении или для изменения pH при сдвиге рН. Типичные регулирующие pH агенты, используемые в целях культивирования клеток, включают в себя жидкие растворы оснований или кислот, таких, как NaOH или HCl. Эти регулирующие pH агенты добавляют в среду в емкости для культивирования/биореакторе. Кроме того, культуральную клеточную среду можно газировать СО2 для корректировки pH.
В соответствии с первым аспектом изобретения раскрывается способ подготовки рекомбинантных полипептидов, включающий культивирование клеток СНО и экспрессирование рекомбинантных полипептидов, где температура и рН изменяются во время способа. В частности, сдвиг от первой более высокой ко второй более низкой температуре происходит после того, как клетки сначала выращивают и поддерживают, по крайней мере, в течение трех дней, альтернативно, по крайней мере, 4 дней или, по крайней мере, 5 дней при первой температуре. Эта вторая более низкая температура на около 1 - около 8°C ниже, чем первая температура. В другом варианте осуществления изобретения температурный сдвиг может составлять от около 2 до около 5°C, в некоторых осуществлениях это составляет около 4°C или около 3,5°C. Эта вторая температура затем поддерживается, по крайней мере, в течение двух дней. В дополнение к сдвигу по температуре также изменяют рН от первого ко второму pH.
Точные параметры, касающиеся сдвига температуры и pH, определяются заранее и адаптированы в соответствии с потребностями клеточной линии, которая была трансфицирована одной или несколькими конкретными генными конструкциями, кодирующими соответствующей полипептид, который получается. С другой стороны, потребности можно определить в зависимости от метаболических параметров, которые определяются во время культивирования при крупномасштабном получении в биореакторе.
Температурный сдвиг от более высокой температуры к более низкой температуре полезен, поскольку первая температура является оптимальной для роста клеток, в то время как низкая температура снижает скорость гибели клеток. Сниженная температура, следовательно, позволит дольше поддерживать высокую плотность жизнеспособных клеток. Клеточно-специфическая продуктивность представляющего интерес полипептида при этой пониженной температуре, как правило, не радикально уменьшается по сравнению с начальной температурой, иногда клеточно-специфическая продуктивность может быть такой же или иногда даже превосходит. Более длительное поддержание высокой плотности жизнеспособных клеток может, кроме того, обеспечивать сведение к минимуму образование продукта ненадлежащего качества. Сочетание этих факторов обеспечивает возможность высокой объемной производительности и достижения высоких титров представляющего интерес продукта надлежащего качества на время сбора клеток, выращенных в культуре. В одном варианте осуществления первая температура находится в диапазоне от около 33°C до примерно 38°C. В другом примере, первая температура находится в диапазоне от около 36°C до примерно 38°C. Вторая температура, достигнутая после температурного сдвига, может находиться в диапазоне от около 30°C до примерно 37°C, или от около 32 до примерно 34°C, или же приблизительно от 30 до примерно 32°C.
Расчет времени температурного сдвиг важен для максимальной продуктивности. В случае если температурный сдвиг выполняется слишком рано, высокая плотность клеток не будет достигнута, или для достижения потребуется много времени. В случае если температурный сдвиг выполняется слишком поздно, он не может эффективно предотвратить спад в плотности жизнеспособных клеток. Предпочтительно, расчет времени температурного сдвига выражается в днях после инокуляции биореактора, используемого для крупномасштабного получения рекомбинантных полипептидов. В другом варианте осуществления изобретения расчет времени можно определить через плотность клеток, которая достигается в биореакторе для крупномасштабного получения. Например, температурный сдвиг начинается в линейной и логарифмической стадии роста клеток или когда будет достигнуто от 40 до 90% максимальной плотности клеток. Зависящее от плотности клеток заданное значение может быть выражено в относительном выражении (% максимальной плотности клеток, которую можно достичь) или в абсолютном выражении (жизнеспособные клетки/мл). В одном конкретном примере плотность клеток выбрана в пределах от 60 до 90%.
Расчет времени между инокуляцией биореактора/емкости для выращивания и температурным сдвигом может варьировать от 3 до около 14 дней в зависимости от конкретных используемых биореактора/емкости для выращивания и клеточной линии. Альтернативно, сдвиг происходит в диапазоне от 3 до 8 дней. В качестве альтернативы единому критерию, как указано выше, также может быть установлен двойной критерий путем объединения двух упомянутых выше переменных, таких, что выбранные условия, касающиеся времени и/или плотности клеток, должны быть выполнены.
Если необходимо для оптимального роста и получения, можно также использовать более чем одну температурную стадию, например, по крайней мере, 2 стадии, в каждую из которых входит изменение температуры, по крайней мере, на около 1°C, в качестве альтернативы, по крайней мере, на около 2°C, где каждая температура поддерживается, по крайней мере, один день. Таким образом, температуру можно еще больше уменьшить, и можно следовать более сложному температурному профилю.
В соответствии с изобретением клетки выращивают при первом значении рН до сдвига pH в течение, по крайней мере, 2 дней, в качестве альтернативы, по крайней мере, 3 дней, например, в течение не менее 4 дней, или даже в течение не менее 5 дней. pH в течение первых нескольких дней после начала культивирования выбирается благоприятным для быстрого увеличения плотности клеток в биореакторе. В течение этого времени pH биореактора контролируется на определенном заданном значении, которое является оптимальным для роста клеток. Как только определенная клеточная плотность клеток будет достигнута, предпочтительно изменить рН культуры. рН сдвигают после этого первого периода времени до второго значения рН, которое примерно на 0,05-1 единиц рН ниже, чем первое значение pH. Клетки выращивают при указанном втором pH в течение не менее 2 дней. В некоторых вариантах осуществления настоящего изобретения второе значение pH может быть на около 0,15 - примерно 1 единицу рН ниже, чем первое значение pH. Этот сдвиг рН обычно достигают путем изменения заданного значения pH в биореакторе/емкости для культивирования. Второе значение рН выбирают для снижения гибели клеток (например, апоптоза) и обеспечивают поддержание высокой скорости клеточно-специфического получения полипептидов надлежащего качества. Как следствие, в первом варианте осуществления расчет времени сдвига рН выражается в днях после инокуляции биореактора, который используется для крупномасштабного получения рекомбинантного полипептида. Во втором варианте осуществления расчет времени можно определить с помощью плотности клеток, которая достигается в крупномасштабном биореакторе. В соответствии с дополнительной альтернативой расчет времени можно также производить в зависимости от конкретных метаболических параметров, измеряемых в ходе культивирования в среде для культивирования клеток. В одном неограничивающем примере это может быть концентрация лактата. И, кроме того, могут быть использованы непрямые параметры, которые отражают метаболическое состояние культуры, такие как, например, требуемая дозировка CO2 или контролирующей кислоты на время поддержания pH в верхнем заданном значении pH, или требуемая дозировка NaOH или контролирующего каустического агента для поддержания pH при низком заданном значении pH. Альтернативно, вместо того, чтобы использовать только один критерий для сдвига рН, можно установить комбинированный критерий путем сочетания параметров, таких как, например, дни после инокуляции и плотность клеток.
Преимущества стратегии сдвига pH также включают тот факт, что уровни растворенного углекислого газа и добавление основания можно уменьшить во время хода культивирования, что, следовательно, позволяет избежать их негативных эффектов. В начале культивирования выгодно иметь более высокие значения рН (например, 7,0) в емкости для культивирования или биореакторе, поскольку более низкое значение pH (например, 6,8) потребует более высоких уровней содержания углекислого газа в целях поддержания pH. Такие высокие уровни углекислого газа, однако, могут оказать негативное воздействие на клетки и снизить скорость роста. Напротив, на более поздних этапах культивирования, поддержание высокого pH (например, 7,0) требует большего добавления основания, чем поддержание при низком значении рН (например, 6,8). Это происходит потому, что образуется молочная кислота, и полученная в результате кислотность должна быть компенсирована за счет добавления основания. Чем выше заданное значение рН, тем большее количество основания требуется. Добавление основания увеличивает осмолярность культуры, что может быть неблагоприятным для роста и поддержания высокой плотности жизнеспособных клеток.
Потенциальные преимущества стратегии сдвига pH также могут быть описаны с точки зрения минимизации образования молочной кислоты. Клетки СНО, как правило, производят меньше молочной кислоты при более низких значениях рН (например, 6,8), чем при более высоких значениях (например, 7,0). Меньшее продуцирование молочной кислоты приводит к меньшему добавлению основания, что выгодно, как описано выше.
В одном варианте осуществления первое значение pH выбирают в диапазоне рН от 6,8 до 7,5. В другом варианте осуществления первое значение pH выбирают в диапазоне pH от 6,8 до 7,2. В дополнительном варианте осуществления первое значение pH выбирают большим, чем рН 7, или, альтернативно, ниже рН 7. Второе значение рН, которое достигается после сдвига pH, находится в диапазоне от pH 6,0 до рН 7,5, или между значениями pH от 6,5 до 6,8.
Относительный расчет времени сдвига температуры и pH выбирают для того, чтобы добиться наиболее оптимального результата. Оптимальный расчет времени сдвига температуры и pH выбирают на основе конкретного способа и осуществляют в зависимости от состояния роста или метаболического состояния культуры. Температурный сдвиг в принципе может быть реализован в момент времени культуры независимо от расчета времени сдвига рН. В одном варианте осуществления изобретения температурный сдвиг может произойти до сдвига рН или одновременно с ним. В одном варианте осуществления изобретения температурный сдвиг происходит до сдвига pH. Например, температурный сдвиг можно инициировать за 1-5 дней до того, как происходит сдвиг рН. В еще одном варианте осуществления изобретения температурный сдвиг инициируют одновременно со сдвигом pH. Термин «одновременно» в настоящем документе относится к непрерывному сдвигу обоих соответствующих параметров с первого значения на второе значение. Такие одновременные сдвиги могут произойти, если заданное значение температуры и заданное значение рН были изменены, и оба параметра еще не достигли своего второго стабильного значения. В качестве альтернативы, такой сценарий может возникнуть, когда заданное значение температуры было изменено во время фазы пассивного сдвига рН. Это происходит в случае регулирования pH путем заданного значения и зоной нечувствительности, определяющих верхний и нижний предел pH (смотри также ниже). В дополнительном варианте осуществления изобретения температурный сдвиг может произойти после сдвига pH. Например, температурный сдвиг можно инициировать через 1-5 дней после сдвига pH.
В еще одном аспекте настоящего изобретения рН активно или пассивно изменяют от указанного первого до указанного второго значения pH. Существует несколько возможных путей для контроля pH культур, а также для реализации сдвига pH. В одном аспекте изобретения рН активно сдвигают с первого значения pH до второго путем изменения заданного значения pH (без зоны нечувствительности) рН-контроллера на новое значение.
В результате изменение первого значения pH на второе значение рН является квазинемедленным (пошаговое изменение) в культуре. Фиг.1 иллюстрирует такое осуществление пошагового изменения сдвига рН, со сдвигом от pH 7,00 до 6,80 в данном конкретном примере. В этом варианте осуществления изобретения рН поддерживают сначала на верхнем значение рН путем дозировки агентов, регулирующих pH, соответственно (например, CO2 или NaOH), а потом изменяют к более низкому значению путем активного изменение заданного значения (без зоны нечувствительности). рН более низкого заданного значения можно достичь либо путем активного дозирования/добавления подкисляющего вещества в культуру, что приводит к быстрому изменению, или путем добавления агента, который удерживал рН при более щелочном первом pH. В зависимости от размера биореактора и вышеупомянутого способа воздействия на pH, изменение рН может быть завершено в течение от нескольких минут до 24 часов.
В еще одном аспекте изобретения рН дают возможность пассивно сдвигаться (медленно изменяться) с первого до второго значения pH, соответствующих верхнему и нижнему значению pH, и, таким образом, следовать специфическому для культуры клеток метаболическому профилю. В результате, изменение от первого значения рН до второго значения рН происходит постепенно. Этот альтернативный способ регулирования рН среды для культивирования клеток и реализации сдвига pH достигается путем программирования pH-контроллера биореактора с заданным значением и зоной нечувствительности. Это определяет допустимый диапазон pH для способа, в котором рН-контроллер не принимает никакого участия. Например, заданное значение рН 6,90 с нечувствительностью 0,10 единицы рН будет определять рН 7,00 как верхний предел pH, а pH 6,80 - как нижний предел pH. В биореакторе с продуцирующей клеточной культурой pH, как правило, должен быть на уровне верхнего предела в начале культивирования (в первые несколько дней), когда контроллер препятствует повышению pH путем дозирования углекислого газа к культуре. За счет постепенного накопления молочной кислоты, вырабатываемой клетками, рН с течением времени будет непрерывно уменьшаться от, н