Антитела против axl и способы их применения
Иллюстрации
Показать всеДанное изобретение относится к области иммунологии. Предложено выделенное антитело или его фрагмент, которые связываются с Axl человека и охарактеризованные последовательностями гипервариабельных участков (CDR). Также рассмотрены: нуклеиновая кислота; клетка-хозяин и способ получения антитела или его фрагмента по изобретению. Кроме того, представлены: иммуноконъюгат, содержащий антитело или его фрагмент по изобретению и цитотоксическое средство; фармацевтический состав для нацеливания на патологические состояния, связанные с экспрессией и/или активностью каскадов передачи сигнала Axl; и применение антитела или его фрагмента по изобретению для получения лекарственных средств для лечения злокачественной опухоли и для ингибирования конститутивной активации Axl. Настоящее изобретение может найти дальнейшее применение в терапии заболеваний, связанных с Axl. 8 н. и 10 з.п. ф-лы, 12 ил., 1 табл.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет согласно 35 USC § 119 временной заявки США номер 61/356508, поданной 18 июня 2010 года, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, который был предоставлен в формате ASCII через EFS-Web и включен в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против Axl и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Axl является членом семейства рецепторных тирозинкиназ TAM (Tyro3, Axl и Mer) (O'Bryan et al., 1991; Lai et al., 1991). Первоначально она была идентифицирована в качестве трансформирующего гена при гематологических злокачественных опухолях (O'Bryan et al., 1991; Janssen et al., 1991). Нарушение регуляции Axl или его лиганда Gas6 вовлечено в патогенез различных злокачественных опухолей человека. Сверхэкспрессия Axl была описана при широком наборе злокачественных опухолей человека (Berclaz et al., 2001; Craven et al., 1995; Shieh et al., 2005; Sun et al., 2004; Ito et al., 1999) и связана с инвазивностью и метастазированием при злокачественных опухолях легкого (Shieh et al., 2005), предстательной железы (Sainaghi et al., 2005), молочной железы (Meric et al., 2002; Zhang et al., 2008), желудка (Wu et al., 2002) и поджелудочной железы (Koorstra et al., 2009), почечноклеточном раке (Chung et al., 2003), а также глиобластоме (Hutterer et al., 2008). Недавно путем определения профиля передачи сигнала фосфотирозина активированный белок Axl был выявлен приблизительно в 5% первичных опухолей NSCLC (Rikova et al., 2007). Экспрессия Axl индуцируется направленными и химиотерапевтическими лекарственными средствами, и индуцируемая лекарственным средством экспрессия Axl обеспечивает устойчивость к химиотерапии при остром миелоидном лейкозе (Hong et al., 2008), а также устойчивость к иматинибу и лапатинибу/герцептину при желудочно-кишечных стромальных опухолях (Mehadevan, et al., 2007) и раке молочной железы (Liu et al., 2009), соответственно. Другие публикации, касающиеся Axl и антител против Axl, включают WO2004/039955, WO2009/063965; заявку США номер 61/228915 того же заявителя, поданную 27 июля 2009 года; WO2009/062690; WO2004/008147; 5468634.
Очевидно, продолжает существовать необходимость в средствах, которые обладают клиническими признаками, которые являются оптимальными для разработки лекарственных средств. Изобретение, описанное в настоящем описании, удовлетворяет эту необходимость и обеспечивает другие преимущества.
Все ссылки, цитированные в настоящем описании, включая патентные заявки и публикации, включены в качестве ссылок в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к антителам против Axl и способам их применения.
В одном из аспектов изобретение относится к выделенному антителу, которое связывается с Axl человека, где антитело связывает Axl человека с аффинностью ≤600 пМ, где антитело связывает Axl мыши с аффинностью ≤1 нМ. В некоторых вариантах осуществления антитело стимулирует подавление рецептора Axl. В некоторых вариантах осуществления антитело ингибирует конститутивную активацию Axl. В некоторых вариантах осуществления антитело связывает полипептид, содержащий, по существу состоящий или состоящий из следующей аминокислотной последовательности:
MAWRCPRMGRVPLAWCLALCGWACMAPRGTQAEESPFVGNPGNITGARGLTGTLRCQLQVQGEPPEVHWLRDGQILELADSTQTQVPLGEDEQDDWIVVSQLRITSLQLSDTGQYQCLVFLGHQTFVSQPGYVG (SEQ ID NO:111).
В других вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой антитело человека, гуманизированное или химерное антитело. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, который связывает Axl. В некоторых вариантах осуществления антитело представляет собой антитело человека.
В одном из аспектов изобретение относится к антителу против Axl, где антитело содержит (a) HVR-H1, содержащую GFX1X2X3X4X5X6X7H, где X1 представляет собой S или T; X2 представляет собой L, F или V; X3 представляет собой S, T или R; X4 представляет собой G или S; X5 представляет собой S, H, T или I; X6 представляет собой W или G; X7 представляет собой I или L (SEQ ID NO:112), (b) HVR-H2, содержащую X1X2IX3PX4X5X6X7X8X9X10YYADSVKG, где X1 представляет собой G или A; X2 представляет собой W или G; X3 представляет собой N, S, A или P; X4 представляет собой Y, A или V; X5 представляет собой R, G или S; X6 представляет собой G, R или S; X7 представляет собой Y, S, H или Y; X8 представляет собой A, T или P (SEQ ID NO:113), и/или HVR-H2, содержащую X1X2IX3PX4X5X6X7X8X9X10YYADSVKG, где X1 представляет собой G или A; X2 представляет собой W или G; X3 представляет собой N, S, A или P; X4 представляет собой Y, A или V; X5 представляет собой R, G или S; X6 представляет собой G, R или S; X7 представляет собой Y, S, H или Y; X8 представляет собой A, T или P; X9 представляет собой любую аминокислоту или отсутствует; X10 представляет собой любую аминокислоту или отсутствует (SEQ ID NO:166); (c) HVR-H3, содержащую ARX1X2X3X4X5X6X7X8X9X10X11X12X13MDY, где X1 представляет собой E или W; X2 представляет собой Y или R; X3 представляет собой S, N или P; X4 представляет собой G, D или L; X5 представляет собой W или S; X6 представляет собой G, R, A или S; X7 представляет собой G или S; X8 представляет собой S или отсутствует; X9 представляет собой S, Y или отсутствует; X10 представляет собой V, I или отсутствует; X11 представляет собой G или отсутствует; X12 представляет собой Y или отсутствует; X13 представляет собой A, E или отсутствует (SEQ ID NO:114); (d) HVR-L1, содержащую RASQX1X2X3X4X5X6A, где X1 представляет собой D, I или S; X2 представляет собой V или I; X3 представляет собой S, G или R; X4 представляет собой T, I, N или R; X5 представляет собой A или S; X6 представляет собой V или L (SEQ ID NO:115); (e) HVR-L2, содержащую X1ASX2LX3S, где X1 представляет собой S, A или V; X2 представляет собой F, N или S; X3 представляет собой Y или A (SEQ ID NO:116); и (f) HVR-L3, содержащую QQX1X2X3X4X5X6T, где X1 представляет собой S или A; X2 представляет собой Y, K или N; X3 представляет собой T, S, Y, M, R или A; X4 представляет собой T, N, S или F; X5 представляет собой P или R; X6 представляет собой P, Y, S или L (SEQ ID NO:117).
В другом аспекте изобретение относится к антителу против Axl, где антитело содержит (a) HVR-H1, содержащую GFX1X2X3GX4WIH, где X1 представляет собой T или S, X2 представляет собой F или L, X3 представляет собой T или S, X4 представляет собой H, S или T (SEQ ID NO:118); (b) HVR-H2, содержащую GWIX1PYX2X3X4X5YYADSVKG, где X1 представляет собой S, N или A; X2 представляет собой G, R или S; X3 представляет собой G или R; X4 представляет собой S, Y или H; X5 представляет собой T, A или P (SEQ ID NO:119); (c) HVR-H3, содержащую AREYX1X2WX3X4SX5X6GYX7MDY, где X1 представляет собой S, N или P; X2 представляет собой G или D; X3 представляет собой G, R или A; X4 представляет собой G или S; X5 представляет собой S или Y; X6 представляет собой V или I; X7 представляет собой A или E (SEQ ID NO:120); и (d) HVR-L3, содержащую QQSYX1X2X3X4T, где X1 представляет собой T, S или Y; X2 представляет собой T, N, S или F; X3 представляет собой P или R; X4 представляет собой P, Y или S (SEQ ID NO:121).
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9, (b) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12, и (c) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8.
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:7, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8, и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9.
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12.
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12.
В некоторых вариантах осуществления антитело дополнительно содержит последовательность каркасной области вариабельного домена тяжелой цепи или вариабельного домена легкой цепи, представленную на фигуре 3A-B, 4, 5 или 6.
В одном из аспектов изобретение относится к антителу против Axl, содержащему (a) последовательность VH, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:103; (b) последовательность VL, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:104; или (c) последовательность VH как в (a) и последовательность VL как в (b). В некоторых вариантах осуществления антитело содержит последовательность VH SEQ ID NO:103. В некоторых вариантах осуществления антитело содержит последовательность VL SEQ ID NO:104. В некоторых вариантах осуществления антитело содержит последовательность VH SEQ ID NO:103 и последовательность VL SEQ ID NO:104.
В некоторых вариантах осуществления антитело представляет собой полноразмерное антитело IgG1.
Также изобретение относится к выделенной нуклеиновой кислоте, кодирующей любые из антител по изобретению.
Также изобретение относится к клеткам-хозяевам, содержащим нуклеиновые кислоты по изобретению.
Также изобретение относится к способам получения антитела, включающим культивирование клетки-хозяина по изобретению так, чтобы продуцировалось антитело. В некоторых вариантах осуществления способы дополнительно включают выделение антитела из клетки-хозяина.
Изобретение также относится к иммуноконъюгату, содержащему любое из антител против Axl по изобретению и цитотоксическое средство.
Также изобретение относится к фармацевтическому составу, содержащему любое из антител против Axl по изобретению и фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтический состав содержит дополнительное лекарственное средство. В некоторых вариантах осуществления дополнительное лекарственное средство выбрано из антагониста VEGF, антагониста EGFR и химиотерапевтического средства.
Также изобретение относится к любому из антител против Axl, описанных в настоящем описании, для применения в качестве лекарственного средства. В некоторых вариантах осуществления применение представляет собой применение для лечения злокачественной опухоли. В некоторых вариантах осуществления применение представляет собой применение для лечения иммунного расстройства, сердечно-сосудистого расстройства, тромбоза или диабета. В некоторых вариантах осуществления применение представляет собой применение для ингибирования пролиферации клеток. В некоторых вариантах осуществления применение представляет собой применение для стимуляции подавления Axl. В некоторых вариантах осуществления применение представляет собой применение для ингибирования ангиогенеза.
Также изобретение относится к любому из антител против Axl, описанных в настоящем описании, для изготовления лекарственного средства. В некоторых вариантах осуществления лекарственное средство предназначено для лечения злокачественной опухоли. В некоторых вариантах осуществления лекарственное средство предназначено для лечения иммунного расстройства, сердечно-сосудистого расстройства, тромбоза или диабета. В некоторых вариантах осуществления лекарственное средство предназначено для ингибирования пролиферации клеток, ингибирования ангиогенеза, стимуляции подавления Axl, ингибировании метастазов, ингибирования ангиогенеза.
Также изобретение относится к способам лечения индивидуума, имеющего злокачественную опухоль, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании. В некоторых вариантах осуществления способы, кроме того, включают введение индивидууму дополнительного лекарственного средства. В некоторых вариантах осуществления дополнительное лекарственное средство выбрано из группы, состоящей из антагониста VEGF, антагониста EGFR и химиотерапевтического средства.
Также изобретение относится к способам лечения индивидуума, имеющего иммунное нарушение, сердечно-сосудистое нарушение, тромбоз или диабет, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании.
Также изобретение относится к способам ингибирования ангиогенеза, ингибирования пролиферации клеток, стимуляции подавления рецептора Axl или ингибирования метастазирования у индивидуума, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании, для ингибирования ангиогенеза, ингибирования пролиферации клеток, стимуляции подавления рецептора Axl или ингибирования метастазирования.
Также изобретение относится к способам ингибирования конститутивной активации Axl, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании, для ингибирования конститутивного Axl.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, где у индивидуума развилась устойчивость к лечению антагонистом EGFR, включающим определение того, имеет ли индивидуум экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и введение этим индивидуумам, имеющим активирующую мутацию Axl или амплификацию гена Axl, антагониста EGFR и любого из антител против Axl, описанных в настоящем описании.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и (ii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум проявляет активирующую мутацию Axl или амплификацию гена Axl.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум устойчивость к ингибитору, (ii) исследование индивидуума для определения того, имеет ли индивидуум экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и (iii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум имеет активирующую мутацию Axl или амплификацию гена Axl.
В одном из аспектов изобретение относится к способам оценки антагониста EGFR, включающим: (i) мониторинг группы индивидуумов, подвергаемых лечению антагонистом EGFR, для идентификации индивидуумов, которые проявляют устойчивость к терапевтическому средству, (ii) исследование устойчивых индивидуумов для определения того, имеют ли индивидуумы экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и (iii) модификацию режима лечения индивидуумов путем включения любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуумы имеют экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl.
В одном из аспектов изобретение относится к способам снижения фосфорилирования EGFR в злокачественной клетке, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка содержит активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения опосредуемой PI3K передачи сигнала в злокачественной клетке, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения опосредуемой EGFR передачи сигнала в злокачественной клетке, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим приведение в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам восстановления чувствительности злокачественной клетки к антагонисту EGFR, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим приведение в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения роста или пролиферации злокачественной клетки, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам усиления апоптоза злокачественной клетки, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения устойчивости злокачественной клетки к антагонисту EGFR, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам лечения приобретенной устойчивости к антагонисту EGFR в злокачественной клетке, где указанная клетка имеет активирующую мутацию Axl или амплификацию гена Axl, включающим приведение в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В некоторых вариантах осуществления злокачественная клетка представляет собой клетку любой запускаемой EGFR злокачественной опухоли. В некоторых вариантах осуществления, злокачественная клетка содержит активирующую мутацию EGFR. В некоторых вариантах осуществления злокачественная клетка имеет амплификацию гена EGFR. В некоторых вариантах осуществления амплификация гена EGFR является по меньшей мере 2-кратной. В некоторых вариантах осуществления амплификация Axl является по меньшей мере 2-кратной. В некоторых вариантах осуществления злокачественная клетка содержит мутацию гена EGFR, связанную с увеличенной устойчивостью к антагонисту EGFR. В некоторых вариантах осуществления мутация гена EGFR, связанная с увеличенной устойчивостью к антагонисту EGFR, представляет собой мутацию T790M в EGFR. В некоторых вариантах осуществления антагонист EGFR представляет собой низкомолекулярное терапевтическое средство, терапевтическое средство на основе нуклеиновой кислоты или белковое терапевтическое средство. В некоторых вариантах осуществления антагонист EGFR представляет собой антитело, антисмысловую молекулу или низкомолекулярный ингибитор киназ. В некоторых вариантах осуществления антагонист EGFR представляет собой ингибитор киназ EGFR, выбранный из группы, состоящей из: гефитиниба, эрлотиниба, цетуксимаба, пантинумумаба. В некоторых вариантах осуществления антагонист EGFR представляет собой антитело против EGFR, выбранное из группы, состоящей из: цетуксимаба, панитумумаба. В некоторых вариантах осуществления терапевтическое средство на основе нуклеиновой кислоты представляет собой молекулу миРНК (siRNA).
В одном из аспектов изобретение относится к способам идентификации индивидуума в качестве кандидата для лечения антагонистом EGFR и любым из антител против Axl, описанным в настоящем описании, где указанного индивидуума лечат антагонистом EGFR, и он страдает от злокачественной опухоли, которая имеет приобретенную устойчивость к указанному антагонисту EGFR, включающим детекцию экспрессии Axl, активирующей мутации Axl или амплификации гена Axl в злокачественной клетке от указанного индивидуума.
В одном из аспектов изобретение относится к способам идентификации индивидуума, которого лечат антагонистом EGFR и который имеет риск приобретения устойчивости к указанному антагонисту EGFR, включающим детекцию присутствия экспрессии Axl, активирующей мутации Axl или амплификации гена Axl в злокачественной клетки от указанного индивидуума, где присутствие указанной экспрессии Axl, активирующей мутации Axl или амплификации гена Axl указывает на риск приобретения устойчивости.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, который является устойчивым к лечению антагонистом EGFR, включающим введение индивидууму антагониста EGFR и любого из антител против Axl, описанных в настоящем описании.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, где индивидуум проявляет устойчивость к лечению антагонистом EGFR, включающим определение того, имеет ли индивидуум экспрессию Axl, такую как повышенные уровни и/или активность Axl, и введение индивидуумам, имеющим экспрессию Axl, такую как повышенная активность Axl, антагониста EGFR и любого другого из антител против Axl, описанных в настоящем описании.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум экспрессию Axl, такую как повышенные уровни и/или активность Axl, и (ii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум проявляет экспрессию Axl, такую как повышенные уровни и/или активность Axl.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с актирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум устойчивость к ингибитору, (ii) исследование индивидуума для определения того, имеет ли индивидуум экспрессию Axl, такую как повышенные уровни и/или активность Axl, и (iii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум имеет повышенные уровни и/или активность Axl.
В другом аспекте изобретение относится к способу (i) восстановления чувствительности злокачественной клетки к антагонисту EGFR, (ii) снижения чувствительности злокачественной клетки к антагонисту EGFR, и/или (iii) лечения приобретенной устойчивости к антагонисту EGFR в злокачественной клетке путем приведения в контакт клетки с антагонистом EGFR и любым из антител против Axl, описанных в настоящем описании. В иллюстративных вариантах осуществления злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR и имеет повышенные уровни активности и/или экспрессии Axl, например, связанные с активирующей мутацией в гене Axl, амплификацией гена Axl, или опосредуемой Gas6 активацией Axl. Способы, описанные в настоящем описании, можно использовать для восстановления чувствительности, снижения устойчивости и/или лечения приобретенной устойчивости злокачественной клетки.
В другом аспекте изобретение относится к способу снижения роста и/или пролиферации злокачественной клетки или усиления апоптоза злокачественной клетки, путем приведения в контакт клетки с антагонистом EGFR и любым из антител против Axl, описанных в настоящем описании. В иллюстративных вариантах осуществления злокачественная клетка приобрела устойчивость к антагонисту EGFR и имеет повышенную активность и/или экспрессию Axl, например, связанную с активирующей мутацией в гене Axl, амплификацией гена Axl или опосредуемой Gas6 активацией Axl.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ.1A-F: Последовательности петли HVR тяжелой цепи и легкой цепи антител против FGFR3. На фигурах показаны последовательности HVR тяжелой цепи, H1, H2 и H3, и последовательности HVR легкой цепи, L1, L2 и L3. Аминокислотные положения пронумерованы согласно системе нумерации Kabat, как описано в настоящем описании.
ФИГ. 2: представлены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи антител против Axl.
ФИГ. 3A-B и 4: представлены акцепторные консенсусные каркасные последовательности человека для применения на практике настоящего изобретения со следующими идентификаторами последовательностей:
Консенсусные каркасные области вариабельной области тяжелой цепи (VH) (ФИГ. 3A-3B)
консенсусная каркасная область VH человека подгруппы I минус CDR по Kabat (SEQ ID NO:131-133 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы I минус удлиненные гипервариабельные области (SEQ ID NO:134-135, 133, 125, 134-136, 125, 134-135, 137 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы II минус CDR по Kabat (SEQ ID NO:138-140 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы II минус удлиненные гипервариабельные области (SEQ ID NO:141-142, 140, 125, 141-143, 125, 141-142, 144 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы II минус удлиненные консенсусная каркасная область VH человека подгруппы III минус CDR по Kabat (SEQ ID NO:145-147 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы III минус удлиненные гипервариабельные области (SEQ ID NO:122-123, 147, 125, 122-123, 148, 125 и 122-125, соответственно, в порядке появления);
акцепторная каркасная область VH человека минус CDR по Kabat (SEQ ID NO:149, 146, 150 и 125, соответственно, в порядке появления);
акцепторная каркасная область VH человека минус удлиненные гипервариабельные области (SEQ ID NO:122-123, 150, 125, 122-123, 151 и 125, соответственно, в порядке появления);
каркасная область акцептора 2 VH человека минус CDR по Kabat (SEQ ID NO:149, 146, 152 и 125, соответственно, в порядке появления);
каркасная область акцептора 2 VH человека минус удлиненные гипервариабельные области (SEQ ID NO:122-123, 152, 125, 122-123, 153, 125, 122-123, 154 и 125, соответственно, в порядке появления);
Консенсусные каркасные области вариабельной области легкой цепи (VL) (ФИГ. 4)
консенсусная каркасная область VL-каппа человека подгруппы I (SEQ ID NO:126-129, соответственно, в порядке появления);
консенсусная каркасная область VL-каппа человека подгруппы II (SEQ ID NO:155-157 и 129, соответственно, в порядке появления);
консенсусная каркасная область VL-каппа человека подгруппы III (SEQ ID NO:158-160 и 129, соответственно, в порядке появления);
консенсусная каркасная область VL-каппа человека подгруппы IV (SEQ ID NO:161-163 и 129, соответственно, в порядке появления);
ФИГ. 5: представлены последовательности каркасной области легкой (SEQ ID NO:126-127, 164 и 129, соответственно, в порядке появления) и тяжелой цепей (SEQ ID NO:122-123, 154 и 125, соответственно, в порядке появления) huMAb4D5-8. Номера надстрочными знаками/полужирным шрифтом указывают на положения аминокислот согласно Kabat.
ФИГ. 6: представлены модифицированные/вариантные последовательности каркасной области легкой (SEQ ID NO:126-129, соответственно, в порядке появления) и тяжелой цепей (SEQ ID NO:122-125, соответственно, в порядке появления) huMAb4D5-8. Номера надстрочными знаками/полужирным шрифтом указывают на положения аминокислот согласно Kabat.
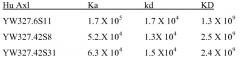
ФИГ. 7A-H: Охарактеризация mAb против Axl YW327.6S2. A-B. Измерение аффинности YW327.6S2 с использованием BIAcore. Константы ассоциации (kon) и константы диссоциации (koff) вычисляли с использованием модели связывания Ленгмюра "один к одному". Равновесную константу диссоциации (Kd) получали в качестве отношения kon/koff. C. Перекрестная реактивность YW327.6S2. YW327.6S2 перекрестно реагирует с Axl мыши и яванского макака, но не с Tyro3 или Mer. На планшеты наносили антитело против Fc IgG человека, а затем инкубировали с Fc антитела против Axl, Mer, Tyro3 человека, Fc антитела против Axl мыши или яванского макака. После промывания добавляли изотипическое контрольное антитело или YW327.6S2, а затем конъюгированное с HRP антитело против IgG человека. D-E. YW327.6S2 блокирует связывание Gas6 с Axl. Фиг. 7D: ELISA. На планшеты наносили антитело против Fc IgG человека и инкубировали с Fc антитела против Axl человека. После промывания добавляли Gas6 с антителами или без них. Детекцию связывания Gas6 проводили с помощью биотинилированного антитела против Gas6 и конъюгата стрептавидин-HRP. Фиг. 7E: FACS. HUVEC собирали и обрабатывали YW327.6S2 или контрольным антителом, а затем инкубировали с Gas6 в течение 30 минут на льду. Детекцию связывания Gas6 с клеточной поверхностью проводили с помощью биотинилированного антитела против Gas6 и конъюгата стрептавидин-PE. F. YW327.6S2 подавляет экспрессию Axl. Клетки A549 инкубировали с 1 мкг/мл YW327.6S2 в течение указанного времени, и экспрессию Axl на клеточной поверхности определяли с помощью FACS (верхняя панель), и общую экспрессию белка определяли с помощью вестерн-блот анализа (нижняя панель). G. YW327.6S2 ингибирует индуцируемое Gas6 фосфорилирование и передачу сигнала Axl. Клетки H1299 культивировали в бессывороточной среде в течение ночи, предварительно инкубировали с YW327.6S2 в течение 4 ч, и обрабатывали Gas6 в течение 30 минут. Фосфорилированный Axl измеряли с помощью ELISA (верхняя панель), и фосфорилированный Akt измеряли с помощью вестерн-блот-анализа (нижняя панель). H. YW327.6S2 ингибирует рост клеток Baf3Axl. Клетки Baf3Axl выращивали в среде, содержавшей 200 нг/мл Gas6, и обрабатывали YW327.6S2 в указанных концентрациях в течение 72 ч. Жизнеспособность клеток измеряли с помощью анализа CellTiter Glo.
ФИГ. 8A-F: YW327.6S2 ослабляет рост ксенотрансплантата опухоли A549 и усиливает эффект средства против VEGF. A. Кривая роста опухоли. mAb вводили в/б в дозе 10 мг/кг (YW327.6S2 и изотипическое контрольное антитело) или 1 мг/кг (средство против VEGF) два раза в неделю, начиная, когда средний размер опухоли достигал 100 мм3 (0 сутки). Планки погрешности соответствуют стандартной ошибке среднего значения (n=10 для каждой группы в каждом эксперименте). p=0,0003 (YW327.6S2 против контроля), p=10-11 (YW327.6S2 против комбинации). B. Кривая Каплана-Мейера для различных групп обработки. Мышей удаляли из исследования, когда их размер опухоли достигал 800 мм3, и результаты животных, остававшихся в каждой группе (% оставшихся), наносили на график. C. 12A11 усиливает эффект средства против VEGF. 12A11 и средство против VEGF вводили в/б в дозе 30 мг/кг и 1 мг/кг, соответственно, два раза в неделю, начиная, когда средний размер опухоли достигал 100 мм3 (0 сутки). Планки погрешности соответствуют стандартной ошибке среднего значения (n=10 для каждой группы в каждом эксперименте). p=0,006 (12A11 против контроля); p=0,0001 (12A11 против комбинации). D. YW327.6S2 снижает экспрессию Axl. Мышам вводили YW327.6S2 в дозе 10 мг/кг и в указанные моменты времени вырезали опухоли. Клеточные лизаты из опухолей анализировали вестерн-блоттингом в отношении экспрессии Axl. E. YW327.6S2 индуцирует апоптоз. Опухоли, обрабатываемые контролем или YW327.6S2 в течение 2 недель, вырезали и для измерения апоптоза проводили CC3 IHC. F. YW327.6S2 усиливает эффект средства против VEGF в отношении снижения плотности внутриопухолевых сосудов. Опухоли из мышей, которым проводили введение, как указано выше в D, вырезали через 0 и 72 ч после дозирования и сосуды опухоли визуализировали окрашиванием иммуногистохимией с помощью MECA32 и количественно определяли в анализе изображения (выражали в квадратных микрометрах). Для каждой пары вычисляли t-критерий Стьюдента (p<0,05 для контроля против комбинации).
ФИГ. 9A-B: YW327.6S2 усиливает противоопухолевый эффект эрлотиниба и химиотерапии в модели с ксенотрансплантатом A549. A. YW327.6S2 усиливает эффект эрлотиниба. Введение антитела было таким же, как в случае фиг. 2. Эрлотиниб вводили путем перорального принудительного введения в количестве 100 мг/кг/сутки. n=10 для каждой группы. p=1,7×10-9 (YW327.6S2 против контроля), p=2,3×10-10 (YW327.6S2 против комбинации). B. YW327.6S2 усиливает химиотерапию. Введение антитела было таким же, как на фиг.2. Паклитаксел и карбоплатин вводили подкожно в дозе 6,25 мг/кг/сутки в течение 5 суток, и 100 мг/кг для однократной дозы в начале лечения (0 сутки), соответственно. n=10 для каждой группы. p=3×10-5 (YW327.6S2 против контроля), p=10-9 (химиотерапия против контроля), p=10-5 (комбинация против химиотерапии отдельно).
ФИГ. 10A-G: YW327.6S2 снижает рост ксенотрансплантата опухоли MDA-MB-231 путем модулирования стромальных функций опухоли. A и B. YW327.6S2, но не 12A11, снижает рост опухоли MDA-MB-231 и усиливает эффект средства против VEGF. mAb вводили в/б в дозе 20 мг/кг (YW327.6S2 и изотипическое контрольное антитело), 30 мг/кг (12A11) и 2 мг/кг (средство против VEGF), два раза в неделю, начиная, когда средний размер опухоли достигал 100 мм3 (0 сутки). Планки погрешностей соответствуют стандартной ошибке среднего значения (n=10 для каждой группы в каждом эксперименте). p=8,5×10-6 (YW327.6S2 против контроля), p=2,8×10-8 (YW327.6S2 против комбинации), p=0,05 (12A11 против контроля), p=0,145 (средство против VEGF против комбинации). C и D. YW327.6S2 подавляет экспрессию Axl. Мышам, имеющим ксенотрансплантаты опухолей MDA-MB231 (средний размер 500 мм3), вводили mAb в дозе 20 мг/кг, и опухоли вырезали в указанные моменты времени. Клеточные лизаты опухолей использовали в вестерн-блот-анализе для экспрессии Axl. E. YW327.6S2 снижает плотность связанных с опухолью сосудов. Опухоли мышей, которым проводили введение, как указано выше для C, вырезали через 0 ч и 1 неделю после дозирования и сосуды опухоли визуализировали путем окрашивания иммуногистохимией с помощью MECA32 и количественно определяли с помощью анализа изображения (выражали в качестве квадратных микрометров). Для каждой пары вычисляли t-критерий Стьюдента (p<0,05 для YW327.6S2 против контроля, средство против VEGF против контроля и средство против VEGF против комбинации). F. Axl в высокой степени экспрессируется в инфильтрирующих макрофагах первичного рака молочной железы человека. Иммуногистохимию использовали для исследования 79 первичных опухолей. 21% из этих опухолей экспрессируют высокие уровни Axl в инфильтрирующих макрофагах. Макрофаги идентифицировали путем окрашивания с помощью антитела против CD68, и экспрессию Axl на макрофагах определяли с помощью двойной IHC с антителами против Axl/CD68. Использовали серийные срезы. G. YW327.6S2 ингибирует секрецию воспалительных цитокинов/хемокинов из связанных с опухолью макрофагов. Мышам, которые имели ксенотрансплантаты опухолей MDA-MB231 (средний размер 500 мм3), вводили контрольное YW327.6S2 или 12A11 в дозе 20 мг/кг и опухоли вырезали через 1 неделю после в