Устройство и способ выделения лейкоцитов и раковых клеток путем фильтрования
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Устройство включает фильтрационные устройства. Каждое фильтрационное устройство содержит верхнюю камеру, которая является цилиндрической трубкой, нижнюю камеру, которая является цилиндрической трубкой, и сложенные в стопку фильтровальные мембраны между верхней и нижней камерами. Сложенные в стопку фильтровальные мембраны способны задерживать лейкоциты. Внутренние диаметры верхней и нижней камер одинаковы, чтобы создать цилиндрическую трубку, что дозволяет жидкостям протекать через нее. Сложенные в стопку фильтровальные мембраны помещены между резьбой верхней камеры и нижней камеры. Камеры скреплены друг с другом. Приемный сосуд для сбора эритроцитов из образца цельной крови выбран из приемной пробирки, многолуночного приемного сосуда или мультипробирочного приемного сосуда. Фильтрационное устройство размещается над приемным сосудом. Устройство предназначено для использования вместе с центрифугой. Раскрыт способ получения лизата лейкоцитов из образца цельной крови без существенного разбавления терапевтического средства. Изобретения обеспечивают получение клеточных лизатов из выделенных клеток типа лейкоцитов и/или циркулирующих опухолевых клеток без существенного разбавления терапевтического средства, как-то противоракового препарата. 2 н. и 12 з.п. ф-лы, 2 табл., 32 ил.
Реферат
Перекрестные ссылки на родственные заявки
Настоящее изобретение претендует на приоритет по предварительной заявки на патент США №61/444044, поданной 17 февраля 2011 г., и №61/489998, поданной 25 мая 2011 г., содержание которых включено сюда путем отсылки во всей полноте на все случаи.
Уровень техники
Рак является второй ведущей причиной смертности в США. Существует постоянно растущая потребность в точном анализе онкогенных маркеров для диагностики и прогнозирования рака. Например, выявление массива онкогенных маркеров даст возможность врачам обнаруживать рак на ранней стадии и отслеживать течение рака. Зная восприимчивость больного к противораковой терапии до начала приема лекарства, врачи бы могли выбрать самый лучший курс лечения для каждого отдельного больного. Кроме того, рутинный анализ эффективности препарата во время курса лечения может выявить невосприимчивость пациента к определенным противораковым препаратам. Такая информация могла бы использоваться для лучшего выбора схемы приема препарата.
Современные методы анализа онкогенных маркеров основываются на выявлении злокачественных клеток в гетерогенной смеси нормальных и раковых клеток типа цельной крови. Такие методы, как система выделения тотальной РНК LeukoLOCK (Ambion), выхватывают циркулирующие злокачественные клетки из цельной крови путем пропускания образца крови через одноразовые фильтры, задерживающие лейкоциты. Как правило, при извлечении злокачественных клеток эти задерживающие фильтры промывают буфером типа PBS. Эта стадия промывки изменяет внутриклеточные концентрации противораковых препаратов, ранее попавших в клетки, и тем самым может вызвать de novo сигнальные ответы внутри клеток и изменить экспрессию онкогенных маркеров. Следовательно, экспрессия онкогенных маркеров в анализируемом образце может не точно отражать реакцию больного на определенную противораковую терапию. Это может привести к неправильной оценке диагноза и/или прогноза. Настоящее изобретение преодолевает этот потенциальный источник ошибки путем обеспечения способов и устройств для выделения субпопуляций клеток крови без изменения внутриклеточной концентрации противоракового препарата.
Сущность изобретения
Настоящим изобретением предусмотрено устройство и способы выделения, сбора и/или извлечения субпопуляций клеток крови, таких как нормальные лейкоциты, пораженные болезнью лейкоциты, злокачественные лейкоциты, лейкемические клетки, пенистые клетки и/или циркулирующие опухолевые клетки (CTCs) из образца крови путем фильтрования без изменения внутриклеточной (in vivo) концентрации терапевтического средства, т.е. противоракового препарата (например, ингибитора тирозинкиназ). В некоторых аспектах настоящего изобретения предусмотрены устройства для выделения клеток, включающие фильтрационное устройство и приемную пробирку.
В одном аспекте настоящего изобретения предусмотрено устройство для выделения и отделения лейкоцитов от эритроцитов в образцах цельной крови, которое включает:
фильтрационное устройство, содержащее верхнюю камеру, нижнюю камеру и одну или несколько сложенных в стопку фильтровальных мембран между верхней и нижней камерами, причем одна или несколько сложенных в стопку фильтровальных мембран способны задерживать лейкоциты; и
приемную пробирку для сбора эритроцитов из образца цельной крови, причем фильтрационное устройство размещается над приемной пробиркой, при этом эритроциты отделяются от лейкоцитов и попадают в приемную пробирку после центрифугирования. В предпочтительном аспекте нижняя камера располагается между верхней камерой и приемной пробиркой.
В другом предпочтительном воплощении настоящего изобретения предусмотрен способ получения лизата лейкоцитов из образца цельной крови без существенного разбавления средства (например, противоракового препарата), который включает:
(a) внесение образца цельной крови в (фильтрационное) устройство для выделения клеток, такое как устройство, описанное здесь;
(b) центрифугирование устройства для захвата лейкоцитов на одну или несколько сложенных в стопку фильтровальных мембран для отделения эритроцитов в приемную пробирку; и
(c) лизис лейкоцитов, захваченных на одну или нескольких сложенных в стопку фильтровальных мембран, с помощью буфера для лизиса, но без стадии промывки между стадиями (b) и (с), получая при этом лизат лейкоцитов.
В другом аспекте настоящего изобретения предусмотрен способ мониторинга эффективности противоракового препарата у субъекта, причем субъект страдает гематологическим раковым заболеванием, который включает:
введение противоракового препарата субъекту, причем первое введение противоракового препарата происходит во время T1;
измерение активационного состояния и/или уровня экспрессии BCR-ABL во время T2 в образце от субъекта; и
определение курса лечения на основе активационного состояния и/или уровня экспрессии BCR-ABL.
В некоторых воплощениях способ дополнительно включает измерение активационного состояния BCR-ABL во время T0, т.е. перед первым введением противоракового препарата. В некоторых случаях гематологическое раковое заболевание представлено лимфомой или лейкемией типа хронической миелогенной лейкемии (CML). Разница во времени между T1 и T2 составляет от 1 недели до 6 месяцев, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 недели. Разница во времени между T0 и T1 составляет от 1 дня до 3 недель. В некоторых других аспектах способы дополнительно включают измерение уровня экспрессии и/или активации по меньшей мере еще одной молекулы передачи сигналов типа CRKL, AKT, STAT5 и SRC.
В некоторых аспектах курс лечения выбирают из изменения дозы противоракового препарата, замены противоракового препарата, в том числе дополнительного противоракового препарата, изменения продолжительности лечения и поддержания существующего курса лечения.
В некоторых аспектах образец включает экстракт выделенных клеток. В некоторых аспектах выделенные клетки инкубируют in vitro по меньшей мере с одним противораковым препаратом (например, 2 противораковыми препаратами) во время T0 (до начала лечения). В других случаях выделенные клетки инкубируют in vitro по меньшей мере с двумя противораковыми препаратами во время T2, перед определением курса лечения.
В следующем воплощении настоящего изобретения предусмотрен способ выбора противоракового препарата у субъекта, причем субъект страдает гематологическим раковым заболеванием, который включает:
измерение уровня активационного состояния BCR-ABL в выделенных клетках из образца от субъекта;
инкубирование выделенных клеток по меньшей мере с одним противораковым препаратом до начала лечения;
измерение уровня активационного состояния BCR-ABL в инкубированных клетках; и
выбор курса лечения на основе уровня активационного состояния BCR-ABL.
В некоторых аспектах курс лечения выбирается из группы, состоящей из выбора противоракового препарата, выбора дозы противоракового препарата и определения продолжительности лечения. В некоторых других аспектах способы дополнительно включают измерение уровня экспрессии и/или активации по меньшей мере еще одной молекулы передачи сигналов типа CRKL, AKT, STAT5 и SRC.
Таким образом, настоящим изобретением предусмотрен способ выбора противоракового препарата для субъекта с гематологическим раковым заболеванием, который включает:
1) измерение уровня активационного состояния BCR-ABL в выделенных клетках из образца от субъекта;
2) инкубирование выделенных клеток по меньшей мере с одним противораковым препаратом до начала лечения;
3) измерение уровня активационного состояния BCR-ABL в инкубированных клетках; и выбор курса лечения на основе уровня активационного состояния BCR-ABL.
Настоящим изобретением также предусмотрен способ мониторинга эффективности противоракового препарата у субъекта, причем субъект страдает гематологическим раковым заболеванием, который включает:
a) измерение активационного состояния BCR-ABL во время T0, перед первым введением противоракового препарата;
b) введение противоракового препарата субъекту, причем первое введение противоракового препарата происходит во время T1;
c) измерение активационного состояния и/или уровня экспрессии BCR-ABL во время T2 в образце от субъекта; и
d) определение курса лечения на основе активационного состояния и/или уровня экспрессии BCR-ABL.
Другие цели, особенности и преимущества настоящего изобретения станут понятными специалистам в данной области из последующего подробного описания и рисунков.
Краткое описание фигур
На фиг. 1 представлена блок-схема одного воплощения настоящего изобретения.
На фиг. 2A-G представлен один вариант устройства для выделения клеток. На фиг. 2А представлен один вариант верхней камеры. На фиг. 2В-С представлена верхняя камера с крышкой; на фиг. 2D-E - нижняя камера; а на фиг. 2F-G - приемная пробирка.
На фиг. 3A-D представлены варианты нижней камеры с воронками различной функциональности.
На фиг. 4A-D представлены варианты устройства для выделения клеток. На фиг. 4А представлен вариант верхней и нижней камеры; на фиг. 4В - другой вариант верхней и нижней камеры; на фиг. 4С - вариант приемной пробирки; а на фиг. 4D - вариант сборки из верхней камеры, нижней камеры и приемной пробирки.
На фиг. 5A-D представлен другой вариант устройства для выделения клеток. На фиг. 5А представлен вариант верхней и нижней камеры; на фиг. 5В - вариант верхней и нижней камеры с крышкой; на фиг. 5С - вариант приемной пробирки с крышкой; а на фиг. 5D - вариант нижней камеры и воронки.
На фиг. 6А-С представлен еще один вариант устройства для выделения клеток. На фиг. 6А представлен вариант верхней и нижней камеры; на фиг. 6В - вариант верхней и нижней камеры со средним рукавом; на фиг. 6С - вариант нижней камеры.
На фиг. 7А-В показано, что в клеточных лизатах, полученных из клеток K562 путем фильтрации, выявляется и измеряется как общий, так и фосфорилированный BCR-ABL. Уровень общего BCR-ABL в клетках после фильтрации близок уровням, наблюдающимся в нефильтрованных образцах. Кроме того, из фиг. 7B видно, что уровни фосфорилированного BCR-ABL в клетках K562 после фильтрации сравнимы с уровнями, обнаруженными в необработанных клетках.
На фиг. 8А-В показано, что в клеточных лизатах выявляется и измеряется уровень как общего (фиг. 8А), так и фосфорилированного BCR-ABL (фиг. 8В), при этом клеточные лизаты были получены из образцов крови с добавлением клеток K562, профильтрованы через фильтровальные мембраны и подвергнуты анализу на микроматрицах типа описанного здесь иммуноанализа, основанного на близком взаиморасположении. На фиг. 8В представлено сравнение выхода общего и фосфорилированного BCR-ABL в различных образцах, которые центрифугировали с различной скоростью. Самый высокий уровень сигнала фосфо-BCR-ABL (63, 60%) и общего BCR-ABL (141, 55%) получали при использовании фильтровальной мембраны PALL и центрифугировании при 600 об/мин.
На фиг. 9А-В показано, что уровень фосфорилированного BCR-ABL (А) выявляется и измеряется в клеточных лизатах, полученных из образцов крови с добавлением различного количества клеток K562, профильтрованных через фильтровальные мембраны и подвергнутых анализу на микроматрицах типа описанного здесь иммуноанализа, основанного на близком взаиморасположении. Способы по настоящему изобретению можно использовать для определения уровня фосфо-BCR-ABL в образцах с добавлением клеток K562. В частности, измеренный уровень фосфорилированного BCR-ABL зависит от числа клеток K562, добавленных в образцы крови. На фиг. 9В показан выход общего BCR-ABL.
На фиг. 10 представлены пациенты, подвергавшиеся анализу в одном воплощении настоящего изобретения. Пациент 1 страдает активным CML и находится на лечении с декабря 2006 г. Пациент 2 также страдает активным CML и получает иматиниб с января.
На фиг. 11А-В показано, что пациент 1 (А) имеет меньшее содержание фосфо-BCR-ABL на мл (например, 10979 ед/мл ± 1245 ед/мл) крови по сравнению с пациентом 2 (например, 185934 ед/мл ± 11019 ед/мл) (В), свидетельствуя, что пациент 1 реагирует на лечение иматинибом. Значения определяли без вычитания фона крови.
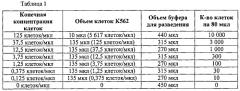
На фиг. 12А-В представлено выявление уровня активированного (фосфорилированного) BCR-ABL при определении описанными здесь способами. Образцы клеточных лизатов, полученные от пациента 1, разводили 1:5 и 1:20 в соответствии со способами, описанными в примере 6. Стандартный образец представляет лизаты необработанных клеток K562 с различным числом клеток на 80 мкл лизата (например, 10000, 3000, 1000, 300, 100, 30, 10 или 0 клеток / 80 мкл). Сверху на фиг. 12А представлены снимки анализа BCR-ABL методом CEER.
На фиг. 13А-В показано, что обработка иматинибом in vitro образца крови от пациента 1 резко уменьшает содержание фосфорилированного BCR-ABL по сравнению с обработкой нилотинибом. На фиг. 13А представлены снимки анализа BCR-ABL методом CEER.
На фиг. 14 показано, что уровни активированного BCR-ABL в образце крови от пациента 1 изменяются при обработке возрастающими количествами ингибитора BCR-ABL (например, иматиниба или нилотиниба). Различные концентрации препарата инкубировали с образцом крови пациента 1 в течение 1,5 ч при 37°С. Среднее значение составило 26 ед. после обработки 1 мкМ иматиниба и 110 ед. после обработки 0,1 мкМ иматиниба. Сверху на фиг. 13 представлены снимки анализа BCR-ABL методом CEER.
На фиг. 15А-В показано, что иматиниб более эффективно, чем нилотиниб, снижает уровень активированного белка BCR-ABL в образце крови пациента 1. Из гистограмм видно, что обработка 1 мкМ иматиниба снижает уровень активированного BCR-ABL (А) по сравнению с необработанным образцом. Фиг.15В - после вычитания фона крови.
На фиг. 16A-D представлен профиль других фосфорилированных компонентов пути передачи сигналов, таких как CRKL (А), AKT (В), STAT5 (С) и SRC (D). Из него видно, что терапия дасатинибом снижает уровни активированного AKT, STAT4 и SRC в образце крови пациента 1. Обработка in vitro образцов крови пациента 1 мкМ дасатиниба была более эффективной, чем 10 мкМ иматиниба или 10 мкМ нилотиниба.
На фиг. 17 показано, что образец крови пациента 1 содержит очень высокий уровень общего BCR (около 8000000 ед/мл).
На фиг. 18А-В показано, что нилотиниб по сравнению с иматинибом более эффективно снижает уровень активированного BCR-ABL в обработанных in vitro образцах крови от пациента 2. Из фиг. 18А видно, что инкубация in vitro образца крови пациента 2 с 10 мкМ нилотиниба наиболее эффективно снижала выход сигнала фосфо-BCR-ABL. Уровни фосфорилированного BCR-ABL выявляли и измеряли после обработки in vitro образцов крови пациента различными дозами ингибиторов BCR-ABL в течение 1,5 ч при 37°С. Из фиг. 18B видно, что увеличение дозы нилотиниба снижает уровень активированного BCR-ABL, в то время как иматиниб не оказывает влияния на образец крови пациента 2. Выход сигнала фосфо-BCR-ABL снижался до 39,35% при 10 мкМ нилотиниба и только до 96,46% при 10 мкМ иматиниба.
На фиг. 19A-D показано, что обработка in vitro образца крови пациента 2 дасатинибом уменьшает уровни активированного CRKL (А), AKT (В), STAT5 (С) и SRC (D). С другой стороны, такая же обработка иматинибом или нилотинибом снижает только фосфорилированный AKT.
На фиг. 20A-D показано, что уровень фосфорилированного CRKL выявляется и измеряется в нескольких образцах крови пациентов, которые также обрабатывали ингибиторами тирозинкиназы in vitro. Ингибиторы BCR-ABL, такие как иматиниб и нилотиниб, снижали уровень CRKL только в образцах крови пациента 1, но не пациента 2. Из фиг. 20А-В видно, что уровень фосфо-CRKL (ед/мл крови) уменьшался в образцах крови от пациента 1, обработанных in vitro 10 мкМ иматиниба или 10 мкМ нилотиниба, по сравнению с необработанным образцом. Точно так же из фиг. 20C-D видно, что выход сигнала фосфо-CRKL в образцах от пациента 1 уменьшался после обработки in vitro. Аналогичного ответа не наблюдалось в образцах от пациента 2.
На фиг. 21A-D показано, что пациент 1 и пациент 2 не одинаково реагируют на иматиниб и нилотиниб. Активированный AKT повышался в образцах от пациента 1 после обработки иматинибом, но уменьшался в образцах от пациента 2. В ответ на нилотиниб уровень AKT оставался в основном неизменным в образцах от пациента 1 по сравнению с необработанными образцами, причем он сильно снижался в образцах от пациента 2. На фиг. 21А-В представлены результаты, рассчитанные в пикограммах активированного AKT на 1000 проанализированных клеток. На фиг. 21C-D представлены результаты при определении в процентах от сигнала AKT, полученного при анализе методом CEER.
На фиг. 22А-В представлены профили активированного STAT5 в обработанных in vitro образцах крови от пациента 1 (А) и пациента 2 (В). Обработка дасатинибом снижала уровень фосфо-STAT5 в образцах от пациента 1 и пациента 2. Обработка иматинибом или нилотинибом не влияла на активированный STAT5 в такой же степени.
На фиг. 23A-D показано, что образцы от пациентов 1 и 2 имеют более низкие уровни фосфо-SRC в ответ на иматиниб, нилотиниб и дасатиниб. На фиг. 23А-В представлены уровни фосфо-SRC, рассчитанные в пикограммах на 1000 проанализированных клеток. На фиг. 23C-D представлены уровни фосфо-SRC в процентах от сигнала фосфо-SRC.
На фиг. 24 представлен список пациентов, участвовавших в данном исследовании. Пациенты с диагнозом CML получали целенаправленное лечение. У этих пациентов отслеживали модуляции ингибирования BCR-ABL in vivo методом CEER.
На фиг. 25 представлен список некоторых пациентов, участвовавших в данном исследовании. Звездочкой обозначены образцы крови, которые были обработаны с использованием пробирочного варианта устройства для выделения клеток настоящего изобретения. Другие образцы крови обрабатывали с использованием варианта с 96-луночным планшетом.
На фиг. 26 представлен уровень экспрессии BCR-ABL, BCR и ABL в образце крови от нормального, здорового субъекта.
На фиг. 27А-В представлен уровень активированного BCR-ABL у пациентов 1 (А) и 7 (В) в различные моменты времени. WBC = лейкоциты. pBCR-ABL=фосфо-BCR-ABL. tBCR-ABL = общий BCR-ABL. %Р/Т=фосфо-BCR-ABL/tBCR-ABL в процентах.
На фиг. 28А-С представлен профиль BCR-ABL у пациента 2 в различные моменты времени. Из фиг. 28А видно, что соотношение pBCR-ABL/WBC уменьшалось в крови, взятой 5/11, и возрастало к 10/12. Звездочка означает, что данные по pBCR-ABL умножали на 10, чтобы они были видны на графике. Из фиг. 28B видно, что соотношение pBCR-ABL/общий BCR-ABL было самым низким на 5/11. На фиг. 28С представлены результаты количественного анализа RT-PCR с использованием набора MolecularMD для BCR-ABL при низких уровнях мРНК. Процент BCR-ABL/ABL изменяется в зависимости от количества мРНК в образце.
На фиг. 29А-В представлено количество лейкоцитов WBC и соотношение pBCR-ABL/WBC у пациента 3 в различные моменты времени (А). На фиг. 29B представлены изменения уровней общего и активированного BCR-ABL и проценты мРНК.
На фиг. 30А-В представлены уровни общего и активированного BCR-ABL у пациента 8 в различные моменты времени (А). На фиг. 30B представлены изменения уровни общего и активированного BCR-ABL и проценты мРНК после перевода лечения с иматиниба на дасатиниб.
На фиг. 31А-В представлены уровни общего и активированного BCR-ABL у пациентов 14(В) и 18(А) в различные моменты времени.
На фиг. 32А-В представлена реакция пациента 14 на обработку иматинибом или нилотинибом in vitro. Уровни общего и фосфо-BCR-ABL уменьшались после обработки препаратами.
Раскрытие сущности изобретения
Введение
Настоящим изобретением преимущественно предусмотрены новые устройства и способы выделения или извлечения субпопуляций клеток крови, таких как нормальные и/или злокачественные лейкоциты, лейкемические клетки, пенистые клетки и/или циркулирующие опухолевые клетки (CTCs), из образцов крови путем фильтрования без изменения внутриклеточной концентрации терапевтического средства, как-то противоракового препарата (например, ингибитора тирозинкиназ, такого, например, как иматиниб мезилат (Gleevec®), нилотиниб (Tasigna®), дасатиниб (Sprycel®), босутиниб (SKI-606), гефитиниб (Iressa®), сунитиниб (Sutent®), эрлотиниб (Tarceva®), лапатиниб (GW-572016; Tykerb®), канертиниб (CI 1033), семаксиниб (SU5416), ваталаниб (PTK787/ZK222584), сорафениб (BAY 43-9006; Nexavar®), лефлуномид (SU101), вандетаниб (Zactima™; ZD6474), понатиниб (АР24534) и их комбинации). В отличие от предшествующего уровня техники, устройства и способы настоящего изобретения дают клеточные лизаты из выделенных клеток, таких как лейкоциты, лейкемические клетки, пенистые клетки и/или циркулирующие опухолевые клетки, без существенного разбавления терапевтического средства, как-то противоракового препарата (например, ингибитора тирозинкиназ).
Слитый белок BCR-ABL человека связан с хронической миелогенной лейкемией (CML), а также с острой лимфобластной лейкемией (ALL). В частности, белок BCR-ABL является активной тирозинкиназой, которая играет важную роль в патогенезе рака. Хотя в настоящее время иматиниб (Gleevec®) является препаратом первого ряда для недавно диагностированных пациентов с CML, однако примерно 20-25% больных не достигают устойчивого полного цитогенетического ответа. Исследования показали, что главной причиной резистентности является реактивация BCR-ABL киназной активности при продолжительном лечении иматинибом. Таким образом, измерение активности BCR-ABL найдет применение при прогнозировании ответа на терапию такими ингибиторами тирозинкиназ, как иматиниб, а также при идентификации тех пациентов, у которых возникает устойчивость к таким ингибиторам.
В некоторых воплощениях устройства и способы настоящего изобретения могут применяться для выделения или извлечения нужных клеток (например, лейкоцитов, лейкемических клеток, пенистых клеток и/или циркулирующих опухолевых клеток) из таких образцов, как кровь, и получения из них клеточных лизатов, при этом такие аналиты, как, например, BCR-ABL, которые присутствуют в полученном лизате, можно подвергнуть анализу на уровень их экспрессии и/или активации таким методом, как совмещенный усиленный ферментом реактивный иммуноанализ (Collaborative Enzyme Enhanced Reactive ImmunoAssay, CEER™), также известный как совмещенный иммуноанализ, основанный на близком взаиморасположении (Collaborative Proximity ImmunoAssay, COPIA). CEER™ описан в следующих патентных документах, которые включены сюда путем ссылки во всей полноте на все случаи: публикация РСТ No. WO 2008/036802; публикация РСТ No. WO 2009/012140; публикация РСТ No. WO 2009/108637; публикация РСТ No. WO 2010/132723; публикация РСТ No. WO 2011/008990; и публикация РСТ No. PCT/US 2010/053386, поданная 20 октября 2010 г.
В определенных воплощениях выявление профиля экспрессии/активации одного или нескольких онкогенных слитых белков, их субстратов и/или других белков пути передачи сигналов (например, BCR-ABL, BCR, ABL, CRKL, JAK2, STAT5, Src, FAK, с-ABL, c-CBL, SHC, SHP-2, VAV, BAP-1, AKT, SRC, EGFR, HER-2, HER-3, HER-4, VEGFR-1, VEGFR-2, VEGFR-3, PDGFR, c-Met, c-KIT, IGF-IR, PI3K и др.) может выполняться на клеточных лизатах, полученных с применением устройств и способов настоящего изобретения, для определения эффективности ингибиторной терапии у пациентов с опосредованными BCR-ABL заболеваниями (например, хронической миелогенной лейкемией). В некоторых случаях пациенты могут получать ингибиторную терапию типа лечения ингибиторами тирозинкиназ, как описано здесь. В определенных случаях лейкемические клетки выделяют из образцов крови таких пациентов без существенного разбавления ингибитора тирозинкиназ. В некоторых других случаях выявление профиля экспрессии/активации онкогенных слитых белков и/или компонентов пути передачи сигналов в образцах после обработки ингибиторами тирозинкиназ in vitro может дать ценную информацию, позволяющую врачу выбрать эффективный режим терапии.
В качестве неограничивающего примера, можно подвергнуть анализу образец крови от пациента, получающего терапию ингибитором тирозинкиназ, чтобы определить эффективность лечения. Можно взять кровь у пациента и выделить нужные клетки, как-то лейкоциты, лейкемические клетки и/или циркулирующие опухолевые клетки, фильтрационным методом с применением устройств и способов по изобретению. Затем клетки подвергают лизису и анализируют таким методом, как CEER™, чтобы определить эффект лечения ингибитором тирозинкиназ на активационное состояние и/или общее количество одного или нескольких онкогенных слитых белков (например, BCR-ABL), их субстратов (например, таких субстратов BCR-ABL, как CRKL, JAK2, STAT5, Src, FAK, с-ABL, c-CBL, SHC, SHP-2, VAV и/или BAP-1) и/или других молекул передачи сигналов. В определенных воплощениях можно определить число лейкоцитов, лейкемических клеток и/или циркулирующих опухолевых клеток и профиль фосфорилированного BCR-ABL и других компонентов пути передачи сигналов. При этом также можно рассчитать соотношение сигналов фосфорилирования и использовать его для определения прогноза у пациента. В определенных воплощениях можно отслеживать эффективность терапии ингибиторами тирозинкиназ у пациента путем введения ингибитора тирозинкиназ во время T1, измерения активационного состояния и/или уровня экспрессии BCR-ABL во время T2 в образце от пациента и определения курса лечения, исходя из активационного состояния и/или уровня экспрессии BCR-ABL.
В качестве другого неограничивающего примера, можно инкубировать образец крови от пациента (например, не получающего лечения ингибитором тирозинкиназ) in vitro с одним или несколькими ингибиторами перед выделением лейкоцитов, лейкемических клеток и/или циркулирующих опухолевых клеток (CTCs). В определенных случаях образцы цельной крови, взятые у пациентов с диагнозом CML, обрабатывают одним или несколькими ингибиторами тирозинкиназ (например, иматинибом, нилотинибом, дасатинибом и др.). Представляющие интерес клетки, как-то лейкемические клетки, выделяют путем фильтрования с применением устройств и способов настоящего изобретения. Клетки затем подвергают лизису и анализируют таким методом, например, как CEER™, для определения эффекта лечения ингибитором тирозинкиназ на активационное состояние и/или общее количество одного или нескольких онкогенных слитых белков (например, BCR-ABL), их субстратов (например, таких субстратов BCR-ABL, как CRKL, JAK2, STAT5, Src, FAK, c-ABL, c-CBL, SHC, SHP-2, VAV и/или BAP-1) и/или других молекул передачи сигналов. В определенных воплощениях можно выбрать подходящий ингибитор тирозинкиназ для пациента на основе измерения активационного состояния или уровня BCR-ABL в выделенных клетках из образца, инкубации выделенных клеток по меньшей мере с одним противораковым препаратом, как-то с одним или несколькими ингибиторами тирозинкиназ до начала лечения, измерения активационного состояния или уровня BCR-ABL в проинкубированных клетках и выбора курса лечения, исходя из активационного состояния или уровня BCR-ABL.
Определения
В настоящем изобретении следующие термины имеют приписываемые им значения, если не указано иначе.
Термин "рак" охватывает всех представителей класса заболеваний, характеризующихся неконтролируемым ростом аномальных клеток. Термин охватывает все известные раковые и неопластические заболевания, будь то злокачественные, доброкачественные, мягкие или твердые (солидные), а также рак на всех стадиях и всякой степени, включая пре- и пост-метастатический рак. Неограничивающими примерами различных типов рака являются гематологические раковые заболевания (например, лейкемия, лимфома); остеогенные саркомы (например, саркома Юинга); саркомы мягких тканей (например, выступающая дерматофибросаркома (DFSP), рабдомиосаркома); другие раковые заболевания мягких тканей, папиллярная карцинома щитовидной железы; рак простаты; рак желудка; рак молочной железы; рак легких (например, немелкоклеточный рак легких); рак пищеварительного и желудочно-кишечного тракта (например, колоректальный рак, желудочно-кишечные стромальные опухоли, желудочно-кишечные карциноидные опухоли, рак толстой кишки, рак прямой кишки, рак заднего прохода, рак желчных протоков и рак тонкой кишки); рак пищевода; рак желчного пузыря; рак печени; рак поджелудочной железы; рак червеобразного отростка (аппендикса); рак яичников; рак почек (например, почечно-клеточная карцинома); рак центральной нервной системы; рак кожи; хориокарцинома; и рак головы и шеи. При этом "опухоль" включает одну или несколько раковых клеток.
"Гематологические раковые заболевания" включают любые типы рака, которые затрагивают кровь, костный мозг и/или лимфатические узлы. Примерами гематологических раковых заболеваний являются, без ограничения, лейкемия, лимфома и множественная миелома. Неограничивающими примерами различных видов лейкемии являются хроническая миелогенная лейкемия (CML), острая лимфобластическая лейкемия (ALL), хроническая лимфоцитарная лейкемия (CLL), острая миелогенная лейкемия (AML) и крупно-гранулярная лимфоцитарная лейкемия. Разновидности CML включают, например, хроническую моноцитарную лейкемию. Разновидности ALL включают, например, острую лимфобластическую лейкемию предшественников В-клеток, острую лимфобластическую лейкемию про-В-клеток, острую лимфобластическую лейкемию предшественников Т-клеток и острую бифенотипическую лейкемию. Разновидности CLL включают, например, пролимфоцитарную В-клеточную лейкемию. Разновидности AML включают, например, острую промиелоцитарную лейкемию, острую миелобластическую лейкемию и острую мегакариобластическую лейкемию. Примеры различных типов лимфомы включают, без ограничения, лимфому Ходжкина (четыре подтипа) и неходжкинскую лимфому, как-то, например, малую лимфоцитарную лимфому (SLL), диффузную крупно-В-клеточную лимфому (DLBCL), фолликулярную лимфому (FL), лимфому клеток мантии (MCL), волосковидно-клеточную лейкемию (HCL), лимфому маргинальной зоны (MZL), лимфому Беркитта (BL), пост-трансплантационную лимфопролиферативную болезнь (PTLD), Т-клеточную пролимфоцитарную лейкемию (Т-PLL), В-клеточную пролимфоцитарную лейкемию (B-PLL), макроглобулинемию Вальденстрома (также известна как лимфоплазмацитарная лимфома) и другие NK- или Т-клеточные лимфомы.
Термин "определяемое вещество (аналит)" охватывает любые молекулы, обычно макромолекулы типа полипептидов, наличие, количество и/или идентичность которых определяется. В определенных случаях аналитом является клеточный компонент раковых клеток, предпочтительно онкогенный слитый белок или молекула передачи сигналов.
Термин "трансформация" или "преобразование" охватывает физические и/или химические изменения аналита или образца для того, чтобы экстрагировать аналит либо изменить или модифицировать его определенным образом. В настоящем изобретении экстракция, обработка, химическая преципитация, ELISA, комплексообразование, иммуноэкстракция, физическая или химическая модификация аналита или образца для измерения уровня или концентрации или активационного состояния аналита - все это составляет преобразование. Иными словами, если аналит или образец не идентичны до и после стадии трансформации, то изменение или модификация составляет преобразование.
В настоящем изобретении термин "серийное разведение" служит для обозначения ряда понижающихся концентраций определенного образца (например, клеточного лизата) или реагента (например, антитела). Серийное разведение обычно получают смешиванием отмеренного количества образца или реагента в исходной концентрации с разбавителем (например, разбавляющим буфером), получая меньшую концентрацию образца или реагента, и повторением этого процесса достаточное количество раз до получения нужного числа серийных разведений. Образец или реагент может быть серийно разведен по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 500 или 1000 раз, давая серийные разведения, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45 или 50 понижающихся концентраций образца или реагента. Например, серийные разведения, составляющие 2-кратное серийное разведение реагента захватывающего антитела при исходной концентрации в 1 мг/мл, можно получить при смешивании одного объема захватывающего антитела в исходной концентрации с равным объемом разбавляющего буфера, получая концентрацию захватывающего антитела в 0,5 мг/мл, и повторяя этот процесс до получения концентраций захватывающего антитела в 0,25 мг/мл, 0,125 мг/мл, 0,0625 мг/мл, 0,0325 мг/мл и т.д.
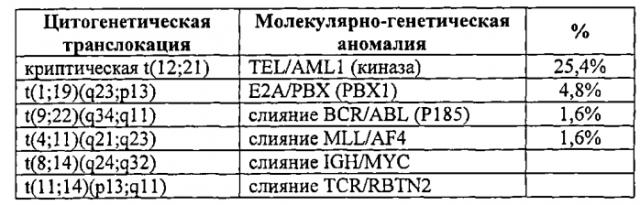
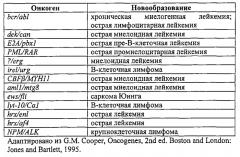
Термин "слитый белок" или "химерный белок" охватывает белки, образующиеся при соединении двух или нескольких генов, исходно кодирующих отдельные белки. Такие слияния генов обычно происходят тогда, когда хромосомная транслокация замещает терминальные экзоны одного гена интактными экзонами из второго гена. При этом образуется единый ген, который может транскрибироваться, подвергаться сплайсингу и транслироваться с образованием функционального слитого белка. В определенных воплощениях слитый белок является онкогенным слитым белком, т.е. слитым белком, вовлеченным в онкогенез. Примеры онкогенных слитых белков включают, без ограничения, BCR-ABL, DEK-CAN, Е2А-РВХ1, RARα-PML, IREL-URG, CBFβ-MYH11, AML1-MTG8, EWS-FLI, LYT-10-Cα1, HRX-ENL, HRX-AF4, NPM-ALK, IGH-MYC, RUNX1-ETO, TEL-TRKC, TEL-AML1, MLL-AF4, TCR-RBTN2, COL1A1-PDGF, E2A-HLF, PAX3-FKHR, ETV6-NTRK3, RET-PTC, TMRSS-ERG и TPR-MET.
Термин "молекула передачи сигналов" или "сигнальный трансдуктор" включает белки и другие молекулы, осуществляющие процесс, посредством которого клетка преобразует внеклеточный сигнал или раздражитель в ответ, который как правило включает упорядоченную последовательность биохимических реакций внутри клетки. Примеры молекул передачи сигналов включают, без ограничения, рецепторные тирозинкиназы, такие как EGFR (например, EGFR/HER-1/ErbB1, HER-2/Neu/ErbB2, HER-3/ErbB3, HER-4/ErbB4), VEGFR-1/FLT-1, VEGFR-2/FLK-1/KDR, VEGFR-3/FLT-4, FLT-3/FLK-2, PDGFR (например, PDGFRA, PDGFRB), c-Met, c-KIT/SCFR, INSR (инсулиновый рецептор), IGF-IR, IGF-IIR, IRR (рецептор, родственный инсулиновому рецептору), CSF-1R, FGFR 1-4, HGFR 1-2, CCK4, TRK А-С, MET, RON, ЕРНА 1-8, ЕРНВ 1-6, AXL, MER, TYRO3, TIE 1-2, TEK, RYK, DDR 1-2, RET, c-ROS, V-кадгерин, LTK (тирозинкиназа лейкоцитов), ALK (киназа анапластической лимфомы), ROR 1-2, MUSK, AATYK 1-3, RTK 106, и укороченные формы рецепторных тирозинкиназ, такие как p95ErbB2; нерецепторные тирозинкиназы, такие как Src, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack и LIMK; тирозинкиназы компонентов сигнального каскада, такие как Акт, MAPK/ERK, MEK, RAF, PLA2, MEKK, JNKK, JNK, р38, She (р66), PI3K, Ras (например, K-Ras, N-Ras, H-Ras), Rho, Racl, Cdc42, PLC, PKC, киназа p70 S6, p53, циклин D1, STAT1, STAT3, PIP2, PIP3, PDK, mTOR, BAD, p21, P27, ROCK, IP3, TSP-1, NOS, PTEN, RSK 1-3, JNK, c-Jun, Rb, CREB, Ki67 и паксиллин; ядерные рецепторы гормонов, такие как эстрогеновый рецептор (ER), прогестероновый рецептор (PR), андрогеновый рецептор, глюкокортикоидный рецептор, минералокортикоидный рецептор, рецептор витамина А, рецептор витамина D, ретиноидный рецептор, рецептор тиреоидного гормона и рецепторы-"сироты", ко-активаторы и репрессоры ядерных рецепторов; и их комбинации.
Термин "образец" в настоящем изобретении охватывает любые биологические образцы, полученные от пациента. Образцы включают, без ограничения, цельную кровь, плазму, сыворотку, смывную жидкость протоков, аспират из сосков, лимфу (например, рассеянные опухолевые клетки лимфатических узлов), аспират костного мозга, слюну, мочу, кал (т.е. фекалии), мокроту, смывную жидкость бронхов, слезы, тонкоигольный аспирационный биоптат (например, взятый при рандомной периареолярной тонкоигольной аспирации) и любые другие жидкости организма, образцы тканей (например, опухолевой ткани), как-то биоптаты опухолей (например, игольные биоптаты) или лимфатических узлов (например, биоптат индикаторного лимфоузла) и клеточные экстракты из них. В некоторых воплощениях образец представлен цельной кровью или ее фракционным компонентом, таким как плазма, сыворотка, эритроциты, лейкоциты типа мононуклеаров периферической крови и/или редкие циркулирующие клетки. В некоторых воплощениях образец получают путем выделения лейкоцитов или циркулирующих клеток твердой опухоли из цельной крови или ее клеточных фракций, используя любые известные способы. В других воплощениях образцом является фиксированный формалином заключенный в парафин (FFPE) образец раковой ткани, например, из твердой опухоли.
В настоящем изобретении термин "циркулирующие клетки" охватывает внеопухолевые клетки, которые дали метастазы или микрометастазы из твердой опухоли. Примеры циркулирующих клеток включают, без ограничения, циркулирующие опухолевые клетки, раковые стволовые клетки и/или клетки, которые мигрируют в опухоль (например, циркулирующие эндотелиальные клетки-предшественники, циркулирующие эндотелиальные клетки, циркулирующие проангиогеннвые миелоидные клетки, циркулирующие дендритные клетки и др.).
"Биопсия" означает процесс извлечения образца ткани для диагностической или прогностической оценки, а также сам образец ткани. В отношении способов и