Способ производства лактоферрина, фракция, содержащая лактоферрин, и ее применения
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложены способ производства лактоферрина, фракция, содержащая лактоферрин, и ее применения. В качестве сырья используют молоко, которое не подвергалось обработке при температуре выше чем 55°C. Экстрагируют указанное сырье на катионнообменной смоле с использованием концентрированного раствора хлорида натрия. Получают раствор основного молочного белка, содержащий лактоферрин, лактопероксидазу и другие примеси. Проводят очистку раствора основного молочного белка на катионнообменной смоле, уравновешенной ацетатным буфером с концентрацией 50 мМ при значениях pH от 4 до 9. Элюирование осуществляют растворами ацетатного буфера с концентрацией 50 мМ при разных концентрациях раствора хлорида натрия - от 0,02 до 1,5 М. Собирают фракцию, содержащую лактоферрин. Фракция содержит лактоферрин с чистотой более чем 95% и, по существу, не содержит липополисахариды, эндотоксины и ангиогенин, имеет уровень насыщения железом от 9% до 20%. Полученную фракцию применяют для ускорения созревания желудочно-кишечного тракта у новорожденного или восстановления слизистой оболочки кишечника после гастроэнтерита, для увеличения активности моноцитов и увеличения цитотоксической функции клеток-киллеров, в качестве противоопухолевого агента, для уменьшения экспрессии противовоспалительных цитокинов, для ингибирования или уничтожения бактерий, лечения заболеваний, связанных с бактериальными биопленками, для приготовления растворов и мазей для обработки ран или для ухода за глазами, для лечения инфекционных заболеваний дыхательных путей. 9 н. и 6 з.п. ф-лы, 4 табл., 11 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к качеству лактоферрина (ЛФ) с целью достижения оптимальности всех его действий и устранения каких-либо побочных эффектов.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
Впервые лактоферрин, названный "красным белком", был обнаружен в коровьем молоке более 65 лет назад, и сразу после его выделения и очистки в 1960 году заинтриговал и озадачил исследователей. Впоследствии была определена его аминокислотная последовательность, трехмерная структура и подробно описаны свойства связывания железа, точно установлено, что лактоферрин является гликопротеином как член семейства трансферрина, и было подтверждено естественное предположение, что его биологическая функция относится к связыванию железа.
Важную роль сыграли разные исследовательские центры, сосредоточившие усилия на некоторых ключевых биологических функциях указанного белка. Лактоферрин был выделен как основной компонент определенных гранул полиморфно-ядерных лейкоцитов, имеющих большое значение для усиления воспалительной реакции. Большая работа исследовательской бельгийской группы под руководством Masson привела к установлению очевидной роли лактоферрина в клеточном иммунитете и к идентификации специфичных рецепторов лактоферрина на макрофагах, опосредовании эндотоксического шока и гипосидеремии. Исследовательские работы Montreuil и его французской группы привели к открытию биологической химии лактоферрина. Пищевая роль лактоферрина, состоящая в абсорбции ионов металлов в кишечном тракте, была открыта автором Lönnerdal. Регуляторная функция лактоферрина в миелопоэзе была раскрыта в работах Broxmeyer и его коллег. Со своей стороны Reiter опубликовал данные о способности лактоферрина из молока ингибировать рост некоторых микроорганизмов и обнаружил, что удаление железа из питания бактерий способствует антибактериальному действию. Бактерицидное действие лактоферрина против ряда микроорганизмов рассмотрено в работах Arnold и его коллег. Исследовательская группа под руководством Tomita в японской молочной производственной компании Morinaga обнаружила, что кислотный/пепсиновый гидролиз лактоферрина может приводить к образованию катионных антибактериальных пептидов "лактоферрицин".
В ряде исследований было установлено, что добавление лактоферрина может обеспечить исключительную пользу для здоровья и мощную защиту против ряда заболеваний. Технологии функциональных характеристик объяснили молекулярные механизмы лактоферрин-опосредованной полифункциональной активности. Кроме того, исследователи из лабораторий всего мира подтвердили функциональные результаты добавления лактоферрина в рандомизированных исследованиях на людях и в экспериментальных моделях in vivo.
Но если проявление полифункциональной активности указанного внеклеточного гликопротеина, который действует как ключевой компонент первой линии иммунной защиты млекопитающих против поражающих факторов окружающей среды, наблюдалось при использовании высококачественного лактоферрина, полученного в лаборатории, авторы обнаружили отсутствие такой активности у лактоферрина промышленного производства.
Во время производственного процесса ЛФ извлекают из молока или сыворотки в присутствии других основных молочных белков (ОМБ), таких как лактопероксидаза, некоторые иммуноглобулины и другие примеси, концентрация которых зависит от специфичности катионообменной смолы. Это простая технология, которая заключается в выделении и очистке ЛФ. Фактически, существует преимущество в том, что большинство белков и ферментов, содержащихся в ОМБ, являются окрашенными. Элюирование разных компонентов, связанных со смолой, осуществляется с помощью растворов, имеющих разные концентрации NaCl. Применяя такие методики, промышленные производители полагают, что чистота от 90 до 92% соответствует достаточной чистоте ЛФ в целях его использования для разных применений.
Вместе с тем, ни один из указанных способов, ни любой другой существующий способ очистки промышленного лактоферрина не способен удалить примеси, которые влияют на стабильность и активность лактоферрина.
Предполагается, что в существующих промышленных препаратах лактоферрина присутствуют ферменты-загрязнители. Во время очистки лактоферрина из молока или сыворотки происходит сопутствующая очистка от этих ферментов.
В отношении загрязнителей, как будет показано ниже, авторы также выявили, что во время очистки ЛФ может быть очищен ангиогенин. Указанная молекула имеет молекулярную массу 15 кДа и изоэлектрический уровень pH 9,5, что очень близко к ЛФ.
Указанная молекула отвечает за образование кровеносных сосудов для снабжения раковых клеток, неоваскуляризацию, непременную для опухолевого роста и развития метастазов.
Во время очистки ЛФ концентрация указанной молекулы возрастает по меньшей мере в 4 раза, что, безусловно, не является полезным для здоровья потребителей.
Ангиогенин способствует воспалительному процессу, то есть создает возможность для миграции эндотелиальных и гладкомышечных клеток через базальную мембрану и прохождения их в участок повреждения. Ангиогенин способствует неоваскуляризации опухолевых клеток и росту метастазов раковых клеток.
Ангиогенин представляет собой белок массой 15 кДа с изоэлектрическим уровнем pH 9,5, что является очень близким к показателям ЛФ. Как описано в 1997 году авторами Strydom et al. (Eur. J. Biochem, 247, 535-544), ангиогенин наносили на СМ-52 (катион-обменную хроматографическую смолу) и элюировали 1M NaCl в 50 мМ фосфате натрия, при уровне pH раствора 6,6. Таким образом, не удивительно, что указанная молекула очищается совместно с ЛФ, и ее присутствие выявляют электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия SDS-PAGE во всем промышленном ЛФ.
Другой проблемой является производство полимеров ЛФ путем термической обработки, которые авторы также рассматривают, см. ниже.
В этой связи существует большая потребность в новых способах придания стабильности и очистки препаратов лактоферрина для удаления примесей, расщепления белка и ЛПС, для усиления действия на рост бактерий и сохранения стабильности белка в течение более длинного периода времени.
Первоначально лактоферрин был выделен как белок, обильно представленный в секретируемом молоке, вместе с тем он преимущественно выделяется поверхностным эпителием и секретируется в слизистую среду. Известно, что высокий уровень продукции лактоферрина выявлен не только в молоке, но также и в носовых и трахеальных путях и в желудочном, генитальном и глазном секрете. Высокий уровень выработки лактоферрина также наблюдается в нейтрофилах, где он накапливается во вторичных гранулах и высвобождается во время воспаления, способствуя их антибактериальному действию.
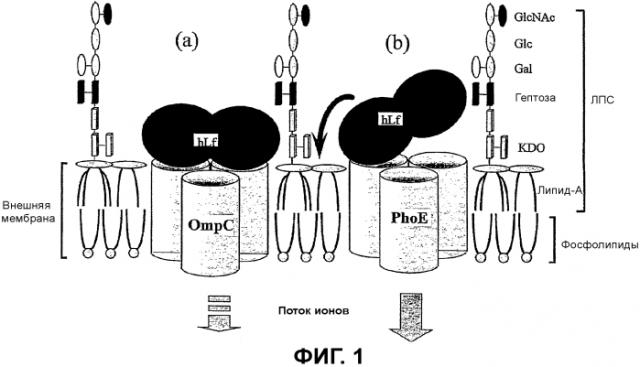
Лактоферрин содержит 2 гомологичных домена связывания железа, которые изолируют доступное железо и могут лишать домены бактерий, для которых требуется железо, этого необходимого элемента роста. Таким образом указанный белок проявляет бактериостатический эффект против широкого диапазона микроорганизмов и некоторых дрожжей. Кроме того, показано, что благодаря наличию катионоактивного пептида, расположенного близко к амино-концу белка, лактоферрин обладает и антибактериальным, и антиэндотоксическим действием, которые не зависят от функции связывания железа указанного белка. Эти области действуют посредством разрушения бактериальных мембран и связывания и инактивации содержащих липид-A бактериальных липополисахаридов, также называемых эндотоксинами (см. фигуру 1).
Лактоферрин также может регулировать клеточные сигнальные пути, затрагивающие такие действия, как облегчение воспаления, стимуляцию роста кости и подавление канцерогенеза.
Таким образом, противовоспалительное действие лактоферрина связано с его способностью ингибировать выработку провоспалительных цитокинов, но посредством нескольких разных механизмов, а регуляцию роста кости лактоферрин осуществляет посредством митоген-активируемых протеинкиназных путей. Растущее число исследований показывает, что лактоферрин обладает противораковыми свойствами, ингибируя раковый рост, что обусловлено его способностью модулировать пути, нарушающие клеточный цикл, или приводить к ап-регуляции экспрессии цитокинов, например интерлейкина-18.
Кроме того, антибактериальные функциональные возможности лактоферрина зависят от состояния его белковой конформации, связывания металлов и условий среды (Naidu AS and Arnold RR., 1995, Lactoferrin interactions and biological Functions pp. 259-275 Totowa, NJ, Humana Press). Антибактериальная активность возрастает при связывании лактоферрина с бактериальной поверхностью. Были определены специфичные бактериальные мишени связывания лактоферрина на различных грамположительных и грамотрицательных бактериальных патогенах (Naidu SS et al., 1991, APMIS, 99, 1142-1150). Высокоаффинное взаимодействие лактоферрина с белками внешней мембраны порообразующих грамотрицательных кишечных бактерий, включающих в себя Escherichia coli, является важным для результата антибактериального действия лактоферрина (Erdei et al., 1994, Infect Immun, 62, 1236-1240). Таким образом, типичными примерами результатов указанного антибактериального действия является опосредуемое лактоферрином повреждение внешней мембраны грамотрицательных бактерий и индуцируемое лактоферрином потенцирование антибиотиков в результате изменения проницаемости внешней мембраны (Naidu et al., Diagn Microbiol Infect, 1988, Infect Immun, 56, 2774-2781). Взаимодействие лактоферрина с бактериальной поверхностью, в частности с внешними мембранами, создает другие антибактериальные механизмы, такие как блокада бактериальной адгезии к кишечному эпителию и специфичное отслаивание патогенов от слизистой оболочки кишки.
Специфичное связывание лактоферрина способно непосредственно нарушать барьерную функцию внешней мембраны бактерий и приводить к удалению факторов патогенной колонизации и прекращению выработки энтеротоксинов.
С другой стороны, Appelmelk и его коллеги (Appelmelk BJ, et al., 1994, Infection and Immunity, 62, 2628-2632) выявили, что ЛФ связывается с участком ЛПС - липидом-A, и исследователи Elass (Elass-Rochart E, et al. 1995, Biochem J. 312, 839-845) показали, что этот связывающий участок расположен на N-конце лактоферрина (пептиды от 1 до 52), где также расположена основная часть функциональных групп ЛФ. По этим результатам легко понять взаимоотношения между активностью лактоферрина и присутствием ЛПС, связанного с молекулярной структурой лактоферрина.
Существует непрерывный транспорт ЛПС и эндотоксина из просвета кишечника в кровеносное русло. У здоровых людей плазма крови инактивирует ЛПС и эндотоксины, поступающие из кишечника, и защищает внутренние органы от повреждения. Однако любые нарушения проходимости кишечника могут увеличивать поступление ЛПС и эндотоксинов в кровеносное русло. Такой массивный приток может исчерпать способность плазмы инактивировать ЛПС и эндотоксины и в итоге привести к клинической эндотоксемии (Opal SM, 2002, J. Endotoxin Res, 8, 473-476). Экспериментальные данные предполагают, что активные формы кислорода являются важными медиаторами клеточного повреждения при эндотоксемии, а также после макромолекулярного повреждения или нарушения внеклеточных и внутриклеточных регуляторных процессов. Важным механизмом предотвращения физиологической эндотоксемии является уменьшение поступления липополисахаридов (ЛПС) из просвета кишечника.
На N-конце пептида лактоферрицина происходит высокоаффинное связывание ЛФ с липидом-A, представляющим собой токсическую функциональную группу ЛПС, и ЛФ действует как терапевтический агент для нейтрализации эффектов ЛПС и эндотоксинов (Appelmelk BJ et al., 1994, Infect Immun, 62, 2628-2632). ЛФ может эффективно уменьшить ЛПС и приток эндотоксинов в кровеносное русло, когда токсины остаются в просвете кишечника, но для достижения такого результата важно, чтобы в произведенном ЛФ не содержалось ЛПС и эндотоксинов. Кроме того, если поступающие с пищей здоровому человеку ЛФ были покрыты ЛПС, необходима возможность удалять эти ЛПС из молекулы и переносить их в кровеносное русло.
Вместе с тем, в указанном способе содержание ЛФ также быстро уменьшается, и возможно, что при непрерывном высвобождении большого количества ЛПС и эндотоксинов для осуществления этой функции количество присутствующего ЛФ не является достаточным (Caccavo et al., 2002, J. Endotoxin Res, 8, 403-417). Имеются сообщения о защитном эффекте ЛФ против летального шока, индуцированного внутривенным введением эндотоксина. Проблема опосредуемой ЛФ защиты против эндотоксина (если молекула сама по себе не содержит эндотоксин во время ее изготовления) коррелирует и с устойчивостью к индуцированной гипотермии, и с общим улучшением состояния здоровья. Исследования in vitro в анализе проточной цитометрии показали, что ЛФ дозозависимым образом ингибирует связывание эндотоксина с моноцитами, что предполагает, что механизм действия ЛФ in vivo может быть обусловлен предотвращением индукции воспалительно-токсических цитокинов моноцитарно/макрофагального происхождения (Lee WJ et al., 1998, Infect Immun, 66, 1421-1421).
Клинические испытания на людях также показали положительное влияние употребления ЛФ для первичной активации защиты организма-хозяина (Yamauchi et al., 1998, Adv Exp Med Biol, 443, 261-265). У здоровых людей было выявлено улучшение функции нейтрофилов сыворотки, включающее в себя повышение фагоцитарной активности и выработку супероксидов. Кроме того, специфичное взаимодействие ЛФ с альвеолярными макрофагами, моноцитами, купферовскими клетками, эндотелием печени, нейтрофилами, тромбоцитами и T-лимфоцитами подчеркивает роль ЛФ в гуморальном и клеточном иммунитете (Hanson LA, 1988, Biology of human milk. Nestle Nutrition Workshop series, 15, New-York, Raven Press). Тем не менее, все эти действия, обусловленные взаимодействием ЛФ с указанными клетками, уменьшаются по причине присутствия ЛПС в структуре ЛФ и повреждения гликановых цепей ЛФ при применении очень высоких температур (> 550°C, более 15 секунд) во время производственного процесса и по причине очень высокой температуры при сушке молекулы, и также по причине присутствия полимеров ЛФ, которые возникают во время термической обработки молекулы.
В отношении развития кишечника и восстановления слизистой оболочки было показано, что пероральное введение ЛФ может действовать в слизистой оболочке кишечника как иммуностимулирующий фактор.
В период грудного вскармливания новорожденного происходит более быстрое развитие желудочно-кишечного тракта. Его активация зависит от связывания ЛФ с кишечным эпителием. ЛФ может усиливать включение тимидина в ДНК клеток крипт in vivo. Этот трофический эффект способствует регенерации клеток и восстановлению ткани слизистой оболочки кишечника при таких состояниях, как гастроэнтерит (Nichols et al., 1990, Pediatr Res., 27, 525-528). Присутствие ЛПС в структуре ЛФ уменьшает это действие ЛФ вследствие того, что связывание ЛФ с кишечным эпителием происходит в пептиде (1-52), что относится к той же локализации, что ЛПС.
ЛФ также играет важную роль в кишечной абсорбции железа и других необходимых микроэлементов, таких как цинк, медь (Lonnerdäl B., 1989, J. Nutr. Suppl, 119, 1839-1844). ЛФ также защищает слизистую оболочку кишечника от излишнего захвата ионов тяжелых металлов. Рецепторы специфичного связывания ЛФ щеточной каемки в двенадцатиперстной кишке человека вовлечены в абсорбцию железа (Cox et al., 1979, Biochem Biophy Acta, 588, 120-128). Был идентифицирован кишечный рецептор ЛФ. Исследователи (Kawakami H et al., 1991, AmJ. Physiol, 261, G841-G846 and Rosa G et al., J.Med Biol. Res, 27, 1527-1531) опубликовали данные об увеличенной абсорбции железа посредством указанного рецептора ЛФ из кишечных мембран щеточной каемки, и также было показано, что пептид ЛФ, который отвечает за связывание молекулы с ее специфичным рецептором, локализуется на пептиде 1-52, который также отвечает за связывание с ЛПС.
В отношении противоопухолевого действия ЛФ было показано, что ЛФ дозозависимым образом усиливает активность моноцитов как натуральных киллеров (NK). ЛФ значительно усиливает цитотоксическую активность и NK, и лимфокин-активируемых клеток-киллеров (LAK). ЛФ в низких дозах является эффективным модулятором клеточно-опосредованного иммунного ответа и сывороточных цитотоксических факторов, если ЛПС не связаны со структурой ЛФ и если ЛФ не загрязнен ангиогенином. Однако в более высоких концентрациях ЛФ-опосредуемая индукция может быть причиной, соответственно, положительной или отрицательной обратной связи, которая не является необходимой для плотности и субпопуляций в популяции иммунных клеток, но также к присутствию ЛПС в структуре ЛФ.
С открытием специфичных рецепторов ЛФ на макрофагах, T- и B-лимфоцитах и лейкозных клетках был установлен возможный потенциал противоопухолевого действия ЛФ (Shau et al., 1992, L. Leukoc Biol, 51, 343-349), который может быть уничтожен присутствием ЛПС в его структуре.
Противовоспалительное действие ЛФ прежде всего связано с его способностью извлекать железо. Известно, что накопление железа в воспаленных тканях может приводить к каталитической продукции высокотоксичных свободных радикалов. Во время воспалительного ответа нейтрофилы, содержащие кислотные гранулы, мигрируют к участку поражения для высвобождения своего ЛФ. В результате в воспаленном участке ткани создается очень кислая среда, чтобы усилить возможности ЛФ к связыванию железа и детоксикации. Помимо модуляции гомеостаза железа во время воспаления, установлено доказательство, что ЛФ может непосредственно регулировать разные воспалительные реакции. Независимый от железа механизм действия основан на связывании ЛФ с бактериальными ЛПС, которые являются основными провоспалительными медиаторами при бактериальных инфекциях и септическом шоке (Miyazawa et al., 1991, J. Immunol, 146, 723-729). ЛФ может играть важную роль в модуляции желудочного воспаления, поскольку этот белок также экспрессируется в слизистой оболочке желудка и взаимодействует с рецепторами, локализующимися в эпителиальных клетках желудочно-кишечного тракта. Это действие ЛФ значительно уменьшено или даже полностью отсутствует, если структура ЛФ имеет оболочку в виде ЛПС. Ряд исследований in vivo показали, что пероральное введение ЛФ может облегчать гастрит, вызванный Helicobacter pilory, и защитить целостность слизистой оболочки кишечника при эндотоксемии. Аналогично, такое действие ЛФ является очень слабым, если ЛПС связаны со структурой ЛФ.
Независимое от железа действие ЛФ может быть описано следующим образом: одной из основных провоспалительных функций эндотелиальных клеток является рекрутинг лейкоцитов циркулирующей крови в воспаленных участках ткани. Липополисахариды (ЛПС) или эндотоксины являются наиболее распространенными гликолипидами внешней мембраны грамотрицательных бактерий. ЛПС представляют собой мощные стимуляторы воспаления, которые индуцируют или непосредственно, или посредством цитокинов экспрессию молекул адгезии, таких как молекула эндотелиальной-лейкоцитарной адгезии (E-селектин) и молекула внутриклеточной адгезии (ICAM-1). Эндотоксиновая стимуляция эндотелиальных клеток опосредуется выявленным растворимым белком CD14 (sCD14), представляющим собой специфичный рецептор. CD14 является гликопротеином размером 55 кДа, который находится в сыворотке, и в виде заякоренного белка (mCD14) на поверхности моноцитов - макрофагов. В зависимости от концентрации ЛПС (эндотоксинов) в этом механизме присутствуют промежуточное звено, называемое ЛПС-связывающим белком (LBP), который катализирует перенос мономеров ЛПС из агрегатов в CD14, чтобы образовать комплекс SCD14-ЛПС. Таким образом, активация эндотелиальных клеток комплексом SCD14-ЛПС или ЛПС единственными вызывает различные патофизиологические реакции, включающие в себя лихорадку и гипотонию, способствует лейкоцитарной инфильтрации и микроваскулярному тромбозу и способствует развитию диссеминированного внутрисосудистого воспаления при септическом шоке.
Тем не менее, лактоферрин, обнаруженный в экзокринном секрете млекопитающих и высвобождаемый из гранул нейтрофилов во время воспаления, способен модулировать активацию клеток и предотвращать серьезные повреждения, вызванные присутствием ЛПС.
Концентрации лактоферрина как следствие инфекции, превышающие 20 мкг/мл, можно обнаружить в крови. Лактоферрин представляет собой часть первичной системы защиты против воспаления. Предполагается, что любое присутствие бактерий в организме может вызвать воспаление, рак и другие патологии. Эта индукция будет стимулировать иммунные ответы, включающие в себя продукцию цитокина, повышение экспрессии молекул клеточной адгезии и секрецию провоспалительного медиатора моноцитами, макрофагами и нейтрофилами, которые поступают в определенные ткани хозяина вследствие системного воздействия ЛПС. Реакция хозяина на ЛПС опосредована и иммуномодулирующими молекулами, такими как фактор некроза опухоли-альфа (ФНО-альфа), члены семейства интерлейкинов (ИЛ), активные формы кислорода и липиды. Повышенная продукция указанных медиаторов вызывает повреждение тканей, которое предшествует полиорганной недостаточности.
Лактоферрин предотвращает LBP-опосредованное связывание ЛПС с mCD14 и уменьшает высвобождение цитокинов из ЛПС-стимулируемых моноцитов. Лактоферрин также может модулировать воспалительный процесс. Опубликованы сообщения об исследования, подтвердивших защитную функцию лактоферрина против сублетальных доз ЛПС у мышей. В заключение, способность лактоферрина связывать свободные ЛПС частично может объяснять противовоспалительное действие молекулы.
Поэтому при введении человеку и животному лактоферрина перорально или путем инъекции для укрепления или профилактики дефицита первичной защитной системы организма основная задача заключается в том, чтобы качество лактоферрина было идентично качеству лактоферрина, вырабатываемого эндогенно здоровым человеком, организму которого необходима защита против микробной атаки. Понимая, что по мере старения выработка эндогенного лактоферрина резко снижается, пациенты должны принимать экзогенный лактоферрин или перорально, или в виде инъекций.
Примеси в исходном материале могут мешать применению ЛФ для здоровья человека. Все из перечисленных факторов, включающих в себя происхождение исходного материала, очистку белка, способы сушки и сбора полученной продукции, условия производства и условия хранения в комплексе содействуют биологической нагрузке белка ЛФ. Соответственно, с молоком, сывороткой или молочной сывороткой, которые применяются в качестве исходного материала, могут поступать ферментирующие стрептококки (Streptococcus thermophilus,...), и среда с кислой реакцией может быть селективно обогащена некоторыми дрожжами и плесневыми грибами. Кстати, общеизвестно, что указанные популяции микроорганизмов размножаются и конкурентно ограничивают рост некоторых пробиотиков.
При получении ЛФ из молока при загрязнении молочного резервуара источником мастита с молоком могут поступать находящиеся в нем ЛПС из грамположительных кокков, включающих в себя Streptococcus uberis, Staphycoccus aureus и грамотрицательных стафилококков. С другой стороны, загрязнители из окружающей среды, такие как спорообразующие Bacillus spp., Acinetobacter calcoaceticus, Klebsiella oxytoca, Pseudomonas spp. и коли-формы, включающие в себя E.coli, и ЛПС таких микроорганизмов могут поступать в материал ЛФ через промывочный буфер, оборудование с биопленками, вентиляционные каналы и т.д. Подобные проблемы микробиологического качества могут возникать для белков ЛФ ГМО-происхождения и рекомбинантных ЛФ от разных видов, таких как рис, табак, дрожжи, клеточные культуры или трансгенные животные. Таким образом, удаление или значительное уменьшение таких ЛПС-микробных загрязнений является очень желательным для применения промышленного ЛФ в целом для здоровья человека.
Согласно вышеприведенному объяснению, наличие ЛПС и эндотоксина в исходном материале может иметь неблагоприятный эффект на применение ЛФ. Липополисахариды (ЛПС) во внешней мембране грамотрицательных бактерий обычно состоят из гидрофобной области, известной как липид-A (или эндотоксин), неповторяющегося олигосахаридного ядра и дистального полисахарида (или O-антигена) (Erridge et al., 2002, Microbes Infect, 4, 837-851). ЛПС и эндотоксины могут стимулировать индукцию цитокинов и других медиаторов воспаления, что, в свою очередь, способно запускать широкий диапазон неблагоприятных физиологических ответов (Raetz et al., 2002, Annu Rev Biochem, 71, 635-700). Грамотрицательная биологическая нагрузка молока или его производных, используемых для выделения белка, среда и условия заводской обработки в совокупности создают уровни содержания ЛПС и эндотоксина в исходном материале ЛФ. Потенциальные резервуары загрязнения эндотоксинами при выделении белковых материалов рассмотрены в публикации (Majde et al., 1993, Peptides 14, 629-632). В работе Rylanders (Rylander 2002, J. Endotoxin Res, 8, 241-252) также рассмотрено появление содержания эндотоксина в разных условиях окружающей среды и дополнительно указано на риски, связанные с небактериальными эндотоксинами, в частности 1-3-β-D-гликаном из клеточных оболочек плесневых грибов. Таким образом, микробиологические стандарты хранения хроматографических смол, санитарные нормы обработки оборудования, еще более важно, качество воды, используемой при очистке ЛФ, могут в совокупности способствовать наличию ЛПС и эндотоксина в очищенном ЛФ-материале и, таким образом, могут ограничивать применения промышленного ЛФ in vivo. Предварительное присутствие комплексов ЛФ-ЛПС и эндотоксинов уменьшает потенциал взаимодействия ЛФ с кишечным эпителием и уменьшает его способность регулировать поступление из кишечника ЛПС и эндотоксинов.
Таким образом, из всего промышленного лактоферрина необходимо удалять ЛПС, связанные с его молекулярной структурой. Например, авторами Ward, Loren и коллегами в патенте WO2009/009706 описан способ удаления эндотоксинов, связанных с ЛФ, и производство лактоферринового продукта, не содержащего эндотоксин (EFL). Речь не идет об анализе концентрации ЛПС с использованием limulus-теста. Было также показано, что при значительной концентрации ЛПС, связанных со структурой лактоферрина, комплекс ЛПС-ЛФ способен в некоторой степени индуцировать продукцию медиаторов воспаления в макрофагах, вместо полного ингибирования действия ЛПС. В основном это обусловлено тем, что при высокой концентрации ЛПС существует равновесие между связанными ЛПС → несвязанными ЛПС, и именно присутствие несвязанных ЛПС индуцирует продукцию медиаторов воспаления. Это является причинами, которые обязывают производителей ЛФ в целях безопасности очищать молекулу, не содержащую ЛПС, связанных с поверхностью молекулярной структуры ЛФ.
Поскольку лактоферрин производят из молока и/или сыворотки, молекулярная структура ЛФ в норме имеет покрытие в виде бактериальных ЛПС, находящихся в молоке, и может представлять опасность загрязнение молочного резервуара микробной колонизацией из молока коров с маститом. Авторы выяснили, что активность лактоферрина частично представлена его антибактериальной ролью, которая заключается в связывании с ЛПС бактерий, присутствующих в молоке. Это означает прогнозируемую экстракцию из молока лактоферрина, полностью покрытого ЛПС, который потерял важную часть своей биологической активности в отношении антиоксидантного, антибактериального действия и свое ингибирующее действие на образование бактериальной биопленки и, соответственно, свое пробиотическое действие.
Кроме того, ЛФ можно денатурировать термической обработкой. Можно использовать разные параметры для изучения термостабильности лактоферрина. Термическая денатурация соответствует первому закону кинетики. Денатурация возрастает с повышением температуры. Не содержащий железо лактоферрин (Apo-лактоферрин) показывает более быструю денатурацию, чем лактоферрин, насыщенный железом (Holo-лактоферрин). Это отражает более стабильную конформацию при связывании с железом. Во время термической денатурации разрыв нескольких связей вызывает серьезные изменения в структуре ЛФ. Термическая стабильность увеличивается в присутствии других компонентов молока благодаря взаимодействию между лактоферрином и казеинатами и другими молочными белками.
Экстрагируемый из молока лактоферрин имеет уровень насыщения железом от 9 до 20% насыщенного железом лактоферрина. Однако после пастеризации молочной или творожной сыворотки экстрагированный белок не обладает тем же уровнем активности и имеет другие показатели по сравнению с лактоферрином, экстрагированным перед любой термической обработкой молочной или творожной сыворотки.
Фактически, термическая обработка способна разрушать гликановые цепи молекулы, которые играют роль в защите лактоферрина от протеолитических ферментов, присутствующих в желудке, и также могут продуцировать ЛФ-полимеры. Этот эффект также подтверждается тем фактом, что при термическом воздействии на лактоферрин молекула имеет более высокую спектральную поглощательную способность при 280 нм (таблица 1).
Разрушение гликановых цепей, чувствительных к термической обработке, также увеличивает неспецифическое связывание лактоферрина на клетках. Вместо содействия клеточному росту неспецифичное связывание лактоферрина скорее вызовет «удушье» клеток. Фактически, производители промышленного ЛФ установили определение чистоты ЛФ с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии ВЭЖХ с использованием градиента ацетонитрила. Анализируя чистоту некоторых промышленных ЛФ, авторы отмечают, что белковые примеси составляют примерно 8-9% по отношению к пику ЛФ. Однако при разведении того же количества промышленного ЛФ, с регулированием содержания золы и влаги, авторы не получили аналогичного значения оптической плотности при 280 нм. Это означает, что некоторые белки, элюируемые как ЛФ, могут увеличивать оптическую плотность. В фигуре авторы отмечают, что в анализе ионнообменной хроматографии быстрого разрешения FPLC (смола Mono-S-сульфопропил) ЛФ показывает меньшую поверхность по сравнению с поверхностью ЛФ при термической обработке. Уменьшение высоты поверхности обусловлено присутствием новой поверхности, которая соответствует плечу, наблюдаемому в анализе FPLC и называемому авторами пиком C для упрощения описания хроматограммы. Авторы также отмечают, что поверхность ЛФ разделена на две части: пик A и пик B, очень близкие друг к другу и соответствующие пику А в присутствии одной сиаловой кислоты, содержание которой придают молекуле менее основные характеристики по сравнению с исходной молекулой, которая не содержит сиаловой кислоты. В случае ЛФ-NFQ поверхность ЛФ также состоит из двух поверхностей (поверхность A и поверхность B). Плечо (поверхность C) наблюдается только у промышленного ЛФ. Плечо или поверхность C имеет более высокую спектральную поглощательную способность при 280 нм по сравнению с исходной ЛФ, см. таблицу 1 ниже.
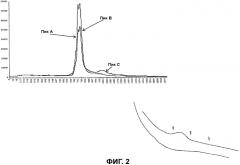
В любом случае авторы считают, что пик A и пик B составляют части очищенного ЛФ. Присутствие пика C невозможно обнаружить с помощью обращенно-фазовой хроматографии. Чтобы получить представление о наличии этого пика C, авторы проводили анализ полного спектра поглощательной способности от 280 нм до 800 нм и наблюдали полосу Soret при 410 нм (фигура 2), которая не зависит от содержания железа в ЛФ, поскольку указанная полоса Soret должна присутствовать при длине волны, близкой к 465 нм. Кроме того, спектральная поглощательная способность этого пика C при 280 нм почти вдвое превышает значение для ЛФ единственного.
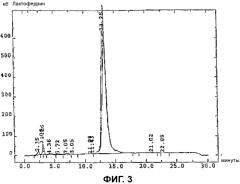
Получая данные только о пиках A и B и при повторном нанесении на смолу моно-S авторы отмечают присутствие на хроматограмме только пиков A и B без загрязнения пиком C. С другой стороны, если на раствор, содержащий пики A и B, воздействовали температурой 72°C в течение 5 минут и анализировали указанный раствор на смоле моно-S, авторы наблюдали значительное уменьшение поверхности пика A и поверхности пика B по сравнению с исходной хроматограммой, но также появление пика C (фигура 2). Если термическое воздействие на ЛФ было более продолжительным, больше пиков A и B будут иметь более низкую поверхность, и пик C будет выражен больше.
При сравнении обращенно-фазовой хроматограммы ЛФ без термической обработки и хроматограммы того же самого ЛФ после термического воздействия (72°C) в течение 5 минут авторы отмечают, что поверхность ЛФ без термической обработки ниже, чем поверхность ЛФ после термической обработки (фигура 3). Пик C указывал на полимеры ЛФ, имеющие намного большую поглощательную способность.
| Таблица 1 | |
| Нагревание(30 секунд) | Поглощение при 280 нм для раствора ЛФ 1 мг/мл |
| <50°C | 1,326 |
| 70°C | 1,38 |
| 80°C | 1,42 |
| 85°C | 1,42 |
Проблема заключается не только в том, что очищенный изготовителем лактоферрин теряет процент своей биологической активности, что можно компенсировать добавлением молекул в более высокой концентрации, но в том, что чем чаще рекомендуется использовать относительно высокую концентрацию ЛФ для достижения определенного уровня активности, тем чаще рекомендуется использовать ЛПС в высокой концентрации. Это может автоматически вызывать воспалительный процесс вместо защитного действия для пациентов (таблица 3).
В настоящее время на рынке здоровой пищи в мире доступен ряд продуктов ЛФ. Большинство таких продуктов получено из частично выделенного ЛФ из молозива, молочной или творожной сыворотки. Кроме того, существует компромисс проблем микробиологического и токсикологического качества и стандартов действия ЛФ in vivo в качестве потенциального пищевого материала.
Лактоферрин обычно очищают из молока или сыворотки (молочной сыворотки или творожной сыворотки) с помощью одного или больше разных методик хроматографии со смолами, таких как ионнообменная, в частности катионообменная, аффинная (с иммобилизированным гепарином, одноцепочечной ДНК, лизином или аргинином), аффинная хроматография с красителем и эксклюзионная хроматография. Также можно применять ультрафильтрационную мембрану для сепарации лактоферрина из молока или сыворотки. Tornita и его коллеги (Tomita и др., 2002, biochem Cell Biol, 80, 109-112) приводят пример способа производства, в котором применяется и катионообменная хроматография и мембранная фильтрация с тангенциальным потоком. Другой способ очистки с использованием катионообменной хроматографии был описан исследователями Okonogi и его коллегами (Okonoki et al., новозеландский патент № 221082), Ulber (Ulber et al., 2001, Acta Biotechnol, 21, 27-34) и Zhang и его коллегами (Zhang et al., Milchwissenschaft 2002, 57, 614-617). Некоторые исследователи использовали гидрофобные свойства молекулы для очистки лактоферрина с помощью хроматографии гидрофобного взаимодействия. Machold описал характер удержания лактоферрина на некоторых смолах гидрофобного взаимодействия при разных концентрациях солей (Machold et al., 2002, J. Chromatogr. A972, 3-19).
Разные способы были подробно описаны доктором Denis Petitclercq в патентной заявке WO 2006/119644, цель его изобретения состояла в обеспечении способа удаления ферментных примесей, отвечающих за расщепление лактоферрина. Удаление этих ферментов или добавление специфичных ингибиторов может предотвращать расщепление препаратов лактоферрина и потерю активности лактоферрина. Указанный способ автор применил ко всему промышленному лактоферрину, продемонстрировав возможность улучшения стабильности и активности лактоферрина. Автор рассматривает способ очистки лактоферрина, содержащий стадии контакта по схеме связывания-и-элюирования и методики адсорбции раствора лактоферрина с гидрофильньным абсорбентом и с гидрофобным в присутствии сурфактанта как в присутствии исключенного растворенного вещества и сбора фракции, содержащей лактоферрин, который, по существу, не содержит примесных ферментов, так и/или ингибитора лактоферрина.
Автор показал, что по сравнению с лактоферрином, очищенным с применением его способов, промышленный лактоферрин, полученный от того же поставщика, а также от других поставщиков, доступных на рынке, не проявлял аналогичного действия. В отношении антибактериальной активности очищенный лактоферрин не терял своего действия при более высокой концентрации лактоферрина в среде (фигура 4). Ни один из доступных на р