Антитела против notch2 и способы их применения
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к антителам, которые связывают Notch2. Заявлены моноклональные антитела, которые специфически связываются с доменом Lin12/Notch Repeat (LNR)-А и доменом гетеродимеризации (HD)-С отрицательной регуляторной области (NRR) Notch2 и ингибируют передачу сигнала Notch2. Также изобретение относится к способам применения этих антител. Изобретение позволяет использовать антитела, связывающие Notch2, для лечения нарушения, ассоциированного с повышенной экспрессией или передачей сигнала Notch2, такого как злокачественная опухоль. 9 н. и 28 з.п. ф-лы, 47 ил., 1 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По данной заявке испрашивается приоритет предварительной заявки США No. 61/101917, поданной 1 октября 2008 года, содержание которой включено в настоящий документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, главным образом, к области молекулярной биологии. Более конкретно, изобретение относится к антителам против Notch, в том числе к антителам против отрицательной регуляторной области (NRR) Notch2, и к их применению. Также представлены антитела против NRR Notch1 и способы их применения.
УРОВЕНЬ ТЕХНИКИ
Семейство рецепторов Notch представляет собой класс эволюционно консервативных трансмембранных рецепторов, которые передают сигналы, влияющие на развитие организмов, настолько разнообразных, как морские ежи и человек. Рецепторы Notch и их лиганды, Delta и Serrate (у млекопитающих известных как Jagged), представляют собой трансмембранные белки с крупными внеклеточными доменами, которые содержат подобные эпидермальному фактору роста (EGF) повторы. Количество паралогов Notch отличается между видами. Например, существует четыре рецептора Notch у млекопитающих (Notch1-Notch4), два у Caenorhabditis elegans (LIN-12 и GLP-1) и один у Drosophila melanogaster (Notch). Также рецепторы Notch в процессе транспорта к поверхности клетки подвергаются протеолитическому процессингу фурин-подобной протеазой в участке S1 на N-концевой стороне трансмембранного домена, с образованием внеклеточной субъединицы Notch (ECN) и трансмембранной субъединицы Notch (NTM). Эти две субъединицы остаются нековалентно связанными и формируют зрелый гетеродимерный рецептор клеточной поверхности. Рецепторы Notch и каскад передачи сигнала Notch рассмотрены, например, в Aster et al., Annu. Rev. Pathol. Mech. Dis. 3:587-613, 2008, и Bolos et al., Endocrine Reviews 28:339-363, 2007.
Субъединицы Notch2 ECN содержат 36 N-концевых EGF-подобных повторов, за которыми следуют три тандемно повторяющихся модуля Lin 12/Notch Repeat (LNR), которые предшествуют участку S1. Каждый модуль LNR содержит три дисульфидных связи и группу консервативных кислотных и полярных остатков, которые, как предполагают, координируют ион кальция. В области EGF-повтора находятся связывающие участки для активирующих лигандов.
Notch2 NTM содержит внеклеточную область (которая содержит участок расщепления S2), трансмембранный сегмент (который содержит участок расщепления S3) и крупную внутриклеточную часть, которая включает домен RAM23, шесть анкириновых повторов, домен трансактивации и C-концевую последовательность PEST. Стабильная ассоциация субъединиц ECN и NTM зависит от домена гетеродимеризации (HD), содержащего C-конец ECN (называемый HD-N) и внеклеточный N-конец NTM (называемый HD-C). Перед индуцируемой лигандом активацией Notch поддерживается в покоящейся конформации с помощью отрицательной регуляторной области (NRR), которая содержит три LNR и HD-домен. Кристаллическая структура NRR Notch2 описана в Gordon et al, (2007) Nature Structural & Molecular Biology 14:295-300, 2007.
Связывание лиганда Notch с субъединицей ECN инициирует два последовательных протеолитических расщепления, которые происходят путем регулируемого внутримембранного протеолиза. Первое расщепление металлопротеиназой (ADAM17) в участке S2 делает трансмембранную субъединицу Notch чувствительной ко второму расщеплению в участке S3 вблизи внутреннего слоя плазматической мембраны. Расщепление в участке S3, которое катализируется мультибелковым комплексом, содержащим пресенилин и никастрин и стимулирующим активность γ-секретазы, высвобождает внутриклеточную часть трансмембранной субъединицы Notch, позволяя ей перемещаться в ядро и активировать транскрипцию генов-мишеней. (Для обзора протеолитического расщепления Notch, см., например, Sisodia et al., Nat. Rev. Neurosci. 3:281-290, 2002.)
У человека идентифицировано пять лигандов Notch классов Jagged и Delta-подобных белков (Jagged1 (также называемый Serrate1), Jagged2 (также называемый Serrate2), Delta-подобный 1 (также называемый DLL1), Delta-подобный 3 (также называемый DLL3) и Delta-подобный 4 (также называемый DLL4)). Каждый из этих лигандов представляет собой однократно пронизывающий мембрану трансмембранный белок с консервативным N-концевым мотивом Delta, Serrate, LAG-2 (DSL), необходимым для связывания Notch. Серии EGF-подобных модулей, находящихся со стороны C-конца мотива DSL, предшествуют трансмембранному сегменту. В отличие от рецепторов Notch, лиганды имеют на C-конце короткие цитоплазматические хвостовые части из 70-215 аминокислот. Кроме того, описаны другие типы лигандов (например, DNER, NB3 и F3/контактин). (Для обзора лигандов Notch и опосредуемой лигандами активации Notch, см., например, D'Souza et al., Oncogene 27:5148-5167, 2008.)
Каскад Notch функционирует в ходе различных связанных с развитием и физиологических процессов, включая процессы, влияющие на нейрогенез у мух и позвоночных. Как правило, передача сигнала Notch вовлечена в латеральное ингибирование, определение направления дифференцировки и установление границ между группами клеток (см., например, Bray, Molecular Cell Biology 7:678-679, 2006). Было показано, что множество заболеваний человека, включая злокачественные опухоли и нейродегенеративные нарушения, являются следствием мутаций в генах, кодирующих рецепторы Notch или их лиганды (см., например, Nam et al., Curr. Opin. Chem. Biol. 6:501-509, 2002). Связь между неограниченной передачей сигнала Notch и злокачественной опухолью впервые была признана, когда была идентифицирована рекуррентная t(7;9)(q34;q34,3) хромососмная транслокация, которая приводит к укороченному конститутивно активному варианту Notch1 человека в подгруппе острых лимфобластных лейкозов (T-ALL) человека (см., например, Aster et al., Annu. Rev. Pathol. Mech. Dis. 3:587-613, 2008). В моделях на мышах было показано, что передача сигнала Notch1 является необходимой для развития T-клеток и что опосредуемые Notch1 сигналы стимулируют развитие T-клеток за счет развития B-клеток (см., например, Wilson et al., J. Exp. Med. 194:1003-1012, 2001).
Notch2 также вовлечен в некоторые злокачественные опухоли. В частности, Notch2 сверхэкспрессируется при B-клеточном хроническом лимфоцитарном лейкозе (B-CLL), что в свою очередь приводит к сверхэкспрессии CD23, характерного признака клеток B-CLL. (См. Hubmann et al., Blood 99:3742-3747, 2002.) Как Notch1, так и Notch2, высоко экспрессируются в клетках множественной миеломы (злокачественных плазматических B-клетках), и стимуляция лигандом резко увеличивает рост опухолевых клеток. (См. Jundt et al., Blood 103:3511-3515, 2004.) Notch2 и последующие эффекторы сверхэкспрессируются при меланоме (см. Hoek et al., Cancer Res. 64:5270-5282, 2004; Seykora et al., Am J Dermatopathol 25:6-11, 2003), и локус Notch2 рекуррентно амплифицируется в клеточных линиях меланомы (Jonsson et al., Oncogene, 26:4738- 4748, 2007). Кроме того, во множестве исследований выявлена связь нарушенной передачи сигнала Notch2 с раком молочной железы и другими солидными опухолями (рассмотрено Leong and Karsay, Blood 107:2223-2233, 2006). Notch2 также требуется для развития B-клеточной маргинальной зоны. (См. Pillai et al., Annu. Rev. Immunol. 23:161-196, 2005.)
С учетом вовлечения передачи сигнала Notch в широкое множество заболеваний человека, очевидно, что продолжает существовать потребность в средствах, которые регулируют передачу сигнала Notch и которые имеют клинические качества, подходящие для их разработки в качестве лекарственных средств. Изобретение, описанное в настоящем документе, удовлетворяет эту потребность и обеспечивает другие преимущества.
Все ссылки, цитированные в настоящем документе, включая патентные заявки и публикации, включены в качестве ссылок в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к антителам против Notch и способам их применения.
В одном аспекте представлено моноклональное антитело, которое связывается с NRR Notch2. В одном варианте осуществления антитело ингибирует активность Notch2. В другом варианте осуществления антитело по существу не связывается с представителями семейства Notch, отличными от Notch2. В другом варианте осуществления антитело связывается с NRR Notch2 мыши и NRR Notch2 человека. В другом варианте осуществления антитело связывается с NRR Notch2 с Kd ≤ 10 нМ.
В следующем варианте осуществления представлено моноклональное антитело, которое связывается с NRR Notch2, где антитело содержит:
(a) HVR-H1, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:3;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:4;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:5;
(d) HVR-L1, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO: 10;
(e) HVR-L2, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO: 14; и
(f) HVR-L3, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO: 19.
В одном из таких вариантов осуществления антитело содержит HVR-H1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 1-2; HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 6-9; HVR-L2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 11-13; и HVR-L3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 15-18. В одном варианте осуществления HVR-H1 содержит аминокислотную последовательность SEQ ID NO: 1, HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 6, HVR-L2 содержит аминокислотную последовательность SEQ ID NO: 11, и HVR-L3 содержит аминокислотную последовательность SEQ ID NO: 15. В другом варианте осуществления HVR-H1 содержит аминокислотную последовательность SEQ ID NO: 2, HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 7, HVR-L2 содержит аминокислотную последовательность SEQ ID NO: 11 и HVR-L3 содержит аминокислотную последовательность SEQ ID NO: 16. В другом варианте осуществления HVR-H1 содержит аминокислотную последовательность SEQ ID NO: 2, HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 8, HVR-L2 содержит аминокислотную последовательность SEQ ID NO: 12 и HVR-L3 содержит аминокислотную последовательность SEQ ID NO: 17. В другом варианте осуществления HVR-H1 содержит аминокислотную последовательность SEQ ID NO: 2, HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, HVR-L2 содержит аминокислотную последовательность SEQ ID NO: 13 и HVR-L3 содержит аминокислотную последовательность SEQ ID NO: 18. В любом из указанных выше вариантов осуществления антитело, кроме того, содержит по меньшей мере одну каркасную область, выбранную из каркасной области акцептора 2 VH человека и консенсусной каркасной области подгруппы I VL каппа человека.
В другом аспекте представлено моноклональные антитело, которое связывается с NRR Notch2, где антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO: 20-21, и вариабельный домен легкой цепи, имеющий по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO: 22-25. В одном варианте осуществления антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 20 и вариабельный домен легкой цепи, имеющий по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 22. В одном из таких вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 20, и вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 22. В другом варианте осуществления антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 21, и вариабельный домен легкой цепи, имеющий по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO: 23-25. В одном из таких вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 21, и вариабельный домен легкой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 23-25.
В другом аспекте представлено выделенное антитело, которое связывается с тем же эпитопом, что и антитело, выбранное из антитела D, антитела D-1, антитела D-2 или антитела D-3. В другом аспекте представлено выделенное антитело, которое связывается с доменом LNR-A и с доменом HD-C Notch2.
В другом аспекте антитело против NRR Notch2 представляет собой фрагмент антитела, выбранный из Fab-, Fab'-SH-, Fv-, scFv- или (Fab')2-фрагмента. В другом аспекте антитело против NRR Notch2 представляет собой гуманизированное, химерное антитело или антитело человека.
Любой из указанных выше вариантов осуществления может существовать отдельно или в комбинации.
В другом аспекте представлен способ ингибирования активности Notch2, включающий воздействие на клетку, которая экспрессирует Notch2, антитела согласно любому из указанных выше вариантов осуществления. В другом аспекте представлен способ лечения нарушения, ассоциированного с повышенной экспрессией или активностью Notch2, включающий введение индивидууму, нуждающемуся в этом, эффективного количества антитела согласно любому из указанных выше вариантов осуществления. В другом аспекте представлен способ лечения B-клеточной злокачественной опухоли, включающий введение индивидууму, нуждающемуся в этом, эффективного количества антитела согласно любому из указанных выше вариантов осуществления. В другом аспекте представлен способ лечения меланомы, включающий введение индивидууму, нуждающемуся в этом, эффективного количества антитела согласно любому из указанных выше вариантов осуществления.
В другом аспекте представлен способ лечения нарушения, ассоциированный с повышенной экспрессией или активностью Notch1, включающий совместное введение индивидууму, нуждающемуся в этом, эффективного количества антитела против NRR Notch1 и лекарственного средства, выбранного из дексаметазона и тамоксифена, где лекарственное средство снижает изменение дифференцировки клеток кишечника, вызываемое антителом. В одном из таких вариантов осуществления нарушение представляет собой T-клеточную злокачественную опухоль.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 представлены последовательности гипервариабельных областей (HVR) H1, H2 и H3 тяжелых цепей моноклональных антител против NRR Notch2, обозначаемых как антитело D, антитело D-1, антитело D-2 и антитело D-3, как описано в примере B(1). Аминокислотные положения пронумерованы согласно системе нумерации Kabat, как описано ниже.
На фигуре 2 представлены последовательности HVR L1, L2 и L3 легких цепей моноклональных антител против NRR Notch2, обозначаемых как антитело D, антитело D-1, антитело D-2 и антитело D-3, как описано в примере B(1). Аминокислотные положения пронумерованы согласно системе нумерации Kabat, как описано ниже.
На фигуре 3 представлено выравнивание последовательностей вариабельных областей тяжелых цепей антитела D, антитела D-1, антитела D-2 и антитела D-3. HVR заключены в рамки, как описано в примере B(1).
На фигуре 4 представлено выравнивание последовательностей вариабельных областей легких цепей антитела D, антитела D-1, антитела D-2 и антитела D-3. HVR заключены в рамки.
На фигурах 5A и 5B представлены иллюстративные консенсусные каркасные последовательности вариабельных областей тяжелых цепей (VH) человека для применения для осуществления на практике настоящего изобретения. Идентификаторы последовательностей являются следующими:
- консенсусная каркасная область "A" подгруппы I VH человека минус CDR по Kabat (SEQ ID NO: 32, 33, 34, 35).
- консенсусные каркасные области "B," "C" и "D" подгруппы I VH человека минус удлиненные гипервариабельные области (SEQ ID NO: 36, 37, 34, 35; SEQ ID NO: 36, 37, 38, 35; и SEQ ID NO: 36, 37, 39, 35).
- консенсусная каркасная область "A" подгруппы II VH человека минус CDR по Kabat (SEQ ID NO: 40, 41, 42, 35).
- консенсусные каркасные области "B," "C" и "D" подгруппы II VH человека минус удлиненные гипервариабельные области (SEQ ID NO: 43, 44, 42, 35; SEQ ID NO: 43, 44, 45, 35; и SEQ ID NO: 43, 44, 46, и 35).
- консенсусная каркасная область "A" подгруппы III VH человека минус CDR по Kabat (SEQ ID NO: 47, 48, 49, 35).
- консенсусные каркасные области "B," "C" и "D" подгруппы III VH человека минус удлиненные гипервариабельные области (SEQ ID NO: 50, 51, 49, 35; SEQ ID NO: 50, 51, 52, 35; и SEQ ID NO: 50, 51, 53, 35).
- каркасная область акцептора "A" VH человека минус CDR по Kabat (SEQ ID NO: 54, 48, 55, 35).
- каркасные области акцептора "B" и "C" VH человека минус удлиненные гипервариабельные области (SEQ ID NO: 50, 51, 55, 35; и SEQ ID NO: 50, 51, 56, 35).
- каркасная область акцептора 2 "A" VH человека минус CDR по Kabat (SEQ ID NO: 54, 48, 57, 35).
- каркасные области акцептора 2 "B", "C" и "D" VH человека минус удлиненные гипервариабельные области (SEQ ID NO: 50, 51, 57, 35; SEQ ID NO: 50, 51, 58, 35; и SEQ ID NO: 50, 51, 59, 35).
На фигуре 6 представлены иллюстративные акцепторные консенсусные каркасные последовательности вариабельной области легкой цепи (VL) человека для применения для осуществления на практике настоящего изобретения. Идентификаторы последовательностей являются следующими:
- консенсусная каркасная область подгруппы I VL каппа человека (κv1): SEQ ID NO: 60, 61, 62, 63
- консенсусная каркасная область подгруппы II VL каппа человека (κv2): SEQ ID NO: 64, 65, 66, 63
- консенсусная каркасная область подгруппы III VL каппа человека (κv3): SEQ ID NO: 67, 68, 69, 63
- консенсусная каркасная область подгруппы IV VL каппа человека (κv4): SEQ ID NO: 70, 71, 72, 63
На фигуре 7 показаны каркасные последовательности легкой и тяжелой цепей huMAb4D5-8. Числа в виде надстрочных знаков/выделенные полужирным шрифтом указывают на аминокислотные положения по Kabat.
На фигуре 8 показаны каркасные последовательности легкой и тяжелой цепей huMAb4D5-8 с указанными модификациями. Числа в виде надстрочных знаков/выделенные полужирным шрифтом указывают на аминокислотные положения по Kabat.
На фигурах 9A и 9B показано, что антитела против NRR1 и против NRR2 специфично связываются с их рецепторами, как описано в примере B(1). (A) Анализ ELISA для измерения связывания антитела против NRR1 (левая панель) и антитела против NRR2 (правая панель) с очищенными фрагментами белка NRR из каждого из четырех рецепторов Notch человека (h) и мыши (m). Связывание, показанное как A560 на оси y, представлено на графике против титров антитела против NRR1 или антитела против NRR2. (B) Анализ FACS для определения связывания антитела против NRR1 (панели 1-6) или антитела против NRR2 (панели 7-12) с нетрансфицированными клетками K1-CHO (панели 1, 4, 7 и 10), клетками K1-CHO, стабильно трансфицированными N-myc-Notch1 (панели 2, 5, 8 и 11) или клетками K1-CHO, стабильно трансфицированными N-myc-Notch2 (панели 3, 6, 9 и 12). Трансгены N-myc-Notch экспрессировали под контролем индуцибельного промотора tet; нижний ряд, контрольная экспрессия в отсутствии индукции доксицилином (-Dox); верхний ряд, индуцированная экспрессия после добавления доксицилина (+Dox); следует отметить, что линия K1-CHO эндогенно экспрессирует Notch2, который выявляется антителом против NRR2 в присутствии и отсутствии доксицилина (например, панели 7 и 10 для сравнения).
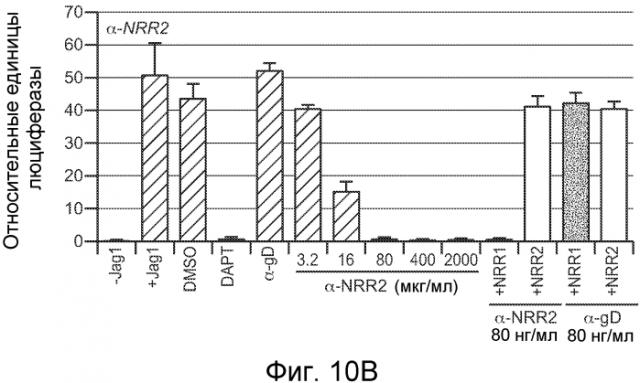
На фигурах 10A-C показано, что антитело против NRR1 и антитело против NRR2 специфично ингибирует передачу сигнала от его рецепторов-мишеней, включая рецепторы, несущие активирующие мутации, как описано в примерах B(2) и B(3). (A) Анализ совместной культуры для определения ингибирования антителом против NRR1 передачи сигнала Notch1. Клетки NIH-3T3, стабильно трансфицированные Jag1, использовали для индукции передачи сигнала Notch в клетках NIH-3T3, стабильно трансфицированных Notch1 (за исключением "-Jag1", где вместо клеток, экспрессирующих Jag1, использовали нетрансфицированные клетки NIH-3T3). Передачу сигнала Notch определяли с использованием репортерного гена Notch (CSL-зависимый промотор, запускающий экспрессию люциферазы светляка), и она выражена относительно экспрессии контрольного гена (конститутивный промотор, запускающий экспрессию люциферазы Renilla), нормализованной к условиям с DAPT (определенным как величина 1). +Jag1, стандартный анализ с совместным культивированием; DMSO, носитель DAPT отдельно; DAPT, 5 мкм в DMSO; α-gD, изотипическое контрольное антитело в концентрации 2000 нг/мл; α-NRR1, антитело против NRR1 в указанных концентрациях; последние четыре анализа включали 80 нг/мл либо α-NRR1, либо α-gD, вместе с очищенными белковыми фрагментами NRR либо Notch1, либо Notch2, как указано (+NRR1 или +NRR2). (B) Анализ совместной культуры для определения ингибирования антителом против NRR2 передачи сигнала Notch2. Клетки NIH-3T3, стабильно трансфицированные Jag1, использовали для индукции передачи сигнала Notch в клетках U87MG, которые экспрессируют высокие уровни Notch2. Анализ проводили, как описано в (A). (C) Анализ совместной культуры для определения ингибирования антителом против NRR1 передачи сигнала Notch1 с рецепторов Notch1 дикого типа или с мутантных рецепторов Notch1. Анализ проводили как в (A) за исключением того, что экспрессирующие рецептор клетки получали путем временной трансфекции плазмид, экспрессирующих указанные рецепторы Notch1. WT, Notch1 дикого типа; ΔPEST, Notch1, лишенный домена PEST; L1594P, Notch1, несущий указанную конститутивно активирующую точечную мутацию; E25, 625 нг/мл изотипического контрольного антитела; α-NRR1, 625 нг/мл антитела против NRR1; DMSO, носитель GSI отдельно; DAPT, 5 мкм в DMSO; CmpE, 1 мкМ соединение E в DMSO.
На фигурах 11A-D показано, что антитело против NRR1 и антитело против NRR2 функционируют в качестве рецептор-специфичных ингибиторов in vivo, как описано в примере B(4). Мышам Balb/c инъецировали четыре раза каждые четверо суток 5 мг/кг изотипического конрольного α-gD, α-NRR1 или α-NRR2, и на 13 сутки, через одни сутки после четвертой дозы, собирали клетки из тимуса или селезенки. (A) Измерение массы тимуса. Масса тимуса (в мг) выражена относительно общей массы тела (в г). Величины соответствуют среднему значению плюс стандартное отклонение для трех мышей на группу. (B) Количество клеток в тимусе. (C) FACS на CD4 и CD8 для идентификации двойных положительных по CD4+/CD8+ T-клеток. Числа соответствуют проценту клеток тимуса в двойных отрицательных, одинарных положительных и двойных положительных популяциях. Относительно контрольного антитела против gD (77,5%), антитело против NRR1 резко снижало процент клеток в популяции CD4+/CD8+ (5,89%) в то время как антитело против NRR2 (80%) не имело значительного эффекта. (D) FACS на CD21 и CD23 для идентификации B-клеток маргинальной зоны. Количества соответствуют средним процентам ± стандартное отклонение (для трех животных) клеток в области ворот MZB, которая заключена в рамку; также указаны значения p; представлены типичные точечные графики для одного из трех животных в каждой группе. Относительно контрольного антитела против gD (6,61%), антитело против NRR2 практически устраняло клетки MZB (0,97%), в то время как антитело против NRR1 (6%) не имело значительного эффекта.
На фигурах 12A-D структура размером 2,2 Ǻ совместного кристалла Fab против NRR1/NRR1 указывает на то, что антитело против NRR1 одновременно контактирует с доменами LNR-A, LNR-B и HD-C, как описано в примере B(5). (A) В таблице обобщенно представлено связывание α-NRR1 или α-NRR2 с фрагментами химерного белка Notch1-NRR или Notch2-NRR. Указанные фрагменты белка NRR (темно-синий, последовательности Notch1; голубой, последовательности Notch2) экспрессировались в качестве секретируемых белков, слитых с щелочной фосфатазой, для обеспечения быстрого определения связывания антитела в анализе на планшетах. После использования активности щелочной фосфатазы для нормализации по экспрессии и секреции NRR, культуральную среду, содержащую указанные химерные белки NRR, добавляли в 96-луночный планшет, на который было нанесено α-NRR1, α-NRR2 или изотипическое контрольное антитело (использованное для оценки фонового связывания, не показано). Связывание антитела оценивали путем измерения активности щелочной фосфатазы, которая оставалась связанной с планшетом. Y, сильное связывание; N, связывание не выявлено; W, выявлено слабое связывание. (B) Структура NRR1 человека. NRR1 представлен в качестве C-альфа изображения. Три иона кальция в мотивах LNR показаны в качестве сфер. Положение участка расщепления S2 указано стрелкой. (C) Наложение NRR1 на NRR2 (цепь A из pdb, код 2OO4), исходя из структурно консервативных атомов. NRR1 (закрашенный) и NRR2 (белый) показаны в качестве C-альфа изображений. (D) Вид по типу "открытая книга" для поверхности контакта между NRR1 (слева) и α-NRR1 Fab (справа, граница между тяжелой и легкой цепями показана черной пунктирной линией). Указана степень, с которой доступная для растворителя площадь поверхности погружается при образовании комплекса. Указаны остатки, которые погружены по меньшей мере на 50%, и идентичные остатки NRR в Notch1 и Notch2 обозначены черным шрифтом (см. также фигуру 18).
На фигурах 13A-C показано, что антитело против NRR1 вызывает гиперветвление эндотелиальных клеток, как описано в примере B(6). (A) Анализ ветвления эндотелиальных клеток in vitro. HUVEC наносили на гранулы Cytodex и совместно культивировали с фибробластами кожи. Культуры либо обрабатывали имитирующей обработкой (контроль), либо их обрабатывали 1 мкМ DBZ, 5 мкг/мл α-NRR1 или 5 мкг/мл α-Dll4. Планка масштаба = 100 мкм. (B) Измерение длины ветвлений в культурах из (A). (C) Анализ сетчатки новорожденных мышей в отношении ветвления эндотелиальных клеток и ангиогенеза. Новорожденным мышам инъецировали на P1 и P3 указанные антитела, и на P5 сетчатки приготавливали для визуализирующей перфузии изолектина или маркера пролиферации Ki67. Панели I и II, планки масштаба = 1 мм. Панели III-VI представляют собой увеличения частей панелей I и II, планка масштаба = 0,2 мм.
На фигурах 14A-E показано, что селективное антитело, блокирующее передачу сигнала Notch1, нарушает ангиогенез опухоли и ингибирует рост опухоли, как описано в примере B(7). На графиках для трех моделей с ксенотрансплантатами показан объем опухоли (среднее значение +/- SEM) против времени после введения указанных антител: антитела против агглютинина амброзии (отрицательный контроль), α-VEGF или α-NRR1. Значения P показаны для сравнения антитела против агглютинина амброзии против α-NRR1. (A) Модель Calu6. (B) Модель HM7. (C) Модель HM7 с титрованием дозы α-NRR1. (D) Окрашивание эндотелиальных клеток в репрезентативных срезах опухолей из модели Calu6, показанной на (A). Антитела, использованные в моделях с ксенотрансплантатами, показаны сверху. DAPI и α-CD31 использовали для окрашивания ДНК и эндотелиальных клеток, соответственно. Нижний ряд панелей демонстрирует объединенные изображения. Планка масштаба = 50 мкм. (E) Количественное определение окрашивания на CD31, представленного в (D). С использованием изображения J для количественного определения окрашивания на CD31 и с помощью DAPI в изображениях, сходных с изображениями, показанными в (D), относительное окрашивание на CD31 (окрашивание на CD31, нормализованное к окрашиванию DAPI) наносили на график для каждого из трех введений антител относительно контрольного антитела против агглютинина амброзии, которое было принято в качестве значения 1; данные соответствуют среднему значению +/- стандартное отклонение на протяжении 8 изображенных полей.
На фигурах 15A-C показано, что селективное антитело, блокирующее Notch1, является достаточным для изменения участи клеток в тонком кишечнике, как описано в примере B(8). (A) Общее изменение массы тела (среднее значение +/- стандартное отклонение) против времени. Мышам проводили введение, как описано для фигуры 11, контрольного изотипического антитела против gD, LTβR-Fc, антитела против NRR1 или антитела против NRR2. Стрелками указаны сутки дозирования. (B) Иммуногистохимические анализы тонкого кишечника. Мышам вводили указанные концентрации контрольного изотипического антитела против gD, DBZ или антитела против NRR1 на 0, 2 и 6 сутки и на 7 сутки тонкие кишечники подготавливали для иммуногистохимического анализа. В каждом ряду, как указано, представлено окрашивание гематоксилином и эозином (H & E), альциановым синим на муцин и для маркирования секреторных бокаловидных клеток, окрашивание на лизоцим для маркирования клеток Панета, окрашивание на Ki-67 для определения пролиферации и на Hes1 в качестве нижерасположенной мишени Notch. См. фигуры 19 и 20 для анализов толстого кишечника на 7 сутки и тонкого кишечника на 2 сутки, соответственно. Планка масштаба = 40 мкм. (C) Сравнение специфического ингибирования Notch1 против специфического ингибирования Notch2 в отношении дифференцировки клеток тонкого кишечника. Тонкие кишечники из исследования, описанного в (A), приготавливали для окрашивания альциановым синим и окрашивания на Ki-67 через одни сутки после конечного дозирования α-gD, α-NRR1 или α-NRR2, как указано. Планка масштаба = 50 мкм.
На фигуре 16 показано, что антитело против NRR1 является сильным ингибитором передачи сигнала Notch1, индуцируемой множеством лигандов, как описано в примере B(2). Анализы передачи сигнала Notch1 в совместной культуре проводили, как описано на фигуре 10A, за исключением того, что лиганд-экспрессирующие клетки экспрессировали Jag1, Jag2 или Dll1, как указано.
На фигуре 17 показаны химерные белковые конструкции NRR Notch1/NRR Notch2 с низким выходом, как описано в примере B(5). Таблица дополняет фигуру 12A, и в ней приведены химерные белки NRR, которые приводили к низкой активности щелочной фосфатазы или к ее отсутствию, указывая на то, что химеры не правильно сворачивались или были иным образом нестабильными. Для фрагментов, которые приводили к слабой, но поддающейся детекции активности щелочной фосфатазы, обобщенно представлено связывание α-NRR1 или α-NRR2. ---, нет экспрессии, и связывание не поддается тестированию; N, отсутствует экспрессия или связывание; W, слабая экспрессия или связывание.
На фигуре 18 показана консервативность остатков NRR1, с которыми контактировало антитело против NRR1, как описано в примере B(1) и B(5). Представлено выравнивание аминокислотных последовательностей NRR-домена Notch1 человека (SEQ ID NO: 26), NRR-домена Notch1 мыши (SEQ ID NO: 27), NRR-домена Notch2 человека (SEQ ID NO: 28) и NRR-домена Notch2 мыши (SEQ ID NO: 29), и границы субдомнов представлены справа. NRR Notch1 человека приведен в качестве эталонной последовательности, и остатки в других последовательностях NRR, которые идентичны остаткам в Notch1 человека, указаны полужирным шрифтом. Остатки, которые по меньшей мере на 25% погружены в структуру Fab против NRR1/Notch1-NRR (фигура 12), подчеркнуты, причем сплошные линии против пунктирных линий отражают повышение степени, с которой остатки погружены. Из 21 аминокислоты, которые по меньшей мере на 25% погружены в последовательности Notch1 человека, все 21 являются идентичными в последовательности Notch1 мыши, но только шесть из них идентичны в последовательностях Notch2 человека и мыши (плюс седьмое консервативное отличие, T вместо S, в S1712 Notch1 человека); среди этих идентичных и "погруженных" остатков в последовательностях Notch2, ни один из них не относится к классу погруженных >75%. Это сравнение последовательностей согласуется с (a) сильным связыванием антитела против NRR1 (приблизительно равные аффинности) с Notch1 как человека, так и мыши и (b) отсутствием связывания антитела против NRR1 с Notch2 человека и мыши. Более того, все погруженные остатки находятся в пределах LNR-A, LNR-B и HD-C, что согласуется с экспериментом по обмену доменов, представленным на фигурах 11A и 17.
На фигуре 19 показано, что селективное антитело, блокирующее Notch1, является достаточным для изменения участи клеток в толстом кишечнике, как описано в примере B(8). Гистопатологический анализ образцов толстого кишечника, взятых на 7 сутки эксперимента, описан на фигуре 15B.
На фигуре 20 показано, что изменения участи клеток кишечника развиваются на 2 сутки после блокирования Notch1, как описано в примере B(8). Гистопатологический анализ образцов тонкого кишечника, взятых на 2 сутки эксперимента, описан на фигуре 15B, на которой показаны образцы, взятые на 7 сутки.
На фигуре 21 показано, что антитело против NRR1 не блокирует индуцируемую Notch2 передачу сигнала in vitro, как описано в примере B(2). Анализ совместной культуры в клетках U87MG, как описано на фигуре 10B. Хотя антитело против NRR1 активно ингибирует передачу сигнала Notch1 in vitro (фигура 10A) и in vivo (фигуры 11A-C), оно не влияет на передачу сигнала Notch2, даже при использовании в концентрации 1000 нг/мл, что более чем в 100 раз превышает IC50. Этот результат согласуется со специфическим связыванием антитела против NRR1 с Notch1 (фигуры 9 и 12), а также с отсутствием ингибирования Notch2 антителом против NRR1 in vivo (фигура 11D).
На фигуре 22 показаны возможные синергические эффекты антитела против NRR1 и антитела против NRR2 на дифференцировку клеток кишечника, как описано в примере B8.
На фигуре 23 показано, что дексаметазон приводит по меньшей мере к частичному восстанавливаю фенотипа кишечника от фенотипа, вызванного антителом против NRR1, как описано в примере B(9).
На фигурах 24A и B показано, что селективное блокирование либо Notch1, либо Notch2 минимизирует или предотвращает метаплазию бокаловидных клеток, ассоциированную с тотальным ингибированием Notch, в то время как блокирование как Notch1, так и Notch2, вызывает тяжелую метаплазию бокаловидных клеток. (A) Как описано в примере B8, мышам вводили дозы 5 мг/кг антитела против NRR1, антитела против NRR2, или оба, или отрицательное контрольное антитело против gD на сутки, отмеченные стрелками; показано общее изменение массы тела (среднее значение +/- стандартное отклонение) против времени. (B) Иммуногистохимические анализы тонкого кишечника от мышей, которым проводили введение согласно (A), с использованием альцианового синего, окрашивающего муцин, для мечения секреторных бокаловидных клеток.
На фигурах 25A и 25B показано, что антитело против NRR2 (обозначаемое как "антитело против N2") ингибирует рост клеточных линий меланомы человека SK23 и LOX-IMVI in vitro, как описано в примере B(10).
На фигуре 26 показан эффект антитела против NRR2 (обозначаемого как "антитело против Notch2") на пять клеточных линий диффузных крупноклеточных B-клеточных лимфом (DLBCL) (приведенных справа). Как описано в примере B(11), рост одной из клеточных линий, "DB" строго ингибировался обработкой антителом против NRR2.
На фигуре 27 показан эффект антитела против NRR2 (называемого "антителом против Notch2") на рост клеточной линии DB DLBCL с течением времени, как описано в примере B(11).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к выделенным антителам, которые связываются с Notch, и к способам их применения, например, для диагностики или лечения заболеваний, ассоциированных с экспрессией или активностью Notch.
I. ОБЩИЕ СПОСОБЫ
Способы и процедуры, описанные или цитированные в настоящем документе, обычно хорошо понятны и широко применяются с использованием общепринятых технологий специалистами в данной области, например, таких как широко используемые технологии, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (F. M. Ausubel, et al. eds., (2003)); серия Methods in Enzymology (Academic Press, Inc.): PCR 2: A Practical Approach (M. J. MacPherson, B. D. Hames и G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M. J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R. I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al, eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C. A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (V. T. DeVita et al., eds., J. B. Lippincott Company, 1993).
II. ОПРЕДЕЛЕНИЯ
Для интерпретации описания применяются следующие определения, и, когда это приемлемо, термины, используемые в единственном числе, также включают множественное число и наоборот. В случае, когда любое указанное ниже определение противоречит документу, включенному в настоящий документ в качестве ссылки, следует руководствоваться определением, указанным ниже.
Термин "антитело" используют в настоящем документе в наиболее широком значении и, конкретно, он охватывает моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные из по меньшей мере двух целых антител, и фрагменты антител, при условии, что они проявляют требуемую биологическую активность.
"Выделенное" антитело представляет собой антитело, которое идентифицировано и отделено и/или извлечено из компонента его естественных окружающих условий. Загрязняющие компоненты его естественных окружающих условий представляют собой вещества, которые препятствуют исследовательскому, диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и д