Способ получения производных 3-(2-фурил)фталида
Иллюстрации
Показать всеИзобретение относится к разработке способа получения производных 3-(2-фурил)фталида общей формулы 1, представляющих интерес в качестве исходных соединений для синтеза ряда биологически активных и перспективных для биологического скрининга гетероциклических систем. Способ заключается в термостатировании смеси доступных 2-формилбензойных кислот и 2-метилфурана при температуре от 60°C до 80°C в воде при перемешивании в течение 3-7 суток. Для соединений 1б-е реакцию проводят при 80°C, для 1а - при 65°C, для 1ж - при 60°С. Технический результат - упрощение процесса за счет исключения использования кислотного катализатора и растворителя диоксана. 2 табл., 10 пр.
Реферат
Изобретение относится к области органической химии - синтезу производных 3-(2-фурил)фталида, представляющих интерес в качестве исходных соединений для синтеза ряда биологически активных и перспективных для биологического скрининга гетероциклических систем.
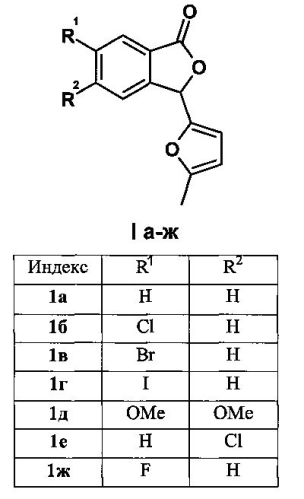
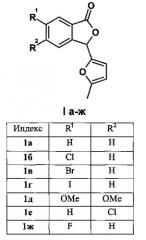
Изобретение относится к разработке способа получения производных 3-(2-фурил)фталида общей формулы 1
которые могут быть использованы для получения 2-(2-карбоксибензил)-фуранов [С.С. Lopes, Е.L.S. Lima, A.J. Monteiro, P.R.R. Costa, Synth. Commun., 1988, 18, 1731-1741], привлекательных предшественников природных нафто[2,3-b]фуран-4,9-дионов [С.L. Zani, А.В. de Oliveira, V. Snieckus, Tetrahedron Lett, 1987, 28, 6561-6564], обладающих цитотоксическим и антипаразитарным действием [R. Ribeiro-Rodrigues, W.G. dos Santos, А.В. Oliveira, V. Snieckus, С.L. Zani, A.J. Romanha, Bioorg. Med. Chem. Lett., 1995, 5, 1509-1512]. Кроме того, 2-(2-карбоксибензил)фураны могут быть использованы в синтезе производных изокумарина [А.V. Butin, A.S. Dmitriev, М.G. Uchuskin, V.Т. Abaev, I.V. Trushkov, Synth. Commun., 2008, 38, 1569-1578], изохинолона [A.S. Dmitriev, V.Т. Abaev, W. Bender, А.V. Butin, Tetrahedron, 2007, 63, 9437-9447] и пиридазиноизохинолона [А.V. Butin, A.S. Dmitriev, О.N. Kostyukova, V.Т. Abaev, I.V. Trushkov, Synthesis, 2007, 14, 2208-2214], которые также могут проявлять различные виды биологического действия.
Большинство описанных в литературе методов синтеза 3-(2-фурил)фталидов основаны на применении реакции направленного орто-металлирования бензамидов, протекающей при использовании дорогостоящих металлоорганических реагентов в условиях низких температур (до -78°C) и инертной атмосферы [S.М. Starling, D.S. Raslan, А.B. de Oliveira, Synth. Commun., 1998, 28, 1013-1030; S.М. Starling, D.S. Raslan, A.B. de Oliveira, C.L. Zani, Synth. Commun., 1998, 28, 3567-3578; L.M. Bradley, C.G. Collins, E.R. Tabakin, D.A. Hunt, Org. Prep. Proc. Int., 2010, 42, 187-190; P. Garibay, P.H. Toy, T. Hoeg-Jensen, K.D. Janda, Synlett, 1999, 9, 1438-1440]. Указанные ограничения и связанная с ними необходимость в специальном лабораторном оборудовании препятствуют широкому распространению 3-(2-фурил)фталидов в синтетической практике.
Разработан также способ получения хирального 3-(2-фурил)фталида, представляющий собой восстановительную циклизацию этил-2-(2-фуроил)бензоата с помощью йодида самария и комбинации хирального и ахирального катализаторов [Ling-Lin Huang, Ming-Hua Xu, Guo-Qiang Lin, J. Am. Chem. Soc., 2006, 128, 5624-5625]. Несмотря на высокую энантиоселективность процесса, труднодоступность исходных соединений, дороговизны каталитической системы, а также необходимость проведения реакции при низких температурах (от -78°C до -50°C) и умеренный выход (65%) существенно ограничивают возможность применения данного способа.
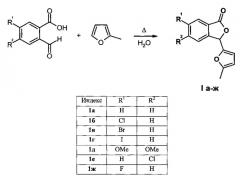
В основе заявляемого способа лежит описанная ранее кислотно-катализируемая конденсация 2-формилбензойных кислот и 2-алкилфуранов в кипящем диоксане, в ходе которой наряду с арилдифурилметанами наблюдалось образование производных 3-(2-фурил)фталида в качестве побочных продуктов реакции с весьма низкими выходами [V.Т. Abaev, A.S. Dmitriev, А.V. Gutnov, S.A. Podelyakin, А.V. Butin, J. Heterocycl. Chem., 2006, 43, 1195-1204; A.S. Dmitriev, A.S. Pilipenko, V.T. Abaev, A.V. Butin, Chem. Heterocycl. Compd., 2005, 41, 1102-1104].
Модификация вышеуказанного способа позволила получить целевые 3-(2-фурил)фталиды с удовлетворительными выходами [П.М. Шпунтов, В.А. Щербинин, А.В. Бутин, ХГС, 2014, 12, 1920-1923]. Данное превращение реализуется при использовании в качестве растворителя воды и небольшого количества диоксана для облегчения растворения исходных соединений, а также соляной кислоты как катализатора. Однако недостатками данного метода являются параллельно протекающая в этих условиях тримеризация 2-алкилфуранов [D.S.P. Eftax, А.P. Dunlop, J. Org. Chem., 1965, 30, 1317-1319] с образованием соответствующих 5,5-бис(5-алкил-2-фурил)пентан-2-онов и образование небольших количеств арилдифурилметанов, что значительно затрудняет очистку реакционной смеси.
В то же время известен способ синтеза производных 3-индолил-фталида, представляющий собой конденсацию 2-формилбензойных кислот и индолов по Фриделю-Крафтсу в воде при нагревании [Н. Lin, X.-W. Sun, Tetrahedron Lett, 2008, 49, 5343-5346].
Задача изобретения - разработка эффективного, удовлетворяющего принципам «зеленой химии» метода синтеза производных 3-(2-фурил)-фталида 1а-ж, представляющих собой ценные исходные соединения для синтетической органической и фармацевтической химии.
Техническим результатом изобретения является создание простого, экологичного способа получения производных 3-(2-фурил)фталида, позволяющего синтезировать целевые соединения с высокими выходами, а также варьировать природу заместителей в бензольном кольце, что расширяет возможности применения указанных соединений в синтезе потенциально биологически активных веществ.
Технический результат достигается тем, что смесь доступных 2-формилбензойных кислот [V.Т. Abaev, A.S. Dmitriev, А.V. Gutnov, S.А. Podelyakin, А.V. Butin, J. Heterocycl. Chem., 2006, 43, 1195-1204] и 2-метилфурана термостатируют при температуре от 60°C до 80°C в воде при перемешивании в течение 3-7 суток. Для соединений 1б-е реакцию проводят при 80°C, для 1а - при 65°C, для 1ж - при 60°C. Указанные условия получения позволяют за счет мягкого катализа исходными 2-формил-бензойными кислотами избежать образования нежелательных арилдифурил-метанов и продукта тримеризации 2-метилфурана. Это, в свою очередь, существенно облегчает выделение и очистку целевых соединений. Различие в температурных режимах в зависимости от исходного субстрата объясняется тем, что для минимизации протекания побочных процессов, упрощения обработки реакционной смеси и увеличения выходов целевых 3-(2-фурил)фталидов необходимым условием является выпадение продуктов из реакционной среды в виде твердого осадка, что реализуется при указанных температурах. Нагрев выше указанных температур приводит к образованию масел, дальнейшее термостатирование которых сопровождается образованием арилдифурилметанов в качестве основных продуктов реакции.
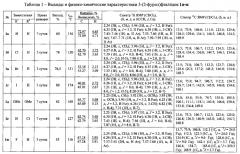
Температуры плавления, выходы, время реакции, данные элементного анализа и спектральные характеристики 3-(2-фурил)фталидов 1а-ж приведены в таблице 1.
Способ позволяет получать желаемые продукты 1a-ж с высокими выходами в соответствующих принципам «зеленой химии» (отсутствие дополнительных реагентов и катализаторов, осуществление реакции в воде) в условиях, перспективных с точки зрения масштабирования процесса. Установлено, что масштабирование разработанного способа не приводит к снижению выхода целевых продуктов реакции.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения 6-хлор-3-(5-метилфуран-2-ил)-2-бензофуран-1 (3H)-она 1б.
Пример 1
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.27 мл (3 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 78% (0.39 г).
Тпл.=119-120°C.
Найдено для C13H9ClO3, %: C, 62.70; H 3.72.
Вычислено: C, 62.79; H 3.65.
Спектр 1H ЯМР (CDCl3), (δ, м.д. и КССВ, J, Гц): 2.24 (3H, с, CH3); 5.96 (1Н, д, J=3.2, Н Fur); 6.27 (1Н, д, J=3.2, Н Fur); 6.38 (1Н, с, 3-СН); 7.39 (1Н, д, J=8.0, Н-4); 7.65 (1Н, д. д, J=8.0, J=2.0, Н-5); 7.90 (1Н, д, J=2.0, Н-7).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 13.5; 75.8; 106.7; 112.2; 124.3; 125.6; 128.4; 134.4; 136.0; 144.7; 146.1; 154.6; 168.4.
Пример 2
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.27 мл (3 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 80°C в течение 5 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 80% (0.40 г).
Пример 3
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.27 мл (3 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 65°C в течение 5 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 64% (0.32 г).
Пример 4
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.27 мл (3 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 75°C в течение 5 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 72% (0.36 г).
Пример 5
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.27 мл (3 ммоль) 2-метилфурана и 20 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 70% (0.35 г).
Пример 6
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.22 мл (2,4 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 68% (0.34 г).
Пример 7
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.18 мл (2 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 64% (0.32 г).
Пример 8
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.36 мл (4 ммоль) 2-метилфурана и 25 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 78% (0.39 г).
Пример 9
Смесь 0.37 г (2 ммоль) 5-хлор-2-формилбензойной кислоты, 0.27 мл (3 ммоль) 2-метилфурана и 30 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 40 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 74% (0.37 г).
Пример 10 (масштабирование)
Смесь 3.7 г (0.02 моль) 5-хлор-2-формилбензойной кислоты, 2.7 мл (0.03 моль) 2-метилфурана и 250 мл воды в виале перемешивают при 80°C в течение 3 суток. Выпавший продукт отфильтровывают, сушат и очищают, пропуская через слой силикагеля (d 50 мм, h 30 мм) марки КСК, фракция 5-40 мкм, элюент - хлористый метилен/петролейный эфир (1:2). Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 74% (3.7 г).
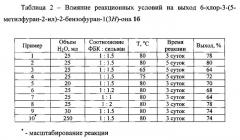
В таблице 2 приведены данные о влиянии условий проведения реакции на выход 6-хлор-3-(5-метилфуран-2-ил)-2-бензофуран-1(3H)-она 1б (примеры 1-10).
Как видно из таблицы 2, результат, а именно получение 6-хлор-3-(5-метилфуран-2-ил)-2-бензофуран-1(3H)-она 1б, может быть достигнут при использовании воды в качестве растворителя и в отсутствие каких-либо дополнительных катализаторов. Оптимальными условиями проведения реакции является перемешивание смеси 5-хлор-2-формилбензойной кислоты (2 ммоль) и 2-метилфурана (3 ммоль) в 25 мл воды при 80°C в течение 3 суток. Увеличение времени реакции не приводит к существенному увеличению выхода целевого продукта, в то время как уменьшение температуры, количества воды или избытка 2-метилфурана по отношению к исходной кислоте приводят к его снижению.
Изобретение позволяет получать целевые соединения с высокими выходами в доступных, технологичных условиях, удовлетворяющих принципам «зеленой химии», а также за счет мягкого катализа исходными 2-формилбензойными кислотами избежать образования нежелательных арилдифурилметанов и продукта тримеризации 2-метилфурана.
Способ получения производных 3-(2-фурил)фталида общей формулы 1 характеризующийся тем, что смесь доступных 2-формилбензойных кислот и 2-метилфурана термостатируют в воде при температуре от 60°С до 80°С в течение 3-7 суток при перемешивании без использования дополнительных реагентов и катализаторов.