Соединения 2-арилбензофуран-7-формамида, способ их получения и применение
Иллюстрации
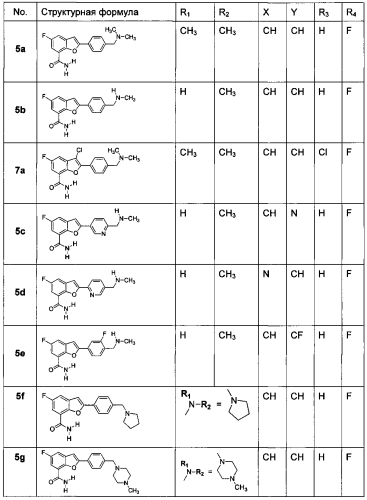
Показать всеНастоящее изобретение относится к новым производным 2-арилбензофуран-7-формамида общей формулы I, где R1 и R2 каждый независимо друг от друга представляет собой водород, прямой или разветвленный С1-С4-алкил, С3-С4-циклоалкил или замещенный 5- или 6-членный гетероциклил, содержащий кислород или азот; или R1 и R2 вместе с N образуют незамещенный или замещенный насыщенный 5- или 6-членный гетероциклил, содержащий по меньшей мере один гетероатом, где гетероатом представляет собой О, N и S, заместитель представляет собой метил на N; R3 представляет собой атом водорода или атом хлора; R4 представляет собой атом водорода или атом фтора; X представляет собой СН, CF или N; и Y представляет собой СН, CF или N, или его фармакологически или физиологически приемлемой соли, а также к способу его получения и применению при получении противоопухолевых и противовоспалительных лекарственных средств. 3 н. и 5 з.п. ф-лы, 5 табл., 24 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области фармацевтической химии и фармакотерапии, в частности к соединениям 2-арилбензофуран-7-карбоксамида или их фармакологически или физиологически приемлемым солям, способам получения и их применению при получении лекарственного препарата для лечения заболеваний, связанных с поли(аденозиндифосфат-рибоза)-полимеразой, такими как злокачественные опухоли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Поли(АДФ-рибоза)-полимераза (PARP) (АДФ - аденозиндифосфат) представляет собой ядерный фермент большинства эукариот, основная функция которого заключается в синтезе поли(АДФ-рибозы) (PAR) при помощи никотинамидадениндинуклеотида (NAD+) в качестве ее субстрата и переносе синтезированной поли(АДФ-рибозы) на белок-рецептор, таким образом происходит регулирование функции белка (см.: Schreiber, V.; Dantzer, F.; Ame, J.С.; de Murcia, G. Poly(ADPribose): novel functions for an old molecule. Nat. Rev. Mol. Cell Biol. 2006, 7, 517-528). Обнаружено по меньшей мере 16 гомологов в семействе PARP, но только шесть членов (PARP1, PARP2, PARP3, PARP4 (VPARP), Танкираза 1 (TNKS1) и Танкираза 2 (TNKS2), соответственно) обладают функцией поли(АДФ-рибоза)полимеразы согласно строгим структурным и функциональным критериям, в то время как другие члены семейства могут действовать в качестве моно-АДФ-рибозилтрансфераз (см.: Rouleau, М.; Patel, A.; Hendzel, М. J.; Kaufmann, S.Н.; Poirier, G. G. PARP inhibition: PARP1 and beyond. Nat. Rev. Cancer 2010, 10, 293-301). Только PARP1 и PARP2 семейства PARP могут быть активированы посредством разрывов цепи ДНК, опосредовать поли-АДФ-рибозилирование и участвовать в репарации одноцепочечных разрывов ДНК за счет эксцизионной репарации оснований (BER). Поли-АДФ-рибозилирование вызывает деполимеризацию хроматина в поврежденном участке, инициирует механизм репарации и ускоряет репарацию повреждения ДНК. Так как PARP1 и PARP2 играют двойственные роли, включая детекцию повреждения ДНК и сигнальную трансдукцию в течение процесса репарации. PARP1 человека представляет собой полипептид с молекулярной массой 113 кДа (килодальтон) и содержит три функциональных домена. Домен связывания ДНК (DBD), локализованный на N-терминальном конце, включает два «цинковых пальца», распознающих одноцепочечные разрывы и двуцепочечные разрывы ДНК. Автомодифицирующий домен локализован в среднем участке, за счет которого PARP1 связывается с АДФ-рибозилом, таким образом, PARP полиАДФ-рибозилирует сам себя. Каталитический домен, расположенный на С-терминальном конце, действует в качестве основы для переноса NAD+ на АДФ-рибозу и представляет собой активную структуру для функционирования PARP1. Напротив, PARP2 человека представляет собой полипептид с молекулярной массой 62 кДа. Его ДНК-связывающий домен отличен от такового PARP1, и поэтому его основной функцией является распознавание пробелов, возникающих в результате делеции нуклеотида в поврежденной цепи ДНК. Каталитический домен, расположенный на С-терминальном конце PARP2, схож с таковым PARP1, однако тонкое отличие в их структурах все же отражает разницу в белках-мишенях, которые они катализируют. PARP1 и PARP2 играют важную роль в репарации повреждения ДНК, стабильности генома и регуляции клеточного апоптоза посредством эксцизионной репарации оснований. Поэтому они являются одной из интересных мишеней в исследованиях противоопухолевых лекарственных средств в последние годы (см.: Yelamos, J.; Farres, Jordi.; Llacuna, L.; Ampurdanes, C.; targeCaballero, J.M. PARP-1 and PARP-2: New players in tumour development. Am. J. Cancer Res. 2011, 1(3), 328-346). Однако важная роль PARP в процессах, таких как воспаление, ишемическая реперфузия и т.д., показывает, что PARP также обладает потенциальной практической значимостью при заболеваниях (таких как диабет, сердечно-сосудистые заболевания и т.д.), за исключением злокачественных опухолей (см.: Peralta-Leal, A.; Rodriguez-Vargas, J.М.; Aguilar-Quesada, R.; Rodriguez, M.I.; Linares, J.L.; de Almodovar, M.R.; Oliver, F.J. PARP inhibitors: new partners in the therapy of cancer and inflammatory diseases. Free Radical Biol. Med. 2009, 47, 13-26).
В 2005 году было сообщено в Nature, что ингибиторы PARP1/2, применяемые сами по себе, оказывают значительный ингибирующий эффект на клетки рака молочной железы с дефектным BRCA1/2 (см.: Bryant, Н. Е.; Schultz, N.; Thomas, H. D.; Parker, К. M.; Flower, D.; Lopez, E.; Kyle, S.; Meuth, M.; Curtin, N. J.; Helleday, T. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature 2005, 434, 913-917. And Farmer, H.; McCabe, N.; Lord, C. J.; Tutt, A. N.; Johnson, D. A.; Richardson, Т. В.; Santarosa, M.; Dillon, K. J.; Hickson, I.; Knights, C.; Martin, N. M.; Jackson, S. P.; Smith, G. C.; Ashworth, A. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature 2005, 434, 917-921.), что стало открытием в исследовании применения ингибиторов PARP1/2 самих по себе при противоопухолевом лечении. ДНК является нестабильной и может быть повреждена в результате воздействия неблагоприятных условий окружающей среды (таких как ультрафолетовое излучение и т.д.), биопродуктов нормального клеточного метаболизма и разрывов некоторых химических связей в ДНК. Для сохранения генома целым и стабильным нормальным клеткам человека требуется репарация повреждений ДНК, вызванных различными факторами, десятки тысяч раз каждый день. Основной путь репарации ДНК включает эксцизионную репарацию оснований (BER), эксцизионную репарацию нуклеотидов (NER), гомологичную рекомбинацию (ГР) и негомологичное спаривание концов (NHEJ); где BER, при которой задействован PARP1/2, является главным путем репарации одноцепочечных разрывов ДНК, в то время как ГР является главным путем репарации двуцепочечных разрывов ДНК (см.: Hoeijmakers, J. Н. Genome maintenance mechanisms for preventing cancer. Nature 2001, 411, 366-74). BRCA1/2 представляют собой известные гены-супрессоры опухоли и ключевые факторы репарации при ГР. Дефекты в BRCA1/2 будут увеличивать нестабильность генома и вызывать возникновение злокачественной опухоли. В таких клетках двуцепочечные разрывы ДНК не могут быть репарированы при помощи ГР и в конечном итоге разрывы приведут к гибели клетки. Ингибирование PARP1/2 в BRCA1/2-дефицитных опухолевых клетках приведет к увеличению накопления одноцепочечных разрывов ДНК; в случае развития репликативной вилки одноцепочечные разрывы ДНК превращаются в летальные двуцепочечные разрывы, которые обязательно приведут к гибели клетки. Феномен того, что ингибирование PARP1/2 вместе с дефектами BRCA1/2 приводит к гибели клеток, также называют синтетической летальностью. Применение феномена синтетической летальности обеспечивает новую стратегию при лечении злокачественных опухолей, таким образом, открывая новую эру ингибиторов PARP1/2 для исследования и развития высоко селективных противоопухолевых лекарственных средств (см.: Kaelin, W.G., Jr. The concept of synthetic lethality in the context of anticancer therapy. Nat. Rev. Cancer 2005, 5, 689-698; He JX, Yang CH, Miao ZH. PARP inhibitors as promising cancer therapeutics. Acta Pharmacol. Sin. 2010, 31, 1172-1180).
Первое поколение ингибиторов PARP1/2 возникло тридцать лет назад и большинство из них представляют собой аналоги никотинамида, но такие ингибиторы лишены селективности и эффективности. Второе поколение ингибиторов PARP1/2 было разработано в 1990-х гг. и были показана четкая взаимосвязь между структурой и активностью; поэтому, ингибиторы PARP1/2 обладают более четкими структурными чертами. Структурные черты включают электрон-богатое ароматическое кольцо; карбоксамидную группу, по меньшей мере включающую один свободный водород для образования водородной связи; и одну негидролизуемую химическую связь в положении, соответствующем 3-положению фармакофора карбоксамида и т.д. (см.: Zaremba, Т.; Curtin, N.J. PARP inhibitor development for systemic cancer targeting. Anti-Cancer Agents Med. Chem. 2007, 7, 515-523). В настоящее время по меньшей мере семь ингибиторов PARP1/2 прошли клинические испытания в качестве противоопухолевых лекарственных средств (см.: С. Toulmonde1, U.М.; Bonnefoi, Н.A review of PARP inhibitors: from bench to bedside. Annals of Oncology 2011, 22 (2), 268-79; Ferraris, D.V. Evolution of Poly(ADP-ribose) Polymerase-1(PARP-1) Inhibitors. From Concept to Clinic. J. Med. Chem. 2010, 53, 4561-4584; He JX, Yang CH, Miao ZH. PARP inhibitors as promising cancer therapeutics. Acta Pharmacol. Sin. 2010, 31, 1172-1180). Однако данные ингибиторы все еще имеют много недостатков, таких как относительно низкая биодоступность при пероральном введении, потеря селективности в отношении подтипов PARP за исключением PARP1/2 и т.п.
Кроме того, соединения 2-арилбензофурана широко распространены в природных продуктах. Из-за их хороших биоактивностей и потенциальной фармацевтической ценности исследователи всегда уделяют им пристальное внимание. С другой стороны, ученые, изучающие природные продукты, постоянно выделяют и изолируют новые соединения 2-арилбензофурана из природных продуктов, исследуют и развивают их биологические активности (см.: Halabalaki, М.; Aligiannis, N.; Papoutsi, Z.; Mitakou, S.; Moutsatsou, P.; Sekeris, C.; Skaltsounis, A.-L. Three New Arylobenzofurans from Onobrychis ebenoides and Evaluation of Their Binding Affinity for the Estrogen Receptor. J. Nat. Prod. 2000, 63, 1672-1674; and Tsai, I. L.; Hsieh, C.-F.; Duh, C.-Y. Additional Cytotoxic Neoligants From Perseaobovatifolia. Phytochemistry 1998, 48, 1371-1375); с другой стороны, значительные усилия могут быть приложены химиками для развития и оптимизации ряда способов конструирования соединений 2-арилбензофурана (см.: Ziegert, R.Е.; Torang, J. Knepper, К.; Brase, S. The Recent Impact of Solid-Phase Synthesis on Medicinally Relevant Benzoannelated Oxygen Heterocycles. J. Comb. Chem. 2005, 7, 147-169. Chen, C.Y.; Dormer, P.G. Synthesis of Benzo[b]furans via Cul-Catalyzed Ring Closure. J. Org. Chem. 2005, 70, 6964-6967. And Liang, Z.D.; Hou, W.Z.; Du, Y.F.; Zhang, Y.L.; Pan, Y.; Mao, D.; Zhao, K. Oxidative Aromatic C-O Bond Formation: Synthesis of 3-Functionalized Benzo[b]furans by FeCl3-Mediated Ring Closure of α-Aryl Ketones. Org. Lett. 2009, 21, 4978-4981, etc.). Различные активности выявлены у известных соединений 2-арилбензофурана, таких как агонисты рецептора ретиноевой кислоты (RAP) (см.: Santín, Е.Р.; Khanwalkar Н.; Voegel, J.; Collette, P.; Mauvais, P.; Gronemeyer, H.; A. R. de Lera. Highly Potent Naphthofuran-Based Retinoic Acid Receptor Agonists. ChemMedChem. 2009, 4, 780-791), ингибиторы полимеризации тубулина (см.: Flynn, В.L.; Hamel E.; Jung, M.K. One-Pot Synthesis of Benzo[b]furan and Indole Inhibitors of Tubulin Polymerization. J. Med. Chem. 2002, 45, 2670-2673), metalloproteinase inhibitors (see: Nakatani, S.; Ikura, M.; Yamamoto, S.; Nishita, Y.; Itadani, S.; Habashita, H.; Sugiura, T.; Ogawa, K.; Ohno, H.; Takahashi, K.; Nakai, H.; Toda, M. Design and synthesis of novel metalloproteinase inhibitors. Bioorg. Med. Chem. 2006, 14, 5402-5422), и антимикробные агенты (см.: Emirdağ-Öztürk, S.; Karayildirim, Т.; Anil, H. Synthesis of egonol derivatives and their antimicrobial activities. Bioorg. Med. Chem. 2011, 18, 1179-1188). Из-за хороших биологических активностей и потенциальной огромной медицинской значимости, некоторые соединения были запатентованы, например, применение при лечении заболеваний, связанных с рецептором простагландина Е2 (WO 2008/098978), применение при лечении заболеваний, связанных с рецептором каннабиноида (WO 2011/022679) применение при лечении заболеваний, связанных с рецептором эстрогена (WO 2009/124968), применение для предупреждения бактериальной и грибковой инфекции (WO 2005/047275), и применение при лечении нарушения, возникающего при рефлектороном сокращении мочевого пузыря (ЕР 0306226 А2). Упомянутые выше соединения 2-арилбензофурана не покрывают их применения в качестве ингибиторов PARP1/2 согласно настоящему изобретению.
На основании вышеупомянутого авторы изобретения разработали и синтезировали новые соединения 2-арилбензофуран-7-карбоксамида в качестве ингибиторов PARP1/2 с высокой селективностью. Соединения по настоящему изобретению обладают явными взаимосвязями между структурой и активностью, и некоторые соединения, такие как соединение 5b, обладают высокой селективностью по отношению к PARP1/2 и превосходной биодоступностью (после введения 10 мг/кг 5b крысам посредством зондового питания, абсолютная биодоступность составляла 58,9%, в то время как оральная биодоступность у крыс для соединения AZD2281 в течение фазы II клинических испытаний составила только 11,1%). Такой новый ингибитор PARP1/2 обещает стать новым противоопухолевым лекарственным препаратом.
Краткое описание изобретения
Цель настоящего изобретения обеспечить соединения 2-арилбензофуран-7-карбоксамида, как изображено на общей формуле I, или их фармакологически или физиологически приемлемые соли,
где
R1 и R2 каждый независимо друг от друга представляет собой Н, прямой или разветвленный С1-С4-алкил, С3-С4-циклоалкил или насыщенную 5- или 6-членную гетероцикличную группу, содержащую О или N;
или R1 и R2 вместе с N образуют незамещенную или замещенную насыщенную 5- или 6-членную гетероцикличную группу, содержащую по меньшей мере один гетероатом, где гетероатом представляет собой О, N и S, заместитель представляет собой метил на N;
R3 представляет собой атом водорода или атом хлора;
R4 представляет собой атом водорода или атом фтора;
X представляет собой CH, CF или N; и
Y представляет собой CH, CF или N.
Предпочтительно, R1 представляет собой Н, метил, этил, изопропил, циклопропил, пиперидин-4-ил или (R)тетрагидрофуран-3-ил;
R2 представляет собой Н, метил, этил, изопропил, циклопропил, пиперидин-4-ил или (R)тетрагидрофуран-3-ил;
или R1 и R2 вместе с N образуют незамещенный или замещенный морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, пиперидинил или пирролидинил, где заместитель представляет собой метил на N;
R3 представляет собой атом водорода;
R4 представляет собой атом фтора;
X представляет собой CH, CF или N; и
Y представляет собой CH, CF или N.
Более предпочтительно, R1 представляет собой Н или метил;
R2 представляет собой метил, изопропил, циклопропил, пиперидин-4-ил или (R)тетрагидрофуран-3-ил;
R1 и R2 вместе с N образуют незамещенный или замещенный морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, пиперидинил или пиролидинил, где заместитель представляет собой метил на N;
R3 представляет собой атом водорода;
R4 представляет собой атом фтора;
X представляет собой CH, CF или N; и
Y представляет собой CH, CF или N.
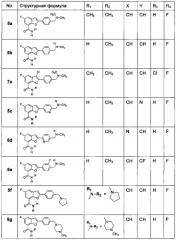
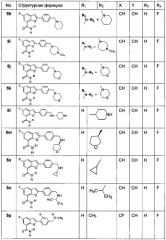
Изобретение предлагает наиболее предпочтительное соединение, как показано в таблице 1:
Предпочтительно фармакологически или физиологически приемлемая соль представляет собой гидрохлорид.
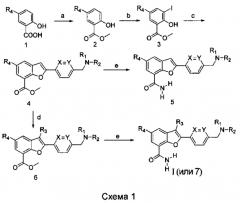
Другая цель настоящего изобретения предложить способ получения соединений общей формулы I, путь синтеза которых приведен на схеме 1:
a) салициловую кислоту, замещенную в 5-положении, подвергают реакции этерификации с образованием соединения 2;
b) соединение 2 подвергают реакции йодирования с образованием соединения 3;
c) соединение 3 и замещенный ароматический алкин подвергают реакции Соногаширы и затем циклизации с образованием соединения 4;
d) соединение 4 подвергают реакции галогенирования с образованием соединения 6;
e) соединение 4 или 6 подвергают реакции аммонолиза с образованием соединения 5 или I (или 7), соответственно;
условия этапа а): дефлегмирование проводят с метанолом в качестве растворителя в присутствии каталитического количества кислоты, такой как серная кислота;
условия этапа b): N,N-диметилформамид применяют в качестве растворителя, и соединение 2 и N-йодсукцинимид перемешивают при комнатной температуре под азотом до завершения реакции, которое определяют посредством тонкослойной хроматографии;
условия этапа с): N,N-диметилформамид применяют в качестве растворителя, бис(трифенилфосфин)палладий(II) дихлорид и йодид меди применяют в качестве катализаторов, диизопропилэтиламин применяют в качестве основания, и реакцию продолжают в течение 2-3 часов при комнатной температуре под азотом, и затем реакцию проводят при 50-90°С до завершения реакции, которое опрежедяют при помощи тонкослойной хроматографии;
условия этапа d): тетрагидрофуран применяют в качестве растворителя и соединение 4 и N-хлорсукцинимид перемешивают при комнатной температуре под азотом до завершения реакции, которое определяют при помощи тонкослойной хроматографии.
Условия этапа е): при 70-120°С насыщенный раствор аммиака в метаноле применяют в качестве растворителя и реакцию проводят в течение ночи в запаянной пробирке; или соединение 4 или 6 реагирует непосредственно с концентрированным водным раствором аммиака при перемешивании в течение ночи в запаяной пробирке при 70-120°С,
где струтктурная формула замещенного ароматического алкина 8 представляет собой следующее:
где R1, R2, R3, R4, X и Y такие, как определено выше.
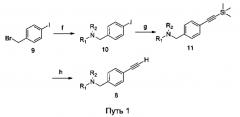
Изобретение предлагает различные способы получения замещенного ароматического алкина 8 и путь синтеза представляет собой следующее, как представлено на схеме пути 1 или пути 2:
f) соединение 9 подвергают реакции замещения амина с образованием соединения 10;
g) соединение 10 или 12 подвергают реакции Соногаширы с образованием соединения 11 или 13, соответственно;
h) соединение 11 или 13 подвергают снятию защитных групп с образованием соединения 8 или 14, соответственно;
i) соединение 14 подвергают восстановительному аминированию с образованием соединения 8;
условия этапа f): насыщенный раствор С1-С4-алкиламина или 5-членного/6-членного вторичного амина, содержащего по меньшей мере один гетероатом (О/N/S), в спирту применяют в качестве растворителя и реакционную смесь перемешивают при комнатной температуре;
условия этапа g): тетрагидрофуран применяют в качестве растворителя, бис(трифенилфосфин)палладий(II)дихлорид и йодид меди применяют в качестве катализатора, диизопропилэтиламин применяют в качестве основания и соединение 10 или 12 реагирует с этинилтриметилсиланом с обратным холодильником под азотом;
условия этапа h): метанол применяют в качестве растворителя, карбонат калия применяют в качестве основания и реакционную смесь перемешивают при комнатной температуре;
условия этапа i): метанол применяют в качестве растворителя, цианоборогидрид натрия применяют в качестве восстановителя и соединение 14 реагирует с различными аминами при перемешивании при комнатной температуре;
где R1, R2, X и Y такие, как определенные выше.
Другая цель изобретения предложить применение соединения общей формулы I или его фармакологически или фармацевтически приемлемых солей при получении лекарственных препаратов для заболеваний, связанных с PARP, таких как противоопухолевые, противовоспалительные лекарственные препараты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Структура и способ получения соединений по настоящему изобретению и их in vitro и in vivo PARP1/2-ингибирующая активность будут проиллюстрированы посредством сочетания следующих примеров. Однако данные примеры предназначены для иллюстрации изобретения, но не с целью его ограничения каким-либо образом.
Во всех примерах 5-фторсалициловая кислота поставлена Shanghai Bepharm, Ltd.; бис(трифенилфосфин)палладий(II)дихлорид поставлен Shanghai Chiral Chemistry Co., Ltd.; триметилсилилацетилен поставлен Dalian Research & Design Institute of Chemical Industry; 4-бромбензальдегид поставлен Shanghai Bangcheng Chemical Co., Ltd.; и N-йодсукцинимид поставлен Shanghai Darui Chemical Co., Ltd. Исходные реагенты, растворители и материалы поставлены Sinopharm Chemical Reagent Co., Ltd, если не указано иное, микроволновую реакцию проводят в СВЧ-реакторе (сверхвысокочастотное излучение) СЕМ NULL; 1Н-ЯМР регистрируют при помощи ядерно-магнитного резонансного спектрометра Brucher АМ-400 или GEMINI-300, где химический сдвиг представлен в виде δ (мкг/г); масс-спектрометрию регистрируют при помощи масс-спектрометра типа Finnigan МАТ-95 или одноквадрупольного Agilent 1200-6110 ЖХ/МС (жидкостная хромотография/масс-спектрометрия) и точку плавления измеряли при помощи прибора для измерения точки плавления Buchi 510 без корректировки температуры. Силикагель разделения представлял собой силикагель 200-300 меш для хроматографической колонки от Qingdao Marine Chemical Plant. В описании химические реагенты, представленные посредством английских аббревиатур, представляют собой следующее:
NBS N-бромсукцинимид
NIS N-йодсукцинимид
NCS N-хлорсукцинимид
DMF N,N-диметилформамид
DIPEA диизопропилэтиламин
THF тетрагидрофуран
Получение и синтез данных соединений
Пример 1
Получение метил-5-фторсалицилата (соединение 2а):
10 г (0,064 моль) 5-фторсалициловой кислоты растворяли в 60 мл метанола в 250 мл круглодонном сосуде с магнитной мешалкой. 5 мл концентрированной серной кислоты добавляли по капле в ледяной бане. После добавления смесь нагревали при конденсации с обратным потоком в течение ночи в масляной бане при 80°С. На следующий день реакционную смесь охлаждали до комнатной температуры, и метанол удаляли при пониженном давлении при помощи роторного испарителя. 60 мл этилацетата добавляли к осадку и органический слой промывали 50 мл насыщенного раствора бикарбоната натрия и 50 мл насыщенного раствора хлорида натрия последовательно. Затем органический слой высушивали на безводном сульфате натрия и выпаривали до сухости. Осадок очищали при помощи хроматографии на колонке (силикагель, петролейный эфир/этилацетат=150:1) для получения 10,0 г продукта в качестве масла светлого цвета с выходом 92%. Затем масло затвердевало до узкого кристалла при откачке до сухости при помощи масляного насоса.
1Н-ЯМР (300 МГц, CDCl3) δ 10,51 (s, 1Н), 7,50 (dd, J=3,3, 8,7 Гц, 1Н), 7,22-7,15 (m, 1Н), 6,94 (q, J=4,5 Гц, 1Н), 3,96 (s, 3Н); МС (ИЭР) М+: m/z (%) 170 (50). (ИЭР - ионизация электрораспылением).
Получение метил-5-фтор-3-йодсалицилата (соединение 3а):
7 г (0,041 моль) метил-5-фторсалицила (соединение 2а) растворяли в 40 мл DMF в 100 мл круглодонном сосуде с магнитной мешалкой. Добавляли 11,1 г (0,049 моль, 1,2 экв) NIS, и реакционную смесь перемешивали в течение выходных под азотом при комнатной температуре. После окончания реакции, 80 мл этилацетата добавляли к смеси, и органический слой промывали дважды 50 мл насыщенного раствора хлорида натрия. Затем органический слой высушивали на безводном сульфате натрия и выпаривали до сухости. Осадок очищали при помощи хроматографии на колонке (силикагель, петролейный эфир/этилацетат=150:1) для получения 10,8 г продукта в качестве белого хлопьевидного твердого вещества с выходом 89%.
1Н-ЯМР (300 МГц, CDCl3) δ 11,37 (s, 1Н), 7,70 (dd, J=3,3, 7,8 Гц, 1Н), 7,56 (dd, J=3,3, 8,7 Гц, 1Н), 3,98 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 297,0 (55).
Пример 2
Получение N,N-диметил-1-(4-йодфенил)метиламина (соединение 10а):
100 мл водного раствора диметиламина добавляли в 250 мл круглодонный сосуд. 12 г (40 ммоль) п-йодбензилбромида (соединение 9) добавляли в три серии и перемешивали в течение ночи при комнатной температуре. На следующий день реакционную смесь экстрагировали при помощи этилацетата за три раза. Органический слой высушивали на безводном сульфате натрия и выпаривали до сухости при помощи роторного испарителя. 8,4 г желтой жидкости получали при помощи хроматографии на колонке (силикагель, петролейный эфир/этилацетат = 5-1) с выходом 80%.
1Н-ЯМР (300 МГц, CDCl3) δ 7,63 (d, J=8,1 Гц, 2Н), 7,05 (d, J=8,1 Гц, 2Н), 3,35 (s, 2Н), 2,22 (s, 6Н); МС (ИЭР) (М+Н)+: m/z (%) 262,0 (100).
Получение N,N-диметил-1-{4-[(триметилсилил)этинил]фенил}-метанамина (соединение 11а):
9,03 г (34,5 ммоль) N,N-диметил-1-(4-йодфенил)метиламина (соединение 10а), 6,86 г (70 ммоль) триметилсилилацетилена, 300 мг (0,35 ммоль) бис(трифенилфосфин)палладий(II)дихлорида, 133 мг (0,7 ммоль) йодида меди(I), 10 мл триэтиламина и 100 мл THF добавляли в 250 мл круглодонный сосуд. Сосуд вакуумировали и заполняли азотом три раза, после чего реакцию проводили в течение ночи с дефлегмированием в масляной бане при 80°С. На следующий день реакционную смесь охлаждали до комнатной температуры и большую часть растворителя удаляли при пониженном давлении при помощи роторного испарителя. Силикагель добавляли непосредственно к смеси и затем очищали при помощи хроматографии на колонке (петролейный эфир/этилацетат = 5:1) для получения 6,8 г продукта в виде коричневого масла с выходом 85%.
1Н-ЯМР (300 МГц, CDCl3) δ 7,44 (d, J=8,1 Гц, 2Н), 7,22 (d, J=8,1 Гц, 2Н), 3,39 (s, 2Н), 2,21 (s, 6Н), 0,24 (s, 9Н); МС (ИЭР) (М+Н)+: m/z (%) 232,0 (100).
Получение N,N-диметил-1-(4-ацетиленнилфенил)-метиламина (соединение 8а):
8 г (34,6 ммоль) N,N-диметил-1-{4-[(триметилсилил)ацетиленил]фенил}-метиламина (соединение 11а) растворяли в 80 мл метанола в 250 мл круглодонном сосуде и добавляли 2,46 г (17,3 ммоль) карбоната калия. Сосуд вакуумировали и наполняли азотом три раза, и затем реакцию проводили в течение двух часов при комнатной температуре. После окончания реакции большую часть растворителя удаляли при пониженном давлении при помощи роторного испарителя. Добавляли 80 мл этилацетата, и органический слой промывали 50 мл насыщенного раствора хлорида натрия. Затем органический слой высушивали на безводном сульфате натрия и выпаривали до сухости. Осадок очищали при помощи хроматографии на колонке (силикагель, петролейный эфир/этилацетат=2:1) для получения 4,8 г продукта в виде желтой жидкости с выходом 87%.
1Н-ЯМР (300 МГц, CDCl3) δ 7,46 (d, J=8,1 Гц, 2Н), 7,25 (d, J=8,1 Гц, 2Н), 3,40 (s, 2Н), 3,05 (s, 1Н), 2,21 (s, 6Н); МС (ИЭР) (М+Н)+: m/z (%) 160,2 (100).
Получение метил-5-фтор-2-{4-((диметиламино)метил)фенил}бензофуран-7-карбоксилата (соединение 4а):
3,4 г (21,4 ммоль) N,N-диметил-1-(4-ацетиленилфенил)-метиламина (соединение 8а), 3,16 г (10,7 ммоль) метил-5-фтор-3-йодсалицилата (соединение 3а), 750 мг (1,07 ммоль) бис(трифенилфосфин)палладий(II) дихлорида, 203 мг (1,07 ммоль) йодида меди, 2,16 г (21,4 ммоль) триэтиламина и 10 мл DMF добавляли в 100 мл двугорловый круглодонный сосуд. Затем сосуд вакуумировали и наполняли азотом три раза, реакцию проводили в течение двух часов при комнатной температуре и затем в течение ночи в масляной бане при 70°С. На следующий день 60 мл этилацетата добавляли к смеси и органический слой промывали 50 мл насыщенного раствора хлорида натрия. Затем органический слой высушивали на безводном сульфате натрия и выпаривали до сухости. Осадок очищали при помощи хроматографии на колонке (силикагель, дихлорметан/метанол=60:1) для получения 1,7 г продукта в виде коричневого маслла с выходом 48%.
1Н-ЯМР (300 МГц, CDCl3) δ 7,90 (d, J=8,7 Гц, 2Н), 7,64 (dd, J=3,0, 9,3 Гц, 1Н), 7,54 (d, J=8,1 Гц, 2Н), 7,43 (dd, J=3,0, 8,1 Гц, 1Н), 7,04 (s, 1Н), 4,05 (s, 3Н), 3,73 (s, 2Н), 2,44 (s, 6Н); МС (ИЭР) (М+Н)+: m/z (%) 328,2 (100).
Получение 5-фтор-2-{4-[(диметиламино)метил]фенил}бензофуран-7-карбоксамида (соединение 5а):
1,65 г (5 ммоль) метил-5-фтор-2-{4-[(диметиламино)метил]фенил}бензофуран-7-карбоксилата (соединение 4а) и 50 мл насыщенного аммиачного раствора метанола помещали в 100 мл запаянную пробирку и оставляли реагировать в течение ночи в масляной бане при 80°С. На следующий день реакционную смесь охлаждали до комнатной температуры и отстаивали до получения иглообразных кристаллов. 1,18 г светло-желтых иглообразных кристаллов получали при помощи фильтрации и промывали метанолом с выходом 75%.
1Н-ЯМР (300 МГц, d6-DMSO) δ 7,98-7,60 (m, 3Н), 7,89 (br s, 1Н), 7,66 (dd, J=3,0, 8,7 Гц, 1Н), 7,49-7,43 (m, 4Н), 3,45 (s, 2Н), 2,17 (s, 6Н); МС (ИЭР) (М+Н)+: m/z (%) 313,2 (100).
Пример 3
Получение N-метил-1-(4-йодфенил)метиламина (соединение 10b):
13,8 г желтой жидкости получали с выходом 83% согласно способу получения соединения 10а, где 20 г (67 ммоль) п-йодбензилбромида (соединение 9) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 7,63 (d, J=8,1 Гц, 2Н), 7,06 (d, J=8,1 Гц, 2Н), 3,68 (s, 2Н), 2,43 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 248 (61).
Получение N-метил-1-{4-[(триметилсилил)ацетиленил]фенил}-метиламина (соединение 11b):
9,1 г коричневого твердого вещества получали с выходом 80% согласно способу получения соединения 11а, где 13 г (52,6 ммоль) N-метил-1-(4-йодфенил)метиламина (соединение 10b) применяли в качестве реагента.
МС (ИЭР) (М+Н)+: m/z (%) 218,2 (87).
Получение N-метил-1-(4-ацетеленилфенил)-метиламина (соединение 8b):
4,6 г коричневой жидкости получали с выходом 86% согласно способу получения соединения 8а, где 8 г (36,8 ммоль) N-метил-1-{4-[(триметилсилил)ацетиленил]фенил}-метиламина (соединение 11b) применяли в качестве реагента.
1Н-ЯМР (300 МГц, d6-DMSO) δ 7,41 (d, J=8,1 Гц, 2Н), 7,32 (d, J=8,1 Гц, 2Н), 4,10 (s, 1Н), 3,64 (br s, 2Н), 2,24 (br s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 146,1 (10).
Получение метил-5-фтор-2-{4-[(метиламино)метил]фенил}бензофуран-7-карбоксилата (соединение 4b):
3,2 г коричневого масла получали с выходом 51% согласно способу получения соединения 4а, где 3,19 г (22 ммоль) N-метил-1-(4-ацетиленилфенил)-метиламина (соединение 8b) и 5,92 г (20 ммоль) метил-5-фтор-3-йодсалицилата (соединение 3а) применяли в качестве реагентов.
1Н-ЯМР (300 МГц, CDCl3) δ 7,86 (d, J=8,7 Гц, 2Н), 7,62 (dd, J=2,7, 9,6 Гц, 1Н), 7,44-7,41 (m, 3Н), 7,00 (s, 1Н), 4,05 (s, 3Н), 3,82 (s, 2Н), 3,48 (s, 1Н), 2,49 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 314,1 (30).
Получение 5-фтор-2-{4-[(метиламино)метил]фенил}бензофуран-7-карбоксамида (соединение 5b):
1,81 г бежевого зернистого твердого вещества получали с выходом 70% согласно способу получения соединения 5а, где 2,7 г (8,6 ммоль) метил-5-фтор-2-{4-[(метиламино)метил]фенил}бензофуран-7-карбоксилата (соединение 4b) применяли в качестве реагентов.
1Н-ЯМР (300 МГц, d6-DMSO) δ 7,97-7,94 (m, 3Н), 7,88 (br s, 1Н), 7,64 (dd, J=2,7, 8,4 Гц, 1Н), 7,50-7,42 (m, 4Н), 3,70(s, 2Н), 2,28 (s, 3Н); МС (ИЭР) (М): m/z (%) 298 (100).
Пример 4
Получение N-метил-1-(4-ацетелинилфенил)-метиламина (соединение 8b):
238 мг (1,5 ммоль) 4-ацетиленилбензальдегида растворяли в 10 мл метанола в 100 мл круглодонном сосуде, затем добавляли 101 мг (1,5 ммоль) метиламингидрохлорида и 142 мг (2,25 ммоль) цианоборгидрида натрия. Реакцию проводили при комнатной температуре в течение трех часов. После окончания реакции добавляли воду, и значение рН подводили до 10 разбавленным раствором гидроксида натрия. Раствор экстрагировали 50 мл этилацетата и органический слой промывали 30 мл насыщенного раствора хлорида натрия. Органический слой высушивали на безводном сульфате натрия и выпаривали до сухости. Осадок очищали при помощи хроматографии на колонке (силикагель, петролейный эфир/этилацетат=1:1) до получения 133 мг продукта в виде коричневой жидкости с выходом 61%.
1Н-ЯМР (300 МГц, d6-DMSO) δ 7,41 (d, J=8,1 Гц, 2H), 7,32 (d, J=8,1 Гц, 2H), 4,10 (s, 1Н), 3,64 (br s, 2H), 2,24 (br s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 146,1 (10).
Пример 5
Получение метил-3-хлоро-5-фторо-2-{4-[(диметиламино)метил]фенил}бензофуран-7-карбоксилата (соединение 6а):
500 мг (1,53 ммоль) метил-2-{4-[(диметиламино)метил]фенил}-5-фторбензофуран-7-карбоксилата (соединение 4а) растворяли в 20 мл тетрагидрофурана в 100 мл двухгорловом круглодонном сосуде. 20 мл раствора NCS (350 мг, 2,6 ммоль) в тетрагидрофуране добавляли по капле в сосуд на ледяной бане в течение 15 минут. Сосуд вакуумировали и наполняли азотом три раза, реакцию проводили при комнатной температуре в течении ночи. На следующий день 50 мл этилацетата добавляли к смеси и органический слой промывали 50 мл насыщенного раствора бикарбоната натрия и 50 мл насыщенного раствора тиосульфата натрия соответственно. Затем органический слой высушивали на безводном сульфате натрия и выпаривали до сухости. Осадок очищали при помощи хроматографии на колонке (силикагель, дихлорметан/этанол=80:1) для получения 170 мг продукта в виде желтого порошка с выходом 31%.
1Н-ЯМР (300 МГц, CDCl3) δ 8,12 (d, J=8,1 Гц, 2Н), 7,70 (dd, J=2,7, 9,3 Гц, 1Н), 7,47-7,44 (m, 3Н), 4,04 (s, 3Н), 3,50 (s, 2Н), 2,27 (s, 6Н); МС (ИЭР) (М+Н)+: m/z (%) 362,1 (100), 364,1 (33).
Получение 3-хлор-5-фтор-2-{4-((диметиламино)метил)фенил}бензофуран-7-карбоксамида (соединение 7а):
38 мг беловатого порошка получали с выходом 79% согласно способу получения соединения 5а, где 50 мг (0,14 ммоль) метил-3-хлор-5-фтор-2-{4-[(диметиламино)метил]фенил}бензофуран-7-карбоксилата (соединение 6а) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 7,99 (d, J=8,7 Гц, 2Н), 7,84 (dd, J=2.7, 9,6 Гц, 1Н), 7,47 (d, J=8,7 Гц, 2Н), 743 (dd, J=2,7, 7,2 Гц, 1Н) 6,28 (s, 1Н), 3,50 (s, 2Н), 2,28 (s, 6Н); МС (ИЭР) (М+Н)+: m/z (%) 347,1 (100), 349,1 (33).
Пример 6
Получение 5-[(триметилсилил)ацетиленил]пиридил-2-альдегида (соединение 13а):
930 мг коричневого порошка получали с выходом 57% согласно способу получения соединения 11а, где 1,5 г (8 ммоль) 5-бром-пиридил-2-альдегида применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 10,05 (s, 1Н), 8,80 (s, 1Н), 7,89 (s, 2Н), 0,28 (s, 9Н); МС (ИЭР) (М+Н)+: m/z (%) 204,1 (64).
Получение 5-ацетиленил-пиридил-2-альдегида (соединение 14а):
377 мг светло-желтого порошка получали с выходом 72% согласно способу получения соединения 8а, где 812 мг (4 ммоль) 5-[(триметилсилил)ацетинил]пиридил-2-альдегида (соединение 13а) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 10,07 (s, 1Н), 8,84 (s, 1Н), 7,93 (s, 2Н), 3,42 (s, 1Н); МС (ИЭР) (М+Н)+: m/z (%) 132,1 (64).
Получение N-метил-1-(5-ацетиленил-2-пиридил)метиламин (соединение 8с):
135 мг коричневой жидкости получали с выходом 62% согласно способу получения в примере 4, где 196 мг (1,5 ммоль) 5-ацетиленил-пиридил-2-альдегида (соединение 14а) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 8,65 (d, J=1,5 Hz, 1Н), 7,73 (dd, J=2,1, 8,1 Гц, 1H), 7,27 (d, J=8,1 Гц, 1H), 3,87 (s, 2Н), 3,18 (s, 1Н), 2,46 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 147,1 (100).
Получение метил-5-фтор-2-{6-[(метиламино)метил]-3-пиридил}бензофуран-7-карбоксилата (соединение 4с):
10 мг светложелтого порошка получали с выходом 5,7% согласно способу получения соединения 4а, где 82 мг (0,56 ммоль) N-метил-1-(5-ацетиленил-2-пиридил)метиламина (соединение 8с) и 166 мг (0,56 ммоль) метил-5-фтор-3-йодсалицилата (соединение 3а) применяли в качестве реагентов.
1Н-ЯМР (300 Мгц, CDCl3) δ 9,07 (d, J=1,8 Гц, 1Н), 8,15 (dd, J=2,1, 8,4 Гц, 1Н), 7,66 (dd, J=2,1, 8,4 Гц, 1Н), 7,47-7,42 (m, 2Н), 7,10 (s, 1Н), 4,05 (s, 3Н), 3,94 (s, 2Н), 2,51 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 315,1 (100).
Получение 5-фтор-2-{6-[(метиламино)метил]-3-пиридил}бензофуран-7-карбоксамида (соединение 5с):
5 мг белого порошка получали с выходом 52,5% согласно способу получения соединения 5а, где 10 мг (0,032 ммоль) метил-5-фтор-2-{6-[(метиламино)метил]-3-пиридил}бензофуран-7-карбоксилата (соединение 4с) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CD3OD) δ 9,09 (s, 1Н), 8,32 (dd, J=2,1, 8,1 Гц, 1Н), 7,58-7,51 (m, 3Н), 7,44 (s, 1Н), 3,96 (s, 2Н), 2,49 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 300,1 (100).
Пример 7
Получение 6-[(триметилсилил)ацетиленил]пиридил-3-альдегида (соединение 13b):
222 мг желтого порошка получали с выходом 73% согласно способу получения соединения 11а, где 279 мг (1,5 ммоль) 6-бром-пиридил-3-альдегида применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 10,09 (s, 1Н), 9,01 (s, 1Н), 8,12 (dd, J=1,2, 8,1 Гц, 1Н), 7,59 (d, J=1,2 Гц, 1Н), 0,28 (s, 9Н); МС (ИЭР) (М+Н)+: m/z (%) 204,1 (22).
Получение 6-ацетиленил-пиридил-3-альдегида (соединение 14b):
175 мг белого хлопьевидного твердого вещества получали с выходом 89% согласно способу получения соединения 8а, где 304 мг (1,5 ммоль) 6-[(триметилсилил)ацетиленил]пиридил-3-альдегида (соединение 13b) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 10,12 (s, 1Н), 9,04 (d, J=0,9 Гц, 1Н), 8,15 (dd, J=2,1, 8,1 Гц, 1Н), 7,63 (d, J=8,1 Гц, 1Н), 3,39 (s, 1H); МС (ИЭР) (М+Н)+: m/z (%) 132,1 (59).
Получение N-метил-1-(б-ацетиленил-3-пиридил)метиламина (соединение 8d):
76 мг коричневого масла получали с выходом 35% согласно способу получения в примере 4, где 196 мг (1,5 ммоль) 6-ацетиленил-пиридил-3-альдегида (соединение 14b) применяли в качестве реагента.
1Н-ЯМР (300 МГц, CDCl3) δ 8,52 (d, J=2,1 Гц, 1Н), 7,65 (dd, J=2,1, 8,4 Гц, 1Н), 7,45 (d, J=8,4 Гц, 1Н), 3,77 (s, 2Н), 3,12 (s, 1Н), 2,45 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 147,1 (100).
Получение метил-5-фтор-2-{5-[(метиламино)метил]-2-пиридил}бензофуран-7-карбоксилата соединение 4d):
71 мг коричневого порошка получали с выходом 45% согласно способу получения соединения 4а, где 73 мг (0,50 ммоль) N-метил-1-(6-ацетиленил-3-пиридил)метиламина (соединение 8d) и 148 мг (0,50 ммоль) метил-5-фтор-3-йодсалицилат (соединение 3а) применяли в качестве реагентов.
1Н-ЯМР (300 МГц, CDCl3) δ 8,62 (s, 1Н), 7,99 (d, J=7,1 Гц, 1Н), 7,81 (dd, J=1,8, 7,1 Гц, 1Н), 7,67 (dd, J=2,7, 9,6 Гц, 1Н), 7,49 (dd, J=2,4, 8,7 Гц, 1Н), 7,44 (s, 1Н), 4,05 (s, 3H), 3,84 (s, 2Н), 2,49 (s, 3Н); МС (ИЭР) (М+Н)+: m/z (%) 315,1 (100).
Получение 5-фтор-2-{5-[(метиламино)метил]-2-пиридил}бензофуран-7-карбоксамида (соединение 5d):
37 мг светложелтого порошка получали с выходом 78% согласно способу получения соединения 5а, где 50 мг (0,16 ммоль) метил 2-{5-[(метиламино)метил]-2-пиридил}-5-фторбензофуран-7-