Способ определения риска аритмии
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, а именно к кардиологии и описывает in vitro способ определения риска медикаментозной аритмии, индуцированной воздействием лекарственного средства. Способ характеризуется тем, что после приведения во взаимодействие кардиомиоцитов, полученных из индуцированных плюрипотентных стволовых клеток, с выбранным лекарственным средством, в системе анализа с высокой производительностью с измерением сопротивления или применением мультиэлектродной матрицы, выявляют неравномерность частоты биения и производят расчет доли нерегулярных сокращений (ДНС), при этом значение ДНС, меньшее или равное 0,2, используется для обозначения низкого риска аритмии. 22 з.п. ф-лы, 2 таб., 1 пр.
Реферат
Способ определения риска аритмии
Настоящее изобретение относится к способу определения риска медикаментозной аритмии с применением полученных из стволовых клеток кардиомиоцитов с помощью высокопроизводительного анализа сопротивления или мультиэлектродной матрицы.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Известно, что медикаментозная полиморфная желудочковая тахикардия типа «пируэт» (двунаправленная тахикардия, ДНТ), приводит к синдрому отмены или жесткому ограничению применения ряда препаратов (Journal of Pharmacological and Toxicological Methods 52: 46-59, 2005). Типичной причиной ДНТ является ингибирование впускающего ректифицирующего калиевого канала, hERG (родственный human ether-a-go-go, кодируемый геном KCNH2), приводящее к удлинению интервала QT. В настоящее время стандартным подходом является проверка потенциальных лекарственных средств на ингибирование hERG с применением некардиальных клеточных линий, сверхэкспрессирующих hERG. Однако, проверка на ингибирование hERG является субоптимальной, поскольку не все соединения, которые ингибируют канал hERG, могут удлинять интервал QT и вызывать ДНТ (Cardiovascular Research 58: 32-45, 2003). Кроме того, аритмия может быть вызвана у человека лекарственными средствами, которые не демонстрируют in vitro ингибирование hERG или не вызывают удлинение интервала QT в доклинических экспериментальных моделях на животных. Например, верапамил, мощный ингибитор hERG, не вызывает удлинение QT или ДНТ у пациентов, и он применяется безопасно и эффективно. Несмотря на такое несоответствие, при поиске новых лекарств много времени и усилий тратится на исследования влияния соединений на ингибирование hERG и удлинение интервала QT в качестве показателя возможности развития ДНТ у человека, главным образом, вследствие отсутствия в целом более эффективных альтернативных способов.
Для измерения потенциала поля и, в случае анализа однородной и электрически соединенной популяции, имитации электрокардиограммы in vivo можно применять такие технологии, как мультиэлектродная матрица (МЭМ) (Journal of Electrocardiology 37 Suppl: 110-116, 2004). МЭМ ранее применяли для оценки общих свойств потенциала действия кардиомиоцитов, полученных из стволовых клеток, и электрофизиологические изменения могут быть использованы в качестве косвенного показателя аритмии. Однако, технические особенности ограничивают пропускную способность и продолжительность исследований с помощью МЭМ (Stem Cell Research 4: 107-116; Stem Cell Research 4: 189-200)). Помимо ингибирования hERG, наиболее часто используемые модельные системы для проверки возможной индукции ДНТ представляют собой модельные системы ex vivo с низкой пропускной способностью, такие как препараты по Лангендорфу и клиновидый препарат желудочка (Journal of Pharmacological and Toxicological Methods 52: 46-59, 2005).
Для снижения нарушений поздней стадии, вызванных лекарственными средствами, в фармацевтической и биотехнологической промышленности существует потребность в усовершенствовании систем in vitro для прогнозирования медикаментозной токсичности. В частности, существует необходимость в модельной системе in vitro с высокой пропускной способностью, которая дает больше, чем возможность определить удлинение QT, и позволяет проанализировать непосредственно функциональное взаимодействие многих ионных каналов, используемых человеческими кардиомиоцитами для координирования нормальных ритмических сокращений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описана первая система функционального анализа с высокой пропускной способностью с применением человеческих кардиомиоцитов, полученных от индуцированных плюрипотентных стволовых клеток (ИПСК-КМ), которая позволяет точно определить медикаментозные нарушения сердечной деятельности. В этой системе используются два независимых способа, один способ основан на применении 96-луночных планшетов с матрицей датчиков из встречно-гребенчатых электродов, измеряющих сопротивление, и второй способ с применением мультиэлектродной матрицы. Сопротивление, обусловленное прикрепленными ИПСК-КМ, измеряется каждые 12,9 миллисекунд, что обеспечивает неразрушающее, непрерывное измерение физического прикрепления клеток к чашке Петри. Осцилограмма сопротивления показывает ритмические сокращения ИПСК-КМ. Лечение с помощью широкого спектра препаратов, влияющих на функционирование сердца, вызывает изменения в частоте сокращений и сократительной способности, выявляемых по сопротивлению. Аналогичные результаты для действия лекарственных препаратов были получены с помощью микроэлектродного анализа, что, таким образом, подтверждает обоснованность модели. Такой подход позволяет выявить и оценить количественно медикаментозную аритмию и рассчитать прогностический проаритмогенный потенциал (ППП; прогностический проаритмогенный показатель (англ. predicted proarrhythmia score)), что иллюстрирует способность данной системы определять функциональные свойства ИПСК-КМ способом, который ранее не был возможным, обеспечивая новые возможности прогностического контроля состояния сердечно-сосудистой системы.
Настоящее изобретение относится к способу определения риска медикаментозной аритмии, включающему:
а) получение кардиомиоцитов;
б) взаимодействие указанных кардиомиоцитов с указанным лекарственным средством;
в) выявление неравномерности частоты сокращений путем мониторинга либо сокращений клеток, либо потенциала поля.
Настоящее изобретение относится к вышеуказанному способу, в котором кардиомиоциты имеют человеческое происхождение.
Настоящее изобретение относится к вышеуказанному способу, в котором кардиомиоциты получают из источника плюрипотентных стволовых клеток. Настоящее изобретение относится к вышеуказанному способу, в котором источник стволовых клеток представляет собой источник индуцированных плюрипотентных стволовых клеток.
Настоящее изобретение относится к вышеуказанному способу, в котором возникновение аритмии выявляют путем мониторинга изменений полевого потенциала клетки.
Настоящее изобретение относится к вышеуказанному способу, в котором сокращение клеток наблюдают путем измерения сопротивления.
Настоящее изобретение относится к вышеуказанному способу, в котором сокращение клеток контролируют путем измерения сопротивления при частоте дискретизации, способной выявить движение кардиомиоцитов при сокращении.
Настоящее изобретение относится к вышеуказанному способу, в котором обнаружение аритмии включает мониторинг увеличения, уменьшения или неравномерности ритма сокращений.
Настоящее изобретение относится к вышеуказанному способу, где способ дополнительно включает:
г) расчет ДНС (от англ. - irregular beat rate, доля нерегулярных сокращений).
Настоящее изобретение относится к вышеуказанному способу, в котором для обозначения низкого риска аритмии используется значение ДНС, меньше или равное 0,2.
Настоящее изобретение относится к вышеуказанному способу, при этом способ, описанный выше, дополнительно включает:
д) расчет отношения НС20 к Cmax с получением ППП (прогностический проаритмогенный показатель) или расчет отношения Cmax к НС20 с получением ППП.
Настоящее изобретение относится к вышеуказанному способу, в котором ППП, меньше или равный 100, используется для обозначения низкого риска аритмии.
Настоящее изобретение относится к вышеуказанному способу, где способ определения риска медикаментозной аритмии осуществляется в формате способа с высокой пропускной способностью.
Настоящее изобретение относится к вышеуказанному способу, где способ определения риска медикаментозной аритмии осуществляется для скрининга молекул при разработке лекарственных средств.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу определения риска медикаментозной аритмии, включающему:
а) получение кардиомиоцитов;
б) взаимодействие указанных кардиомиоцитов с указанным лекарственным средством;
в) выявление неравномерности частоты сокращений путем мониторинга либо сокращений клеток, либо потенциала поля.
Настоящее изобретение обеспечивает вышеуказанный способ, в котором кардиомиоциты происходят от собаки, обезьяны, крысы, кролика или человека. Настоящее изобретение относится к вышеуказанному способу, в котором кардиомиоциты происходят от человека.
Настоящее изобретение относится к вышеуказанному способу, в котором кардиомиоциты получают из источника стволовых клеток.
Настоящее изобретение относится к вышеуказанному способу, в котором кардиомиоциты получены из источника плюрипотентных стволовых клеток.
Настоящее изобретение относится к вышеуказанному способу, в котором источник стволовых клеток представляет собой источник индуцированных плюрипотентных стволовых клеток.
Настоящее изобретение относится к вышеуказанному способу, в котором возникновение аритмии выявляют путем мониторинга изменений клеточного потенциала поля.
Настоящее изобретение относится к вышеуказанному способу, в котором сокращение клеток наблюдают путем измерения сопротивления.
Настоящее изобретение относится к вышеуказанному способу, в котором сокращение клеток контролируют путем измерения сопротивления при частоте дискретизации, способной выявить движение кардиомиоцитов при сокращении.
Настоящее изобретение относится к вышеуказанному способу, в котором обнаружение аритмии включает мониторинг увеличения, уменьшения или неравномерности ритма сокращений.
Настоящее изобретение относится к вышеуказанному способу, в котором неравномерность ритма сокращений свидетельствует о двунаправленной тахикардии.
Настоящее изобретение относится к вышеуказанному способу, в котором неравномерность ритма сокращений свидетельствует об удлинении интервала QT.
Настоящее изобретение относится к вышеуказанному способу, в котором неравномерность ритма сокращений обусловлена нарушениями сердечных ионных каналов.
Настоящее изобретение относится к вышеуказанному способу, в котором сопротивление измеряют с частотой дискретизации каждые 12,9 миллисекунд.
Настоящее изобретение относится к вышеуказанному способу, который дополнительно включает:
г) расчет НС20.
Настоящее изобретение относится к вышеуказанному способу, в котором ДНС, меньше или равное 0,2, используется в качестве показателя низкого риска аритмии.
Настоящее изобретение относится к вышеуказанному способу, где вышеуказанный способ дополнительно включает:
д) расчет отношения НС20 к Cmax с получением ППП, отношения Cmax к НС20 с получением ППП.
Настоящее изобретение относится к вышеуказанному способу, который дополнительно включает:
д) расчет отношения Cmax к НС20 с получением ППП.
Настоящее изобретение относится к вышеуказанному способу, в котором отношение НС20 к Cmax ,меньшее или равное 100, используется в качестве показателя низкого риска аритмии.
Настоящее изобретение относится к вышеуказанному способу, дополнительно включающему:
е) сравнение значения, полученного на этапе стадии д), со значением, известным для препарата, вызывающего аритмию.
Настоящее изобретение относится к вышеуказанному способу, в котором сердечный ионный канал представляет собой калиевый канал.
Настоящее изобретение относится к вышеуказанному способу, в котором калиевый канал представляет собой канал hERG.
Настоящее изобретение относится к вышеуказанному способу, в котором сердечный ионный канал представляет собой кальциевый канал.
Настоящее изобретение относится к вышеуказанному способу, в котором сердечный ионный канал представляет собой натриевый канал.
Настоящее изобретение относится к вышеуказанному способу, где способ определения риска медикаментозной аритмии осуществляют в формате с высокой пропускной способности.
Настоящее изобретение относится к вышеуказанному способу, где способ определения риска медикаментозной аритмии осуществляют для скрининга молекул при разработке лекарственных средств.
Следует понимать, что способы, представленные в настоящей заявке, представляют собой способы in vitro, т.е. их не осуществляют в организме человека или животного.
Возможность направлять дифференцировку плюрипотентных стволовых клеток (ПСК) в сокращающиеся, созревающие кардиомиоциты дает новый путь к изучению функционирования сердечно-сосудистой системы in vitro (Trends in Pharmacological Sciences 30: 536-545, 2009). Кроме того, системы анализа для прогнозирования токсичности, основанные на ПСК, могут помочь привести в соответствие с требованиями безопасности перспективные потенциальные лекарственные средства на ранней стадии процесса разработки и дать представление о механизмах медикаментозной токсичности в отношении какого-либо органа, одновременно сокращая, оптимизируя и замещая использование испытаний на животных. Использование тканей, полученных из кариотипически нормальных человеческих ПСК, может увеличить значимость и прогностическую ценность доклинической оценки безопасности, поскольку традиционные подходы, по существу, основаны на использовании модельных животных, вследствие чего они в незначительной степени предсказывают реакцию человека и обладают ограниченными возможностями для опровержения ложноположительных ответов (Regul. Toxicol. Pharmacol. 32: 56-67, 2000). Кроме того, панель ПСК человека с определенными аллельными вариациями позволит выявлять субпопуляции пациентов, демонстрирующих разные ответы на лекарственные средства, что помогает в оптимизации критериев включения и исключения для успешного клинического испытания.
В подходе, описанном в настоящей заявке, применяются 96-луночные культуральные планшеты со встроено-гребенчатой электродной сенсорной матрицей, способные к быстрой регистрации сопротивления. Ранее известные из литературы способы измерения сопротивления в культуре клеток основывались на более медленной скорости регистрации и в целом ограничивались измерениями общих клеточных эффектов, таких как цитотоксичность или подвижность ((Nature 366: 591-592, 1993, Biotechnology Journal 3: 484-495, 2008). Увеличивая частоту дискретизации до 12,9 миллисекунд, можно наблюдать физическое перемещение сокращающихся кардиомиоцитов. Это позволяет в режиме реального времени без использования меток наблюдать ритмические сокращения живых, человеческих кардиомиоцитов, полученных из иПСК. Прямое измерение функционального сокращения человеческих кардиомиоцитов обеспечивает скрининг in vitro с высокой пропускной способностью проаритмогенного потенциала новых молекулярных соединений.
Поскольку использование быстрой регистрации сопротивления не применялось ранее для детекции спонтанного сокращения кардиомиоцитов, мы прежде всего стремились в полной мере охарактеризовать данную систему. Скорость сокращений иПСК-КМ без обработки стабильно составляет в среднем ~40 ударов в минуту (УВМ) среди отдельных лунок и планшетов, согласно и данным МЭМ, и измерению сопротивления. Чтобы установить, что высокая частота дискретизации показаний сопротивления отражает физическое сжатие клетки, а не электрические изменения, было исследовано действие ингибитора миозина II блеббистатина. После обработки блеббистатином не наблюдали сокращения кардиомиоцитов с помощью измерения сопротивления, а электрофизиологические показатели кардиомиоцитов, детектируемые с помощью МЭМ оставались неизменными, подтверждая, что измерение сопротивления действительно представляет собой прямое измерение физического перемещения кардиомиоцитов при сокращении, а не артефакты измерения, связанные с электрическим полем потенциал-зависимого действия сердечной мышцы.
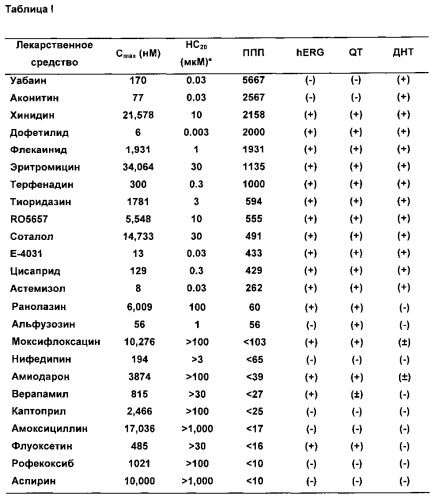
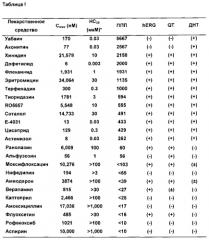
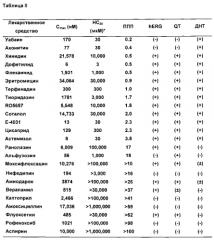
Задачей следующего этапа было систематическое изучение влияния различных классов кардиоактивных препаратов (Таблицы 1-11).
ДНС обозначает «долю неравномерных сокращений», рассчитанную как количество неравномерных сокращений, деленное на общее число ударов за одну минуту (= нерегулярные удары/общее число ударов). ДНС представляет собой величину от 0-1 (или 0-100% при использовании % в качестве единицы). Значение НС20 представляет собой наименьшую концентрацию, которая дает значение ДНС≥0,2 (≥20% нерегулярных сокращений в течение одной минуты). В настоящей заявке ППП рассчитывали двумя различными способами:
1) Cmax/НС20, отношение Cmax к НС20, где значения >100 принимались как уровень риска (Таблица I):
2) HC20/Cmax, отношение HC20 к Cmax, где значения <10 принимались как уровень риска (Таблица II):
Второй способ расчета (НС20/Cmax) обычно используется в области оценки безопасности и его называют «резерв безопасности», что указывает, насколько близко значение концентрации, вызывающее угрозу безопасности, значению концентрации, которое является терапевтически эффективным в клиническом применении. Чем больше резерв безопасности, тем меньше риск токсичности препарата. И наоборот, при использовании первого соотношения (Cmax/НС20), чем больше значение ППП, тем выше риск лекарственной токсичности.
И тетродотоксин, блокатор Na+ канала в чистом виде, изолированный из токсина рыбы фугу, и ZD7288, блокатор тока стимулятора сердца (If), демонстрировали снижение скорости сокращений, как предсказано с помощью настоящей системы анализа. Изопротеренол, агонист β-адренергических рецепторов, увеличивал как скорость сокращений, так и амплитуду сопротивления, а также скорость сокращения в МЭМ. Уабаин, положительный инотропный агент, который блокирует K+/Na+-АТФазу, увеличивая содержание внутриклеточного Na+ и Са2+, увеличивал амплитуду как при измерении МЭМ, так и при измерении сопротивления. Обработка нифедипином, специфическим блокатором Са2+-канала L-типа, приводила к ожидаемому снижению амплитуды каждого сокращения при измерении сопротивления и амплитуды Са2+-пика при измерении МЭМ в сочетании с увеличением скорости сокращений. В качестве отрицательного контроля использовали такие соединения, как аспирин, амоксициллин и каптоприл, не имеющие побочных эффектов на сердечно-сосудистую систему in vivo, которые не вызвали каких-либо изменений ритма в системе ИПСК-КМ. В совокупности, эти результаты показывают, что быстрое измерение сопротивления ИПСК-КМ может определить соответствующий и ожидаемый ответ на модуляцию рецептора/транспортера и ингибирование ионных каналов.
После обработки ингибитором hERG, Е4031, наблюдали дозозависимое снижение скорости сокращений, а также случаи нерегулярных изменений сопротивления, напоминающие следовую деполяризацию и аритмии (Фигура 1). Поскольку считается, желудочковые аритмичные сокращения вызываются изменением циклирования Са2+ в кардиомиоцитах, либо посредством ранней следовой деполяризации (РСД, опосредованная реактивацией инактивированного Са2+ канала L-типа) или замедленной следовой деполяризации (ЗСД, опосредованная увеличением тока антипортера Na+/Ca2+), мы предположили, что изменение передвижения Са2+ может нормализовать истинную медикаментозную аритмию. Для подтверждения механистических свойств Е4031-индуцированной аритмии проводили эксперименты по совместному введению нифедипина, ингибитора Са2+-канала. Тот факт, что нифедипин способен нормализовать Е4031-индуцированную аритмию, наблюдаемую как с помощью МЭМ, так и путем анализа сопротивления, позволяет предположить, что регистрируемые нерегулярные изменения сопротивления указывают на истинную медикаментозную аритмию типа следовой деполяризации. Для подтверждения способности ИПСК-КМ повторять аритмию in vitro, исследовали обширную панель соединений, клинически связанных с ДНТ, в том числе цизаприд, эритромицин, флекаинид, уабаин, хинидин, соталол и тиоридазин. Нерегулярные сокращения наблюдали для каждого соединения дозозависимым и зависимым от времени образом. Для сравнения, аритмические сокращения, вызванные уабаином, не характеризовались неравномерностью сокращений и амплитуды, а вместо этого индуцировали аритмичные желудочковые подобные фибрилляции «фасцикуляции». Терфенадин, который был отозван с рынка в связи с индукцией ДНТ, блокирует некоторые сердечные ионные каналы (hERG, Na+ и Са2), хотя удлинение QT in vitro было слабо детектировано. Хотя ингибирование hERG терфенадином, вероятно, вносит существенный вклад в его торсадогенный эффект, электрофизиологические эффекты маскируются ингибированием Са2+ и Nа+-каналов и, таким образом, не проявляются сразу на краткосрочных электрофизиологических моделях. Аритмический эффект наблюдался только после длительного воздействия лекарственного средства (более 12 часов). Для тиоридазина, другого блокатора множественных ионных каналов, также требуется более длительное воздействие для проявления аритмии. Следует отметить, что ранее проаритмогенная реакция на тиоридазин не была показана с использованием МЭМ устройств из-за короткой продолжительности экспериментов МЭМ, что подчеркивает важность более долгосрочных экспериментов по оценке риска аритмий. Кроме того, с помощью МЭМ и анализа сопротивления было проанализировано внутреннее соединение длительного воздействия, вызывающее ДНТ у приматов, отличных от человека. Как и Е4031, это соединение вызвало дозозависимое и зависимое от времени возникновение аритмии в системе ИПСК-КМ. Индуцированная аритмия также нормализовалась при воздействии нифедипина, что также подтверждает, что такие наблюдаемые in vitro изменения представляют собой истинные аритмии. В качестве отрицательного контроля использовали такие соединения, как амоксициллин, аспирин и каптоприл, не обладающие побочными эффектами на сердечно-сосудистую систему in vitro, которые не вызвали каких-либо изменений ритма или аритмических ударов в системе ИПСК-КМ человека.
Способность предлагаемой системы анализа различать соединения, которые ингибируют hERG в отдельности, при этом не вызывают клинически ДНТ, была исследована с помощью таких соединений, как верапамил и альфузозин. Эти соединения in vitro демонстрировали результаты, схожие с клинической практикой, а именно удлинение QT, но отсутствие запуска ДНТ. Тем не менее, в концентрациях значительно более высоких, чем те, которые используются in vivo, альфузозин вызывал уменьшение скорости сокращений и появление аритмичных сокращений, аналогично другим блокаторам hERG. Таким образом, быстрое измерение сопротивление ИПСК-КМ человека обеспечивает существенное улучшение прогнозирования ДНТ, по сравнению с общей аффинностью к hERG, и предлагает новые парадигмы в детекции ДНТ для человека в системе анализа in vitro на самом раннем этапе процесса разработки.
Способность обнаруживать аритмию с использованием коммерчески доступных ИПСК-КМ человека с контролируемым качеством с помощью системы с высокой пропускной способностью, описанной в настоящей заявке, открывает новые возможности для изучения биологии сердечно-сосудистой системы человека в in vitro. Тем не менее, если такая система предназначена для достижения максимально эффективного применения в процессе разработки лекарственных средств в биотехнологической и фармацевтической промышленности, она должна быть способна обеспечить количественные данные, которые могут быть использованы для оценки новых лекарств-кандидатов по предсказанному для них риску индукции сердечных аритмий. Таким образом, в качестве первоначальной попытки определить, могут ли измерения сопротивления для медикаментозных аритмий обеспечить количественную меру проаритмогенного риска, мы разработали метод расчета «прогностического проаритмогенного показателя» (ППП). Во-первых, была определена наиболее низкая концентрация лекарственного средства, вызывающая более чем 20% нерегулярных сокращений (НС20) в течение одной минуты. Этот порог был выбран эмпирически для оптимизации чувствительности и специфичности. Далее, значения НС20 делили на опубликованное значение максимальной клинически эффективной концентрации препарата Cmax в плазме для получения значения ППП. Таким образом, расчет ППП представляет собой попытку количественно охарактеризовать выявленную на основе сопротивления аритмию, относительно эффективности воздействия препарата. ППП может быть рассчитана путем НС20/Cmax, как показано в Таблице II. При использовании этих расчетов ППП<10 указывает на возможность риска индуцированной аритмии.
С другой стороны, ППП может быть рассчитана путем деления Cmax на долю нерегулярных сокращений (ДНС). Используя это соотношение, и на основании клинического появления ДНТ и наших данных, значения ППС>100 были выбраны в качестве возможного риска аритмии. Кардиоактивные средства, как флекаинид, уабаин, терфенадин, аконитин и хинидин индуцируют аритмию при значениях концентрации, меньших эффективной концентрации, и таким образом они характеризуются высоким ППП. Все другие соединения с высоким ППП были ассоциированы с ДНТ и/или индуцированной аритмией при концентрациях в пределах 5-кратной эффективной концентрации. Соединения, характеризующиеся низким риском, имеют низкий ППП (<100). К ним относятся соединения, не удлиняющие QT и не обуславливающие ДНТ (амоксициллин, аспирин, каптоприл, нифедипин, рофекоксиб, верапамил), удлиняющие QT, но не обуславливающие ДНТ (альфузозин и ранолазин) или ассоциированные с очень низким риском ДНТ (флуоксетин и амиодарон, Cardiovascular Research 58: 32-45, 2003). Модельная система, описанная в настоящей заявке, демонстрирует улучшенную точность, в частности отсутствие ложноположительных ответов, по сравнению как со скринингом hERG, так и анализом удлинения QT. В частности ранолазин, верапамил и моксифлоксацин ингибируют hERG, а альфузозин, ранолазин и моксифлоксацин вызывают удлинение QT, но не они не проявляют торсадогенный эффект в нашей модели или в организме человека. Таким образом, количественная оценка проаритмогенного эффекта и риска (на основе эффекта относительно эффективности) для известных кардиоактивных средств обеспечивает средство для прогнозирования потенциального клинического эффекта. Сочетание передовых технологий микроэлектродных биосенсорных устройств и ИПСК-КМ человека вместе создает уникальную возможность оценки эффекта препарата лекарств-кандидатов на функционирование сердца с высокой пропускной способностью и для исследования биологии сердечно-сосудистой системы человека. Анализ сопротивления с частотой дискретизации показывает, что система ИПСК-КМ повторяет сердечные сокращения и расслабления миокарда и подтверждает ожидаемые эффекты известных кардиоактивных лекарств. Аритмогенные лекарственные средства демонстрировали характер сопротивления для аритмии надежно и воспроизводимо в концентрациях, сопоставимых с эффективным клиническим воздействием. Лекарственные средства, не вызывающие ДНТ и другие тяжелые аритмии, не вызывали какого-либо аритмогенного эффекта при концентрациях, до 10 раз превышающих их максимальное клиническое действие, независимо от того, ингибирует ли соединение hERG или удлиняет QT in vivo, что демонстрирует более высокую точность системы на основе ИПСК-КМ человека в предсказании аритмогенного риска лекарств-кандидатов, по сравнению с применяемыми в настоящее время подходами на анализе ингибирования hERG или удлинения QT. Исследование лекарств-кандидатов на аритмические изменения с помощью системы ИПСК-КМ человека облегчает определение полного профиля оценки кардиологической безопасности и улучшает решение основной проблемы оценки кардиологической безопасности: обнаружение аритмогенного эффекта.
Определения
В настоящей заявке упоминание понятия в единственном числе относится к одному или более такому же понятию, например термин «соединение» относится к одному или более соединению, или, как минимум, к одному соединению. В связи с этим, термины в единственном числе, «один или более» и «как минимум один» в настоящей заявке могут быть использованы взаимозаменяемо.
В описании настоящего изобретения независимо от того, встречаются ли термины «содержит/включает», «содержащий/включающий» в переходной фразе или в части формулы изобретения, их следует интерпретировать как имеющие открытое, допускающее изменение значение. То есть, термины следует интерпретировать синонимично с фразой «имеющий как минимум» или «включающий как минимум». При использовании в контексте процесса, термин «включающий» означает, что процесс включает как минимум перечисленные стадии, но может иметь и дополнительные стадии. При использовании в контексте соединения или композиции, термин «включающий» означает, что соединение или композиция включает как минимум перечисленные свойства или компоненты, но может также включать дополнительные свойства или компоненты.
В данном документе, если не указано иначе, союз «или» используется в «объединяющем» значении «и/или», но не в «исключающем» значении «или/или».
Термин «необязательный» или «необязательно» при использовании в данном документе означает, что впоследствии описываемое событие или обстоятельство может произойти, но не обязательно должно произойти, и что описание включает примеры, в которых событие или обстоятельство происходит, и примеры, в которых это событие или обстоятельство не происходит.
Термин «приблизительно» используется в данном документе, для обозначения приблизительно, около, ориентировочно или приближенно. Если термин «приблизительно» используется вместе с численным рядом, то это означает, что границы ряда изменяются в пределах численных значений, указанных далее. В общем, термин «приблизительно» используется в данном документе, чтобы расширить значения численного ряда в пределах 20%.
Термин «аритмия» обычно используется в данном документе для обозначения состояния, которое характеризуется аномальной электрической активностью в сердце, которая приводит к усиленному или замедленному сердцебиению, причем биение сердца может быть равномерным или неравномерным. Некоторые формы аритмии являются угрозой жизни и могут приводить к остановке сердца и внезапной смерти, тогда как другие аритмии незначительны и могут рассматриваться как разновидности нормы. Аритмию можно классифицировать по уровню, например, нормальная, тахикардия (более 100 ударов/минуту) и брадикардия (менее 60 ударов/минуту); по механизму, например, автоматия, циркуляция возбуждения и фибрилляция. Считается, что причиной сокращений сердца при желудочковой аритмии являются изменения в циклическом обороте ионов кальция Са2+ в кардиомиоцитах, или ранняя следовая деполяризация (РСД, англ. EAD- early-afterdepolarization, опосредованная реактивацией инактивированных кальциевых каналов L-типа) или замедленная следовая деполяризация (ЗСД, англ. DAD - delayed-afterdepolarization, опосредованная усиленным потоком через Na+/Са2+-обменник).
Термин «проаритмия» используется в данном документе для обозначения вновь обнаруженного или более часто встречающегося явления уже существовавшей аритмии, течение которой ускоряется лечением, направленным против аритмии. То есть, в этом может проявляться побочное действие терапии аритмии, например, сердечными гликозидами.
Термин «медикаментозная аритмия» используется в данном документе для обозначения вызванной, индуцированной или ускоренной аритмии, или если полагается, что аритмия вызвана, индуцирована или ускорена лекарственным средством или лечением.
Термин «кардиомиоцит» или «кардиомиоциты» широко используется в данном документе для обозначения одной или более мышечных клеток сердца. Термин кардиомиоцит включает гладкие мышечные клетки сердца, а также мышечные клетки сердца, которые включают поперечнополосатые мышечные клетки и спонтанно-пульсирующие мышечные клетки сердца.
Термин «потенциал поля» означает измерение разницы потенциала между парой электродов, которая возникает от изменения «мембранного потенциала» группы кардиомиоцитов в течение цикла сокращения-расслабления. Термин «мембранный потенциал» иногда используется взаимозаменяемо с термином «клеточный потенциал», но он применим к любому двойному слою липидов или к мембране. Мембранный потенциал (также используют термины «трансмембранный потенциал» или «разница трансмембранного потенциала», или «градиент трансмембранного потенциала») является разницей электрического потенциала плазматической мембраны клетки. Мембранный потенциал возникает вследствие действия транспортеров ионов, встроенных в мембрану, которые поддерживают физиологические концентрации ионов внутри клетки. Типичный мембранный потенциал клетки возникает вследствие отделения ионов натрия от неподвижных внутриклеточных анионов и оттока ионов натрия через мембрану клетки. Это отделение происходит из-за градиента концентрации калия, создаваемого помпами или транспортерами. Хотя на мембране есть электрический потенциал вследствие разделения зарядов, настоящей измеряемой разницы в общей концентрации положительных и отрицательных ионов относительно мембраны не наблюдается. Соответственно, нет измеряемого преобладания заряда на любой из двух сторон. Клеточные мембраны обычно проницаемы для определенного набора видов ионов, включая, но не ограничиваясь данным примером, ионы калия, хлоридные ионы, двууглекислые ионы, и другие.
Термин «плюрипотентная стволовая клетка» в данном документе означает и включает способность клетки дифференцироваться во все три линии или зародышевые листки (то есть, эндодерму, эктодерму и мезодерму). Термин «мультипотентный» имеет значение, понимаемое на практике как способность клетки дифференцироваться во множественные типы клеток. Также понимается, что мультипотентные клетки могут быть более ограниченными в способности к дифференцировке, чем плюрипотентные клетки. Термин «иСК» в данном документе относится к «иПСК, индуцированным плюрипотентным стволовым клеткам» или к индуцированным мультипотентным стволовым клеткам (иМСК). Время от времени, может быть использован термин «иПС» или «иПС клетка» вместо «иПСК»; сходным образом, иногда может встречаться термин «иМС» или «иМС клетка» вместо «иМСК». Способы и композиции, описанные в настоящем документе, применимые к иПСК, также применимы к индуцируемым стволовым клеткам (иСК) и иМСК.
Термин «импеданс/сопротивление» используется в широком смысле для обозначения любого полученного, измеренного и/или определенного значения, которое может включать по отдельности или вместе резистивный и реактивный компоненты. Данные импеданса могут включать значения электрических параметров, которые могут быть использованы для определения импеданса (такие как значения силы тока и/или напряжения).
Термин «МЭМ, англ. МЕА, multi-ormicro-electrodearrays» в данном документе означает мульти- или микроэлектродные матрицы и может использоваться для измерения потенциала поля и, в случае исследования однородной и электрически спаренной популяции клеток, может имитировать электрокардиограмму in vivo. МЭМ ранее использовали для изучения основных свойств потенциала действия кардимиоцитов, полученных из стволовых клеток; электрофизиологические изменения могут использоваться как модель для изучения аритмии.
Термин «ДНТ» в данном документе обозначает двунаправленную тахикардию.
Термин «интервал ОТ» в данном документе относится к измерению времени между началом Q-волны и концом Т-волны в электрическом цикле сердца.
Интервал QT, соответственно, зависит от частоты сердцебиения (чем быстрее бьется сердце, тем короче QT интервал). Если QT интервал анормально длинный или короткий, то есть риск развивающейся желудочковой аритмии. Длительность интервала QT может быть измерена на основе исследований, в которых измеряют блокирование ионных каналов. Примером такого исследования является hERG исследование канала. Исследование канала hERG приведено в данном документе в качестве ассоциированного с определением длительности QT интервала; это исследование также является первичным индикатором блокады K(+)-канала. Ген hERG (от англ. Human Ether-a-go-goRelatedGene) кодирует к