Композиции и способы, используемые для стабилизации белоксодержащих готовых форм
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и касается фармацевтической композиции, содержащей антитело и полиоксиэтилен (ПОЭ) сорбитан, без полисорбата, а также способа приготовления композиции и способа стабилизации белоксодержащих готовых форм. Группа изобретений обеспечивает улучшенную стабильность путем предотвращения агрегации белков в водных растворах. 5 н. и 9 з.п. ф-лы, 11 ил.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Данной заявкой является не предварительная заявка, поданная по 37 CFR 1,53(b)(1), испрашивающая приоритет по 35 USC 119(e) для предварительной заявки номер 61/316326, поданной 22 марта 2010 года, содержимое которой включено в данную заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к использованию соединений без поверхностно-активных веществ, включая, например, полиоксиэтилен (ПОЭ) сорбитаны и полиэтиленгликоли (ПЭГ), для стабилизации белоксодержащих готовых форм и для предотвращения агрегации белков в подобных готовых формах.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Когда с целью защиты белка от денатурации при встряхивании, взбалтывании, расщеплении и замерзании-оттаивании, или в состоянии покоя на границе раздела для белкового препарата необходим стабилизатор, часто используют неионный детергент (т.е., поверхностно-активное вещество) (см., например, патент США № 5183746). Примером этого является использование полисорбатов во многих белоксодержащих продуктах. Например, полисорбаты 20 и 80 (Tween® 20 и Tween® 80) используют в составе биотерапевтических продуктов как для предотвращения поверхностной адсорбции, так и в качестве стабилизаторов против агрегации белка (Kerwin, J. Pharm. Sci. 97(8):2924-2936 (2008)). Полисорбаты представляют собой амфипатические, неионные поверхностно-активные вещества, состоящие из сложных эфиров жирных кислот полиоксиэтилен (ПОЭ) сорбитана, представляющего собой полиоксиэтиленсорбитана монолаурат для полисорбата 20 и полиоксиэтиленсорбитана моноолеат для полисорбата 80.
К сожалению, однако, полисорбаты могут подвергаться распаду либо посредством окисления, либо гидролиза. Когда молекула полисорбата распадается, она образует различные побочные продукты распада, содержащие, например, жирные кислоты, ПОЭ сорбитан, ПЭГ, ПЭГ сложные эфиры и алкиловые кислоты. Некоторые из этих побочных продуктов распада полисорбата, включая свободные жирные кислоты, могут являться причиной повышения мутности и агрегации белка в белоксодержащих готовых формах. Вследствие этого, несмотря на то, что полисорбаты широко используются в качестве стабилизаторов белка, жирные кислоты и другие побочные продукты распада, высвобождающиеся со временем при распаде полисорбата, могут неблагоприятно влиять на защитное действие, которое полисорбаты демонстрируют в белоксодержащих готовых формах.
В связи с этим существует потребность в дополнительных композициях, используемых для предотвращения агрегации белков в белоксодержащих водных готовых формах.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Представленное изобретение основано на новом открытии, что полиоксиэтилен (ПОЭ) сорбитаны и полиэтиленгликоли (ПЭГ), присутствующие в определенных концентрациях в водной готовой форме, применимы для стабилизации белок- и пептидсодержащих готовых форм и для предотвращения агрегации белков в подобных готовых формах.
Соответственно, в одном аспекте, изобретение относится к композиции, содержащей антитело или другой белок или пептид и ПОЭ сорбитан. В одном варианте осуществления, полиоксиэтиленсорбитан присутствует в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д. В еще одном варианте осуществления, композиция, содержащая антитело или другой белок или пептид и ПОЭ сорбитан, не содержит неионогенные поверхностно-активные вещества, например, не содержит полисорбат. Необязательно, композиция также может не содержать лиопротектанты, такие как, например, сахара, свободные аминокислоты и их варианты и т.д. В некоторых вариантах осуществления, композиция может быть в водной или твердой форме.
В еще одном аспекте, изобретение относится к композиции, содержащей антитело, или другой белок или пептид, и полиэтиленгликоль. В некоторых вариантах осуществления, полиэтиленгликоль присутствует в указанной композиции в концентрации, ниже чем приблизительно 10000 м.д., предпочтительно между приблизительно 20 м.д. и приблизительно 10000 м.д. В еще одном варианте осуществления, композиция необязательно содержит по меньшей мере один ПОЭ сорбитан, который необязательно может присутствовать в указанной композиции в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д. Необязательно, композиция может также не содержать неионогенные поверхностно-активные вещества, например, не содержать полисорбат. Необязательно, композиция также может не содержать лиопротектанты, такие как, например, сахара, свободные аминокислоты и их варианты и т.д. В некоторых вариантах осуществления, композиция может быть в водной или твердой форме.
В еще одном аспекте, изобретение относится к изделию, содержащему контейнер, вмещающий любую из описанных в данном случае композиций.
В еще одном аспекте, предоставлен способ получения стабилизированного антитела (или другого белка или пептида), включающий композицию посредством смешивания антитела или другого белка вместе с ПОЭ сорбитаном или ПЭГ. В еще одном аспекте, представленное изобретение направлено на способ повышения стабильности антитела или другого белка или пептида в водной готовой форме, включающий смешивание антитела или другого белка или пептида, со стабилизирующим количеством ПОЭ сорбитана, при этом ПОЭ сорбитан повышает стабильность антитела или другого белка или пептида. В одном варианте осуществления, ПОЭ сорбитан присутствует в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д., при этом необязательно может не содержать неионогенные поверхностно-активные вещества, например, не содержит полисорбат, или лиопротектанты, такие как, например, сахара, свободные аминокислоты и их варианты и т.д.
В еще одном аспекте, представленное изобретение направлено на способ повышения стабильности антитела в водной готовой форме, или другого белка или пептида, включающий смешивание антитела, или другого белка или пептида, со стабилизирующим количеством полиэтиленгликоля, при этом полиэтиленгликоль повышает стабильность антитела или другого белка или пептида. В одном варианте осуществления, полиэтиленгликоль присутствует в концентрации, составляющей ниже чем приблизительно 10000 м.д., предпочтительно между приблизительно 20 м.д. и приблизительно 10000 м.д. В еще одном варианте осуществления, композиция необязательно содержит по меньшей мере один ПОЭ сорбитан, который может необязательно присутствовать в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д., и необязательно может не содержать неионогенные поверхностно-активные вещества, например, не содержит полисорбат, или лиопротектанты, такие как, например, сахара, свободные аминокислоты и их варианты и т.д.
В еще одном аспекте, представленное изобретение направлено на способ предотвращения или уменьшения агрегации антитела, или другого белка или пептида, в водной готовой форме, включающий смешивание антитела, или другого белка или пептида, с ПОЭ сорбитаном. В одном варианте осуществления, ПОЭ сорбитан присутствует в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д. Водная готовая форма необязательно не содержит неионогенные поверхностно-активные вещества, например, не содержит полисорбат, или лиопротектанты, такие как, например, сахара, свободные аминокислоты и их варианты и т.д. В еще одном варианте осуществления, агрегацию антитела или другого белка индуцируют взбалтыванием водного раствора.
В еще одном аспекте, представленное изобретение направлено на способ предотвращения или уменьшения агрегации антитела, или другого белка или пептида, в водной готовой форме, включающий смешивание антитела, или другого белка или пептида, с полиэтиленгликолем. В одном варианте осуществления, полиэтиленгликоль присутствует в концентрации, ниже чем приблизительно 10000 м.д., предпочтительно между приблизительно 20 м.д. и приблизительно 10000 м.д. В еще одном варианте осуществления, водная готовая форма необязательно содержит по меньшей мере один ПОЭ сорбитан, который может необязательно присутствовать в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д., и необязательно может не содержать неионогенные поверхностно-активные вещества, например, не содержит полисорбат, или лиопротектанты, такие как, например, сахара, свободные аминокислоты и их варианты и т.д. В еще одном варианте осуществления, агрегацию антитела или другого белка индуцируют взбалтыванием водного раствора.
В способе очистки белка, пептида или антитела от рекомбинантных клеточных белков или других загрязняющих белков, вариант осуществления изобретения относится к усовершенствованию, включающему добавление ПОЭ сорбитана или полиэтиленгликоля к белку, пептиду или антителу во время процесса очистки.
Еще одним аспектом изобретения является способ изготовления неагрегированных водных растворов аутоагрегирующего иным образом антитела или другого белка или пептида посредством смешивания по меньшей мере одного ПОЭ сорбитана или полиэтиленгликоля в водном растворе, содержащем аутоагрегирующее антитело или другой белок или пептид, а затем концентрирования водного раствора.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания и примеров, которые не следует трактовать, как ограничивающие. Содержание всех ссылок, патентов и опубликованных патентных заявок, цитируемых на протяжении данной заявки, в прямой форме включено в данную заявку посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 показывает результаты, полученные из анализа мутности антитела анти-IL13 в комбинации с различными добавками, включая полисорбат 20 (PS), лауриновую кислоту (LA) или ПОЭ сорбитан 20 (ПОЭ).
Фигура 2 показывает результаты, полученные из анализа концентрации белка антитела анти-IL13 в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 3 показывает результаты, полученные из анализа концентрации белка антитела анти-IgE в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 4 показывает результаты, полученные из анализа мутности антитела анти-IL13 в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 5 показывает результаты, полученные из анализа мутности антитела анти-IgE в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 6 показывает результаты, полученные из анализа размера частиц (частиц больше, чем 2 мкм) антитела анти-IL13 в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 7 показывает результаты, полученные из анализа размера частиц (частиц больше, чем 2 мкм) антитела анти-IgE в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 8 показывает результаты, полученные из анализа размера частиц (частиц больше, чем 10 мкм) антитела анти-IL13 в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 9 показывает результаты, полученные из анализа размера частиц (частиц больше, чем 10 мкм) антитела анти-IgE в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 10 показывает результаты, полученные из анализа размера частиц (частиц больше, чем 50 мкм) антитела анти-IL13 в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
Фигура 11 показывает результаты, полученные из анализа размера частиц (частиц больше, чем 50 мкм) антитела анти-IgE в комбинации с различными добавками, включая ПОЭ сорбитан 20, ПЭГ 1000 или ПЭГ 6000, все с различными концентрациями.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ
Представленное изобретение может быть понято более легко с помощью ссылки на следующее подробное описание специфических вариантов осуществления и содержащихся в них примеров.
Если не определено иное, все технические и научные термины, использованные в данном случае, имеют такое же значение, которое широко понятно рядовым специалистам в области, к которой относится данное изобретение. Хотя при практическом использовании или испытании изобретения могут быть использованы любые способы и материалы, аналогичные или эквивалентные способам и материалам, описанным в данном случае, далее описаны предпочтительные способы и материалы. Все публикации, упомянутые в данном случае, включены в данную заявку посредством ссылки во всей полноте.
Агрегация антител и других белков вызывается главным образом гидрофобными взаимодействиями, которые в конечном счете приводят к денатурации. Когда гидрофобная область частично или полностью развернутого белка подвергается воздействию воды, это создает термодинамически неблагоприятную ситуацию, вследствие того, что обычно скрытая гидрофобная внутренняя часть теперь подвергается воздействию гидрофильной водной среды. Следовательно, уменьшение энтропии в результате структурирования молекул воды вокруг гидрофобной области вызывает агрегирование денатурированного белка, главным образом через подвергнутые воздействию гидрофобные области. Таким образом, также может быть подвергнута риску растворимость белка. В некоторых случаях, самоассоциация белковых субъединиц, либо нативных, либо неправильно свернутых, может происходить в определенных условиях, и это может приводить к осаждению и потере активности.
Факторы, которые влияют на агрегацию белка в растворе, обычно включают концентрацию белка, pH, температуру, другие эксципиенты и механические напряжения. Некоторые факторы (например, температуру) можно более легко контролировать в процессе очистки, составления смеси, изготовления, хранения и применения, чем другие (например, механические напряжения). Исследования технологии приготовления лекарственных средств будут предписывать правильный выбор (выборы) pH и эксципиентов, которые не будут вызывать агрегацию и/или, в действительности, будут содействовать предотвращению агрегации. Концентрация белка предписывается необходимой терапевтической дозой и, в зависимости от того, какой является данная концентрация, будет определять, существует ли возможность повышенных объединенных состояний (димеры, тетрамеры и т.д.), которые затем могут приводить к агрегации в растворе. в процессе разработки технологии приготовления лекарственного средства должны быть проведены тщательные исследования с целью определения, какие факторы оказывают влияние на агрегацию белка, а затем, как эти факторы можно устранить или контролировать.
Необходимость идентифицирования препаратов антитела или другого белка со стабильным раствором для использования при парентеральном или ином введении может приводить к разработке методики испытаний для оценки влияния различных добавок на физическую стабильность. Основываясь на известных факторах, влияющих на агрегацию белка, и требованиях к подобному применению, физическую стабильность можно оценивать, используя механические процедуры, включающие взбалтывание или вращение белковых растворов. Методология для испытания с физическим напряжением с целью идентификации способности различных добавок предотвращать агрегацию может включать подвергание встряхиванию или помешиванию в горизонтальной плоскости или вращению x см от оси колеса, вращающегося при n об/мин в вертикальной плоскости. мутность, являющаяся результатом агрегации, обычно определяют, как функцию времени при визуальном осмотре или посредством анализа рассеяния света. В качестве альтернативы, уменьшение содержания растворимого белка вследствие осаждения может быть количественно оценено посредством анализа ЖХВР в качестве функции времени.
Представленное изобретение основано на новом открытии, что полиоксиэтилен (ПОЭ) сорбитаны и полиэтиленгликоли (ПЭГ), присутствующие в определенных концентрациях в жидкой готовой форме, применимы для стабилизации белоксодержащих готовых форм и для предотвращения агрегации белков в подобных готовых формах.
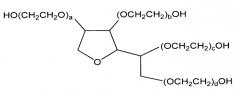
Соответственно, в одном аспекте, представленное изобретение описывает композиции, содержащие антитело или другой белок, либо в высокой, либо в низкой концентрации, и ПОЭ сорбитан. Как используется в данном описании, «полиоксиэтиленсорбитан» или «ПОЭ сорбитан» относится к соединению не являющемуся поверхностно-активным веществом, имеющего следующую химическую структуру:
,
где a+b+c+d предпочтительно составляет от приблизительно 6 до приблизительно 80, более предпочтительно от приблизительно 8 до приблизительно 60, еще более предпочтительно от приблизительно 10 до приблизительно 40, и еще более предпочтительно от приблизительно 10 до приблизительно 20. В отношении сказанного выше, в данной области понятно, что результатом химического синтеза соединений, таких как ПОЭ сорбитаны, описанные в данном документе, является весьма гетерогенная смесь соединений, а не полностью гомогенный препарат. В связи с этим, когда в данном случае описано, что a+b+c+d, например, предпочтительно составляет приблизительно от 6 до 80, необходимо учитывать что данное определение относится к большинству составных элементов гетерогенной смеси, которые являются результатом их химического синтеза.
ПОЭ сорбитаны могут быть использованы раздельно в качестве агента, стабилизирующего антитело или другой белок, или могут быть использованы в комбинации с другими ПОЭ сорбитанами для стабилизации антитела или другого белка в водном растворе. ПОЭ сорбитаны находят применение в качестве агентов, стабилизирующих антитело или другой белок (или антиагрегационных) в широком диапазоне концентраций в водном растворе. В некоторых вариантах осуществления представленного изобретения, ПОЭ сорбитан (если используется в качестве единственного стабилизирующего агента) или ПОЭ сорбитаны (если используются в комбинации) может присутствовать в водной содержащей антитело или другой белок готовой форме в концентрации, составляющей от приблизительно 20 м.д. до приблизительно 100000 м.д., более предпочтительно от 100 м.д. до приблизительно 50000 м.д., еще более предпочтительно от 150 м.д. до приблизительно 10000 м.д., еще более предпочтительно от 200 м.д. до приблизительно 5000 м.д., еще более предпочтительно от 200 м.д. до приблизительно 1000 м.д.
В еще одном аспекте, представленное изобретение описывает композиции, содержащие антитело или другой белок либо в высокой, либо в низкой концентрации, и полиэтиленгликоль.
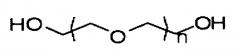
Как используется в данном описании, «полиэтиленгликоль», «ПЭГ» и аналогичные термины предназначены охватывать полиэтиленгликоль и различные его производные, такие как метокси-ПЭГ-амин, диамин-ПЭГ и тому подобное. Более конкретно и в некоторых вариантах осуществления представленного изобретения, термин «полиэтиленгликоль» или «ПЭГ» относится к соединению, не являющемуся поверхностно-активным веществом, имеющему следующую химическую структуру:
,
где n составляет от приблизительно 5 до приблизительно 240 и может необязательно включать некоторую степень ненасыщенности. ПЭГ, предназначенные для использования в представленном изобретении, могут быть разветвленными или линейными, предпочтительно линейными. В отношении сказанного выше, в данной области понятно, что результатом химического синтеза соединений, таких как ПЭГ, описанных в данном случае, является весьма гетерогенная смесь соединений, а не полностью гомогенный препарат. В связи с этим, когда в данном случае описано, что n предпочтительно составляет от приблизительно 5 до 240, должно быть понятно, что данное определение относится к большинству составных элементов гетерогенной смеси, которые являются результатом их химического синтеза.
ПЭГ могут быть использованы раздельно в качестве агента, стабилизирующего антитело или другой белок, или могут быть использованы в комбинации с другими ПЭГ для стабилизации антитела или другого белка в водном растворе. ПЭГ находят применение в качестве агентов, стабилизирующих антитело или другой белок (или антиагрегационных) в широком диапазоне концентраций в водном растворе. В некоторых вариантах осуществления представленного изобретения, ПЭГ (если используется в качестве единственного стабилизирующего агента) или ПЭГ (если используются в комбинации) может присутствовать в водной готовой форме, содержащей антитело или другой белок, в концентрации, равной менее чем приблизительно 10000 м.д., предпочтительно от приблизительно 20 м.д. до приблизительно 10000 м.д., более предпочтительно от приблизительно 200 м.д. до приблизительно 10000 м.д., более предпочтительно от приблизительно 200 м.д. до приблизительно 5000 м.д., более предпочтительно от приблизительно 200 м.д. до приблизительно 1000 м.д., более предпочтительно от приблизительно 200 м.д. до приблизительно 500 м.д.
Предпочтительные ПЭГ включают полимеры молекулярной массы, составляющей приблизительно 200-12000, но полимеры с более высокой молекулярной массой также находятся в пределах объема правовых притязаний изобретения. ПЭГ включает линейные и разветвленные полимеры, молекулы в виде звезд и ПЭГ блок-сополимеры, образованные посредством соединения по меньшей мере двух различных ПЭГ полимеров с образованием полимера с более высокой молекулярной массой, все из которых хорошо известны в данной области.
Под термином «полипептид» или «белок» подразумевается последовательность аминокислот, для которой длина цепи является достаточной для получения более высоких уровней третичной и/или четвертичной структуры. Таким образом, белки отличаются от «пептидов», которые также представляют собой основанные на аминокислотах молекулы, которые не имеют подобной структуры. Как правило, белок для использования в данном случае будет иметь молекулярную массу, равную по меньшей мере приблизительно 5-20 кД, в качестве альтернативы по меньшей мере приблизительно 15-20 кД, предпочтительно по меньшей мере приблизительно 20 кД. «Пептид» подразумевает последовательность аминокислот, которая в общем не демонстрирует более высокий уровень третичной и/или четвертичной структуры. В общем, пептиды имеют молекулярную массу, равную менее чем приблизительно 5 кД.
Примеры полипептидов, попадающих в пределы определения в данном случае, включают белки млекопитающих, такие как, например, ренин; гормон роста, включая человеческий гормон роста и бычий гормон роста; фактор, стимулирующий выделение гормона роста; паратиреоидный гормон; тиреостимулирующий гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывающей системы крови, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; факторы, препятствующие свертыванию крови, такие как C-белок; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как активатор плазминогена урокиназного типа человеческой мочи или тканевого типа (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли альфа-и-бета; энкефалиназа; RANTES (хемокин, выделяемый T-клетками при активации); человеческий макрофагальный белок воспаления (MIP-1-альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин-связанный пептид; белок микроорганизмов, такой как бета-лактамаза; ДНКаза; IgE; антиген цитотоксических T-лимфоцитов (CTLA), такой как CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы для гормонов или факторов роста; белок А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3,-4,-5, или-6 (NT-3, NT-4, NT-5, или NT-6), или фактор роста нервной ткани, такой как NGF-β; тромбоцитарный фактор роста (PDGF); фибробластный фактор роста, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и-II (IGF-I и IGF-II); des(l-3)-IGF-I (IGF-I мозга), белки, связывающие инсулиноподобный фактор роста (IGFBP); CD-белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF, и G-CSF; интерлейкины (ILs), например, от IL-1 до IL-10; супероксиддисмутаза; рецепторы T-клеток; белки поверхности мембран; фактор распада; вирусный антиген, такой как, например, участок оболочки вируса СПИД; транспортные белки; «хоминг»-рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолевый специфический антиген, такой как CA125 (антиген рака яичников) или рецептор HER2, HER3 или HER4; иммуноадгезины; и фрагменты и/или варианты любого из перечисленных выше белков, а также антител, включая фрагменты антител, связанные с любым из перечисленных выше белков.
Белком, который содержится в готовой форме, предпочтительно является по существу чистый и желательно по существу гомогенный (т.е., не содержащий загрязняющих белков). «По существу чистый» белок означает композицию, содержащую по меньшей мере приблизительно 90% белка по массе, в расчете на общую массу композиции, предпочтительно по меньшей мере приблизительно 95% по массе. «По существу гомогенный» белок означает композицию, содержащую по меньшей мере приблизительно 99% белка по массе, в расчете на общую массу композиции.
В некоторых вариантах осуществления, белком является антитело. Антитело в данном случае направлено против представляющего интерес «антигена». Предпочтительно, антиген представляет собой биологически важный белок, а результатом введения антитела млекопитающему, страдающему от заболевания или расстройства, может быть терапевтическая польза для данного млекопитающего. Однако также предполагаются антитела, направленные против небелковых антигенов (таких как опухолеспецифические гликолипидные антигены; см. Патент США 5091178). Когда антигеном является белок, это может быть трансмембранная молекула (например, рецептор) или лиганд, такой как фактор роста. Приведенные для примера антигены включают те белки, которые обсуждались выше. Предпочтительные молекулярные мишени для антител, охватываемых представленным изобретением, включают полипептиды CD, такие как CD3, CD4, CD8, CD19, CD20 и CD34; члены семейства рецепторов HER, такие как рецептор EGF (HER1), рецептор HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Macl, pl50,95, VLA-4, ICAM-1, VCAM и интегрин av/b3, включая его субъединицы либо а, либо b (например, антитела анти-CD11a, анти-CD18 или анти-CDllb); факторы роста, такие как VEGF; IgE; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); mpl-рецептор; CTLA-4; полипептид C и т.д. Для получения антител в качестве иммуногенов могут быть использованы растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами. Для трансмембранных молекул, таких как рецепторы, в качестве иммуногена могут быть использованы их фрагменты (например, внеклеточный домен рецептора). В виде альтернативы, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Подобные клетки могут быть получены из естественного источника (например, линий раковых клеток) или могут представлять собой клетки, которые были трансформированы с помощью рекомбинантных технологий для экспрессирования трансмембранной молекулы.
Примеры антител, подлежащих очистке, в данном случае включают, но без ограничения: антитела против HER2, включая трастузумаб (HERCEPTIN®) (Carter et al, Proc. Natl. Acad. Sci. USA, 89:4285-4289 (1992), патент США № 5725856) и пертузумаб (OMNITARG™) (WO 01/00245); антитела против CD20 (см. ниже); антитела против IL-8 (St John et al., Chest, 103:932 (1993), и международная публикация № WO 95/23865); антитела против VEGF или против рецепторов VEGF, включая гуманизированные и/или аффинно развитые антитела против VEGF, такие как гуманизированное антитело против VEGF huA4.6.1 бевацизумаб (AVASTIN®) и ранибизумаб (LUCENTIS®) (Kim et al., Growth Factores, 7:53-64 (1992), международная публикация № WO 96/30046, и WO 98/45331, опубликованная 15 октября 1998 года); антитела против PSCA (WOO 1/40309); антитела против Cdlla, включая эфализумаб (RAPTIVA®) (Патент США № 6037454, Патент США № 5622700, WO 98/23761, Stoppa et al., Transplant Intl. 4:3-7 (1991), и Hourmant et al., Transplantation 58:377-380 (1994)); антитела, которые связывают IgE, включая омализумаб (XOLAIR®) (Presta et al., J. Immunol. 151:2623-2632 (1993), и международная публикация № WO 95/19181; Патент США № 5714338, выданный 3 февраля 1998 года или Патент США № 5091313, выданный 25 февраля 1992 года, WO 93/04173 опубликованной 4 марта 1993 года, или Международная заявка № PCT/US98/13410, поданная 30 июня 1998 года, Патент США № 5714338); антитела против CD18 (Патент США № 5622700, выданный 22 апреля 1997 года, или как в WO 97/26912, опубликованной 31 июля 1997 года); антитела против рецептора Apo-2 (WO 98/51793, опубликованный 19 ноября 1998 года); антитела против Тканевого Фактора (TF) (Европейский Патент № 0420937 B1, выданный 9 Ноября 1994 года); антитела против α4-α7 интегрина (WO 98/06248, опубликованной 19 Февраля 1998 года); антитела против EGFR (например, химеризованное или гуманизированное антитело 225, цетуксимаб, ERBUTIX® как в WO 96/40210 опубликованной 19 Декабря 1996 года); антитела против CD3, такие как OKT3 (Патент США № 4515893, выданный 7 мая 1985 года); антитела против CD25 или Tac, такие как CHI-621 (SIMULECT®) и ZENAPAX® (см. Патент США № 5693762, выданный 2 декабря 1997 года); антитела против CD4, такие как антитело cM-7412 (Choy et al., Arthritis Rheum 39(l):52-56 (1996)); антитела против CD52, такие как CAMPATH-1H (ILEX/Berlex) (Riechmann et al, Nature 332:323-337 (1988)); антитела против рецептора Fc, такие как антитело M22, направленное против Fc(RI, как у Graziano et al., J. Immunol. 155(10):4996-5002 (1995)); антитела против карциноэмбрионного антигена (CEA), такие как hMN-14 (Sharkey et al., Cancer Res. 55(23Suppl): 5935s-5945s (1995)); антитела, направленные против эпителиальных клеток молочной железы, включая huBrE-3, hu-Mc 3 и CHL6 (Ceriani et al, Cancer Res. 55(23): 5852s-5856s (1995); и Richman et al, Cancer Res. 55(23 Supp): 5916s-5920s (1995)); антитела, которые связываются с клетками карциномы толстой кишки, такими как C242 (Litton et al, Eur J. Immunol. 26(1):1-9 (1996)); антитела против CD38, например, АТ13/5 (Ellis et al., J.Immunol. 155(2): 925-937 (1995)); антитела против CD33, такие как Hu M195 (Jurcic et al., Cancer Res. 55 (23Suppl): 5908s-5910s (1995) и СМА-676 или CDP771; антитела против EpCAM, такие как 17-1А (PANOREX®); антитела против GpIIb/IIIa, такие как абциксимаб или с7Е3 Fab (REOPRO®); антитела против RSV, такие как MEDI-493 (SYNAGIS®); антитела против CMV, такие как PROTOVIR®; антитела против ВИЧ, такие как PRO542; антитела против гепатита, такие как антитело против Нер В OSTAVIR®; антитело против CA125, включая анти-MUC16 (WO2007/001851; Yin, BWT и Lloyd, KO, J. Biol. Chem. 276:27371-27375 (2001)) и OvaRex; антитело ВЕС2 против идиотипического эпитопа CD3; антитело против ανβ3 (например, VITAXIN®; Medimmune); антитело против карциномы почечных клеток человека, такое как ch-G250; ING-1; антитело против 17-1А человека (3622W94); антитело против колоректальной опухоли человека (A33); антитело против меланомы человека R24, направленное против ганглиозида GD3; антитело против карциномы сквамозных клеток человека (SF-25); и антитела против лейкоцитарного антигена человека (HLA), такие как Smart ID10, и антитело Oncolym (Lym-1) против HLA DR; антитело против CD37, такое как TRU 016 (Trubion); антитело против IL-21 (Zymogenetics/Novo Nordisk); антитело против B клеток (Impheron); выделяющее В-клетки MAb (Immunogen/Aventis); 1D09C3 (Morphosys/GPC); LymphoRad 131 (HGS); антитело Lym-1, такое как Lym-1Y-90 (USC) или анти-Lym-1 Oncolym (USC/Peregrine); LIF 226 (Enhanced Lifesci.); антитело против BAFF (например, WO 03/33658); антитело против рецептора BAFF (см. например, WO 02/24909); антитело BR3; антитело Blys, такое как белимумаб; LYMPHOSTAT-B™; ISF 154 (UCSD/Roche/Tragen); гомиликсима (Idec 152; Biogen Idee); антитело против рецептора IL-6, такое как атлизумаб (ACTEMRA™; Chugai/Roche); антитело против IL-15, такое как HuMax-II-15 (Genmab/Amgen); антитело против хемокинового рецептора, такое как антитело CCR2 (например, MLN1202; Millieneum); антикомплементное антитело, такое как антитело C5 (например, экулизумаб, 5G1.1; Alexion); пероральная готовая форма человеческого иммуноглобулина (например, IgPO; Protein Therapeutics); антитело против IL-12, такое как ABT-874 (CAT/Abbott); Teneliximab (BMS-224818; BMS); антитела против CD40, включая S2C6 и их гуманизированные варианты (WO 00/75348) и TNX 100 (Chiron/Tanox); антитела против TNF-α, включая cA2 или инфликсимаб (REMICADE®), CDP571, MAK-195, адалимумаб (HUMIRA™), пегилированный фрагмент антитела против TNF-α, такой как CDP-870 (Celltech), D2E7 (Knoll), поликлональное антитело против TNF-α (например, PassTNF; Verigen); антитела против CD22, такие как LL2 или эпратузумаб (LYMPHOCIDE®; Immunomedics), включая эпратузумаб Y-90 и эпратузумаб I-131, антитело Abiogen против CD22 (Abiogen, Italy), CMC 544 (Wyeth/Celltech), комботокс (UT Soutwestern), BL22 (NIH), и LympoScan Tc99 (Immunomedics).
Примеры антител против CD20 включают: «C2B8», называемые в настоящее время «ритуксимаб» («RITUXAN®») (Патент США № 5736137); иттрий-[90]-меченое 2В8 мышиное антитело, обозначенное «Y2D8» или «Ибритумомаб Тиуксетан» (ZEVALIN®), коммерчески доступный от IDEC Pharmaceuticals, Inc. (Патент США № 5736137; 2B8 депонируемый в ATCC под № HB11388 поступления от 22 июня 1993 года); мышиный IgG2a «B1», также называемый «Тозитумомаб», необязательно меченый 131I для образования 131I-B1 антитела или иод I131 тозитумомаб, (BEXXARTM), коммерчески доступный от Corixa (см., также, Патент США № 5595721); мышиное моноклональное антитело «1F5» (Press et al, Blood 69(2):584-591 (1987)) и его варианты, включая «имеющее «очажки» каркасной области» или гуманизированное 1F5 (WO03/002607, Leung, S.; депозит ATCC НВ-96450); мышиное антитело 2Н7 и химерное антитело 2Н7 (Патент США 5677180); гуманизированное антитело 2Н7; (WO 2004/056312, Lowman et al.); 2F2 (HuMax-CD20), полностью человеческое, высокоаффинное антитело, направленное на молекулу CD20 в клеточной мембране B-клеток (Genmab, Denmark; см., например, Glennie and van de Winkel, Drug Discovery Today 8:503-510 (2003) и Cragg et al, Blood 101: 1045-1052 (2003); WO 2004/035607; US2004/0167319); человеческие моноклональные антитела, изложенные в WO 2004/035607 и US2004/0167319 (Teeling et al.); антитела, имеющие комплекс сцепленных с N-гликозидом сахарных цепей, связанных с Fc-областью, описанной в US 2004/0093621 (Shitara et al.); моноклональные антитела и антигенсвязывающие фрагменты, связанные с CD20 (WO 2005/000901, Tedder et al.), такие как HB20-3, HB20-4, HB20-25 и MB20-11; CD20-связывающие молекулы, такие как серия антител AME, например, антитела AME 33, как изложено в WO 2004/103404 и US2005/0025764 (Watkins et al, Eli Lilly/Applied Molecular Evolution, AME); CD20-связывающие молекулы, такие как молекулы, описанные в US 2005/0025764 (Watkins et al.); антитело A20 или его варианты, такие как химерное или гуманизированное антитело A20 (cA20, hA20, соответственно) или IMMU-106 (US 2003/0219433, Immunomedics); CD20-связывающие антитела, включая эпитоп-истощенные Leu-16, 1H4 или 2B8, необязательно конъюгированные с IL-2, как в US 2005/0069545A1 и WO 2005/16969 (Carr et al.); биспецифическое антитело, которое связывает CD22 и CD20, например, hLL2xhA20 (WO2005/14618, Chang et al.); моноклональные антитела L27, G28-2, 93-1B3, B-Cl или NU-B2, доступные от International Leukocyte Typing Workshop (Valentine et al, In: Leukocyte Typing III (McMichael, Ed., p. 440, Oxford University Press (1987)); 1H4 (Haisma et al, Blood 92: 184 (1998)); конъюгат анти-CD20 ауристан E (Seattle Genetics); анти-CD20-IL2 (EMD/Biovation/City of Hope); анти-CD20 MAb терапевтик (EpiCyte); анти-CD20 антитело TRU 015 (Trubion).
Термин «антитело», в том смысле, в котором он используется в данном описании, включает моноклональные антитела (включая антитела с полной длиной, которые имеют Fc-область иммуноглобулина), композиции антител с полиэпитопной специфичностью, мультиспецифические антитела (например, биспецифические антитела, диатела и молекулы с единственной цепью, а также фрагменты антител (например, Fab, F(ab')2 и Fv). Термин «иммуноглобулин» (Ig) используется в данном описании взаимозаменяемо с «антителом».
Основная 4-цепочечная единица антитела представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Антитело IgM состоит из 5 основных гетеротетрамерных единиц наряду с дополнительным полипептидом, называющимся цепь J, и содержит 10 антиген связывающих сайтов, тогда как антитела IgA содержат от 2 до 5 основных 4-цепочечных единиц, которые могут полимеризоваться с образованием поливалентных комплексов в комбинации с цепью J. в случае IgGs, 4-цепочечная единица составляет в общем приблизительно 150000 дальтон. Каждая L-цепь соединена с H-цепью одной ковалентной дисульфидной связью, тогда как две H-цепи сцеплены друг с другом одной или более дисульфидными связями в зависимости от изотипа H-цепи.