Комбинированная терапия афукозилированным антителом cd20 и ингибитором mtor
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к комбинированной терапии афукозилированным антителом против CD20 и ингибитором mTOR для лечения рака. Заявлено применение афукозилированного гуманизированного антитела против CD20 В-Ly1 для изготовления лекарственного средства для лечения В-клеточной неходжкинской лимфомы в комбинации с ингибитором mTOR, таким как темсиролимус или эверолимус. Изобретение позволяет достичь синергического антипролиферативного эффекта при лечении рака. 1 з.п. ф-лы, 1 ил., 3 табл.
Реферат
Настоящее изобретение направлено на комбинированную терапию афукозилированным антителом CD20 и ингибитором mTOR для лечения рака.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Афукозилированные антитела
Клеточно-опосредованные эффекторные функции моноклональных антител можно усилить конструированием их олигосахаридного компонента, как описано в Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180 и US 6602684. Антитела типа IgG1, используемые чаще всего антитела в иммунотерапии рака, представляют собой гликопротеины, которые имеют консервативный сайт N-связанного гликозилирования на Asn297 в каждом домене СН2. Два сложных двухантенных олигосахарида, присоединенных к Asn297, спрятаны между доменами СН2, образуя обширные контакты с полипептидным остовом, и их присутствие является существенным для того, чтобы антитело опосредовало эффекторные функции, такие как зависимую от антител клеточную цитотоксичность (ADCC) (Lifely, M.R., et al., Glycobiology 5 (1995) 813-822; Jefferis, R., et al., Immunol. Rev. 163 (1998) 59-76; Wright, A., and Morrison, S.L, Trends Biotech. 15 (1997) 26-32). Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180 и WO 99/54342 показали, что сверхэкспрессия β(1,4)-N-ацетилглюкозаминилтрансферазы III ("GnTIII"), гликозилтрансферазы, катализирующей образование разделенных надвое олигосахаридов, в клетках яичника китайского хомячка (СНО) значительно увеличивает активность ADCC антител in vitro. Изменения состава углевода на N297 или его устранение также влияют на связывание Fc с FcγR и С1 q (Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180; Davies, J., et al., Biotechnol. Bioeng. 74 (2001) 288-294; Mimura, Y., et al., J. Biol. Chem. 276 (2001) 45539-45547; Radaev, S, et al., J. Biol. Chem. 276 (2001) 16478-16483; Shields, R.L, et al., J. Biol. Chem. 276 (2001) 6591-6604; Shields, R.L, et al., J. Biol. Chem. 277 (2002) 26733-26740; Simmons, L.C., et al., J. Immunol. Methods 263 (2002) 133-147).
Iida, S., et al., Clin. Cancer Res. 12 (2006) 2879-2887 показали, что эффективность афукозилированного антитела против CD20 ингибировалась добавлением фукозилированного антитела против CD20. Эффективность смеси 1:9 (10 мкг/мл) афукозилированного и фукозилированного антител против CD20 была хуже эффективности 1000-кратного разведения (0,01 мкг/мл) одного афукозилированного антитела против CD20. Они сделали заключение о том, что афукозилированный IgG1, не включающий фукозилированных аналогов, может уклоняться от ингибирующего эффекта IgG плазмы на ADCC через его сильное связывание с Fc гамма RIIIa. Natsume, A., et al., показывают в J. Immunol. Methods 306 (2005) 93-103, что удаление фукозы из олигосахарида комплексного (сложного) типа человеческого антитела типа IgG1 приводит к значительному усилению зависимой от антител клеточной цитотоксичности (ADCC). Satoh, M., et al., Expert Opin. Biol. Ther. 6 (2006) 1161-1173 обсуждают афукозилированные терапевтические антитела в качестве терапевтических антител следующего поколения. Satoh заключает, что антитела, состоящие только из афукозилированной формы человеческого lgG1, по-видимому, являются идеальными. Kanda, Y., et al., Biotechnol. Bioeng. 94 (2006) 680-688 сравнили фукозилированное антитело CD20 (96% фукозилирования, CHO/DG44 1Н5) с афукозилированным антителом CD20. Davies, J., et al., Biotechnol. Bioeng. 74 (2001) 288-294 сообщают о том, что для антитела CD20 повышенная ADCC коррелирует с повышенным связыванием с FcγRIII.
Способы увеличения клеточно-опосредованных эффекторных функций моноклональных антител путем уменьшения количества фукозы описаны, например, в WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2004/065540, WO 2005/011735, WO 2005/027966, WO 1997/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739, Niwa, R., et al., J. Immunol. Methods 306 (2005) 151-160; Shinkawa, Т., et al, J. Biol. Chem. 278 (2003) 3466-3473; WO 03/055993 или US 2005/0249722.
CD20 и антитела против CD20
Молекула CD20 (также именуемая как человеческий ограниченный В-лимфоцитами антиген дифференцировки или Вр35) представляет собой гидрофобный трансмембранный белок с молекулярной массой приблизительно 35 кДа, локализованный на пре-В и зрелых В-лимфоцитах (Valentine, M.A., et al., J. Biol. Chem. 264 (1989) 11282-11287 и Einfeld, DA, et al., EMBO J. 7 (1988) 711-717; Tedder, T.F., et al., Proc. Natl. Acad. Sci. U.S.A. 85 (1988) 208-212; Stamenkovic, I., et al., J. Exp. Med. 167 (1988) 1975-1980; Tedder, T.F., et al., J. Immunol. 142 (1989) 2560-2568). CD20 находится на поверхности больше чем 90% В-клеток из периферической крови или лимфоидных органов, экспрессируется на протяжении раннего развития пре-В-клеток и сохраняется до дифференцировки плазматической клетки. CD20 присутствует как на нормальных В-клетках, так и на злокачественных В-клетках. В частности, CD20 экспрессируется на более чем 90% В-клеток неходжкинских лимфом (NHL) (Anderson, K.C., et al., Blood 63 (1984) 1424-1433)), но не обнаруживается на гематопоэтических стволовых клетках, про-В-клетках, нормальных плазматических клетках или других нормальных тканях (Tedder, T.F., et al., J. Immunol. 135 (1985) 973-979).
Карбоксиконцевая область белка CD20 из 85 аминокислот локализуется в цитоплазме. Длина данной области отличается от длины других специфичных для В-клеток поверхностных структур, таких как тяжелые цепи IgM, IgD и IgG или α или β цепи антигенов гистосовместимости класса II, которые имеют относительно короткие внутрицитоплазматические области из 3, 3, 28, 15 и 16 аминокислот соответственно (Komaromy, M., et al. NAR II (1983) 6775-6785). Из последней 61 карбоксиконцевой аминокислоты 21 представляют собой кислотные остатки, тогда как только 2 являются основными, указывая на то, что данная область имеет сильный отрицательный заряд. №доступа GenBank является NP-690605. Считается, что CD20 может участвовать в регуляции ранней стадии(ий) в процессе активации и дифференцировки В-клеток (Tedder, T.F., et al., Eur. J. Immunol. 16 (1986) 881-887) и мог бы функционировать в качестве кальциевого ионного канала (Tedder, T.F., et al., J. Cell. Biochem. 14D (1990) 195).
Существуют два разных типа антител против CD20, значительно отличающихся их способом связывания CD20 и биологическими активностями (Cragg, M.S., et al., Blood 103 (2004) 2738-2743; и Cragg, M.S., et al., Blood 101 (2003) 1045-1052). Антитела типа I, как, например, ритуксимаб, являются эффективными в цитотоксичности, опосредованной комплементом, тогда как антитела типа II, как, например, тозитумомаб (В1), 11 В8, АТ80 или гуманизированные антитела B-Ly1, эффективно инициируют смерть клетки-мишени через независимый от каспаз апоптоз с сопутствующей экспозицией фосфатидилсерина.
Наличие общих характеристик антител против CD20 типа I и типа II обобщено в Таблице 1.
| Таблица 1: | |
| свойства антител против CD20 типа I и типа II | |
| Антитела против CD20 типа I | Антитела против CD20 типа II |
| Эпитоп CD20 типа I | Эпитоп CD20 типа II |
| Локализуют CD20 на липидных рафтах | Не локализуют CD20 на липидных рафтах |
| Увеличивают CDC (зависимая от | Снижают CDC (при изотипе IgG1) |
| комплемента цитотоксчность (при изотипе IgG1) | |
| ADCC активность (при изотипе IgG1) | ADCC активность (при изотипе IgG1) |
| Полная способность к связыванию | Пониженная способность к связыванию |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Индукция апоптоза при поперечном связывании | Сильная индукция клеточной смерти без поперечного связывания |
mTOR и ингибиторы mTOR
mTOR представляет собой мишень рапамицина млекопитающих (mTOR), также известную как механистическая мишень рапамицина или FK506 связывающий белок 12-ассоциированный с рапамицином белок 1 (FRAP1), представляющий собой белок, который у людей кодируется геном FRAP1 (Brown, E.J., et al., Nature 369 (1994) 756-758; Moore, PA, et al., Genomics 33 (1996) 331-332). mTOR представляет собой серин/треониновую протеинкиназу, которая регулирует рост клеток, пролиферацию клеток, подвижность клеток, выживание клеток, синтез белка и транскрипцию (Hay, N., et al., Genes Dev. 18 (2004) 1926-1945; Beevers, С.S., et al., Int. J. Cancer 119 (2006) 757-764).
mTOR интегрирует входящий сигнал от находящихся выше по течению путей, включая (сигналы) инсулина, факторов роста (таких как IGF-1 (инсулиноподобный фактор роста-1) и IGF-2) и митогенов. mTOR также воспринимает уровни клеточных питательных веществ и энергии и редокс-статус. Регуляция пути mTOR нарушается при заболеваниях человека, особенно при определенных раковых заболеваниях. Рапамицин представляет собой бактериальный продукт, который может ингибировать mTOR путем ассоциации с его внутриклеточным рецептором FKBP12. Комплекс РКВР12-рапамицин непосредственно связывается с РКВР12-рапамицинсвязывающим доменом (FRB) mTOR.
mTOR представляет собой каталитическую субъединицу двух молекулярных комплексов. Комплекс 1 mTOR (mTORC1) состоит из mTOR, регуляторного ассоциированного белка mTOR (Raptor), белка, подобного LST8 млекопитающих/β-субъединице G-белка (mLST8/GβL), и недавно идентифицированных партнеров - PRAS40 и DEPTOR. Данный комплекс характеризуется классическими свойствами mTOR, функционируя как сенсор питательных веществ/энергии/редокс-статуса и контролируя синтез белка. Активность данного комплекса стимулируется инсулином, факторами роста, сывороткой, фосфатидной кислотой, аминокислотами (особенно лейцином) и окислительным стрессом.
mTORC1 ингибируется низкими уровнями питательных веществ, удалением факторов роста, восстановительным стрессом, кафеином, рапамицином, фарнезилтиосалициловой кислотой (FTS) и куркумином. Две лучше всего охарактеризованные мишени mTORC1 представляют собой p70-S6 киназу 1 (S6K1) и 4Е-ВР1 белок 1. [3], связывающий эукариотический фактор инициации 4Е (elF4E).
mTORC1 фосфорилирует S6K1 по меньшей мере по двум остаткам, причем самая критическая модификация происходит по остатку треонина (Т389). Данное событие стимулирует последующее фосфорилирование S6K1 посредством PDK1. Активная S6K1 может, в свою очередь, стимулировать инициацию синтеза белка через активацию рибосомального белка S6 (компонент рибосомы) и других компонентов трансляционного аппарата. S6K1 также может участвовать в петле положительной обратной связи с mTORC1 путем фосфорилирования негативного регуляторного домена mTOR по двум сайтам; фосфорилирование по данным сайтам, по-видимому, стимулирует активность mTOR.
Было показано, что mTORC1 фосфорилирует по меньшей мере четыре остатка 4Е-ВР1 иерархическим образом. Нефосфорилированный 4Е-ВР1 прочно связывается с фактором инициации трансляции elF4E, предотвращая его связывание с 5'-кэппированными мРНК и рекрутируя их в рибосомальный инициирующий комплекс. При фосфорилировании посредством mTORC1 4Е-ВР1 высвобождает elF4E, позволяя ему выполнять его функцию. Активность mTORC1, по-видимому, регулируется через динамическое взаимодействие между mTOR и Raptor, то, которое опосредовано GβL Raptor и mTOR имеют сильное N-концевое взаимодействие и более слабое С-концевое взаимодействие около киназного домена mTOR. При восприятии стимулирующих сигналов, таких как высокие уровни питательных веществ/энергии, С-концевое взаимодействие mTOR-Raptor ослабевает и, возможно, полностью утрачивается, обеспечивая включение киназной активности mTOR. При удалении стимулирующих сигналов, как, например, при низких уровнях питательных веществ, С-концевое взаимодействие mTOR-Raptor усиливается, по существу отключая киназную функцию mTOR.
Комплекс 2 mTOR (mTORC2) состоит из mTOR, нечувствительного к рапамицину спутника mTOR (Rictor), GβL и белка млекопитающих 1, взаимодействующего со стресс-активируемой протеинкиназой (mSIN1). Было показано, что mTORC2 функционирует в качестве важного регулятора цитоскелета через стимуляцию им стрессовых волокон F-актина, паксиллина, RhoA, Rac1, Cdc42 и протеинкиназы С а (РКСа). mTORC2 также, по-видимому, обладает активностью ранее неуловимого белка, известного как «PDK2". mTORC2 фосфорилирует серин/треониновую протеинкиназу Akt/PKB по остатку серина S473. Фосфорилирование серина стимулирует фосфорилирование Akt по остатку треонина Т308 посредством PDK1 и приводит к полной активации Akt; куркумин ингибирует обе, предотвращая фосфорилирование серина.
mTORC2, по-видимому, регулируется инсулином, факторами роста, сывороткой и уровнями питательных веществ. Первоначально mTORC2 идентифицировали как нечувствительную к рапамицину молекулу, так как кратковременное воздействие рапамицина не влияло на активность mTORC2 или фосфорилирование Akt. Однако последующие исследования показали, что, по меньшей мере в некоторых линиях клеток, при длительном воздействии рапамицин, не влияя на предсуществующий mTORC2, может связываться со свободными молекулами mTOR, таким образом, ингибируя образование нового mTORC2.
Предполагается, что некоторые диеты, подобные ограничению числа калорий и ограничению метионина, вызывают увеличение продолжительности жизни путем снижения активности mTor.
Ингибиторы mTOR
Были идентифицированы многие ингибиторы mTOR, и несколько находятся в клинических испытаниях для лечения рака (например RAD001 (также известный как эверолимус; Novartis); CCI-779 (также известный как темсиролимус; Wyeth); АР23573 (Ariad Pharmaceuticals) и KU-0059475 (Kudus Pharmaceuticals); Mita, M.M. et al., Cancer Biology & Therapy 2, Suppl. 1 (2003) S169-S177). Также было высказано предположение о потенциальной эффективности комбинаций таких ингибиторов mTOR с другими противораковыми агентами, и они тестируются в клинических испытаниях (Adjei, A.A. and Hidalgo, M., J. Clin. Oncol. 23 (2005) 5386-5403). Такие комбинации включают комбинации ингибиторов mTOR с ингибиторами протеин-тирозинкиназ (Sawyers, С.L, Cancer Cell 4 (2003) 343-348; Gemmill, R.M., et al., Br. J. Cancer 92 (2005) 2266-2277; Goudar, R.К., et al., Mol. Cancer Therapeutics 4 (2005) 101-112; международная публикация патента WO 2004/004644; Birle, D.C., et al., 94th Annual Meeting of the American Association for Cancer Research, Washington, D.C., Vol.44, Second Edition, Proc. Am. Assoc. Cancer Res. (July 2003) p.932, #R4692).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение включает применение афукозилированного антитела против CD20 с количеством фукозы 60% или менее для изготовления лекарственного средства для лечения ракового заболевания в комбинации с ингибитором mTOR.
Одним аспектом изобретения является способ лечения пациента, страдающего от ракового заболевания, путем введения афукозилированного антитела против CD20 с количеством фукозы 60% или менее в комбинации с ингибитором mTOR пациенту, нуждающемуся в таком лечении.
Другим аспектом изобретения является афукозилированное антитело против CD20 с количеством фукозы 60% или менее для лечения ракового заболевания в комбинации с ингибитором mTOR.
Предпочтительно количество фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
Предпочтительно указанное афукозилированное антитело против CD20 представляет собой гуманизированное антитело B-Ly1, и указанное раковое заболевание представляет собой раковое заболевание, при котором экспрессируется CD20, предпочтительно В-клеточную неходжкинскую лимфому (NHL).
Предпочтительно ингибитором mTOR является рапамицин или аналог, или производное рапамицина. Предпочтительно ингибитором mTOR является темсиролимус или эверолимус.
Одно воплощение изобретения представляет собой композицию, содержащую афукозилированное антитело против CD20 с количеством фукозы 60% или менее и ингибитор mTOR для лечения рака.
Неожиданно авторы изобретения выяснили, что комбинация ингибитора mTOR с афукозилированным антителом против CD20 показывает синергетические (например, более чем аддитивные) антипролиферативные эффекты при лечении рака.
Авторы изобретения выяснили, что комбинация афукозилированного антитела против CD20 показывает синергетические (например, даже более чем аддитивные) антипролиферативные эффекты.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
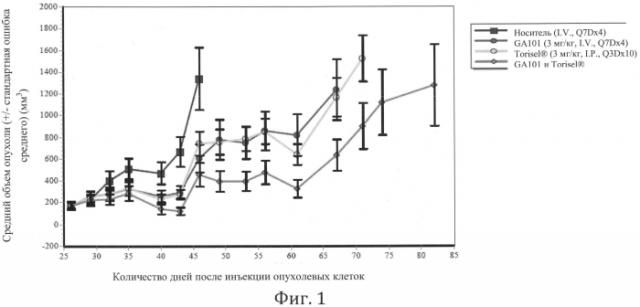
Фиг.1. Противоопухолевая активность in vivo комбинированного лечения афукозилированным антителом против CD20 типа II (GA101=B-HH6-B-KV1 GE) с ингибитором mTOR (темсиролимус) по сравнению с соответствующими монотерапиями.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение включает применение афукозилированного антитела против CD20 (предпочтительно изотипа IgG1 или IgG3, более предпочтительно изотипа IgG1) с количеством фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для изготовления лекарственного средства для лечения рака в комбинации с ингибитором mTOR.
Предпочтительно ингибитором mTOR является рапамицин или аналог или производное рапамицина. Предпочтительно ингибитор mTOR представляет собой темсиролимус или эверолимус.
Предпочтительно количество фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
Термин «антитело» охватывает разные формы антител, включающие, но не ограничивающиеся, цельными антителами, человеческими антителами, гуманизированными антителами и генетически модифицированными антителами, подобными моноклональным антителам, химерным антителам или рекомбинантным антителам, а также фрагментам таких антител, при условии, что сохраняются характерные свойства согласно изобретению. Термины «моноклональное антитело» или «композиция моноклонального антитела» в том виде, как они здесь используются, относятся к препарату молекул антитела одного аминокислотного состава. Соответственно, термин «человеческое моноклональное антитело» относится к антителам, демонстрирующим одну специфичность связывания, которые имеют вариабельные и константные области, происходящие из последовательностей иммуноглобулинов человеческой зародышевой линии. В одном воплощении человеческие моноклональные антитела продуцируются гибридомой, которая включает В-клетку, полученную от трансгенного животного, не являющегся человеком, например, от трансгенной мыши, имеющей геном, содержащий трансген человеческой тяжелой цепи и трансген легкой человеческой цепи, слитую с бессмертной клеткой.
Термин «химерное антитело» относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида и по меньшей мере часть константной области, происходящей из другого источника или вида, обычно полученному методиками генной инженерии. Особенно предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Такие мышиные/человеческие химерные антитела являются продуктом экспрессируемых генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие мышиные вариабельные области иммуноглобулинов и сегменты ДНК, кодирующие человеческие константные области иммуноглобулинов. Другие формы «химерных антител», охватываемых настоящим изобретением, представляют собой антитела, в которых класс или подкласс был модифицирован или изменен относительно класса или подкласса исходного антитела. Такие «химерные» антитела также называются «антитела с переключенным классом». Способы получения химерных антител включают традиционные методики генной инженерии и трансфекции генов, теперь хорошо известные в данной области. Смотрите, например, Morrison, S.L., et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; US 5202238 и US 5204244.
Термин «гуманизированное антитело» относится к антителам, в которых каркас или «области, определяющие комплементарность» (CDR) (гипервариабельные области), были модифицированы с включением CDR иммуноглобулина другой специфичности по сравнению с CDR родительского иммуноглобулина. В предпочтительном воплощении мышиный CDR пересажен на каркасную область человеческого антитела с получением «гуманизированного антитела». Смотрите, например, Riechmann, L, et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270.
Подразумевается, что термин «человеческое антитело» в том виде, как он здесь используется, включает антитела, имеющие вариабельные и константные области, происходящие из последовательностей человеческих иммуноглобулинов зародышевой линии. Человеческие антитела хорошо известны в современном уровне техники (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Chem. Biol. 5 (2001) 368-374). На основе такой технологии можно получать человеческие антитела против широкого спектра мишеней. Примеры человеческих антител, например, описаны в Kellermann, S.A., et al., Curr Opin Biotechnol. 13 (2002) 593-597.
Подразумевается, что термин «рекомбинантное человеческое антитело» в том виде, как он здесь используется, включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, такие как антитела, выделенные из клетки-хозяина, такой как клетка NS50 или СНО, или из животного (например, мыши), которое является трансгенным в отношении человеческих генов иммуноглобулинов, или антитела, экспрессируемые с использованием рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области, происходящие из последовательностей человеческих иммуноглобулинов зародышевой линии, в реаранжированной форме. Рекомбинантные человеческие антитела согласно изобретению подвергались соматической гипермутации in vivo. Таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, происходя из последовательностей VH и VL человеческой зародышевой линии и будучи родственными им, могут не существовать в природе в пределах репертуара человеческих антител зародышевой линии in vivo.
Термин «связывание» или «специфичное связывание» в том виде, как он здесь используется, относится к связыванию антитела с эпитопом опухолевого антигена в анализе in vitro, предпочтительно в анализе плазменным резонансом (BIAcore, GE-Healthcare Uppsala, Швеция) с очищенным антигеном дикого типа. Аффинность связывания определяется показателями ka (константа скорости для ассоциации антитела из комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka). Связывание или специфичное связывание означает аффинность связывания (KD) 10-8 моль/л или меньше, предпочтительно от 10-9 до 10-13 моль/л. Таким образом, афукозилированное антитело согласно изобретению специфично связывается с опухолевым антигеном с аффинностью связывания (KD) 10-8 моль/л или меньше, предпочтительно от 10-9 до 10-13 моль/л.
Подразумевается, что термин «молекула нуклеиновой кислоты» в том виде, как он здесь используется, включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представяет собой двухцепочечную ДНК.
«Константные домены» прямо не участвуют в связывании антитела с антигеном, но участвуют в эффекторных функциях (ADCC, связывание комплемента и CDC).
Термин «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в том виде, как он здесь используется, обозначает каждую пару легкой и тяжелой цепей, которая непосредственно участвует в связывании антитела с антигеном. Домены вариабельных человеческих легких и тяжелых цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасные области (FR), последовательности которых являются в значительной степени консервативными, соединенные тремя «гипервариабельными областями» (или областями, определяющими комплементарность, CDR). Каркасные области принимают конформацию бета-складчатого слоя, и CDR могут образовать петли, соединяющие бета-складчатую структуру. CDR в каждой цепи поддерживаются в их трехмерной структуре каркасными областями и, совместно с CDR из другой цепи, образуют антигенсвязывающий сайт.
Термины «гипервариабельная область» или «антигенсвязывающая часть антитела» при использовании здесь относятся к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из «областей, определяющих комплементарность» или «CDR». «Каркасные» или «FR» области представляют собой те области вариабельных доменов, которые отличаются от остатков гипервариабельной области, как здесь определено. Следовательно, легкие и тяжелые цепи антитела содержат от N- до С-конца домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Особенно CDR3 тяжелой цепи представляет собой область, которая главным образом содействует связыванию антигена. Области CDR и FR определяются согласно стандартному определению Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991) и/или соответствуют тем остаткам из «гипервариабельной петли».
Ингибитор mTOR согласно изобретению может быть любым ингибитором mTOR, который в настоящее время известен в данной области или который будет идентифицирован в будущем, и включает любое химическое соединение, которое, при введении пациенту, приводит к ингибированию mTOR у пациента. Ингибитор mTOR может ингибировать mTOR любым биохимическим механизмом, включая конкуренцию в сайте связывания АТР, конкуренцию где-нибудь в каталитическом сайте mTOR киназы, неконкурентное ингибирование, необратимое ингибирование (например, ковалентную модификацию белка) или модуляцию взаимодействий других белковых субъединиц или связывающих белков с mTOR киназой способом, который приводит к ингибированию киназной антивности mTOR (например, модуляция взаимодействия mTOR с FKBP12, GβL, (mLST8), RAPTOR (mKOG1) или RICTOR (mAV03)). Конкретные примеры ингибиторов mTOR включают: рапамицин; другие рапамициновые макролиды, или аналоги, производные или пролекарства рапамицина; эверолимус (также известный как RAD001, эверолимус/RAD001 представляет собой алкилированный рапамицин (40-O-(2-гидроксиэтил)-рапамицин), раскрытый в патенте США №5665772; Novartis); темсиролимус (также известный как СС1-779, темсиролимус/СС1-779 представляет собой сложный эфир рапамицина (42-сложный эфир с 3-гидрокси-2-гидроксиметил-2-метилпропионовой кислотой), раскрытый в патенте США №5362718; Wyeth); AP23573 или АР23841 (Ariad Pharmaceuticals); ABT-578 (40-эпи-(тетразолил)-рапамицин; Abbott Laboratories); KU-0059475 (Kudus Pharmaceuticals); и TAFA-93 (пролекарство рапамицина; Isotecknika). Примеры аналогов и производных рапамицина, известных в данной области, включают те соединения, которые описаны в патентах США №6329386; 6200985; 6117863; 6015815; 6015809; 6004973; 5985890; 5955457; 5922730; 5912253; 5780462; 5665772; 5637590; 5567709; 5563145; 5559122; 5559120; 5559119; 5559112; 5550133; 5541192; 5541191; 5532355; 5530121; 5530007; 5525610; 5521194; 5519031; 5516780; 5508399; 5508290; 5508286; 5508285; 5504291; 5504204; 5491231; 5489680; 5489595; 5488054; 5486524; 5486523; 5486522; 5484791; 5484790; 5480989; 5480988; 5463048; 5446048; 5434260; 5411967; 5391730; 5389639; 5385910; 5385909; 5385908; 5378836; 5378696; 5373014; 5362718; 5358944; 5346893; 5344833; 5302584; 5262424; 5262423; 5260300; 5260299; 5233036; 5221740; 5221670; 5202332; 5194447; 5177203; 5169851; 5164399; 5162333; 5151413; 5138051; 5130307; 5120842; 5120727; 5120726; 5120725; 5118678; 5118677; 5100883; 5023264; 5023263 и 5023262, которые все включены сюда посредством ссылки. Производные рапамицина также раскрыты, например, в WO 94/09010, WO 95/16691, WO 96/41807, or WO 99/15530, которые включены сюда посредством ссылки. Такие аналоги и производные включают 32-дезоксорапамицин, 16-пент-2-инилокси-32-дезоксорапамицин, 16-пент-2-инилокси-32 (S или Р)-дигидро-рапамицин, 16-пент-2-инилокси-32 (S или К)-дигидро-40-O-(2-гидроксиэтил)-рапамицин, 40-O-(2-гидроксиэтил)-рапамицин, 32-дезоксорапамицин и 16-пент-2-инилокси-32(S)-дигидрорапамицин. Производные рапамицина также могут включать так называемые рапалоги, например, как раскрыто в WO 98/02441 и WO 01/14387 (например, AP23573, АР23464, АР23675 или АР23841). Другими примерами производного рапамицина являются производные, раскрытые под названием биолимус-7 или биолимус-9 (BIOLIMUS A9TM) (Biosensors International, Singapore). Любой из приведенных выше аналогов или производных рапамицина можно легко получить методиками, как описано в приведенных выше ссылках. Дополнительные примеры ингибиторов mTOR, полезных в описанном здесь изобретении, включают ингибиторы, раскрытые и заявленные в заявке на патент США с серийным №11/599663.
Предпочтительно ингибиторы mTOR представляют собой рапамицин или аналоги или производные рапамицина, более предпочтительно - аналоги или производные рапамицина. Предпочтительные аналоги или производные рапамицина представляют собой, например, темсиролимус или эверолимус.
Термин «афукозилированное антитело» относится к антителу изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1) с измененной структурой гликозилирования в области Fc на Asn297, имеющим пониженный уровень остатков фукозы. Гликозилирование человеческого IgG1 или lgG3 происходит по Asn297, как ядре гликозилирования фукозилированного двухантенного комплексного олигосахарида, заканчивающегося остатками Ga1 вплоть до 2-х. Эти структуры обозначены как G0, G1 (α1,6 или α1,3) или G2 гликановые остатки, в зависимости от количества концевых остатков Gal (Raju, T.S., BioProcess Int. 1 (2003) 44-53). Гликозилирование СНО типа частей Fc антитела, например, описано Routier, F.H., Glycoconjugate J. 14 (1997) 201-207. Антитела, которые рекомбинантно экспрессируются в негликомодифицированных клетках-хозяевах СНО, обычно фукозилируются по Asn297 в количестве по меньшей мере 85%.
Таким образом, афукозилированное антитело согласно изобретению означает антитело изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), где количество фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (что означает, что по меньшей мере 40% или более олигосахаридов области Fc на Asn297 являются нефукозилированными). В одном воплощении количество фукозы составляет от 40% до 60% олигосахаридов области Fc на Asn297. В другом воплощении количество фукозы составляет 50% или менее, и в еще одном другом воплощении количество фукозы составляет 30% или менее олигосахаридов области Fc на Asn297. Согласно изобретению фраза «количество фукозы» означает количество указанного олигосахарида (фукозы) в пределах олигосахаридной (сахарной) цепи на Asn297, по отношению к сумме всех олигосахаридов (сахаров), присоединенных к Asn297 (например, сложные, гибридные структуры и структуры с высоким содержанием маннозы), измеренное масс-спектрометрией MALDI-TOF (времяпролетная ионизация лазерной десорбцией с использованием матрицы) и рассчитанное как среднее значение (подробная методика определения количества фукозы описана, например, в WO 2008/077546). Кроме того, олигосахариды области Fc преимущественно являются разделеными надвое. Афукозилированное антитело согласно изобретению можно экспрессировать в гликомодифицированных клетках-хозяевах, сконструированных для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, имеющий GnTIII активность, в достаточном количестве для частичного фукозилирования олигосахаридов в области Fc. В одном воплощении полипептид, имеющий активность GnTIII, представляет собой слитый полипептид. В качестве альтернативы, а1,6-фукозилтрансферазная активность клетки-хозяина может быть снижена или устранена согласно US 6946292 с генерацией гликомодифицированных клеток-хозяев. Уровень фукозилирования антитела может быть задан, например, либо условиями ферментации (например, временем ферментации), либо комбинацией по меньшей мере двух антител с разным уровнем фукозилирования. Такие афукозилированные антитела и соответствующие способы гликоинженерии описаны в WO 2005/044859, WO 2004/065540, WO 2007/031875, Umana, P, et al., Nature Biotechnol. 17 (1999) 176-180, WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739. Данные гликомодифицированные антитела имеют повышенную ADCC. Другие способы гликоинженерии, дающие афукозилированные антитела согласно изобретению, описаны, например, в Niwa, R., et al., J. Immunol. Methods 306 (2005) 151-160; Shinkawa, Т., et al., J. Biol. Chem. 278 (2003) 3466-3473; WO 03/055993 или US 2005/0249722.
Таким образом, одним аспектом изобретения является применение афукозилированного антитела против CD20 изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), специфично связывающегося с опухолевым антигеном, с количеством фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 для изготовления лекарственного средства для лечения рака в комбинации с ингибитором mTOR. Предпочтительно количество фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
CD20 (также известный как В-лимфоцитарный антиген CD20, В-лимфоцитарный поверхностный антиген В1, Leu-16, Bp35, BM5 и LF5; последовательности охарактеризованы записью Р11836 в базе данных SwissProt) представляет собой гидрофобный трансмембранный белок с молекулярной массой приблизительно 35 кДа, локализованный на пре-В и зрелых В-лимфоцитах (Valentine, M.A., et al., J. Biol. Chem. 264 (1989) 11282-11287; Tedder, T.F., et al., Proc. Natl. Acad. Sci. U.S.A. 85 (1988) 208-212; Stamenkovic, I., et al., J. Exp. Med. 167 (1988) 1975-1980; Einfeld, DA, et al., EMBO J. 7 (1988) 711-717; Tedder, T.F., et al., J. Immunol. 142 (1989) 2560-2568). Соответствующим человеческим геном является пронизывающий мембрану 4-доменный член 1 подсемейства А, также известный как MS4A1. Этот ген кодирует члена семейства генов пронизывающих мембрану (белков) 4А. Члены этого образующегося семейства белков отличаются общими структурными характеристиками и аналогичными границами сплайсинга интронов/экзонов, и демонстрируют уникальные картины экспрессии среди гематопоэтических клеток и нелимфоидных тканей. Данный ген кодирует В-лимфоцитарную поверхностную молекулу, которая играет роль в развитии и дифференцировке В-клеток в плазматические клетки. Этот член семейства локализован в 11q12, среди кластера членов семейства. Альтернативный сплайсинг данного гена приводит к двум вариантам транскриптов, которые кодируют тот же самый белок.
Термины "CD20" и "антиген CD20" используются здесь взаимозаменимо и включают любые варианты, изоформы и гомологи вида человеческого CD20, которые экспрессируются клетками в природе или экспрессируются на клетках, трансфицированных геном CD20. Связывание антитела по изобретению с антигеном CD20 опосредует умерщвление клеток, экспрессирующих CD20 (например, опухолевых клеток) путем инактивации CD20. Умерщвление клеток, экспрессирующих CD20, может происходить посредством одного или более чем одного из следующих механизмов: индукция клеточной смерти/апоптоза, ADCC или CDC.
Синонимы CD20, как известно в данной области, включают В-лимфоцитарный антиген CD20, В-лимфоцитарный поверхностный антиген В1, Leu-16, Вр35, BM5HLF5.
Термин «антитело против CD20» согласно изобретению представляет собой антитело, которое специфично связывается с антигеном CD20. В зависимости от свойств связывания и биологических активностей антител против CD20 в отношении антигена CD20, можно различать два типа антител против CD20 (антитела против CD20 типа I и типа II) согласно Cragg, M.S., et al., Blood 103 (2004) 2738-2743 и Cragg, M.S., et al., Blood 101 (2003) 1045-1052, смотрите Таблицу 2.
| Таблица 2: | |
| свойства антител против CD20 типа I и типа II | |
| антитела против CD20 типа I | антитела против CD20 типа II |
| Эпитоп CD20 типа I | Эпитоп CD20 типа II |
| Локализуют CD20 в липидных рафтах | Не локализуют CD20 в липидных рафтах |
| Увеличивают CDC (в случае изотипа IgG1) | Снижают CDC (в случае изотипа IgG1) |
| ADCC активность (в случае изотипа IgG1) | ADCC активность (в случае изотипа IgG1) |
| Полная способность к связыванию | Пониженная способность к связыванию |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Индукция апоптоза при поперечном связывании | Сильная индукция смерти клеток без поперечного связывания |
Примеры антител против CD20 типа II включают, например, гуманизированное антитело, IgG1 B-Ly1 (химерное гуманизированное антитело IgG1, как раскрыто в WO 2005/044859), IgG1 11B8 (как раскрыто в WO 2004/035607) и IgG1 АТ80. Типично антитела против CD20 типа II изотипа IgG1 показывают характерные свойства CDC. Антитела против CD20 типа II имеют пониженную CDC (в случае изотипа IgG1) по сравнению с антителами типа I изотипа IgG1.
Примеры антител против CD20 типа I включают, например, ритуксимаб, IgG3 HI47 (ЕСАСС, гибридома), IgG1 2С6 (как раскрыто в WO 2005/103081), IgG1 2F2 (как раскрыто в WO 2004/035607 и WO 2005/103081) и IgG1 2Н7 (как раскрыто в WO 2004/056312).
Афукозилированные антитела против CD20 согласно изобретению предпочтительно представляют собой антитело против CD20 типа II, более предпочтительно афукозилированное гуманизированное антитело B-Ly1.
Афукозилированные антитела против CD20 согласно изобретению имеют повышенную клеточную цитотоксичность, зависимую от антител (ADCC).
Под «афукозилированным антителом против CD20 с повышенной клеточной цитотоксичностью, зависимой от антител (ADCC)» подразумевается афукозилированное антитело против CD20 в том виде, как здесь определен данный термин, имеющее повышенную ADCC, как определено любым подходящим способом, известным обычным специалистам в данной области. Общепринятыми анализами ADCC in vitro являются следующие:
1) анализ с применением клеток-мишеней, для которых известно, что они экспрессируют антиген-мишень, распознаваевый антигенсвязывающей областью антитела;
2) анализ с применением, в качестве эффекторных клеток, человеческих одноядерных клеток периферической крови (РВМС), выделенных из крови здорового донора, выбранного случайным образом;
3) анализ, проводящийся согласно следующему протоколу:
i) РВМС выделяют с использованием стандартных методик центрифугирования в градиенте плотности и суспендируют в концентрации 5×106 клеток/мл в среде для культуры клеток RPMI;
ii) клетки-мишени выращивают стандартными способами выращивания культуры тканей, собирают в фазе экспоненциального роста с жизнеспособностью, превышающей 90%, промывают в среде для культуры клеток RPMI, метят 100 микрокюри 51Cr, дважды промывают средой для культуры клеток и ресуспендируют в среде для культуры клеток в концентрации 105 клеток/мл;
iii) 100 микролитров описанной выше конечной суспензии клеток-мишеней переносят в каждую лунку 96-луночного планшет