Твердые формы ингибитора диссоциации транстиретина
Иллюстрации
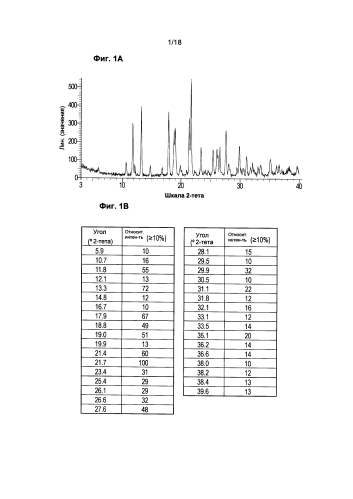
Показать всеИзобретение относится к кристаллической форме меглюмина 6-карбокси-2-(3,5-дихлорфенил)-бензоксазола, где указанная кристаллическая форма имеет порошковую рентгенограмму, содержащую пики при углах дифракции (2θ) 10,7±0,2, 11,8±0,2, 13,3±0,2, 14,8±0,2, 17,9±0,2, 21,4±0,2 и 21,7±0,2. Также изобретение относится к фармацевтической композиции, ингибирующей диссоциацию TTR, содержащей терапевтически эффективное количество указанной кристаллической формы, и способу лечения транстиретин-опосредованного амилоидоза у млекопитающих. Технический результат - кристаллическая форма меглюмина 6-карбокси-2-(3,5-дихлорфенил)-бензоксазола, обладающая улучшенными технологическими свойствами, в частности повышенной стабильностью. 3 н. и 5 з.п. ф-лы, 24 ил., 3 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к твердым формам N-метил-D-глюкаминовой (меглюминовой) соли 6-карбокси-2-(3,5-дихлорфенил)-бензоксазола, и способам их получения. Изобретение также относится к фармацевтическим композициям, содержащим как минимум одну твердую форму, и терапевтическому или профилактическому применению таких твердых форм и композиций.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение относится к твердым формам меглюмина 6-карбокси-2-(3,5-дихлорфенил)-бензоксазола (на который также ссылаются как на "Соединение 1"), пригодным для лечения транстиретин-опосредованного амилоидоза, такого как старческий системный амилоидоз (SSA), семейная амилоидная полинейропатия (FAP) и семейная амилоидная кардиомиопатия (FAC), у млекопитающих. Данное изобретение также относится к композициям, содержащим такие твердые формы, и к способам применения таких композиций в лечении транстиретин-опосредованного амилоидоза у млекопитающих, особенно, людей.
Карбокси-2-фенил-бензоксазолы, такие как 6-карбокси-2-(3,5-дихлорфенил)-бензоксазол, и его соли, описаны в патентах США №7,214,695 и 7,214,696; и в публикации по патентной заявке США №2010/0120919 (все включены в данный документ с помощью ссылок). Способы получения карбокси-2-фенил-бензоксазолов, а также содержащие их фармацевтические композиции, также описаны в указанных документах.
Соединение 1 стабилизирует белок транстиретин (TTR), диссоциация которого влечет за собой TTR амилоидоз (то есть, Соединение 1 предотвращает диссоциацию природного тетрамера TTR на мономеры, что приводит к ингибированию образования TTR амилоидных фибрилл), и которое было разработано для применения в лечении транстиретин-опосредованного амилоидоза.
Твердые формы интересны в отрасли фармацевтики и особенно, для тех, кто разрабатывает приемлемые дозированные формы. Если твердая форма не является постоянной на протяжении клинического испытания или проверки стабильности, то конкретная использованная или исследованная форма не будет сопоставима от одной партии к другой. Также желательно иметь способ получения соединения с выбранной твердой формой в условиях высокой чистоты, при использовании соединения в клинических исследованиях или коммерческих продуктах, в виду того, что примеси могут вызывать нежелательные токсикологические последствия. Определенные твердые формы также могут проявлять улучшенную термодинамическую стабильность, или могут более быстро производиться с высокой чистотой в больших количествах, и таким образом являются более приемлемыми для включения в фармацевтические композиции. Определенные твердые формы могут иметь другие преимущественные физические свойства, такие как отсутствие гигроскопических тенденций, фильтрационная способность, улучшенная растворимость, и улучшенная скорость растворения вследствие различной энергии кристаллической решетки.
Обсуждение предпосылок создания изобретения включено для пояснения контекста данного изобретения. Любой материал, на который ссылались, был опубликован, известен или является частью общего уровня техники в любой стране до даты приоритета любого пункта формулы изобретения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Хотя были идентифицированы различные твердые формы Соединения 1, каждая твердая форма может быть однозначно идентифицирована по нескольким аналитическим параметрам, отдельно или в комбинации, таким как, но не ограничиваясь ими: пики порошковой рентгеновской дифракции, или комбинации двух или более пиков; химические сдвиги ЯМР 13С твердого состояния, или комбинации двух или нескольких химических сдвигов; пики Рамановского сдвига, или комбинации двух или более пиков Рамановского сдвига; и пики инфракрасного сдвига, или комбинации двух или более пиков инфракрасного сдвига, или их комбинации.
В одном аспекте данное изобретение относится к кристаллической форме меглюмина 6-карбокси-2-(3,5-дихлорфенил)-бензоксазола, представленной Соединением 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, содержащую пики при углах дифракции (2θ) 10,7±0,2, 11,8±0,2, и 13,3±0,2. В другом варианте осуществления, кристаллическая форма Соединения 1 имеет порошковую рентгенограмму, содержащую пики при углах дифракции (2θ) 10,7±0,2, 11,8±0,2, 13,3±0,2, и 14,8±0,2. В другом варианте осуществления, кристаллическая форма Соединения 1 имеет порошковую рентгенограмму, содержащую пики при углах дифракции (2θ) 10,7±0,2, 11,8±0,2, 13,3±0,2, 14,8±0,2 и 21,7±0,2.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, содержащую пики при углах дифракции (2θ) по сути такие же, как показано на Фиг. 1А.
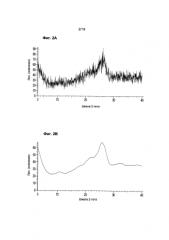
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет положения пиков в порошковой рентгенограмме по сути такие же, как показано на Фиг. 2А. Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет положения пиков в порошковой рентгенограмме по сути такие же, как показано на Фиг. 2В.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет положения пиков в порошковой рентгенограмме по сути такие же, как показано на Фиг. 3А. Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет положения пиков в порошковой рентгенограмме по сути такие же, как показано на Фиг. 3В.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановских пиков (см-1) при 1625±2, 1596±2, и 1548±2. В другом варианте осуществления, кристаллическая форма Соединения 1 имеет Рамановский спектр, содержащий сдвиг Рамановских пиков (см-1) при 1625±2, 1616±2, 1596±2, и 1548±2. В другом варианте осуществления, кристаллическая форма Соединения 1 имеет Рамановский спектр, содержащий сдвиг Рамановских пиков (см-1) при 1625±2, 1616±2, 1596±2, 1574±2 и 1548±2.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановских пиков (см-1) в положениях, по сути таких же, как показано на Фиг. 4А.
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановских пиков (см-1) в положениях, по сути таких же, как показано на Фиг. 5А.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет Рамановский спектр, содержащий сдвиг Рамановских пиков (см-1) в положениях, по сути таких же, как показано на Фиг. 6А.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет инфракрасный спектр, содержащий сдвиг инфракрасных пиков (см-1) при 1581±2, 1273±2, 1010±2, 906±2 и 873±2.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет инфракрасный спектр, содержащий сдвиг инфракрасных пиков (см-1) по сути такой же, как показано на Фиг. 7А.
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет инфракрасный спектр, содержащий сдвиг инфракрасных пиков (см-1) при 1547±2, 1264±2, 936±2, 861±2, и 632±2.
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет инфракрасный спектр, содержащий сдвиг инфракрасных пиков (см-1) по сути такой же, как показано на Фиг. 8А.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет инфракрасный спектр, содержащий сдвиг инфракрасных пиков (см-1) при 1547±2, 1262±2, 935±2, 862±2 и 802±2.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет инфракрасный спектр, содержащий сдвиг инфракрасных пиков (см-1) по сути такой же, как показано на Фиг. 9А.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет спектр ЯМР твердого состояния, включающий 13С химические сдвиги (млн.ч.) при 112,6±0,2, 133,9±0,2, и 171,5±0,2.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет спектр ЯМР твердого состояния, включающий 13С химические сдвиги в положениях по сути таких же, как показано на Фиг. 10А.
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет спектр ЯМР твердого состояния, включающий 13С химические сдвиги (млн.ч.) при 118,5±0,5, 136,3±0,5, и 159,9±0,5.
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная жидкая кристаллическая форма имеет спектр ЯМР твердого состояния, включающий 13С химические сдвиги в положениях по сути таких же, как показано на Фиг. 11А.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет спектр ЯМР твердого состояния, включающий 13С химические сдвиги (млн.ч.) при 135,4±0,5, 143,4±0,5, и 161,0±0,5.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная аморфная форма имеет спектр ЯМР твердого состояния, включающий 13С химические сдвиги в положениях по сути таких же, как показано на Фиг. 12А.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановского пика (см-1) при 1625 см ± 2; и спектр ЯМР твердого состояния, содержащий 13С химический сдвиг (млн.ч.) при 133,9±0,2.
Другой аспект данного изобретения относится к кристаллической форме Соединения 1, где указанная кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановского пика (см-1) при 1625 см ± 2; и спектр ЯМР твердого состояния, содержащий 13С химический сдвиг (млн.ч.) при 171,5±0,2.
Другой аспект данного изобретения относится к жидкой кристаллической форме Соединения 1, где указанная кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановского пика (см-1) при 1573 см ± 2; и спектр ЯМР твердого состояния, содержащий 13С химический сдвиг (млн.ч.) при 136,3±0,2.
Другой аспект данного изобретения относится к аморфной форме Соединения 1, где указанная кристаллическая форма имеет Рамановский спектр, содержащий сдвиг Рамановского пика (см-1) при 1573 см ± 2; и спектр ЯМР твердого состояния, содержащий 13С химический сдвиг (млн.ч.) при 143,4±0,2.
В определенных вариантах осуществления, данное изобретение относится к любой из вышеуказанных кристаллических форм Соединения 1, где указанная форма является негигроскопичной и безводной.
В определенных вариантах осуществления, данное изобретение относится к любой из вышеуказанных кристаллических форм Соединения 1, где указанная форма содержит множество мелких кристаллитов Соединения 1.
В определенных вариантах осуществления, данное изобретение относится к любой из вышеуказанных кристаллических форм Соединения 1, где указанная форма содержит множество кристаллов игольной формы Соединения 1.
В следующем аспекте, данное изобретение предполагает, что любая из твердых форм Соединения 1, описанных в данном документе, может существовать в присутствие любой другой твердой формы или их смесей. Соответственно, в одном варианте осуществления, данное изобретение относится к кристаллической форме, жидкой кристаллической форме или аморфной форме Соединения 1, как описано в данном документе, где указанная кристаллическая, жидкая кристаллическая или аморфная форма присутствуют в твердой форме, которая содержит менее 95 мас.%, менее 90 мас.%, менее 80 мас.%, менее 70 мас.%, менее 60 мас.%, менее 50 мас.%, менее 40 мас.%, менее 30 мас.%, менее 20 мас.%, менее 10 мас.%, менее 5 мас.%, менее 3 мас.%, или менее 1 мас.% любой другой физической формы Соединения 1. Например, в одном варианте осуществления твердая форма Соединения 1, содержащая кристаллическую форму Соединения 1, характеризуется любой одной из вышеописанных порошковых рентгенограмм, Рамановских спектров, инфракрасных спектров и/или ЯМР спектров, где указанная твердая форма содержит менее 95 мас.%, менее 90 мас.%, менее 80 мас.%, менее 70 мас.%, менее 60 мас.%, менее 50 мас.%, менее 40 мас.%, менее 30 мас.%, менее 20 мас.%, менее 10 мас.%, менее 5 мас.%, менее 3 мас.%, или менее 1 мас.% любой другой физической формы Соединения 1.
В определенных вариантах осуществления, данное изобретение относится к любой из вышеописанных форм Соединения 1, где указанная форма является по сути чистой (то есть, по сути чистой кристаллической формой, по сути чистой жидкой кристаллической формой, или по сути чистой аморфной формой).
Следующий аспект данного изобретения относится к фармацевтической композиции, содержащей кристаллическую, жидкую кристаллическую или аморфную форму Соединения 1, как описано в данном документе. В следующем аспекте, изобретение относится к оральной дозированной форме, содержащей кристаллическую, жидкую кристаллическую или аморфную форму Соединения 1, или фармацевтические композиции, описанные в данном документе. Например, в одном варианте осуществления оральная дозированная форма представлена таблеткой, пилюлей или капсулой. Например, в одном варианте осуществления, оральная дозированная форма представлена таблеткой или капсулой.
В одном варианте осуществления изобретение относится к таблетке, содержащей любую из твердых форм Соединения 1, или фармацевтические композиции, описанные в данном документе. Например, в одном варианте осуществления таблетка содержит от приблизительно 1 до приблизительно 10 мг кристаллической формы Соединения 1. Также, например, таблетка содержит от приблизительно 1 до приблизительно 5 мг кристаллической формы Соединения 1. Также, например, таблетка содержит приблизительно 1 мг кристаллической формы Соединения 1. Также, например, таблетка содержит приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг или приблизительно 5 мг кристаллической формы Соединения 1.
В одном варианте осуществления изобретение относится к мягкой желатиновой капсуле, содержащей любую из твердых форм Соединения 1, или фармацевтические композиции, описанные в данном документе. Например, в одном варианте осуществления, мягкая желатиновая капсула содержит от приблизительно 1 до приблизительно 10 мг кристаллической формы Соединения 1. Также, например, мягкая желатиновая капсула содержит от приблизительно 1 до приблизительно 5 мг кристаллической формы Соединения 1. Также, например, мягкая желатиновая капсула содержит приблизительно 1 мг кристаллической формы Соединения 1. Также, например, мягкая желатиновая капсула содержит приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг или приблизительно 5 мг кристаллической формы Соединения 1.
Следующий аспект данного изобретения относится к способу получения Соединения 1 в кристаллической форме, указанный способ включает нагревание 6-карбокси-2-(3,5-дихлорфенил)-бензоксазола и добавление раствора N-метил-D-глюкамина в воду каплями. Например, в одном варианте осуществления, указанное нагревание осуществляют в присутствии соответствующего растворителя. В одном варианте осуществления, растворитель содержит 2-пропанол и воду.
Следующий аспект данного изобретения относится к способу получения Соединения 1 в жидкой кристаллической форме, указанный способ включает растворение кристаллической формы Соединения 1 в воде, замораживание полученного раствора и лиофилизировали полученный замороженный раствор.
Следующий аспект данного изобретения относится к способу получения Соединения 1 в аморфной форме, указанный способ включает нагревание кристаллической формы Соединения 1 в контейнере до его расплавления, и потом помещение контейнера в жидкий азот. Например, в одном варианте осуществления, указанный контейнер является алюминиевым поддоном, и указанное нагревание осуществляют на горячей плитке при 200°С.
Следующий аспект данного изобретения относится к способу лечения транстиретин-опосредованного амилоидоза, такого как старческий системный амилоидоз (SSA), семейная амилоидная полинейропатия (FAP) и семейная амилоидная кардиомиопатия (FAC), у млекопитающих, где способ включает введение млекопитающему терапевтически эффективного количества любой твердой формы Соединения 1 или любой фармацевтической композиции, описанной в данном документе. В определенных вариантах осуществления, введенная твердая форма является кристаллической формой. В определенных вариантах осуществления, введенная твердая форма является жидкой кристаллической формой. В определенных вариантах осуществления, введенная твердая форма является аморфной формой.
КОРОТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 показывает (а) диаграмму XRPD кристаллической формы Соединения 1, полученную на дифрактометре Bruker D8, и (b) соответствующий перечень пиков.
Фигура 2 показывает (а) диаграмму XRPD жидкой кристаллической формы Соединения 1, полученную на дифрактометре Bruker D8, и (b) показывает ее обработанную версию.
Фигура 3 показывает (а) диаграмму XRPD аморфной формы Соединения 1, полученную на дифрактометре Bruker D8, и (b) показывает ее обработанную версию.
Фигура 4 показывает (а) Рамановский спектр кристаллической формы Соединения 1, полученный на спектрометре Nicolet NXR FT-Raman, оснащенном лазером 1064 нм Nd:YVO4 и германиевым детектором с жидкостным охлаждением, и (b) соответствующий перечень пиков.
Фигура 5 показывает (а) Рамановский спектр жидкой кристаллической формы Соединения 1, полученный на спектрометре Nicolet NXR FT-Raman, оснащенном лазером 1064 нм Nd:YVO4 и германиевым детектором с жидкостным охлаждением, и (b) соответствующий перечень пиков.
Фигура 6 показывает (а) Рамановский спектр аморфной формы Соединения 1 полученный на спектрометре Nicolet NXR FT-Raman, оснащенном лазером 1064 нм Nd:YVO4 и германиевым детектором с жидкостным охлаждением, и (b) соответствующий перечень пиков.
Фигура 7 показывает (а) инфракрасный спектр кристаллической формы Соединения 1, полученный на спектрометре Nicolet 6700 FTIR, оснащенном KBr светоделителем и детектором d-TGS KBR, и (b) соответствующий перечень пиков.
Фигура 8 показывает (а) инфракрасный спектр жидкой кристаллической формы Соединения 1, полученный на спектрометре Nicolet 6700 FTIR, оснащенном KBr светоделителем и детектором d-TGS KBR, и (b) соответствующий перечень пиков.
Фигура 9 показывает (а) инфракрасный спектр аморфной формы Соединения 1, полученный на спектрометре Nicolet 6700 FTIR, оснащенном KBr светоделителем идетектором d-TGS KBR, и (b) соответствующий перечень пиков.
Фигура 10 показывает (а) спектр ЯМР 13С твердого состояния кристаллической формы Соединения 1, полученный на Bruker-Biospin 4 мм CPMAS пробе, расположенной в спектрометре Bruker-Biospin Avance III 500 МГц ЯМР с широким просветом, и (b) соответствующий перечень пиков. Химические сдвиги сравнивают с внешним стандартом твердой фазы адамантана при 29,5 млн.ч.
Фигура 11 показывает (а) спектр ЯМР 13С твердого состояния жидкой кристаллической формы Соединения 1 полученный на Bruker-Biospin 4 мм CPMAS пробе, расположенной в спектрометре Bruker-Biospin Avance III 500 МГц ЯМР с широким просветом, и (b) соответствующий перечень пиков. Химические сдвиги сравнивают с внешним стандартом твердой фазы адамантана при 29,5 млн.ч.
Фигура 12 показывает (а) спектр ЯМР 13С твердого состояния аморфной формы Соединения 1 полученный на Bruker-Biospin 4 мм CPMAS пробе, расположенной в спектрометре Bruker-Biospin Avance III 500 МГц ЯМР с широким просветом, и (b) соответствующий перечень пиков. Химические сдвиги сравнивают с внешним стандартом твердой фазы адамантана при 29,5 млн.ч.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Выяснилось, что Соединение 1 может существовать в кристаллической форме, двумерной жидкой кристаллической форме или аморфной форме. Эти формы могут использоваться как лекарственная форма для лечения транстиретин-опосредованного амилоидоза. Каждая форма может иметь преимущества над другими в отношении свойств, таких как биодоступность, стабильность и технологичность. В одном аспекте изобретения, выявили кристаллическую форму Соединения 1, которая является более приемлемой для приготовления и транспортировки нефасованных лекарственных средств, чем жидкая кристаллическая или аморфная формы. Способ получения кристаллической формы Соединения 1 высокой чистоты описан в данном документе. Другой целью данного изобретения является обеспечение способом получения каждой твердой формы Соединения 1, по сути не содержащей другие твердые формы Соединения 1. Так же целью данного изобретения является обеспечение фармацевтическими композициями, содержащими Соединение 1 в различных твердых формах как указывалось выше, и способами лечения транстиретин-опосредованного амилоидоза путем введения таких фармацевтических композиций.
Определение терминов
Термин "лечение", как использовано в данном документе, пока не указано обратное, означает реверсирование, облегчение, ингибирование прогрессирования, или предупреждение расстройства или состояния к которому относится данный термин, или одного или нескольких симптомов такого расстройства или состояния.
Как указано в данном документе, транстиретин или TTR означает 55 кДа гомотетрамер, характеризующийся 2,2,2 симметрией, имеющий два идентичных воронкообразных сайтов связывания на поверхности раздела димер-димер, где тиреоидный гормон (Т4) может связываться в плазме крови и CSF. TTR обычно связывается с менее чем 1 эквивалентом, связывающего голо-ретинол белка. TTR означает белок, состоящий из 127 остатков, который превращается в тетрамер при физиологических условиях. TTR играет роль третичного транспортера тироксина в сыворотке и первичного носителя в цереброспинальной жидкости. TTR также транспортирует ретинол посредством ассоциации с ретинол-связывающим протеином. ТТН образует амилоид при низкой рН.
Как указано в данном документе, "меглюмин" может быть представлен следующей химической структурой:
Как указано в данном документе, "6-карбокси-2-(3,5-дихлорфенил)-бензоксазол" может быть представлен следующей химической структурой:
Как указано в данном документе, термин "по сути чистый", со ссылкой на определенную кристаллическую, жидкую кристаллическую или аморфную форму, означает что кристаллическая или аморфная форма содержит менее 10 мас.%, предпочтительно менее 5 мас.%, предпочтительно менее 3 мас.%, предпочтительно менее 1 мас.% любой другой физической формы соединения.
Как указано в данном документе, термин "по сути такой же", со ссылкой на положения пиков рентгенограммы, означает, что принимаются во внимание обычное положение пика и вариабельность интенсивности. Например, специалист в отрасли понимает, что положения пиков (2θ) будут иметь некоторую вариабельность, обычно где-то 0,1-0,2 градуса, а так же на аппарате используемом для измерения дифракции. Также, специалист в отрасли понимает, что относительная интенсивность пика покажет вариабельность свойственную аппарату, а так же вариабельность вследствие уровня кристалличности, преимущественной ориентации, подготовленной поверхности образца, и других факторов, известных специалистам в отрасли, и должны восприниматься только как качественные характеристики. Аналогично, как использовано в данном документе, термин "по сути одинаковый", со ссылкой на спектр ЯМР твердого тела и Рамановский спектр, также включает вариабельности, связанные с аналитическими техниками, известными специалисту в отрасли. Например, 13С химические сдвиги в ЯМР твердого состояния обычно имеют вариабельность до 0,2 млн.ч для четко различимых пиков, и даже больше для широких линий, в то время как Рамановский и инфракрасный сдвиги обычно имеют вариабельность приблизительно 2 см-1.
Термин "полиморф" относится к различным кристаллическим формам одного и того же Соединения и включает, но не ограничивается другими молекулярными формами в твердом состоянии, включая гидраты (например, связанная вода, присутствующая в кристаллической структуре) и сольваты (например, связанные растворители, не являющиеся водой) одного и того же соединения.
Термин "жидкий кристалл" относится к твердой субстанции, упорядоченной в двух измерениях. В некоторых случаях, аморфные твердые вещества могут характеризоваться известными техниками, включая: порошковая рентгеноструктурная кристаллография (XRPD), спектроскопия ядерно-магнитного резонанса твердого состояния (тсЯМР), дифференциальная сканирующая калориметрия (DSC), или некоторые комбинации этих техник. Как проиллюстрировано ниже, жидкие кристаллические твердые вещества дают размытые XRPD диаграммы, обычно состоящие из одного или двух широких пиков (например, пики с шириной основания приблизительно 5° 2θ или больше).
Термин "аморфный" относится к любому твердому веществу, не упорядоченному в трех измерениях. В некоторых случаях, аморфные твердые вещества могут характеризоваться известными техниками, включая: порошковая рентгеноструктурная кристаллография (XRPD), ядерно-магнитный резонанс твердого состояния (тсЯМР) спектроскопия, дифференциальная сканирующая калориметрия (DSC), иои некоторые комбинации этих техник. Как показано ниже, аморфные твердые вещества дают размытые XRPD диаграммы, обычно состоящие из одного или двух широких пиков (например, например, пики с шириной основания приблизительно 5° 2θ или больше).
Термин "кристаллический" относится к любому твердому веществу, упорядоченному в трех измерениях, которое в отличие от аморфного твердого вещества, дает четкую XRPD диаграмму с четко выделяющимися пиками.
Термин "сольват" описывает молекулярный комплекс, содержащий лекарственное средство и стехиометрическое или нестехиометрическое количество одной или нескольких молекул растворителя (например, этанол). Когда растворитель плотно связан с лекарственным средством, то полученный комплекс будет иметь четко выраженную стехиометрию, независимую от влажности. Когда, однако, растворитель слабо связан, как в каналах, образованных сольватами, и гигроскопичных соединениях, содержание растворителя будет зависеть от условий влажности и сушки. В таких случаях, комплекс зачастую является нестехиометрическим.
Термин "гидрат" описывает сольват, содержащий лекарственное средство и стехиометрическое или нестехиометрическое количество воды.
Термин "порошковая рентгенограмма" или "диаграмма PXRD" относится к экспериментальной дифрактограмме или полученным с ее помощью параметрам. Порошковые рентгенограммы характеризуются положением пиков (абсцисса) и интенсивностью пиков (ордината).
Термин "значение 2 тета" или "2θ" относится к положению пика в градусах полученного на экспериментальном оборудовании рентгеновской дифракции, и является принятой единицей по абсциссе в дифрактограммах. Экспериментальное оборудование требует, чтобы при дифракции отображения, когда входящий луч образует угол тета (θ) с определенной кристаллографической плоскостью, отраженный луч записывался при угле 2 тета (2θ). Нужно понимать, что ссылка на конкретные значения 2θ для конкретной твердой формы означает значения 2θ (в градусах) измеренные, используя условия рентгеновской дифракции, как описано в данном документе. Например, как описано в данном документе, CuKα1 (длина волны 1,54056 Å) использовали как источник излучения.
Термин "фармацевтическая композиция" относится к композиции, содержащей одну или несколько твердых форм Соединения 1, описанных в данном документе, и другие химические компоненты, такие как физиологически/фармацевтически приемлемые носители, растворители, среды и/или наполнители. Целью фармацевтической композиции является облегчение введения Соединения в организм, такой как человеческий или другого млекопитающего.
Термин "фармацевтически приемлемый" "носитель", "растворитель", "среда" или "наполнитель" относится к материалу (или материалам) которые могут быть включены вместе с определенным фармацевтическим агентом для образования фармацевтической композиции, и может быть твердым или жидким. Примеры твердых носителей включат: лактоза, сахароза, тальк, желатин, агар, пектин, акация, стеарат магния, стеариновая кислота и т.д. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, вода и т.д. Аналогично, носитель или растворитель могут включать материал с временной отсрочкой или высвобождением во времени, известный в отрасли, такой как глицерилмоностеарат или глицерилдистеарат, как по отдельности, так и с воском, этилцеллюлоза, гидроксипропилметилцеллюлоза, метилметакрилат и т.д.
Твердые формы Соединения 1
Твердые формы Соединения 1 могут характеризоваться одной или несколькими следующими характеристиками: порошковая рентгенограмма (например, пики рентгенограммы под различным углом дифракции (2θ)), диаграмма спектров ядерно-магнитного резонанса твердого состояния (ЯМР), диаграмма Рамановских спектров, диаграмма инфракрасных спектров, растворимость в воде, стабильность к действию света согласно Международной Конференции по Гармонизации (ICH) касательно условий высокой интенсивности света, и физическая и химическая стабильность при хранении. Например, кристаллическая форма, упорядоченная в двух измерениях жидкая кристаллическая форма и аморфная форма (описанная ниже) Соединения 1 были охарактеризованы положениями и относительной интенсивностью пиков в их порошковых рентгенограммах.
Порошковые рентгенограммы твердых форм Соединения 1 получали, используя дифрактометр Bruker D8, оснащенный источником излучения Си, фиксированными щелями (дивергенция = 1,0 мм, анти-рассеяние = 0,6 мм, и прием = 0,6 мм) и сцинтилляционным счетчиком. Данные собирали в тета-тета гониометре при Cu длине волны Кα1=1,54056 Å от 3,0 до 40,0 градусов 2-тета, используя размер шага размером 0,040 градусов и время шага 2,0 сек. Напряжение и силу тока рентгеновской трубки устанавливали на уровне 40 кВ и 40 мА, соответственно. Образцы подготавливали установкой на никелевый диск (Gasser & Sons, Inc. Commack, NY) и вращали на протяжении сбора данных. Данные собирали и анализировали, используя программное обеспечение Bruker DIFFRAC Plus (версия 2,6). Файлы с данными PXRD (.raw) не обрабатывали до исследования пиков. Обычно, значение предела чувствительности на уровне 1 и значение ширины на уровне 0,3 использовали для получения предварительного определения пиков. Выводы автоматического определения проверяли визуально для обеспечения достоверности и ручной корректировки, в случае необходимости. Кроме того, в случае необходимости, пики вручную определяли внутри спектра.
Для осуществления измерений рентгеновской дифракции на устройстве Bragg-Brentano, таком как система Bruker, использованная для измерений, представленных в данном документе, образец обычно помещали в держатель, имеющий полость. Порошок образца прессовали предметным стеклом или эквивалентным образом, для обеспечения беспорядочной поверхности и соответствующей высоты образца. Держатель образца потом помещали в инструмент. Падающий рентгеновский луч направляли на образец, сначала под маленьким углом относительно плоскости держателя, и потом продвигали через дугу, постоянно увеличивая угол между падающим лучом и плоскостью держателя. Различия измерений, связанные с таким порошковым рентгеновским анализом, являются результатом различных факторов, включая: (а) ошибки при приготовлении образца (например, высота образца); (b) ошибки прибора (например, ошибки плоскости образца); (с) ошибки калибровки; (d) ошибки оператора (включая ошибки, при определении расположения пиков); и (е) природа материала (например, ошибки предпочтительной ориентации и прозрачности). Ошибки калибровки и высоты образца часто приводят к сдвигу всех пиков в одном направлении. Небольшая разница в высоте образцов, при использовании держателя образцов, приводит к значительному смещению положений пиков PXRD. Систематические исследования показали, что используя Shimadzu XRD-6000 в стандартной конфигурации Bragg-Brentano, разница в высоте образцов в 1 мм приводит к сдвигу пиков на 1 градус (2θ (Chen et al., J Pharmaceutical and Biomedical Analysis 26:63 (2001)). Эти сдвиги можно идентифицировать на рентгеновской дифракторамме и могут быть удалены корректировкой сдвигов (применяя систематический фактор корректировки ко всем значениям положений пиков) или перекалибровкой инструмента. Как было указано выше, возможно выявлять ошибки измерений разных приборов, используя систематический фактор корректировки для приведения положений пиков в соответствие. В целом, этот фактор корректировки приводит измеренные положения пиков на устройстве Bruker в соответствие с ожидаемыми положениями пиков, и может находиться в диапазоне 0-0,2 градуса (2θ).
Специалист в отрасли понимает, что положения пиков (2θ) будут показывать некоторую внутреннюю вариабельность прибора, обычно на уровне 0,1-0,2 градуса (2θ). Соответственно, при предоставлении положений пиков (2θ), специалист в отрасли понимает, что такие цифры включают внутреннюю вариабельность прибора. Также, когда кристаллические формы данного изобретения описаны, как такие, которые имеют по сути такие же положения пиков как на рентгенограмме, что и показаны на нижеприведенной фигуре, термин "по сути такие же" также включает внутреннюю вариабельность прибора в положениях пиков дифракции. Также, специалист в отрасли понимает, что относительная интенсивность пиков будет показывать внутреннюю вариабельность прибора, а так же вариабельность вследствие степени кристалличности, предпочтительной ориентации, подготовленной поверхности образца, и других факторов известных специалистам, и должны восприниматься только как качественные показатели.
Твердые формы данного изобретения также могут быть охарактеризованы Рамановской спектроскопией. Рамановские спектры получали, используя аппаратуру Nicolet NXR FT-Raman, присоединенную к столу для ПФ-ИС (преобразование Фурье-инфракрасная спектроскопия). Спектрометр оснащен 1064 нм Nd:YVO4 лазером и германиевым детектором с жидкостным охлаждением. Перед сбором данных, осуществляли проверку работы прибора и калибровки, используя полистирол. Образцы анализировали в стеклянных пробирках для ЯМР, которые вращали на протяжении получения спектров. Спектры получали, используя лазер мощностью 0,5 W и 400 накопленных сканов. Диапазон сканирования составлял 3700-50 см-1. Спектры записывали, используя разрешение 2 см-1, и аподизацию по Хаппу-Гензелю. Пики идентифицировали вручную, используя программное обеспечение Thermo Nicolet Omnic 7.4. Положения пиков были отобраны по максимумам пиков. Значения относительной интенсивности классифицировали как сильную (S), среднюю (М) и слабую (W), используя следующие критерии: сильная (1,00-0,50); средняя (0,49-0,10) и слабая (0,09 и меньше).
Твердые формы данного изобретения также могут быть охарактеризованы, используя (ИК) инфракрасную спектроскопию. ИК-спектр получали, используя спектрометр Nicolet 6700 FTIR, оснащенный KBr светоделителем и детектором d-TGS KBr. Вспомогательное оборудование S peca с Golden Gate Mk II single reflection diamond ATR использовали для отбора проб. Продувку азотом соединяли с ИК-столиком, а также вспомогательным оборудованием. Упорный стержень Golden Gate ATR (метод нарушенного полного внутреннего отражения) находился в верхнем положении, когда собирали фоновый воздух. Образцы с порошком были прессованы вплотную к алмазному окну с помощью упорного стержня Golden Gate. Приблизительно 50 кН м крутящего момента прикладывали к образцу, когда упор полностью прижимался к образцу. Спектр получали с разрешением 2 см-1 с 256 накопленными сканами. Диапазон сбора составлял 4000-525 см-1. Использовали аподизацию по Хаппу-Гензелю. Дополнительной подготовки образц