Композиция для лечения заболеваний кожи, включающая гидролизованные белки и олигосахариды
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой композицию, включающую, по меньшей мере, один N-ацетиллактозамин, выбранный из группы, включающей лакто-N-тетраозу и лакто-N-неотетраозу, по меньшей мере, один сиалилированный олигосахарид и, по меньшей мере, один фукозилированный олигосахарид и гидролизат, включающий частично и/или сильно гидролизованные белки, у которых предпочтительно от 10% до 100% и предпочтительнее от 15% до 95%, популяции белков/пептидов имеют молекулярную массу менее 1000 дальтон, для применения при предупреждении и/или лечении атопического дерматита и экземы. Изобретение обеспечивает расширение арсенала средств, применяемых при предупреждении и/или лечении атопического дерматита и экземы. 2 н. и 15 з.п. ф-лы, 1 пр., 4 ил., 1 табл.
Реферат
Данное изобретение относится к композиции для предупреждения и/или лечения состояний кожи и заболеваний кожи, в частности атопического дерматита, а также для оздоровления кожи.
Предпосылки создания изобретения
Атопический дерматит является хроническим, вызывающим зуд состоянием кожи, которое является обычным у детей, но может иметь место в любом возрасте. Он также известен как экзема или атопическая экзема. Существует прочная связь между пищевой аллергией и атопическим дерматитом в возрастной группе детей младшего возраста, и у детей с атопическим дерматитом нередко подозревают пищевые аллергии.
Атопический дерматит обычно имеет место у людей, имеющих склонность к аллергии. Это означает, что у них может развиваться любое или все три тесно связанных состояния: атопический дерматит, астма и поллиноз (аллергический ринит).
Феномен атопического дерматита проявляется следующим образом. Участки чувствительной кожи покрываются сыпью в ответ на некоторые факторы. Такие факторы варьируют от человека к человеку. В случае младенцев и детей младшего возраста перечень обычно ожидаемых факторов включает коровье молоко и другие возможные ингредиенты детских смесей, такие как пшеница или соя. Атопический дерматит может стать порочным кругом. Что-то раздражает кожу ребенка, делая ее красной и воспаленной. Она зудит, ребенок ее расчесывает, и кожа становится еще более воспаленной. Наружный защитный слой кожи утрачивается, и пораженный участок становится даже более чувствительным к раздражителям и легко сохнет. Ребенок продолжает подвергаться воздействию того, что вызывало такие эпизоды в первую очередь, чем бы оно не являлось. Сыпь развивается далее, и цикл "увековечивает" сам себя.
Не существует одной единственной причины атопического дерматита, которая была бы известна. Он, вероятно, отражает более одного состояния. Существует множество теорий, касающихся лежащих в основе механизмов. Сегодняшний подход исследует роль мутаций гена филаггрина, дефектов в клетках кожи (кератиноцитах), иммунной системы, микробов на поверхности кожи (бактерий, вирусов и дрожжей) и многих других факторов.
Все состояния кожи и заболевания кожи могут поразить население в целом или группу людей с риском аллергии или группу людей, страдающих аллергией (следовательно, больных).
Такие состояния кожи и заболевания кожи, и в частности атопический дерматит, имеют особое значение в случае младенцев, новорожденных или детей младшего возраста, так как они имеют чувствительную кожу, которая претерпевает интенсивный рост и фазы мультипликации, что делает ее еще более чувствительной к заболеваниям кожи. Возрастает количество детей, у которых отсутствуют случаи аллергии в их семье, но которые становятся аллергичными.
Гипоаллергенные пищевые продукты являются типом питания, которое вряд ли вызовет аллергические реакции. Гипоаллергенные пищевые продукты разработаны, в частности, для детских смесей, поскольку становится все более вероятным, что у младенцев и детей младшего возраста будет развиваться аллергия в первые месяцы/годы их жизни.
Человеческое грудное молоко представляет собой бесспорный золотой стандарт в плане детского питания. Детские смеси, которые служат в качестве замены или дополнения к человеческому грудному молоку, должны удовлетворять требованиям к питанию для детей, иметь приемлемый вкус и быть гипоаллергенными и вызывающими иммунологическую толерантность (т.е. способными вызывать оральную толерантность), когда предназначены для детей с риском аллергии. Индукция оральной толерантности к коровьему молоку описана в ЕР 087697. Известно, что аллергия к коровьему молоку и детским смесям, содержащим коровье молоко, имеет место из-за того, что белки коровьего молока отличаются от белков материнского молока и могут представлять аллергены для людей. Основными узнаваемыми аллергенами коровьего молока являются альфа-лактальбумин (aLA), бета-лактоглобулин (bLG) и бычий сывороточный альбумин (BSA). Белок молочной коровьей сыворотки и/или казеин часто используют в качестве источника молочного белка в детских смесях. Для того чтобы уменьшить аллергенность, белки коровьего молока гидролизуют ферментами и таким образом уменьшают до пептидов. Современные гипоаллергенные композиции, составленные из таких гидролизатов коровьего молока, способствующих предупреждению аллергии, также включают другие питательные вещества, такие как животные жиры, растительные масла, крахмал, мальтодекстрин, лактозу и сахарозу. Такие белковые гидролизаты также могут быть включены в молочные напитки для взрослых или пищевые добавки. Гипоаллергенные детские смеси имеют такой недостаток, что их стоимость значительно выше, чем стоимость обычных смесей с коровьим молоком.
Однако все еще существует потребность в гипоаллергенных детских смесях для предупреждения и/или лечения у младенцев и даже детей младшего возраста заболеваний кожи, которые могут у них развиваться, среди которых и атопический дерматит.
Олигосахариды человеческого молока (НМО) все вместе являются третьей самой большой твердой составляющей человеческого молока после лактозы и жира. НМО обычно состоят из лактозы на восстанавливающем конце и углеводной основы, которая часто содержит фукозу или салициловую кислоту на невосстанавливающем конце. Существует приблизительно сто олигосахаридов молока, которые выделены и охарактеризованы, однако они представляют только совсем небольшую часть от общего числа, которое все еще предстоит охарактеризовать.
В прошлом детские смеси для различных целей разрабатывали с использованием ингредиентов НМО, таких как фукозилированные олигосахариды, лакто-N-тетраоза, лакто-N-неотетраоза, или сиалилированные олигосахариды.
В ЕР 0975235 B1, Abbott Laboratories, описывается синтетическая питательная композиция, включающая один или несколько олигосахаридов человеческого молока, при этом НМО в композиции выбирают из группы из восьми НМО (3-фукозиллактоза, лакто-N-фукопентаоза III, лакто-N-фукопентаоза II, дифукозиллактоза, 2′-фукозиллактоза, лакто-N-фукопентаоза I, лакто-N-неотетраоза и лакто-N-фукопентаоза V), при этом указанная композиция предназначается для случаев нормальных здоровых младенцев, детей, взрослых или индивидуумов, имеющих особые потребности, такие как потребности, которые сопровождают некоторые патологические состояния. В данном европейском патенте устанавливается, что, вообще говоря, олигосахариды защищают детей от вирусных и бактериальных инфекций дыхательных путей, желудочно-кишечного и мочеполового трактов. Отсутствуют упоминания, касающиеся атопического дерматита и, в более общем смысле, предупреждения и/или лечения заболеваний кожи.
Из вышеописанного можно понять, что существует потребность в эффективной питательной композиции для предупреждения вторичного атопического дерматита или оздоровления кожи, в частности, у младенцев и детей младшего возраста, и которую можно вводить удобно и безопасно.
Существует потребность в улучшении состояний кожи или при заболеваниях кожи, таких как атопический дерматит, путем вмешательства, основанного не на лекарственных средствах, которое будет совместимо со слабыми индивидуумами, такими как младенцы или малыши.
Существует потребность в длительном эффекте по уменьшению частоты, встречаемости, тяжести и/или длительности таких состояний кожи и заболеваний кожи. Более того, существует потребность в действии, которое становится измеримым "в дальнейшей жизни", в частности, через несколько лет после вмешательства.
Существует потребность во вмешательстве в питание младенцев, малышей и детей с риском развития аллергии или нет, которое вызывает уменьшение аллергических проявлений, в частности, на коже.
Существует потребность в таком вмешательстве, которое поддерживает или вызывает улучшение здоровья кожи.
Сущность изобретения
Авторы настоящего изобретения неожиданно обнаружили, что введение смеси специфических олигосахаридов человека вместе со специфическими гидролизованными белками особенно эффективно для применения при предупреждении и/или лечении состояний кожи и заболеваний кожи, и в частности, при предупреждении и/или лечении атонического дерматита и оздоровления кожи.
Соответственно, настоящее изобретение относится к композиции для применения при предупреждении и/или лечении состояний кожи и заболеваний кожи, причем указанная питательная композиция включает, по меньшей мере, один N-ацетиллактозамин, по меньшей мере, один сиалилированный олигосахарид и, по меньшей мере, один фукозилированный олигосахарид и гидролизат, включающий частично и/или сильно гидролизованные белки.
Композиция предпочтительно представляет собой синтетическую питательную композицию. Композиция включает три различных типа использования в качестве синтетической питательной композиции. В первом случае индивидуумы, и в частности, младенцы, являются здоровыми, без риска аллергии, поскольку аллергический анамнез в семье не имеется. Во втором случае индивидуумы, и в частности, младенцы, являются здоровыми, но с риском аллергии, поскольку аллергический анамнез в семье имеется. В третьем случае индивидуумы, и в частности, младенцы, являются аллергическими и, следовательно, больными. Второй и третий случаи являются предпочтительными мишенями согласно изобретению, причем третий случай является даже более предпочтительной мишенью.
Подробное описание изобретения
Используемые в данном описании следующие далее термины имеют значения, указанные далее.
Термин "младенец" относится к ребенку в возрасте 12 месяцев. Термин "ребенок младшего возраста" относится к ребенку в возрасте от одного года до трех лет.
Термин "детская смесь" обозначает продукт питания, предназначенный для частного применения в питании младенцев в период первых шести месяцев жизни и сам по себе удовлетворяющий требованиям к питанию такой категории детей (статья 1.2 директивы Европейской комиссии 91/321/ЕЕС от 14 мая 1991 по детским смесям и последующим смесям).
Термин "последующая смесь" обозначает продукт питания, предназначенный для применения в питании младенцев старше четырех месяцев и составляющий основной жидкий элемент в постепенно расширяющемся пищевом рационе такой категории детей.
Термин "начальная детская смесь" обозначает продукт питания, предназначенный для частного применения в питании младенцев в первые четыре месяца жизни.
Термин "продукт детского питания" обозначает продукт питания, предназначенный для частного применения в питании детей в первые годы жизни.
Термин "детская злаковая композиция" обозначает продукт питания, предназначенный для частного применения в питании детей в первые годы жизни.
Термин "молоко, способствующее росту" обозначает напиток на молочной основе, адаптированный для специфических потребностей в питании детей младшего возраста.
Термин "период отнятия от груди" обозначает период, во время которого в пищевом рационе младенца материнское молоко заменяется другим продуктом.
Термин "заболевание кожи" обозначает атопический дерматит и другие родственные проблемы кожи. Экзема представляет собой атопический дерматит.
Термин "предупреждение и/или лечение заболеваний кожи" обозначает предупреждение и снижение частоты и/или появления, и/или тяжести, и/или длительности заболеваний кожи, т.е. атопического дерматита и других родственных проблем кожи, в частности атопического дерматита. Появление относится количеству случаев любого заболевания кожи. Частота относится к количеству случаев одного и того же заболевания кожи. Такое предупреждение охватывает снижение частоты и/или тяжести указанных заболеваний кожи в дальнейшей жизни. Термин "в дальнейшей жизни" охватывает действие после окончания вмешательства. Такое действие ″в дальнейшей жизни″ может составлять предпочтительно 2-4 недели, 2-12 месяцев или годы (например, 2, 5, 10 лет) после окончания указанного вмешательства.
Термин "состояния кожи" обозначает состояния, когда кожа раздражена, загрязнена или воспалена. Состояния кожи могут вызывать симптомы заболеваний кожи, такие как краснота, опухание, жжение и зуд.
Термин "предупреждение и/или лечение состояний кожи" обозначает оздоровление кожи и/или предупреждение обезвоживания кожи и/или усиление гидратации кожи и/или уменьшение сыпи, красноты и/или сухости. Такое предупреждение также охватывает установление фенотипа видимое или скрытое, что сопровождается снижением частоты, появления, тяжести и/или длительности указанного состояния кожи в дальнейшей жизни.
Термин "усиление оральной толерантности к аллергенам" обозначает снижение чувствительности к аллергенам при пероральном приеме.
Термин "питательная композиция" обозначает композицию, которая питает субъекта. Такую питательную композицию обычно принимают перорально или внутривенно, и она обычно включает источник липидов или жира и источник белка.
Термин "синтетическая смесь" обозначает смесь, полученную химическим и/или биологическим способом, которая может быть химически идентична смеси, естественно встречающейся в молоке млекопитающих. Говорят, что композиция синтетическая, когда, по меньшей мере, один из ее компонентов получен химическим и/или биологическим (например, ферментативным) способом.
Термин "гипоаллергенная питательная композиция" обозначает питательную композицию, которая не может вызывать аллергические реакции.
Термин "сиалилированный олигосахарид" обозначает олигосахарид, имеющий остаток сиаловой кислоты.
Термин "фукозилированный олигосахарид" обозначает олигосахарид, имеющий остаток фукозы.
Термин "пребиотик" обозначает плохо усваиваемые углеводы, которые благоприятно влияют на реципиента путем селективной стимуляции роста и/или активности полезных бактерий в кишечнике человека, таких как бифидобактерии (Gibson G.R., Roberfi-oid M.B., Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J. Nutr., 1995, 125: 1401-12).
Термин "пробиотик" обозначает препараты микробных клеток или компоненты микробных клеток с благоприятным действием на здоровье или благополучие реципиента (Salminen S., Ouwehand A., Benno Y. et al. "Probiotics: how should they be defined". Trends Food Sci. Technol., 1999: 10, 107-10).
"Аллергия" представляет собой аллергию, которая обнаруживается врачом и которую можно лечить периодически или более надежно. Ее также можно квалифицировать как "явную аллергию".
Все проценты являются массовыми, если не указано иное.
Композиция по изобретению является обычно гипоаллергенной.
Указанная композиция содержит, по меньшей мере, один N-ацетиллактозамин. Иными словами, она содержит N-ацетиллактозамин и/или олигосахарид, содержащий N-ацетиллактозамин. Подходящие олигосахариды, содержащие N-ацетиллактозамин, включают лакто-N-тетраозу (LNT) и лакто-N-неотетраозу (LNnT).
Таким образом, согласно изобретению N-ацетиллактозамин предпочтительно выбирают из группы, включающей лакто-N-тетраозу (LNT) и лакто-N-неотетраозу (LNnT).
LNT и LNnT можно синтезировать химически путем ферментативного переноса сахаридных звеньев от донорных групп к акцепторным группам с использованием гликозилтрансфераз, как описано, например, в патенте США №5288637 и WO 96/10086. С другой стороны LNT и LNnT можно получить химической конверсией кетогексоз (например, фруктозы), или свободных или связанных с олигосахаридом (например, лактулозой), в N-ацетилгексозамин или N-ацетилгексозаминсодержащий олигосахарид, как описано в Wrodnigg, T.M., Stutz, А.Е. (1999), Angew. Chem. Int. Ed., 38: 827-828. N-Ацетиллактозамин, полученный таким путем, затем переносят к лактозе как акцепторной группе.
Предпочтительно композиция по изобретению содержит от 0,1 до 3 г N-ацетиллактозаминлактоз(ы) на 100 г композиции в расчете на сухую массу.
Согласно изобретению сиалилированный олигосахарид выбирают из группы, включающей 3′-сиалиллактозу и 6′-сиалиллактозу. Предпочтительно в указанной композиции присутствуют как 3′-сиалиллактоза, так и 6′-сиалиллактоза, причем соотношение между 3′-сиалиллактозой и 6′-сиалиллактозой лежит предпочтительно в интервале от 5:1 до 1:2.
Формы сиалиллактозы 3′- и 6′- можно выделить хроматографической или фильтрационной технологией из природного источника, такого как молоко животных. С другой стороны, их можно получить биотехнологическим способом с использованием специфических сиалилтрансфераз или сиалидаз, нейраминидаз, основанной на ферментах ферментативной технологией (рекомбинантные или природные ферменты) или химическим синтезом или микробной ферментативной технологией. В последнем случае микробы могут или экспрессировать свои природные ферменты и субстраты или могут быть сконструированы для продуцирования соответствующих субстратов и ферментов. Можно использовать отдельные микробные культуры или смешанные культуры. Образование сиалилолигосахарида может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP), поступательно от DP=1. С другой стороны, сиалиллактозы можно получить химическим синтезом из лактозы и свободной N′-ацетилнейраминовой кислоты (сиаловой кислоты). Сиалиллактозы также доступны коммерчески, например, от Kyowa Hakko Kogyo, Япония.
Предпочтительно композиция по изобретению содержит от 0,05 до 2 г, предпочтительнее от 0,1 до 2 г, сиалилированного(ых) олигосахарида(ов) на 100 г композиции в расчете на сухую массу.
Фукозилированный олигосахарид можно выбрать из группы, включающей 2′-фукозиллактозу, 3-фукозиллактозу, дифукозиллактозу, лакто-N-фукопентаозы (иначе говоря, лакто-N-фукопентаозу I, лакто-N-фукопентаозу II, лакто-N-фукопентаозу III и лакто-N-фукопентаозу V), лакто-N-дифукогексаозу I, фукозиллакто-N-гексаозу, дифукозиллакто-N-гексаозу I и дифукозиллакто-N-гексаозу II. Особенно предпочтительным фукозилированным олигосахаридом является 2′-фукозиллактоза (2FL).
Фукозилированный олигосахарид можно выделить хроматографией или фильтрационной технологией из природного источника, такого как молоко животных. С другой стороны, его можно получить биотехнологическим способом с использованием специфических фукозилтрансфераз и/или фукозидазы или через использование ферментативной технологии на основе ферментов (рекомбинантных или природных ферментов) или микробной ферментативной технологии. В последнем случае микробы могут или экспрессировать свои природные ферменты и субстраты или могут быть созданы инженерией для продуцирования соответствующих субстратов и ферментов. Можно использовать отдельные микробные культуры и/или смешанные культуры. Образование фукозилированного олигосахарида может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP), поступательно от DP=1. С другой стороны, фукозилированные олигосахариды можно получить химическим синтезом из лактозы и свободной фукозы. Фукозилированные олигосахариды также доступны, например, от Kyowa Hakko Kogyo, Япония.
Предпочтительно композиция по изобретению содержит от 0,1 до 3 г фукозилированного(ых) олигосахарида(ов) на 100 г композиции в расчете на сухую массу.
В предпочтительном воплощении композиция по изобретению включает от 0,05 до 3 г общего количества N-ацетилированного(ых) лактозамина(ов), сиалилированного(ых) олигосахарида(ов) и фукозилированного(ых) олигосахарида(ов) на 100 г композиции.
Весьма желательно предоставить частично и/или сильно гидролизованные белки, в частности, для младенцев, как полагают, с риском развития аллергии на коровье молоко. Процесс гидролиза для получения частично и/или сильно гидролизованных белков в рамках гидролизата по изобретению можно осуществить любым желательным способом, который известен в технике.
Гидролизат по изобретению обычно получают из частично гидролизованных белков или сильно гидролизованных белков. Но гидролизат по изобретению также может включать смесь частично гидролизованных белков и сильно гидролизованных белков.
Гидролизованные белки можно охарактеризовать как "частично гидролизованные" или "сильно гидролизованные" в зависимости от степени, до которой осуществляют реакцию гидролиза. В настоящее время не существует стандартного/клинического определения сильно гидролизованных белков согласно Методическим рекомендациям ВОЗ (Всемирная организация здравоохранения) касательно аллергии на белок коровьего молока (СМА), но существует соглашение, что согласно ВОЗ для таких гидролизованных смесей подтверждена их пригодность, и они широко используются в качестве источника белка для детей, страдающих от СМА. В настоящем изобретении частично гидролизованные белки являются белками, в которых 60-70% совокупности белков/пептидов имеет молекулярную массу менее 1000 дальтон, в то время как сильно гидролизованные белки являются белками, в которых, по меньшей мере, 95% совокупности белков/пептидов имеет молекулярную массу менее 1000 дальтон. В настоящее время такие определения используются в промышленности. Частично гидролизованные белки обычно рассматриваются как гипоаллергенные (НА), в то время как сильно гидролизованные белки обычно рассматриваются как неаллергенные.
Гидролизат по изобретению включает гидролизованные белки, в которых предпочтительно от 10% до 100%, предпочтительнее от 15% до 95% популяции белков/пептидов имеют молекулярную массу менее 1000 дальтон.
Гидролизат по изобретению может иметь степень гидролиза, которая характеризуется NPN/TN %. Отношение небелкового азота к общему азоту широко используется в качестве меры растворимых пептидов, образовавшихся при ферментативном гидролизе. NPN/TN % обозначает небелковый азот, деленный на общий азот Х 100. NPN/TN % можно определить так, как подробно описано в AdIer-Nissen J-, 1979, J. Agric. Food Chem., 27 (6), 1256-1262. Вообще, сильно гидролизованные белки характеризуются как имеющие NPN/TN % свыше 95%, в то время как частично гидролизованные белки характеризуются как имеющие NPN/TN % в интервале 75-85%. В предпочтительном воплощении гидролизованные белки по изобретению имеют NPN/TN % в интервале 70-90%, предпочтительно 75-85%. Последние из упомянутых гидролизованные белки являются "частично" гидролизованными белками. Такие гидролизованные белки также можно охарактеризовать тем, что 60-70% популяции белков/пептидов имеет молекулярную массу менее 1000 дальтон.
Согласно изобретению степень гидролиза гидролизованных белков находится в интервале от 50 до 100, предпочтительно от 65 до 99 NPN/TN %.
В другом предпочтительном воплощении, где желательны "сильно" гидролизованные белки, гидролизат по изобретению имеет NPN/TN % в интервале далее 95%. Гидролизат также можно охарактеризовать тем, что, по меньшей мере, 95% популяции белков/пептидов имеет молекулярную массу менее 1000 дальтон.
Степень гидролиза также можно измерить с использованием такого реагента, как тринитробензолсульфоновая кислота (TNBS), которая взаимодействует со свободным лизином. Отношение TNBS, прореагировавшего с азотом % аминогруппы (лизина) N/TN гидролизованных белков по изобретению, обычно находится в интервале 8-15%, предпочтительно 9-14%.
Композиция по изобретению также может включать, по меньшей мере, один пробиотический бактериальный штамм, причем указанный пробиотический бактериальный штамм предпочтительно представляет собой Bifidobacteria и/или Lactobacilli.
Подходящие пробиотические бактериальные штаммы включают Lactobacillus rhamnosus ATCC 53103, доступный от Valio Oy, Финляндия, под товарным знаком LGG, Lactobacillus rhamnosus CGMCC 1.3724, Lactobacillus paracasei CNCM 1-2116, Lactobacillus reuteri, который продает BioGaia A.B под товарным знаком Reuteri, Lactobacillus johnsonii CNCM 1-1225, Streptococcus salivarius DSM 13084, который продает BLIS Technologies Limited, Новая Зеландия, под названием К12, Bifidobacterium lactis CNCM 1-3446 который продвет, inter alia, Christian Hansen company, Дания, под товарным знаком Bb 12, Bifidobacterium longum ATCC BAA-999, который продает Morinaga Milk Industry Co. Ltd., Япония, под товарным знаком ВВ536, Bifidobacterium breve, который продает Danisco под товарным знаком Bb-03, Bifidobacterium breve, который продает Morinaga под товарным знаком M-16V, Bifidobacterium infantis, который продает Procter & Gamble Со. под товарным знаком Bifantis, и Bifidobacterium breve, который продает Institut Rosell (Lallemand) под товарным знаком R0070.
Предпочтительно композиция по изобретению содержит от 10е3 до 10е12 кое пробиотического бактериального штамма, предпочтительнее от 10е7 до 10е12 кое на г композиции в расчете на сухую массу.
Композиция по изобретению также может включать, по меньшей мере, один пребиотик, обычно в количестве от 0,3 до 10% от массы композиции.
Пребиотики обычно плохо усваиваются в том смысле, что они не разрушаются и не абсорбируются в желудке или тонком кишечнике и, таким образом, остаются интактными, когда они проходят в толстую кишку, где они селективно ферментируются полезными бактериями. Примеры пребиотиков включают некоторые олигосахариды, такие как фруктоолигосахариды (FOS) и галактоолигосахариды (GOS). Можно использовать комбинацию пребиотиков, такую как 90% GOS с 10% короткоцепочечных фруктоолигосахаридов, как, например, в продукте, который продает BENEO-Orafti под товарным знаком Orafti® oligofructose (ранее Raftilose®), или 10% инулина, например, в продукте, который продает BENEO-Orafti под товарным знаком Orafti® inulin (ранее Raftiline®). Особенно предпочтительной комбинацией пребиотков является 70% короткоцепочечных фруктоолигосахаридов и 30% инулина, представляющая собой продукт, который продается BENEO-Orafti под товарным знаком "Prebio 1".
Композиция по изобретению предпочтительно является синтетической питательной композицией. В таком случае она может представлять собой начальную детскую смесь, детскую смесь для младенцев, смесь для малышей, злаковую композицию для младенцев, последующую смесь или молоко для роста, и указанная композиция предпочтительно представляет собой начальную детскую смесь.
Согласно предпочтительному воплощению композиция по изобретению предназначена для младенцев и детей младшего возраста с аллергией, в частности, пищевой аллергией. В одном воплощении младенцы и дети младшего возраста имеют состояние явной аллергии или патологию или аллергический статус. В одном воплощении композиции и применения по настоящему изобретению подходят, в частности, для младенцев и детей с риском аллергии, имеющие аллергию в семейной истории болезни или уже испытавшие некоторые эпизоды аллергии (в частности, респираторной аллергии или кожной аллергии). В одном воплощении композиции и применения по изобретению применяют к подросткам или взрослым с риском аллергии или уже испытавшим некоторые эпизоды аллергии (в частности, респираторной аллергии или кожной аллергии).
Композицию по изобретению можно использовать до и/или во время периода отнятия от груди.
Таким образом, в частности, композиция по изобретению является композицией для применения при уменьшении частоты и/или появления и/или тяжести и/или длительности атопического дерматита и/или для применения при оздоровлении кожи.
В воплощении композиция по изобретению является композицией для применения при оздоровлении кожи и/или для предупреждения обезвоживания кожи и/или для применения при усилении гидратации кожи и/или для применения при уменьшении сыпи, красноты и сухости кожи и/или для применения при усилении оральной толерантности к аллергенам.
Композицию по изобретению, в частности, предпочтительна для применения при усилении оральной толерантности к аллергенам.
Изобретение также включает применение композиции, включающей, по меньшей мере, один N-ацетиллактозамин, по меньшей мере, один сиалилированный олигосахарид, по меньшей мере, фукозилированный олигосахарид и гидролизат, включающий частично и/или сильно гидролизованные белки, в виде синтетичсого питательного средства для предупреждения и/или лечения состояний кожи и заболеваний кожи, предпочтительно атонического дерматита, и для усиления оральной толерантности к аллергенам.
Такое применение охватывает случай, когда композиция является добавкой, предпочтительно предоставляемой в форме стандартных доз.
Композиция по изобретению может дополнительно включать другие питательные соединения, которые синергичны с олигосахаридами и гидролизованными белками по изобретению, для предоставления заявляемых благоприятных действий на кожу, такую как при кожных аллергиях или атопическом дерматите. Такие дополнительные соединения могут представлять собой, например, низкоаллергенные белки (т.е. дополнение к гидролизованным или частично гидролизованным белка), ингредиенты с низким содержанием лактозы, олигосахариды с низким содержанием лактозы или гидролизованные сахариды. Постулируется, что синергия ингредиентов может быть установлена по тому факту, что ингредиенты все вместе помогают поддерживать низкий физиологический уровень эффектора, который стоит ниже порога, где действия на кожу (такие как атопический дерматит) начинают проявляться.
Все применения, указанные выше, предназначены, в частности, для младенцев и детей младшего возраста.
Без связи с какой-либо теорией, авторы изобретения полагают, что эффективность комбинации олигосахаридов и частично и/или сильно гидролизованных белков, описанной выше, при предупреждении и/или лечении состояний кожи и заболеваний кожи, в частности атопического дерматита, может являться результатом синергетичной комбинации действий мукозных иммуномодуляторов, запускаемых молочнокислыми бактериями через стимуляцию их специфической смесью олигосахаридов и специфическим гидролизатом. Авторы полагают, что установление мукозаассоциированных микробиот в целом с минимальным воспалительным раздражением достигается за счет селективного промотирования полезных комменсальных молочнокислых бактерий одновременной модуляцией регуляторов воспаления, таких как галектины (например, галектин-1 и галектин-3). Более того, такая композиция может модулировать метаболизм эндогенных микробиот, ведущий к продуцированию короткоцепочечных жирных кислот, которые будут вносить вклад в активацию иммунных клеток, лежащих под слизистой кишки. После запуска мукозной иммунной системы активированные иммунные клетки, иммуноактивные соединения и/или иммунные модуляторы будут циркулировать к дистальным местоположениям, в том числе, тем, где они будут проявлять иммуномодулирующую активность. Все вместе такие механизмы будут вносить вклад в баланс возможных воспалительных состояний кожи, ведущий к улучшению связанных клинических манифестаций, таких как дерматит и экзема. Далее, авторы полагают, что такой организованный иммунитет преобразовывается в меньшую чувствительность кожи к экзогенным раздражителям и более хорошую функцию кожного барьера, что ведет в меньшей сыпи, красноте и сухости кожи, ассоциированным с реактивной кожей.
Олигосахариды и частично и/или сильно гидролизованные белки можно вводить в одной и той же композиции или их можно вводить последовательно.
Если адресатом является возрастная группа 0-12 месяцев жизни, композиция предпочтительно представляет собой питательную композицию, потребляемую в жидкой форме. Это может быть полная питательная смесь, такая как детская смесь, последующая смесь или молоко для роста. С другой стороны, для группы детей младшего возраста композиция может представлять собой напиток с соком или другой охлажденный или сам по себе устойчивый напиток или суп, например, или детское питание или злаковую композицию для детей.
Композиция по изобретению содержит источник белка, предпочтительно в количестве менее 2,0 г на 100 ккал, даже предпочтительнее менее 1,8 г на 100 ккал. Белки, как правило, представляют собой смесь интактных белков и гидролизованных белков, причем гидролизованные белки являются частью гидролизата по изобретению. Полагают, что тип белка критичен для настоящего изобретения, и для уверенности в удовлетворительном росте предпочтительно, когда присутствует количество, превышающее минимальное требуемое содержание незаменимых аминокислот, особенно аргинина. Кроме того, гидролизованная фракция белка, как правило, не содержит лактозу. Предпочтительно гидролизованная фракция белков состоит из гидролизованных белков сыворотки.
Источники белка на основе сыворотки, казеина и их смесей можно использовать так же, как источник белка на основе сои. Что касается белков сыворотки, то источник белка может быть основан на кислой сыворотке или сладкой сыворотке или их смесях.
Добавление частично гидролизованных и/или значительно гидролизованных белков по изобретению представляет интерес, в частности, в случае младенцев, которые, как полагают, находятся в группе риска развития аллергии на коровье молоко. Так как требуются гидролизованные белки, процесс гидролиза можно осуществлять так, как наиболее желательно, способом который известен в данной области техники. Например, гидролизат сывороточных белков можно получить ферментным гидролизом сывороточной фракции в одну или несколько стадий. Если сывороточная фракция, используемая в качестве исходного материала, по существу, не содержит лактозу, обнаружено, что белок значительно меньше страдает от лизиновой блокады во время процесса гидролиза. Это дает возможность снизить лизиновую блокаду с примерно 15 мас.% от всего лизина до менее примерно 10 мас.% лизина, например, примерно 7 мас.% лизина, что существенно улучшает питательное качество источника белка.
Источник белка предпочтительно содержит от примерно 1,5 мас.% до примерно 2,5 мас.% аргинина, предпочтительно в форме свободного основания.
Источник белка может включать другие свободные кислоты, как желательно, такие как свободные аминокислоты L-тирозин и L-гистидин.
Композиция по настоящему изобретению, как правило, содержит источник углеводов. Это предпочтительно, в частности, в случае, когда питательная композиция по изобретению представляет собой детскую смесь. В таком случае можно использовать любой источник углеводов, обычно обнаруживаемый в детских смесях, такой как лактоза, сахароза, мальтодекстрин, крахмал и их смеси, хотя предпочтительным источником углеводов является лактоза.
Композиция по настоящему изобретению, как правило, содержит источник липидов. Это, в частности, уместно, если питательная композиция по изобретению представляет собой детскую смесь. В таком случае можно использовать любой источник липидов или жира, подходящий для использования в детских смесях. Предпочтительные источники жира включают пальмовое олеиновое, высокоолеиновое подсолнечное масло и высокоолеиновое сафлоровое масло. Незаменимые жирные кислоты линолевую и α-линоленовую кислоту также можно добавлять как и небольшие количества масел, содержащих большое количество предварительно образовавшихся арахидоновой кислоты и докозагексаеновой кислоты, такие как рыбий жир или микробные масла. Источник жира предпочтительно имеет отношение жирных кислот n-6 к n-3 от примерно 5:1 до примерно 15:1, например, от примерно 8:1 до примерно 10:1.
Питательная композиция по изобретению также содержит предпочтительно все витамины и минеральные вещества, которые, как предполагают, незаменимы в повседневном пищевом рационе, и в питательно достаточных количествах. Установлены минимальные требования для некоторых витаминов и минеральных веществ. Примеры минеральных веществ, витаминов и других питательных веществ, присутствующих в композиции по изобретению, включают витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин К, витамин С, витамин D, фолиевую кислоту, инозит, ниацин, биотин, пантотеновую кислоту, холин, кальций, фосфор, иод, железо, магний, медь, цинк, марганец, хлор, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минеральные вещества, как правило, добавляют в форме солей. Присутствие и количества специфических минеральных веществ и других витаминов будут изменяться в зависимости′от предполагаемой группы детей.
При необходимости композиция по изобретению может содержать эмульгаторы и стабилизаторы, такие как соя, лецитин, эфиры лимонной кислоты моно- и диглицеридов и подобные вещества.
Композиция по изобретению также может содержать другие вещества, которые оказывают благоприятное действие, такие как лактоферрин, нуклеотиды, нуклеозиды и т.п.
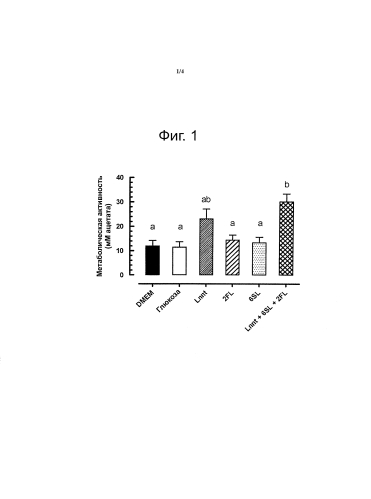
Теперь композиция по изобретению будет описываться с помощью примера.
Смесь можно получить любым подходящим способом, например ее можно получить, смешивая вместе части