Антагонисты неурегулина и применение их в лечении злокачественного новообразования
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способу увеличения периода времени до рецидива опухоли, и может быть использовано в медицине. Получают антагонисты неурегулина, представляющие собой анти-NRG1 антитело, siPHK или shPHK, нацеленные на NRG1, или иммуноадгезин к NRG1 для введения пациенту, ранее получавшему противораковую терапию, в комбинации с терапевтическим средством, выбранным из паклитаксела, цисплатина или их комбинации для отсрочки времени до рецидива опухоли или предотвращения развития резистентности раковых клеток к лечению терапевтическим агентом. Изобретение позволяет увеличить период времени до рецидива опухоли, что повышает выживаемость пациентов. 9 з.п. ф-лы, 8 ил., 1 табл., 8 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет на основании Предварительной заявки США № 61/305878, зарегистрированной 18 Февраля 2010, содержание которой включено в данное описание посредством ссылки в полном ее объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к лечению злокачественного новообразования с помощью антагонистов неурегулина.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В последние годы областью интенсивных исследований были идентификация и свойства раковых стволовых клеток (CSC). Накапливаются доказательства того, что опухоли представляют собой гетерогенную смесь клеток с различными биологическими свойствами. Изолирование отдельной клеточной популяции с уникальной способностью инициировать рост опухоли было описано для многочисленных гематологических злокачественных новообразований и солидных опухолей. Тем не менее, появились противоречия при использовании специфических маркеров клеточной поверхности для проспективной идентификации CSC. Например, в корне отличные данные о фенотипе стволовых клеток были описаны для лейкемии, рака поджелудочной железы, колоректального рака, рака мозга и рака молочной железы (обзор у Brennan and Matsui 2009). Более того, предварительный подсчет частоты CSC значительно отличается между типами опухолей и пациентами. Роль CSC в поддержании роста развившейся опухоли, или в повторной инициации опухоли после химиотерапии, либо в первичной, либо в отдаленной локализации, еще предстоит выяснить.
Для большинства онкологических пациентов, рецидив заболевания после химиотерапии представляет собой основную причину смертности. Соответственно, более глубокие знания о клетках, повторно инициирующих опухоль (TRIC), ответственных за рецидив заболевания, необходимы для более эффективного лечения пациентов, у которых развился рецидив онкологического заболевания после первоначальной реакции на химиотерапевтическое лечение. Это в особенности имеет отношение к немелкоклеточному раку легких (NSCLC), поскольку более чем две трети пациентов с NSCLC не являются кандидатами для хирургической резекции. Большинство пациентов страдают прогрессирующим заболеванием и подвержены химиотерапии, лучевой терапии или комбинации этих двух подходов (принципы и практические приемы при раке легких). Тем не менее, 5-летняя частота выживания при местнораспространенном заболевании составляет 23,7% и при поздней стадии заболевания составляет 3,5%, несмотря на хороший первоначальный ответ на терапию (Horner et al. SEER).
Было продемонстрировано, что дерегулирование сигнального пути EGFR посредством сверхэкспрессии или активирующих мутаций, является частым событием при NSCLC (обзор у Dahabreh et al., 2010). EGFR представляет собой прототипный член семейства HER тирозинкиназ, которое включает в себя EGFR (Her1), Her2, Her3 и Her4. У Her2 отсутствует функциональный лиганд-связывающий домен (Graus-Porta 1997) и у Her3 отсутствует тирозинкиназная активность (Guy 1994), таким образом, эти рецепторы должны действовать как гетеродимеры. Последние данные показывают, что другие члены семейства Her могут также играть определенную роль в NSCLC. Однако их вклад в развитие данного заболевания менее характерен и исследования часто сфокусированы на их взаимоотношениях с активацией EGFR (Kuyama et al. 2008, Hirsch 2009, Zhou 2006, Johnson 2006, Ding 2008).
Неурегулин представляет собой лиганд для рецептора Her3 и Her4 тирозинкиназ. Известны четыре члена семейства неурегулина, NRG1, NRG2, NRG3, и NRG4 (Falls 2003). Транскрипт NRG1 подвергается экстенсивному альтернативному сплайсингу, что в результате приводит к образованию, по меньшей мере, 15 различных изоформ. Все активные изоформы делят EGF-подобный домен, который является необходимым и достаточным для активности (Holmes 1992, Yarden 1991). Показано, что аутокринный сигнальный путь NRG1 регулирует пролиферацию эпителиальных клеток легких (Jinbo 2002), и играет важную роль в развитии легких человека (Patel 2000), и вовлечен в невосприимчивость NSCLC к ингибиторам EGFR (Zhou 2006).
Существует необходимость в обеспечении терапевтическими средствами, эффективными при лечении резистентных злокачественных новообразований у пациентов, у которых развился рецидив злокачественного новообразования.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один аспект данного изобретения предусматривает способ увеличения периода времени до развития рецидива опухоли у онкологического пациента, включающий введение в организм данного пациента эффективного количества антагониста неурегулина. В одном варианте осуществления, данный способ дополнительно включает введение терапевтического средства в организм данного пациента. В одном варианте осуществления данным терапевтическим средством является химиотерапевтическое вещество или антитело. В некоторых вариантах осуществления данное химиотерапевтическое средство представляет собой паклитаксал или цисплатин, или комбинацию паклитаксала и цисплатина.
В некоторых вариантах осуществления данное антитело представляет собой антитело EGFR, HER2, HER3, или HER4. В некоторых вариантах осуществления данным злокачественным новообразованием, которым страдает данный пациент, является немелкоклеточный рак легких, рак молочной железы, рак яичников, рак области головы и шеи, рак шейки матки, рак мочевого пузыря, рак пищевода, рак предстательной железы или колоректальный рак.
В одном варианте осуществления, увеличение периода времени до рецидива опухоли, по меньшей мере, в 1,25 раз больше, чем период времени до рецидива опухоли без применения данного антагониста неурегулина. В одном варианте осуществления, увеличение периода времени до рецидива опухоли, по меньшей мере, в 1,50 раз больше, чем период времени до рецидива опухоли без применения антагониста неурегулина.
В некоторых вариантах осуществления данный антагонист неурегулина представляет собой антитело, малую молекулу, иммуноадгезин или РНК. В одном варианте осуществления, данный антагонист неурегулина представляет собой антагонист NRG1. В одном варианте осуществления данный антагонист NRG представляет собой анти-NRG1 антитело.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
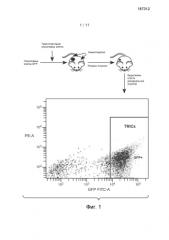
На Фиг. 1 представлено схематическое изображение in vivo модели для исследования клеток, повторно инициирующих опухоль (TRIC).
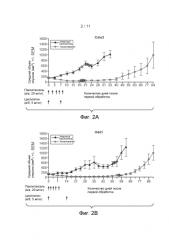
На Фиг. 2A представлена модель ксенотрансплантата Calu3 NSCLC человека на бестимусных голых мышах, где химиотерапия имеет в своем составе пактитаксель и цисплатин. Данные представлены как средний размер опухоли ±SEM, n=12 мышей/группа.
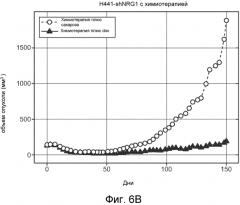
На Фиг. 2B представлена модель ксенотрансплантата H441 NSCLC человека на бестимусных голых мышах, где химиотерапия имеет в своем составе пактитаксель и цисплатин. Данные представлены как средний размер опухоли ±SEM, n=12 мышей/группа.
На Фиг. 2C представлена модель опухоли молочной железы KPL4 человека с ортротропной трансплантацией опухолевых клеток в скопление жировой ткани молочной железы мыши SCID/beiz, где химиотерапия имеет в своем составе паклитаксель. Данные представлены как средний размер опухоли ±SEM, n=12 мышей/группа.
На Фиг. 2D показано лечение с помощью циспатина модели NSCLC у созданной методами генетической инженерии мыши K-rasLSLG12D, CAG-LSL-GFP. Результаты представлены как среднее число GFP-положительных клеток на легкое ±SEM, n=6 мышей/группа.
На Фиг. 3A показано увеличение мРНК NRG1 в TRIC в модели ксенотрансплантата Calu3 продемонстрировано с помощью двух независимых зондов в анализе с использованием микрочипов. Увеличение было подтверждено посредством количественной ПЦР в режиме реального времени (кПЦР) для NRG1a и NRG1b, с использованием РНК, выделенной из несвязанных друг с другом опухолевых образцов.
На Фиг. 3B показано увеличение мРНК NRG1 в TRIC в модели ксенотрансплантата Н441 продемонстрировано с помощью двух независимых зондов в анализе с использованием микрочипов. Это было подтверждено посредством кПЦР для NRG1a и NRG1b, с использованием РНК из тех же опухолевых образов, что и в анализе с использованием микрочипов.
На Фиг. 3C показано увеличение мРНК NRG1в TRIC в модели ксенотрансплантата рака молочной железы KPL4, показанное посредством двух независимых микрочиповых зонда.
На Фиг. 3D показано увеличение мРНК NRG1 в TRIC в модели NSCLC на мышах K-rasLSLG12D, показанное посредством одного микрочипового зонда и подтвержденное с помощью кПЦР.
На Фиг. 4 показано, что увеличение NRG1 является специфичным для резидуальных клеток, о чем свидетельствует анализ кПЦР уровней мРНК NRG1 опухолевых клеток в опухолях разных размеров и в разное время после химиотерапии.
На Фиг. 5A представлен график, демонстрирующий кривые роста опухолей у мышей с прижившимися ксенотрансплантатами опухолей Calu3-shNRG1, получавших инертный наполнитель (сахароза) или dox (2 г/л) в питьевой воде в свободном доступе. Объем опухоли измеряли два раза в неделю на протяжении данного исследования. Результаты представлены как линейная модель со смешанными эффектами (LME), сгенерированная в соответствии с объемом опухоли, изображенной графически как кубические сплайны с самоопределяемыми узлами.
На Фиг. 5B представлен график, демонстрирующий кривые роста опухолей у мышей с прижившимися ксенотрансплантатами опухолей Calu3-shNRG1, получавших химиотерапия+сахароза или химиотерапия+dox. Результаты представлены как модель LME, сгенерированная в соответствии с объемом опухоли, изображенной графически как кубические сплайны с самоопределяемыми узлами.
На Фиг.6A представлен график, демонстрирующий кривые роста опухолей у мышей с прижившимися ксенотрансплантатами опухолей Н441-shNRG1, получавших сахарозу или dox (n=12/группа). Результаты представлены как LME, сгенерированная в соответствии с объемом опухоли, изображенной графически как кубические сплайны с самоопределяемыми узлами.
На Фиг. 6B представлен график, демонстрирующий кривые роста опухолей у мышей с прижившимися ксенотрансплантатами опухолей Н441-shNRG1, получавших химиотерапия+сахароза или химиотерапия+dox (n=12/группа). Результаты представлены как LME, сгенерированная в соответствии с объемом опухоли, изображенной графически как кубические сплайны с самоопределяемыми узлами.
На Фиг. 7A представлен график, демонстрирующий кривые роста опухолей у мышей с прижившимися ксенотрансплантатами опухолей Н1299-shNRG1, получавших сахарозу или dox (n=12/группа). Результаты представлены как LME, сгенерированная в соответствии с объемом опухоли, изображенной графически как кубические сплайны с самоопределяемыми узлами.
На Фиг. 7B представлен график, демонстрирующий кривые роста опухолей у мышей с прижившимися ксенотрансплантатами опухолей Н1299-shNRG1, получавших химиотерапия+сахароза или химиотерапия+dox (n=12/группа). Результаты представлены как LME, сгенерированная в соответствии с объемом опухоли, изображенной графически как кубические сплайны с самоопределяемыми узлами.
На Фиг. 8A представлен график, демонстрирующий средний объем опухоли ±SEM для мышей LSL-K-rasG12D; p53Fl/+, получавших инертный наполнитель+контрольный IgG (n=6), цисплатин+контрольный IgG (n=6), или цисплатин+HER4ECD-Fc (n=8). Амброзия, контрольное антитело IgG2a мыши.
На Фиг. 8B представлен график, демонстрирующий ежедневную кратность изменения опухолевой массы в результате использования лечебной схемы, с 95% доверительными интервалами.
На Фиг. 8C представлен график, демонстрирующий среднее процентное изменение опухолевой массы от исходного уровня ±SEM для мышей LSL-K-rasG12D; p53F1/F1, получавших инертный наполнитель+контрольный IgG (n=10), цисплатин+контрольный IgG (n=11), цисплатин+HER4-ECD (n=8) или инертный наполнитель+HER4-ECD (n=7).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ДАННОГО ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Используемое здесь выражение «акцепторная каркасная область человека» относится к каркасной области, включающей в себя аминокислотную последовательность каркасной области вариабельного домена (VL) легкой цепи, или каркасной области вариабельного домена тяжелой цепи (VH), происходящей из каркасной области иммуноглобулина человека, или консенсусной каркасной области человека, как определено далее. Акцепторная каркасная область человека «происходящая из» каркасной области иммуноглобулина человека, или консенсусной каркасной области человека, может включать в себя ту же самую аминокислотную последовательность, или может содержать в себе изменения аминокислотной последовательности. В некоторых вариантах осуществления число аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых вариантах осуществления данная акцепторная каркасная область VL человека является идентичной по последовательности с последовательностью VL каркасной области иммуноглобулина человека, или последовательностью консенсусной каркасной области человека.
«Аффинность» относится к силе совокупности нековалентных взаимодействий между единственным сайтом связывания молекулы (например, антитело) и его партнером по связыванию (например, антиген). Если не указано иное, используемый здесь термин «аффинность связывания» относится к внутренней аффинности связывания, которая отображает 1:1 взаимодействие между членами пары связи (например, антитело и антиген). Аффинность молекулы Х к ее партнеру Y может быть в целом представлена посредством константы диссоциации (Kd). Аффинность может быть измерена посредством обычных методов, известных в данной области, в том числе тех, которые описаны здесь. Специфические иллюстративные и примерные варианты осуществления для измерения аффинности связывания описаны далее.
Антитело «зрелой аффинности» означает антитело с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (HVR), в сравнении с исходным антителом, которое не имеет таких изменений, такие изменения в результате приводят к повышению аффинности данного антитела к антигену.
Термины «анти-NRG антитело» и «антитело, которое связывается с NRG» относятся к антителу, которое способно связываться с NRG с достаточной аффинностью, так что данное антитело является применимым в качестве диагностического и/или терапевтического агента, нацеленного на NRG. В одном варианте осуществления степень связывания анти-NRG антитела с неродственным, не-NRG белком, составляет менее, чем приблизительно 10% связывания данного антитела с NRG, как измерено, например, посредством радиоиммуннологического анализа (РИА). В некоторых вариантах осуществления антитело, которое связывается с NRG, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-8M или менее, например, от 10-8M до 10-13M, например, от 10-9M до 10-13M). В некоторых вариантах осуществления анти-NRG антитело связывает эпитоп NRG, который является консервативным среди NRG различных биологических видов.
Термин «антитело» используется здесь в широком смысле и охватывает различные антительные структуры, в том числе, но не ограничиваясь этим, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), и фрагменты антител, при условии, что они проявляют необходимую антиген-связывающую активность.
«Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая включает в себя часть интактного антитела, которая связывает антиген, с которым связывается интактное антитело. Примеры фрагментов антитела включают в себя, но не ограничиваются этим, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные антительные молекулы (например, scFv); и мультиспецифические антитела, сформированные из фрагментов антител.
«Антитело, которое связывается с тем же эпитопом», что и референсное антитело, относится к антителу, которое блокирует связывание данного референсного антитела с его антигеном в анализе конкурентного связывания на 50% или более, и наоборот, данное референсное антитело блокирует связывание данного антитела с его антигеном в анализе конкурентного связывания на 50% или более. Здесь приведен пример анализа конкуретного связывания.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из определенного источника или биологических видов, в то время как оставшаяся часть данной тяжелой и/или легкой цепи происходит из другого источника или биологических видов.
Термины «рак» и «раковый» относятся к, или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом/пролиферацией. Примеры рака включают в себя, но не ограничиваются этим, карциному, лимфому (например, Ходжкинская и неходжкинская лимфома), бластому, саркому и лейкемию. Более конкретные примеры таких раков включают в себя плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких, плоскоклеточную карциному легких, рак брюшины, печеночно-клеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, курциному эндометрия или матки, карциному слюнных желез, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатоцеллюлярную карциному, лейкемию и другие лимфопролиферативные заболевания, и различные типы рака области головы и шеи.
«Класс» антитела относится к типу константного домена или константной области, которая находится на его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG, и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1, и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называют α, δ, ε, γ и µ, соответственно.
Используемый здесь термин «цитотоксическое средство» относится к субстанции, которая ингибирует или препятствует клеточной функции и/или вызывает клеточную гибель или деструкцию. Цитотоксические средства включают в себя, но не ограничены этим, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические вещества или лекарственные препараты (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибиторы роста; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, в том числе их фрагменты и/или варианты; и различные противоопухолевые и противораковые средства, раскрытые ниже.
«Эффекторные функции» относятся к тем биологическим активностям, связанным с Fc-областью антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают в себя: C1q связывание и кимплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, рецептора В-клетки); и В-клеточную активацию.
«Эффективное количество» агента, например, фармацевтической композиции, относится к количеству, эффективному, при дозах и в течение необходимых периодов времени, для достижения желаемого терапевтического или профилактического результата.
Термин «Fc-область» используется здесь для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит в себе, по меньшей мере, часть данной константной области. Данный термин включает в себя нативные последовательности Fc-областей и варианты Fc-областей. В одном варианте осуществления Fc-область тяжелой цепи IgG человека простирается от Cys226 или от Pro230, до карбоксильного конца данной тяжелой цепи. Тем не менее, C-концевой лизин (Lys447) данной Fc-области может присутствовать или может отсутствовать. Если не указано иначе, нумерация аминокислотных остатков в Fc-области или константной области, соответствует системе нумерации EU, также называемой индекс EU, как описано у Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
«Каркасный участок» или «FR» относится к остаткам вариабельного домена, кроме остатков гепервариабельного участка (HVR). FR вариабельного домена обычно имеет в своем составе четыре домена FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR в основном представлены в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины «полноразмерное антитело», «интактное антитело» и «цельное антитело» используются здесь взаимозаменяемо и относятся к антителу, имеющему структуру в значительной степени похожую на структуру нативного антитела, или имеющему тяжелые цепи, которые содержат в себе Fc-область, как определено здесь.
Термины «клетка-хозяин», «линия клетки-хозяина» и «культура клетки-хозяина» используются здесь взаимозаменяемо и относятся к клеткам, в которые была встроена экзогенная нуклеиновая кислота, в том числе, к потомству таких клеток. Клетки-хозяева включают в себя «трансформантов» и «трансформированные клетки», которые включают в себя первично трансформированные клетки и потомство, полученное от них, без учета количества переносов. Потомство может не быть полностью идентичным по содержанию нуклеиновой кислоты с родительской клеткой, но может содержать мутации. Здесь учтено мутантное потомство, которое имеет такую же функцию или биологическую активность, по которой был проведен скрининг или отбор исходной трансформированной клетки.
«Антитело человека» представляет собой то, которое обладает аминокислотной последовательностью, которая соответствует таковой антитела, продуцируемого у человека или человеческой клеткой, или получено из источника, не относящегося к человеческому роду, которое использует спектр антител человека, или другим последовательностям, кодирующим антитело человека. Это определение человеческого антитела полностью исключает гуманизированное антитело, содержащее в себе антиген-связывающие остатки, не относящиеся к человеческому роду.
«Консенсусная каркасная область человека» является каркасной областью, которая представляет собой чаще всего встречающиеся аминокислотные остатки в селекции последовательностей каркасной области VL или VH иммуноглобулина человека. Как правило, отбор последовательностей VL или VH иммуноглобулина человека происходит из подгруппы последовательностей вариабельного домена. Обычно, данная подгруппа последовательностей представляет собой подгруппу, как указано у Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном варианте осуществления, для VL, данная подгруппа представляет собой подгруппу каппа I, как представлено у Kabat et al., supra. В одном варианте осуществления, для VH, данная подгруппа представляет собой подгруппу III, как представлено у Kabat et al., supra.
«Гуманизированное» антитело относится к химерному антителу, содержащему в себе аминокислотные остатки из HVR, не относящихся к человеческому роду, и аминокислотные остатки из FR человека. В некоторых вариантах осуществления гуманизированное антитело будет содержать в себе по существу все из, по меньшей мере, одного, и типично двух, вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют таковым нечеловеческого антитела, и все или по существу все FR соответствуют таковым антитела человека. Гуманизированное антитело, необязательно, может содержать в себе, по меньшей мере, часть константной области антитела, происходящей из антитела человека. «Гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергается гуманизации.
Используемый здесь термин «гипервариабельный участок» или «HVR» относится к каждому из участков вариабельного домена антитела, которые имеют гипервариабельные последовательности и/или формируют структурно определенные петли («гипервариабельные петли»). Обычно, нативные четырех-цепочечные антитела содержат в себе шесть HVR; три в VH (H1, H2, H3), и три в VL (L1, L2, L3). HVR, как правило, содержат в себе аминокислотные остатки из гипервариабельных петель и/или из «областей, определяющих комплементарность» (CDR), последние имеют наивысшую вариабельность последовательностей и/или заняты в распознавании антигена. Типичные гипервариабельные петли возникают в аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (H3). (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987)). Типичные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) встречаются в аминокислотных остатках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35B в H1, 50-65 в H2 и 95-102 в H3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). За исключением CDR1 в VH, как правило, CDR содержат в себе аминокислотные остатки, которые формируют данные гипервариабельные петли. CDR также содержат в себе «остатки, определяющие специфичность», или «SDR», которые представляют собой остатки, образующие контакт с антигеном. SDR содержатся в пределах областей в CDR, которые называются укороченные-CDR, или a-CDR. Типичные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2, и a-CDR-H3) встречаются в аминокислотных остатках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35B в H1, 50-58 в H2, и 95-102 в H3. (См. Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008)). Если не указано иначе, остатки HVR и другие остатки в данном вариабельном домене (например, остатки FR) пронумерованы в соответствии с Kabat et al., supra.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или несколькими гетерологичными молекулами, в том числе, но не ограничиваясь этим, с цитотоксическим агентом.
«Индивидуум», или «объект», или «пациент» является млекопитающим. Млекопитающие включают в себя, но не ограничиваются этим, одомашненных животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, человек и не принадлежащие к человеческому роду приматы, такие как обезьяны), кроликов и грызунов (например, мыши и крысы). В некоторых вариантах осуществления данным индивидуумом, объектом или пациентом является человек.
«Изолированное» антитело представляет собой то, которое было отделено от компонентов его естественной среды. В некоторых вариантах осуществления антитело является очищенным до степени более чем 95% или 99% чистоты, как определено, например, электрофоретически (например, SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез), или хроматографически (например, ионобменная или обращенно-фазовая ВЭЖХ). Для обзора методов оценки чистоты антитела, см., например, Flatman et al., J. Chromatogr. B 848: 79-87 (2007).
«Изолированная» нуклеиновая кислота означает молекулу нуклеиновой кислоты, которая была отделена от компонентов ее естественной среды. Изолированная нуклеиновая кислота включает в себя молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат в себе молекулу данной нуклеиновой кислоты, но данная молекула нуклеиновой кислоты представлена экстрахромосомно или в хромосомном положении, которое отличается от ее естественного хромосомного положения.
«Изолированная нуклеиновая кислота, кодирующая анти-NRG антитело» относится к одной или нескольким молекулам нуклеиновой кислоты, кодирующей тяжелую и легкую цепи антитела (или их фрагменты), включая такую молекулу (молекулы) нуклеиновой кислоты в одном векторе или раздельных векторах, и такая молекула (молекулы) нуклеиновой кислоты представлена в одной или нескольких локализациях в клетке-хозяине.
Используемый здесь термин «моноклональное антитело» относится к антителу, получаемому из популяции практически гомогенных антител, т.е. составляющие популяцию отдельные антитела одинаковы, за исключением возможных вариантных антител, например, встречающихся в природе мутаций или возникающих во время производства композиции моноклонального антитела, такие варианты обычно присутствуют в незначительных количествах. В отличие от композиций поликлональных антител, которые обычно включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в композиции моноклонального антитела направлено против единственной детерминанты на антигене. Определитель «моноклональное» указывает на характер этого антитела, как полученного из по существу гомогенной популяции антител, и не должен расцениваться как требование получения этого антитела каким-либо конкретным способом. Например, моноклональные антитела для применения в соответствии с данным изобретением могут быть получены различными способами, включающими в себя, но не ограничиваясь этим, гибридомный метод, методы рекомбинантных ДНК, методы фагового дисплея, и методы, в которых используются трансгенные животные, у которых имеются все или часть локусов иммуноглобулина человека, такие методы и другие иллюстративные методы получения моноклональных антител, описанные здесь.
«Несвязанное антитело» относится к антителу, которое не конъюгировано с гетерологичной молекулой (например, цитотоксичной молекулой) или радиоактивной меткой. Несвязанное антитело может присутствовать в фармацевтической композиции.
«Нативные антитела» относятся к встречающимся в природе молекулам имуноглобулинов с различными структурами. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины приблизительно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными связями. От N- до C-конца, каждая тяжелая цепь имеет вариабельный участок (VH), также называемый вариабельный тяжелый домен или вариабельный домен тяжелой цепи, за которым следуют три константных домена (CH1, CH2, и CH3). Схожим образом, от N- до C-конца, каждая легкая цепь имеет вариабельный участок (VL), также называемый вариабельный легкий домен или вариабельный домен легкой цепи, за которым следует константный легкий домен (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности ее константного домена.
Термин «листовка-вкладыш в упаковке» используется для обозначения инструкций, стандартно входящих в состав коммерческих упаковок лекарственных препаратов, которые содержат в себе информацию о показаниях к применению, применении, дозах, пути введения, комбинированной терапии, противопоказаниях и/или предупреждения, касающиеся применения таких лекарственных препаратов.
«Процент(%) идентичности аминокислотной последовательности» в отношении референсной полипептидной последовательности определен как процент аминокислотных остатков в кандидатной последовательности, которые являются идентичными аминокислотным остаткам в референсной последовательности, после выравнивания данных последовательностей и введения разрывов, при необходимости, для достижения максимального процента идентичности последовательностей, и не учитывая любые консервативные замены как часть данной идентичности последовательности. Выравнивание для определения процента идентичности аминокислотных последовательностей может быть осуществлено различными способами, известными в данной области, например, используя находящееся в открытом доступе компьютерное программное обеспечение, такое как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалист в данной области может определить подходящие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако, для целей данного изобретения, значения % идентичности аминокислотных последовательностей генерируются с помощью компьютерного программного обеспечения для сравнения последовательностей ALIGN-2. Программное обеспечение для сравнения последовательностей ALIGN-2 было разработано Genentech, Inc., и исходная программа была предоставлена с документацией пользователя в Бюро регистрации авторских прав США, Washington D.C., 20559, где была зарегистрирована под № TXU510087 регистрации авторского права США. Программа ALIGN-2 находится в открытом доступе в Genentech, Inc., South San Francisco, California, или может быть скомпилирована из исходной программы. Программа ALIGN-2 должна быть скомпилирована для использования на операционной системе UNIX, в том числе цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены в программе ALIGN-2 и не меняются.
В случаях, когда для сравнения аминокислотных последовательностей используется ALIGN-2, % идентичности аминокислотной последовательности данной аминокислотной последовательности А с, или по отношению к, данной аминокислотной последовательностью В (что можно альтернативно сформулировать как данная аминокислотная последовательность А, которая имеет или содержит в себе некоторый % идентичности аминокислотной последовательности с, или по отношению к данной аминокислотной последовательности В) рассчитывается следующим образом:
100 умножить на дробь X/Y
где X представляет собой число аминокислотных остатков, оцененных как совпадения посредством программы для выравнивания последовательностей ALIGN-2 в этом программном выравнивании А и В, и где Y представляет собой общее число аминокислотных остатков в В. Следует принимать во внимание, что если длина аминокислотной последовательности А отличается от длины аминокислотной последовательности В, то % идентичности аминокислотной последовательности А по отношению к В отличается от % идентичности аминокислотной последовательности В по отношению к А. Если не указано иное, все значения % идентичности аминокислотных последовательностей, используемые здесь, получены как описано в непосредственно предшествующем параграфе с использованием компьютерной программы ALIGN-2.
Термин «фармацевтическая композиция» относится к составу, который находится в такой форме, которая позволяет биологической активности активного ингредиента, содержащегося в ней, быть эффективной, и который не содержит в себе дополнительных компонентов, которые являются недопустимо токсичными для объекта, которому данная композиция будет введена.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который является не токсичным для объекта. Фармацевтически приемлемые носители включают в себя, но не ограничиваются этим, буфер, инертный наполнитель, стабилизирующее вещество или консервант.
Используемый здесь термин «NRG» относится к любому нативному неурегулину (также известен как херегулин), полученному от любого позвоночного животного, включая млекопитающих, таких как приматы (например, человек) и грызунов (например, мыши и крысы), если не указано иное. Данный термин охватывает «полноразмерный», непроцессированный NRG, а также любую форму NRG, полученную в результате процессинга в клетке. Данный термин также охватывает встречающиеся в природе варианты NRG, например, сплайс-варианты или аллельные варианты. Известны четыре формы NRG: NRG1 (Holmes, W.E. et al., Science 256: 1205-1210 (1992)); NRG2 (Caraway, K.L. et al., Nature 387: 512-516 (1997)); NRG3 (Zhang, E. et al., Proc Natl Acad Sci USA 94: 9562-9567)); и NRG4 (Harari, D. et al., Oncogene 18: 2681-2689)). Вследствие альтернативного сплайсинга, существуют две активные изоформы EGF-подобного домена NRG1, который необходим для связывания рецептора, называемые NRG1 альфа (NRG1α) и NRG1 бета (NRGβ). Последовательности иллюстративных NRG1 человека представлены в базе данных Genbank под регистрационным № BK000383 (Falls, D. L., Ex Cell Res, 284: 14-30 (2003) в Патенте США № 5367060.
Используемый здесь термин «лечение» (и его грамматические вариации, такие как «лечить» или «проводить лечение») относится к клиническому вмешательству в попытке изменить естественное течение заболевания у объекта, подвергающегося лечению, и может быть осуществлено либо для профилактики, или в рамках течения клинической патологии. Желательные эффекты лечения включают в себя, но не ограничиваются этим, предотвращение появления или возврата болезни, облегчение симптомов, уменьшение любых прямых или опосредованных патологических последствий болезни, предотвра