Анти-lrp6 антитела
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено выделенное биспецифическое антитело, которое связывается с двумя различными областями белка 6 рецептора липопротеинов низкой плотности (LRP6). Рассмотрен фармацевтический состав для лечения злокачественной опухоли, содержащий биспецифическое антитело по настоящему изобретению; а также применение биспецифического антитела или фармацевтического состава в качестве лекарственного средства для лечения злокачественной опухоли и иммуноконъюгат для лечения злокачественной опухоли, содержащий биспецифическое антитело и цитотоксическое средство. Описана выделенная нуклеиновая кислота, кодирующая биспецифическое антитело по изобретению, и клетка-хозяин, содержащая указанную нуклеиновую кислоту для получения антитела. Биспецифическое антитело по настоящему изобретению способно ингибировать передачу сигнала Wnt изоформ 3, 3a и изоформ 1, 2, 2b, 6, 8a, 9a, 9b и 10b и может найти дальнейшее применение в терапии различных заболеваний, ассоциированных с сигнальным путем Wnt. 7 н. и 10 з.п. ф-лы, 4 табл., 17 ил., 13 пр.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/317137, поданной 24 марта 2010 г. и предварительной патентной заявки США № 61/394836, поданной 20 октября 2010 г, описание которых полностью включено в настоящее описание путем ссылки.
Область техники
Настоящее изобретение относится к анти-LRP6 антителам и способам их применения для лечения раковых заболеваний или нарушений скелета.
Предпосылки создания изобретения
Аналогично путям передачи сигнала от большинства других морфогенов и ростовых факторов, в процессе развития и гомеостаза тканей у млекопитающих многократно запускается передача сигнала от Wnt, в которой задействовано 19 различных лигандов, 10 рецепторов и множество корецепторов, включая LRP5/6, Ror1/2 и Ryk (van Amerongen and Nusse, 2009). Кроме того, различные секретируемые антагонисты, которые связывают либо белки Wnt, такие как SFRP1/2/3/4/5 и WIF1, либо LRP5/6, включая DKK1/2/4 и SOST, модулируют взаимодействие между лигандами и рецепторами. Эти мембранные и внеклеточные белки, а также их многочисленные изоформы, обеспечивают специфичную регуляцию на уровне экспрессии и комбинаторных белковых взаимодействий. Большинство изоформ Wnt, по-видимому, способно связывать корецептор LRP5/6, и активация LRP5/6 определяет каноническую или β-катенин-зависимую передачу сигнала от Wnt. Wnt образует гетеродимеры с LRP5/6 и FZD, опосредуя фосфорилирование внутриклеточного домена LRP5/6 и связывание с Axin (Tamai et al., 2000; Semenov et al., 2001; Tamai et al., 2004). DVL входит в комплекс, напрямую связываясь как с Axin, так и с FZD, и олигомеризация DVL вероятно увеличивает эти белковые комплексы на цитоплазматической стороне мембраны, которые связывают GSK3 и ингибируют обусловленное этой киназой фосфорилирование и дестабилизацию β-катенина (Mi et al., 2006; Bilic et al., 2007; Schwarz-Romond et al., 2007; Cselenyi et al., 2008; Piao et al., 2008; Zeng et al., 2008; Wu et al., 2009).
Уникально большое число изоформ лиганда, имеющих значительные расхождения по первичной последовательности, которые опосредуют каноническую передачу сигнала от Wnt у млекопитающих, составляет контраст с парой высокогомологичных корецепторов. Внеклеточные домены LRP6 и LRP5 состоят в основном из четырех гомологичных областей, называемых Е1-Е4 в направлении от N- к С-концу, каждая из которых содержит β-пропеллер YWTD-типа и EGF-подобный домен (Jeon et al., 2001). Каждый повтор в аналогичном положении в LRP6 и LRP5 является высоко консервативным, в то время как разные повторы в одном белке отличаются в значительно большей степени. Примечательно, что группой Bourhis et al. (2010) было продемонстрировано, что Wnt9b связывается исключительно с областью Е1-Е2 in vitro, в то время как Wnt3a связывается только с фрагментом, содержащим E3-E4, позволяя предположить, что каждый повтор или комбинация двух соседних повторов связывает различные субпопуляции изоформ Wnt. Эта схема может соответствовать разнообразию Wnt-белков и, возможно, также позволяет их специфичную регуляцию с помощью лигандов-антагонистов LRP5/6. У Notch и VEGF-рецепторов, чьи внеклеточные области содержат повторы EGF-подобных и Ig-доменов, соответственно, связывание многочисленных изоформ лиганда локализовано в одной области одного или двух повторов, хотя присутствие других повторов может усиливать связывание. (Rebay et al., 1991; Davis-Smyth et al., 1996; Cunningham et al., 1997).
В случае рецепторных тирозиновых киназ, индуцируемая лигандами димеризация стимулирует киназную активность и сигнальные пути. Несмотря на то, что индуцируемая лигандами гетеродимеризация рецептора и корецептора необходима для канонической передачи сигнала от Wnt, точная роль гомодимеризации LRP5/6 или FZD не определена. Направленная димеризация различных рекомбинантных белков LRP6 может либо активировать, либо ингибировать передачу сигнала от Wnt.
β-катенин-зависимая передача сигнала от Wnt активируется связыванием изоформы Wnt как с рецептором FZD, так и с корецептором LRP5/6, которые затем собираются в мультимерный комплекс на цитоплазматической поверхности мембраны, связывая и инактивируя киназу GSK3. Остается необходимым определить, могут ли и каким образом могут механически различные взаимодействия между изоформами Wnt и рецепторами модулировать этот процесс.
Краткое изложение сущности изобретения
Один аспект изобретения относится к выделенному антителу, которое связывает LRP6, где антитело ингибирует передачу сигнала, индуцированную первой изоформой Wnt, и усиливает передачу сигнала, индуцированную второй изоформой Wnt. В одном варианте осуществления изобретения первая изоформа Wnt выбрана из группы, состоящей из Wnt3 и Wnt3a. В одном варианте осуществления изобретения вторая изоформа Wnt выбрана из группы, состоящей из Wnt 1, 2, 2b, 4, 6, 7a, 7b, 8a, 9a, 9b, 10a и 10b. В другом варианте осуществления изобретения первая изоформа Wnt выбрана из группы, состоящей из Wnt 1, 2, 2b, 6, 8a, 9a, 9b и 10b, и вторая изоформа Wnt выбрана из группы, состоящей из Wnt3 и Wnt3a.
Один аспект изобретения относится к антителу, которое связывает область Е3-E4 белка LRP6. Другой аспект изобретения относится к антителу, которое связывает область Е1-E2 белка LRP6. Еще один аспект относится к антителу, которое связывает две различных области на LRP6, такие как область E1-E2 белка LRP6 и область E3-E4 белка LRP6. В одном аспекте эти антитела ингибируют передачу сигнала от Wnt, индуцированную комбинацией Wnt1 и Wnt3a. В одном аспекте эти антитела ингибируют аутокринную передачу сигнала от Wnt.
Один аспект изобретения относится к способу лечения индивидуума, страдающего раком, включающему введение индивидууму эффективного количества выделенного антитела, которое связывает LRP6 и ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt1 и Wnt3a, и выделенного антитела, которое связывает LRP6 и ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt 1, 2, 2b, 6, 8a, 9a, 9b и 10b.
Другой аспект изобретения относится к способу лечения индивидуума, страдающего раком, который включает введение индивидууму эффективного количества выделенного антитела, которое связывает LRP6 и ингибирует передачу сигнала, индуцированную Wnt3 и Wnt3a, и выделенного антитела, которое связывает LRP6 и ингибирует передачу сигнала, индуцированную Wnt 1, 2, 2b, 6, 8a, 9a, 9b и 10b.
Другой аспект изобретения относится к способу лечения индивидуума, страдающего раком, который включает введение индивидууму эффективного количества выделенного антитела, которое связывает LRP6 и ингибирует передачу сигнала, индуцированную Wnt3 и Wnt3a, и выделенного антитела, которое связывает LRP6 и ингибирует передачу сигнала, индуцированную Wnt 1, 2, 2b, 4, 6, 7a, 7b, 8a, 9a, 9b, 10a и 10b.
Один аспект изобретения относится к способу лечения индивидуума, имеющего нарушение скелета, такое как остеопороз, остеоартрит, переломы костей и поражения костной ткани, включающему введение индивидууму эффективного количества анти-LRP6 антитела, описанного в настоящем описании.
Другой аспект изобретения относится к способу усиления передачи сигнала от Wnt, индуцированной изоформой Wnt, у индивидуума, включающему введение индивидууму эффективного количества анти-LRP6 антитела, описанного в настоящем описании, и изоформы Wnt для усиления передачи сигнала от Wnt, индуцированной изоформой Wnt.
Также изобретение относится к специфичным анти-LRP6 антителам, включая биспецифичные анти-LRP6 антитела. В одном варианте осуществления изобретения выделенное антитело, которое связывает LRP6, включает в себя VH, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 и SEQ ID NO:15. В одном варианте осуществления изобретения антитело дополнительно включает в себя VL, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10 и SEQ ID NO:12. В одном варианте осуществления изобретения выделенное антитело, которое связывает LRP6, включает в себя VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% гомологии с аминокислотной последовательностью SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 и SEQ ID NO:15. В одном варианте осуществления изобретения выделенное антитело, которое связывает LRP6, дополнительно включает в себя VL, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% гомологии с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:10 и SEQ ID NO:12.
В одном варианте осуществления изобретения антителом является выделенное биспецифичное антитело, которое связывает две различные области LRP6, где антитело включает в себя VH, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 и SEQ ID NO:15. В одном варианте осуществления изобретения биспецифичное антитело включает в себя первую VH, содержащую аминокислотную последовательность SEQ ID NO:15, и вторую VH, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:9, SEQ ID NO:11 и SEQ ID NO:13. В одном варианте осуществления изобретения биспецифичное антитело дополнительно включает в себя VL, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10 и SEQ ID NO:12.
В одном варианте осуществления изобретения биспецифичное антитело, которое связывает две различные области LRP6, включает в себя VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% гомологии с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 или SEQ ID NO:15. В одном варианте осуществления изобретения биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первую VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% гомологии с аминокислотной последовательностью SEQ ID NO:15, и вторую VH, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% гомологии с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:9, SEQ ID NO:11 и SEQ ID NO:13. В одном варианте осуществления изобретения биспецифичное антитело дополнительно включает в себя VL, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% гомологии с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:10 и SEQ ID NO:12.
В одном варианте осуществления изобретения выделенное биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первый VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH-HVR, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:17, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:18, и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:19, и включает в себя второй VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH-HVR, выбранные из (d) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:22, (e) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:23, и (f) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:24. В одном варианте осуществления изобретения выделенное биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первый VH-домен, содержащий все три последовательности VH-HVR из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:17, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:18, (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:19, и включает в себя второй VH-домен, содержащий все три последовательности VH-HVR из (d) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:22, (e) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:23, и (f) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:24.
В одном варианте осуществления изобретения выделенное биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первый VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH-HVR, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:17, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:18, (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:21, и включает в себя второй VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH-HVR, выбранные из (d) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:22, (e) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:23, и (f) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:24. В одном варианте осуществления изобретения выделенное биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первый VH-домен, содержащий все три последовательности VH-HVR из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:17, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:18, (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:21, и включает в себя второй VH-домен, содержащий все три последовательности VH-HVR из (d) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:22, (e) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:23, и (f) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:24.
В одном варианте осуществления изобретения выделенное биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первый VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH-HVR, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:20, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:18, (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:19, и включает в себя второй VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH-HVR, выбранные из (d) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:22, (e) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:23, и (f) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:24. В одном варианте осуществления изобретения выделенное биспецифичное антитело, которое связывает две различные области LRP6, включает в себя первый VH-домен, содержащий все три последовательности VH-HVR из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:20, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:18, (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:19, и включает в себя второй VH-домен, содержащий все три последовательности VH-HVR из (d) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:22, (e) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:23, и (f) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:24.
В одном варианте осуществления изобретения биспецифичное антитело по указанным выше вариантам осуществления дополнительно включает в себя по меньшей мере одну, по меньшей мере две или все три последовательности VL-HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:25; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:26; (c) HVR-L3 SEQ ID NO:27.
В одном варианте осуществления изобретения биспецифичное антитело по указанным выше вариантам осуществления дополнительно включает в себя по меньшей мере одну, по меньшей мере две или все три последовательности VL-HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:25; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:26; (c) HVR-L3 SEQ ID NO:28.
Один вариант осуществления изобретения относится к выделенному биспецифичному антителу, которое связывает две различные области LRP6, где антитело включает в себя первую VH, содержащую аминокислотную последовательность SEQ ID NO:15, и вторую VH, выбранную из группы, состоящей из VH, содержащей аминокислотную последовательность SEQ ID NO:9, SEQ ID NO:11 и SEQ ID NO:13. В одном варианте осуществления изобретения это антитело дополнительно включает в себя VL, содержащую аминокислотную последовательность SEQ ID NO:10 или SEQ ID NO:12. В одном варианте осуществления изобретения биспецифичное антитело включает в себя первую VH, содержащую аминокислотную последовательность SEQ ID NO:15, и вторую VH, содержащую аминокислотную последовательность SEQ ID NO:9, и VL, содержащую аминокислотную последовательность SEQ ID NO:10.
В одном варианте осуществления изобретения биспецифичное антитело ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt3 и Wnt3a, и ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt 1, 2, 2b, 6, 8a, 9a, 9b и 10b. В одном варианте осуществления изобретения биспецифичное антитело дополнительно ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt 4, 7a, 7b и 10a. В одном варианте осуществления изобретения биспецифичное антитело ингибирует аутокринную передачу сигнала от Wnt.
Один аспект изобретения относится к биспецифичному антителу, которое ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt3 и Wnt3a, и ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из 1, 2, 2b, 6, 8a, 9a, 9b и 10b. В одном варианте осуществления изобретения биспецифичное антитело дополнительно ингибирует передачу сигнала, индуцированную изоформой Wnt, выбранной из группы, состоящей из Wnt 4, 7a, 7b и 10a.
Один аспект изобретения относится к антителу, которое конкурирует за связывание с LRP6 с любым из анти-LRP6 антител, включая биспецифичные антитела, описанные в настоящем описании.
Другой аспект изобретения относится к антителу, которое связывает такие же два эпитопа, как биспецифичное антитело, описанное в настоящем описании. В одном варианте осуществления изобретения один из двух эпитопов содержит аминокислотные остатки R28, E51, D52, V70, S71, E73, L95, S96, D98, E115, R141 и N185 из LRP6. В одном варианте осуществления изобретения один из двух эпитопов содержит аминокислотные остатки R28, E51, D52, V70, S71, E73, L95, S96, D98, E115, R141, N185, R29, W188, K202, P225, H226, S243 и F266 из LRP6.
Другой аспект изобретения относится к выделенной нуклеиновой кислоте, кодирующей анти-LRP6 антитело, описанное в настоящем описании. Другой аспект относится к клетке-хозяину, содержащей такую нуклеиновую кислоту.
Один аспект изобретения относится к иммуноконъюгату, содержащему анти-LRP6 антитело, описанное в настоящем описании, и цитоплазматический агент. Другой аспект относится к фармацевтическому составу, содержащему анти-LRP6 антитело, описанное в настоящем описании, и фармацевтически приемлемый носитель.
Один аспект изобретения относится к анти-LRP6 антителу, описанному в настоящем описании, для применения в качестве лекарственного препарата. Один аспект относится к анти-LRP6 антителу, описанному в настоящем описании, для использования при лечении ракового заболевания или нарушения скелета. Один аспект относится к анти-LRP6 антителу, описанному в настоящем описании, для применения при ингибировании передачи сигнала, индуцированной первой изоформой Wnt, и усиления передачи сигнала, индуцированной второй изоформой Wnt. Один аспект относится к применению анти-LRP6 антитела, описанного в настоящем описании, при получении лекарственного препарата, пригодного для лечения, например, ракового заболевания или нарушения скелета.
Один аспект изобретения относится к способу лечения индивидуума, страдающего раковым заболеванием, таким как немелкоклеточный рак легких, рак молочных желез, рак поджелудочной железы, рак яичников, рак почек и рак предстательной железы, включающему введение индивидууму эффективного количества анти-LRP6 антитела, описанного в настоящем описании.
Краткое описание фигур
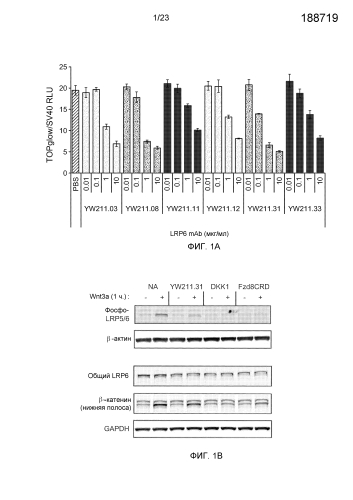
Фиг.1А. На графике показано ингибирование антителами к белку LRP6.E3-E4 активности Wnt-люциферазного репортера, индуцированной 0,1 мг/мл очищенного Wnt3a, в клетках HEK293.
Фиг.1В. Вестерн-блот анализ клеток НЕК293 либо нестимулированных, либо индуцированных Wnt3a, и получавших воздействие указанного антитела к LRP6 или очищенного белка.
Фиг.1С. На графике показано, что антитело YW210.09 усиливает активность Wnt-репортерного гена пропорционально концентрации Wnt3a в клетках HEK293.
Фиг.2А. На графике показано зависимое от концентрации ингибирование и усиление аутокринной передачи сигнала от Wnt в клетках тератокарциномы РА-1, трансфицированных люциферазными репортерами, и к которым были добавлены антитела к LRP6 либо отдельно, либо в комбинации, или белок Fzd8CRD-Fc.
Фиг.2В. На графике показан результат анализа экспрессии с помощью количественной ПЦР Wnt-индуцированных генов SAX1 и GAD1 и Wnt-репрессированного гена, LEFTY2, в клетках PA-1, получавших или не получавших воздействие 0,3 мг/мл белка Wnt3a, и получавших воздействие 10 мг/мл антитела YW211.31, анти-gD моноклонального антитела (отрицательный контроль) или белка Fzd8CRD-Fc (положительный контроль). Данные нормализованы по образцам из клеток без добавления (NA) белка Wnt3a.
Фиг.3. Итоговая таблица, в которой показаны эффекты антител к LRP6 и белка Fzd8CRD-Fc на аутокринную передачу сигнала в клеточных линиях.
Фиг.4А. На графике приведен результат анализа экспрессии с помощью количественной ПЦР мРНК AXIN2 в четырех клеточных линиях, получавших воздействие 25 мкг/мл антитела YW211.31.57 или белка Fzd8CRD-Fc, в присутствии или без (NA) 0,2 мкг/мл белка Wnt3a.
Фиг.4В. На графике изображено, что экспрессия Wnt-индуцируемых генов в клетках NCI-H23 усиливается под действием антитела YW211.31.57 и подавляется антителом YW210.09 (30 мкг/мл). Белок CD4-Fc (30 мкг/мл) служит в качестве отрицательного контроля.
Фиг.4С. На графике изображено, что экспрессия Wnt-индуцируемых генов в клетках M14 усиливается под действием антитела YW211.31.57 и подавляется антителом YW210.09 (30 мкг/мл).
Фиг.4D. На графике показано зависимое от концентрации ингибирование стимулированной Wnt3a передачи сигнала в результате действия антитела YW211.31.57 в клетках Hs578T со стабильно встроенным Wnt-люциферазным репортером.
Фиг.4Е. На графике показано зависимое от концентрации усиление аутокринной передачи сигнала от Wnt антителом YW211.31.57 в клетках Hs578T со стабильно встроенным Wnt-люциферазным репортером.
Фиг.4F. На графике показано, что клетки EKVX, трансфицированные Wnt-люциферазным репортером, демонстрируют усиление аутокринной передачи сигнала от Wnt (NA) и антагонизм в отношении Wnt3a-индуцированной передачи сигнала в результате действия антитела YW211.31.57.
Фиг.4G. На графике показано, что опосредованное антителами усиление аутокринной передачи сигнала от Wnt ингибируется 5 мкг/мл белка Fzd8CRD-Fc.
Фиг.5. Итоговая таблица эффектов 10 мг/мл антител к LRP6 или белка Fzd8CRD-Fc на сигнальный путь, индуцированный трансфекцией конструкций для экспрессии изоформ Wnt в клеточные линии HEK293 или Hs578T со стабильно встроенными Wnt-люциферазными репортерами. Экспрессию Wnt-люциферазного репортера нормализовали на число клеток и дополнительно нормализовали на уровень в клетках, трансфицированных такой же экспрессирующей конструкцией, но к которым не добавляли белки.
Фиг.6. Итоговая таблица эффектов 10 мг/мл антител к LRP6 или белка Fzd8CRD-Fc на передачу сигнала в клеточной лини HEK293 со стабильно встроенными Wnt-люциферазными репортерами. Передачу сигнала индуцировали трансфекцией конструкций для экспрессии химерных белков, состоящих из изоформ Wnt, слитых с изоформами FZD или LRP6. Экспрессию Wnt-люциферазного репортера нормализовали на число клеток и дополнительно нормализовали на уровень в клетках, трансфицированных такой же экспрессирующей конструкцией, но к которым не добавляли белки.
Фиг.7. Итоговая таблица эффектов 10 мг/мл антител к LRP6 или комбинаций антител на передачу сигнала, индуцированную трансфекцией конструкций для экспрессии изоформ Wnt, в клеточных линиях со стабильно встроенными Wnt-люциферазными репортерами. Экспрессию Wnt-люциферазного репортера нормализовали на число клеток и дополнительно нормализовали на уровень в клетках, трансфицированных такой же экспрессирующей конструкцией, но к которым не добавляли белки.
Фиг.8А. На графике показано, что комбинация антител YW211.31.57 и YW210.09 ингибирует передачу сигнала в клетках HEK293 со стабильно встроенным Wnt-люциферазным репортером, которые были трансфицированы для экспрессии либо Wnt3a, Wnt1, либо совместно Wnt3a и Wnt1. Анти-gD антитело и белок Fzd8CRD-Fc показаны в качестве отрицательного и положительного контролей, соответственно, для ингибирования передачи сигнала Wnt.
Фиг.8В. На графике показано, что комбинация антител YW211.31.57 и YW210.09 усиливает аутокринную передачу сигнала от Wnt в клетках Hs578T.
Фиг.8С. На графике показано, что комбинация антител YW211.31.57 и YW210.09 усиливает аутокринную передачу сигнала от Wnt в клетках EKVX.
Фиг.9А и В. Анализ взаимодействия между биослоями (интерферометрия биослоев) с биотинилированным белком LRP6 E1-E4, иммобилизованным на стрептавидиновых биосенсорах, указывает на то, что антитело YW211.31.57 ингибирует связывание Wnt3a и Wnt9b с LRP6, а антитело YW210.09 ингибирует только связывание Wnt9b.
Фиг.9С. Метод интерферометрии биослоев с меньшим, неперекрывающимся фрагментом LRP6 показал, что Wnt3a связывает область Е3-Е4, и это взаимодействие блокируется либо интактным, либо одноплечевым антителом YW211.31.
Фиг.9D. Метод интерферометрии биослоев с меньшим, неперекрывающимся фрагментом LRP6 показал, что антитело YW210.09 связывает фрагмент E1-E2 белка LRP6 и конкурирует за данное связывание с Wnt9b.
Фиг.9Е. Метод интерферометрии биослоев показал, что антитела YW211.31.57 и YW210.09 могут совместно связывать иммобилизованный белок LRP6.E1-E4 при последовательном добавлении в любом порядке, что подтверждает различные эпитопы для этих антител.
Фиг.10А. График, на котором показана регрессия роста аллотрансплантированных опухолей MMTV-Wnt1 при введении мышам антитела YW210.09, аналогично действию, наблюдаемому с использованием белка Fzd8CRD-Fc.
Фиг.10В. На графике с помощью количественного ПЦР-анализа показано, что ксенотрансплантированные опухоли Ntera-2 демонстрируют снижение экспрессии мРНК SP5 у мышей, получавших интактное или одноплечевое антитело YW211.31, но не антитело YW210.09.
Фиг.10С. На графике показано, что воздействие антитела YW210.09, но не антитела YW211.31.62, на эксплантаты свода черепа мышей в культуре значительно повышает плотность минерализации костной ткани (BMD) кальцифицированной теменной кости, аналогично воздействию белка RANK-Fc.
Фиг.11А. На графике показано, что биспецифичные анти-LRP6 антитела, полученные в E. coli или клетках HEK293, аналогично ингибируют зависимым от концентрации образом активность Wnt-люциферазного репортера в клетках HEK293, индуцированных 0,1 мг/мл очищенного Wnt3a. Величины IC50 составляют 0,032 и 0,014 мкг/мл, соответственно.
Фиг.11В. На графике показан эффект воздействия указанных контрольного буфера (PBS), антитела, комбинации антител или белка Fzd8CRD-Fc (концентрация каждого составляла 10 мкг/мл) на аутокринную передачу сигнала от Wnt в клетках PA-1 и M14 со стабильно встроенным Wnt-люциферазным репортером и клетках CAL-51, трансфицированных репортером, при наличии (С) или отсутствии (В) стимуляции 0,1 мкг/мл Wnt3a.
Фиг.11С. На графике показан эффект воздействия указанных контрольного буфера (PBS), антитела, комбинации антител или белка Fzd8CRD-Fc (концентрация каждого составляла 10 мкг/мл) на аутокринную передачу сигнала от Wnt в клетках PA-1 и M14 со стабильно встроенным Wnt-люциферазным репортером и клетках CAL-51, трансфицированных репортером, которые были стимулированы 0,1 мкг/мл Wnt3a.
Фиг.12. Итоговая таблица эффектов антител или белка Fzd8CRD (10 мкг/мл) на передачу сигнала, индуцированную трансфекцией конструкций для экспрессии изоформ Wnt в клеточных линиях HEK293 или Hs578T со стабильно встроенным Wnt-люциферазным репортером.
Фиг.13А. Вестерн-анализ клеток HEK293, трансфицированных или не трансфицированных Wnt3a, и получавших воздействие указанного антитела или белка Fzd8CRD-Fc (5 мкг/мл) в течение 18 часов. Уровни белков β-актина и GAPDH показаны в качестве контроля наноса образца для верхнего и нижнего гелей, соответственно.
Фиг.13В. На графике с помощью количественного ПЦР-анализа показано, что ксенотрансплантированные опухоли М14 у мышей SCID-bg, получавших в течение 16 часов 30 мг/кг биспецифичного антитела к LRP6 или белок Fzd8CRD, но не контрольное антитело анти-gD, демонстрируют снижение экспрессии мРНК AXIN2 и APCDD1.
Фиг.14. Подробное изображение взаимодействия CDR H3 с остатками в бороздке LRP6, которое показывает важную систему взаимодействий, создаваемую NAVK-мотивом.
Фиг.15. Подробное изображение взаимодействий, образуемых CDR H1,2, L1,2 и 3.
Фиг.16. Вариабельная область тяжелой цепи (VH) типовых анти-LRP6 антител, в которой показаны CDR по Кабату.
Фиг.17. Вариабельная область легкой цепи (VL) типовых анти-LRP6 антител, в которой показаны CDR по Кабату.
Подробное описание вариантов осуществления изобретения
I. ОПРЕДЕЛЕНИЯ
В контексте настоящего описания «акцепторная каркасная область человека» является каркасной областью, содержащей аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученные из каркасной области иммуноглобулина человека или из консенсусной каркасной области иммуноглобулина человека. Акцепторная каркасная область человека, «полученная из» каркасной области иммуноглобулина человека или консенсусной каркасной области иммуноглобулина человека, может содержать аминокислотную последовательность одинаковую с ними, или она может содержать аминокислотные замены. В некоторых вариантах осуществления изобретения число аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления изобретения акцепторная каркасная область VL человека идентична последовательности каркасной области VL иммуноглобулина человека или консенсусной каркасной области человека.
«Аффинность» относится к силе общей суммы нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, то используемый в данном описании термин «аффинность связывания» относится к подлинной аффинности связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитела и антигена). Аффинность молекулы Х к его партнеру Y, как правило, можно представить константой диссоциации (Kd). Аффинность можно измерить стандартными способами, известными в данной области, включая способы, описанные в настоящем описании. Конкретные иллюстративные и примеры вариантов осуществления измерения аффинности связывания изобретения описаны ниже.
«Аффинно зрелое» антитело относится к антителу с одним или несколькими изменениями в одной или нескольких гипервариабельных областях (HVR) относительно родительского антитела, которое не несет таких изменений, причем данные изменения приводят к увеличению аффинности антитела к антигену.
Термин «анти-LRP6 антитело» и «антитело, которое связывает LRP6» относятся к антителу, способному связывать LRP6 с достаточной аффинностью, при которой антитело пригодно в качестве диагностического и/или терапевтического агента для обнаружения LRP6. В одном варианте осуществления изобретения связывание анти-LRP6 антитела с неродственным белком (не LRP6) составляет менее примерно 10% от связывания антитела с LRP6, измеренного, например, радиоиммуноанализом (RIA). В некоторых вариантах осуществления изобретения антитело, которое связывает LRP6, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 M или менее, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). В некоторых вариантах осуществления изобретения анти-LRP6 антитело связывает эпитоп LRP6, консервативный среди LRP6 из различных биологических видов.
Термин «антитело» в настоящем описании используется в максимально широком смысле и охватывает различные структуры антител, включая, но без ограничений, моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют желаемую антиген-связывающую активность.
«Фрагмент антитела» относится к молекуле антитела, но не интактному антителу, которая содержит участок интактного антитела, который связывает антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но без ограничений, Fv, Fab, Fab', Fab'-SH, F(ab')2; диантитела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и полиспецифичные антитела, образуемые фрагментами антител.
«Антитело, которое связывается с тем же эпитопом», что и референсное антитело, относится к антителу, которое блокирует связывание референсного антитела с его антигеном в конкурентном анализе на 50% или более, и наоборот, референсное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 50% или более. Пример конкурентного анализа приведен в настоящем описании.
Термины «рак (раковое заболевание)» или «раковый» относятся или описывают физиологическое состояние у млекопитающих, которое обычно отличается неконтролируемым ростом/пролиферацией клеток. Примеры рака включают, но без ограничения, карциному, лимфому (например, Ходжскинскую и неходжскинскую лимфому), бластому, саркому и лейкемию. Более конкретные примеры таких раковых заболеваний включают сквамозноклеточную карциному, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких, сквамозную карциному легких, рак брюшины, гепатоцеллюлярный рак, гастроинтестинальный рак, рак поджелудочной железы, глиому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочных желез, рак толстой кишки, рак толстой и прямой кишки, эндометриальную или маточную карциному, рак слюнных желез, рак почки, рак печени, рак простаты, рак вульвы, рак щитовидной железы, печеночную карциному, лейкемию и другие лимфопролиферативные заболевания, а также различные типы рака головы и шеи.
«Химиотерапевтический агент» относится к химическому соединению, пригодному для лечения рака. Примеры химиотерапевтических агентов включают химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и CYTOXAN® (циклофосфамид); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMITIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретамина оксида гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихимицин, особенно калихимицин-гамма1I и калихимицин-омегаI1 (см., например, Nicolaou et al., Angew. Chem Intl. Ed. Engl., 33: 183-186 (1994)); CDP323, пероральный ингибитор интегрина альфа-4; динемицин, включая динемицин A; эсперамицин; а также неокарциностатиновый хромофор и родственные ему хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMYCIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, липосомальную форму для инъекций доксорубицина-HCl (DOXIL®), липосомальный доксорубицин TCL D-99 (MYOCET®), пеглилированый липосомальный доксорубицин (CAELYX®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур