Способ определения цитотоксичности наноматериалов на основе оксида цинка
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, экологической и промышленной токсикологии. Предложен способ определения цитотоксичности наноматериалов на основе оксида цинка. Наноматериал приготавливают в виде двухслойной наноструктуры, в которой верхний слой модифицирован атомами Fe. Полученная наноструктура нанесена на диэлектрическую подложку, к которой формируют токопроводящие контактные площадки, соединенные посредством контактных проводников с измерительным устройством. Подложка, наноматериал, контактные площадки и контактные проводники образуют биосенсор. Для определения цитотоксичности измеряют временную зависимость сенсорного отклика - изменение сопротивления, емкости или ЭДС пленки при взаимодействии ее поверхности с бактериальной суспензией. Сенсорный отклик двухслойной наноструктуры ZnO-ZnO:Fe пропорционален концентрации живых бактерий. На основании полученной зависимости определяют время, за которое концентрация бактерий уменьшится в е раз за счет их гибели на поверхности пленки. Техническим результатом является расширение спектра исследуемых материалов. 4 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии, экологической и промышленной токсикологии, а именно к аналитическому определению цитотоксичности при проведении измерений и испытаний с использованием жизнеспособных микроорганизмов.
Изобретение предназначено для определения биологической активности (цитотоксичности) наноматериалов на основе полупроводниковых оксидов (оксида цинка), изготовленных в виде тонких пленок, нанесенных на диэлектрические подложки. Под цитотоксичностью понимается появление патологических изменений в клетках при действии физических, химических и биологических агентов, в том числе при их взаимодействии с наноматериалом. В зависимости от силы и мишени воздействия возможна широкая гамма изменений, ограниченная, с одной стороны, цитостатическим эффектом, нарушающим прохождение клетки по клеточному каналу, а с другой стороны - цитоцидным эффектом, ведущим клетку к гибели. При рассмотрении клеточной гибели как конечного результата цитотоксичного действия наноматериалов под цитотоксичностью можно понимать разнообразные нарушения, имеющие на одном фланге запуск механизмов апоптоза, а на противоположном фланге - включение процессов некроза [1].
Повышенное внимание к вопросу цитотоксичности наноматериалов на основе полупроводниковых оксидов определяется тем обстоятельством, что они в силу малой размерности и большой удельной площади поверхности обладают иными физико-химическими и биологическими (в том числе токсическими) свойствами, нежели те же вещества в форме сплошных фаз или микроскопических дисперсий. Следовательно, они относятся к принципиально новым видам материалов и продукций, для которых является обязательной оценка влияния на здоровье человека и экологическое состояния окружающей среды [2].
Известен способ определения биотоксичности наноуглерода [3] путем исследования интенсивности свечения (Iист) рекомбинантного люминесцирующего штамма Escherichia coli K12 с генами люминесцентной системы Photobacterium leiognathi по сравнению с интенсивностью его свечения в контроле (Iк) и последующего вычисления индекса токсичности по формуле T=((Iк-Iист)/Iк)·100%, отличающийся тем, что навеску исследуемых соединений наноуглерода предварительно диспергируют в органическом растворителе с меньшей, чем у воды, степенью полярности - диметилсульфоксиде или этаноле, затем тщательно перемешивают и обрабатывают ультразвуком. Полученные суспензии переносят в водную среду до конечной концентрации использованного растворителя 2,5%, после чего в созданную исследуемую и контрольную пробу, представляющую собой 2,5%-ный водный раствор диметилсульфоксида или этанола, вносят люминесцирующий штамм и после совместной инкубации в течение 60-180 минут измеряют интенсивность свечения. Параллельно в диапазоне длин волн биолюминесценции сенсорного штамма определяют оптические свойства тестируемой суспензии наноуглерода, на основании чего проводят расчет истинной интенсивности свечения сенсорного микроорганизма (Iист) в зависимости от светопоглощающих свойств исследуемых суспензий наноуглерода (D) и определенного в эксперименте уровня свечения бактериального люминесцирующего биосенсора.
Недостатком такого способа является узкий спектр анализируемых наноматериалов, т.е. он позволяет определять индекс токсичности только для наноуглеродов и непригоден для оценки биологической активности других видов наноматериалов, например на основе полупроводниковых оксидов. Кроме того, в данном способе не рассматривается концентрационная зависимость индекса токсичности, а только лишь представлена его градация на: нетоксичный (T<20%), токсичный (20≤T<50%) и сильнотоксичный (T≥50%).
Известен способ определения цитотоксичности антигенов Burkholderia pseudomallei in vitro [4]. Реакцию цитотоксичности выполняют на перевиваемых монослойных клеточных линиях мышиных фибробластов L929 или клеток яичника китайского хомячка СНО-K1. До начала экспериментов клетки выводят из криоконсервированного состояния, параллельно готовят исследуемые антигены, изолированные из различных структурных компонентов бактериальной клетки возбудителя мелиоидоза, с рН 7,0±0,1, стерилизуют их через мембранные фильтры и вносят по 20 мкл в лунки подготовленных к основным опытам в 48-луночных культуральных пластинах со сформированным монослоем клеток-мишеней, оставляя на каждой пластине по 2 лунки с интактной культурой (контроль). Пластину инкубируют в СО2-инкубаторе при 37°C и насыщении атмосферы 5-7% СО2 в течение 3 суток. В случае изменения морфологических и/или адгезивных свойств клеток, размещенных в лунках культуральных пластин, в том числе и гибели клеток, определяют наличие цитотоксического воздействия исследуемых антигенов на клетки, при этом гибель 50% и более клеток свидетельствует о проявлении острой цитотоксичности антигенов.
Недостатком такого способа является его неприменимость при определении цитотоксичности любых видов наноматериалов, в том числе на основе полупроводниковых оксидов.
Известен способ определения биологической активности веществ, содержащихся в жидких средах (в том числе наночастиц) [5]. Способ заключается в том, что живые тестовые клетки помещаются в анализируемую жидкость и для сравнения в дистиллированную воду. Воздействуя на клетки переменным электрическим полем, измеряют амплитуду их колебаний под действием поля. Определяют долю подвижных клеток относительно их общего числа, а также их адаптацию и выживаемость совокупно: по зависимости амплитуд их колебаний и доли подвижных клеток от концентрации веществ в анализируемой жидкой среде, по зависимости тех же параметров от времени инкубирования клеток в жидкой среде. При этом для сравнения амплитуд используют показатель токсичности, вычисляемый как Τ=((Αк-Αп)/Αк)·100%, где Ак - средняя амплитуда колебаний клеток в дистиллированной воде; Ап - средняя амплитуда колебаний клеток в анализируемой пробе.
Недостатком такого способа является его неприменимость при оценке цитоксичности наноматериалов, в том числе на основе полупроводниковых оксидов, в любой среде, кроме жидкой.
Наиболее близким по технической сущности к предлагаемому решению является способ оценки токсичности продукции из полимерных и текстильных материалов [6]. Способ заключается в том, что используют биосенсор на основе кислородного электрода, иммобилизуют целевые клетки микроорганизмов на поверхности кислородного электрода, измеряют дыхательную активность микроорганизмов в присутствии пробы и оценивают токсичность. Способ отличается тем, что иммобилизуют целые клетки бактерий E. coli K-12 на поверхность кислородного электрода с помощью полупроницаемой мембраны, измеряют дыхательную активность с помощью термооксиметра, дополнительно используют стандартные образцы положительного и отрицательного контроля, рассчитывают индекс токсичности (T) по формуле: Τ=(Rпроб-Rотр)/(Rпол-Rотр), где Rпроб, Rпол, Rотр - ответ биосенсора на образец анализируемой пробы, положительного и отрицательного контроля соответственно, [O2 мкг/дм3·с].
К недостаткам прототипа относятся следующие: 1) узкий спектр исследуемых материалов (полимерные и текстильные); 2) не рассмотрена применимость метода при оценке индекса токсичности наноразмерных материалов; 3) относительно большое время анализа (выполняется за 10 минут); 4) относительно низкая стабильность (время функционирования составляет около 30 дней); 5) не учтена концентрационная зависимость индекса токсичности.
Техническим результатом, на достижение которого направлен заявляемый способ, является расширение спектра исследуемых материалов, в том числе анализ наноматериалов на основе оксида цинка, а также учет концентрационных зависимостей.
Сущность заявляемого способа заключается в том, что наноматериал на основе оксида цинка приготавливают в виде тонкой пленки, нанесенной на диэлектрическую подложку. На поверхности пленки формируют токопроводящие контактные площадки, соединенные посредством контактных проводников с измерительным устройством. Подложка, наноматериал, контактные площадки и контактные проводники образуют биосенсор. Для определения цитотоксичности измеряют временную зависимость сенсорного отклика (изменение сопротивления, емкости или ЭДС) пленки при взаимодействии ее поверхности с бактериальной суспензией и для оценки цитотоксичности на основании полученной зависимости определяют среднее время (τ) жизни колонии бактерий, т.е. время, за которое концентрация бактерий уменьшится в е раз за счет их гибели на поверхности пленки. Наноматериал на основе оксида цинка считают сильно токсичным, если величина (где τ0 - время удвоения колонии бактерий при оптимальных условиях, k=е-2=0.135 - коэффициент скорости роста колонии бактерий при ухудшении условий окружающей среды), токсичным, если 20%≤Т<80%, и не токсичным, если Т≥80%. Для увеличения сенсорного отклика пленки наноматериал приготавливают в виде двухслойной наноструктуры, в которой верхний слой модифицирован атомами железа (Fe). Такое сочетание экспериментальных и теоретических данных позволяет определять цитотоксичность наноматериалов на основе оксида цинка.
Пример выполнения способа. Определение цитотоксичности наноструктурированного оксида цинка (ZnO)
1. Наноматериал на основе ZnO формировали в виде двухслойной наоструктуры ZnO-ZnO:Fe, в которой верхний слой модифицирован атомами железа (Fe), методом золь-гель технологии [7]. Пленкообразующие золи получали путем растворения ацетата цинка (CH3COO)2Zn-2H2O и нитрата железа Fe(NO3)3-9H2O в 2-метоксиэтаноле СН3ОСН2СН2ОН с последующим добавлением моноэтаноламина HOCH2CH2NH2 в качестве поверхностно-активного вещества. Нанесение пленок из золей осуществлялось способом погружения покрываемого образца в пленкообразующий раствор. Для получения желаемой толщины пленок проводилось многократное погружение с последующей сушкой в течение 30 мин при 80°C после каждого окунания. Окончательных отжиг пленок осуществлялся при температуре 500°C в течение 1 ч. Верхний и нижний слой двухслойной наноструктуры ZnO-ZnO:Fe формировали тремя погружениями в золь.
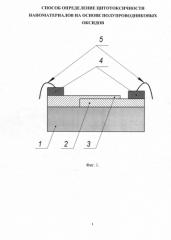
На фиг. 1 представлена конструкция биосенсора изготавливаемого по данному способу. Биосенсор содержит: диэлектрическую подложку 1 (использовался Rubalit® 710), двухслойную наноструктуру, в которой нижний слой 2 выполнен из ZnO, а верхний слой 3 из ZnO:Fe, токопроводящие контактные площадки 4, соединенные при помощи контактных проводников 5 с измерительным устройством (на фиг. 1 не показано), регистрирующим временную зависимость сенсорного отклика (изменение ЭДС).
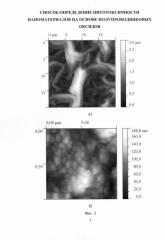
На фиг. 2 представлена морфология поверхности двухслойной наноструктуры ZnO-ZnO:Fe, полученная с помощью атомно-силовой микроскопии. Видно, что данная наноструктура имеет развитую пористо-фрактальную поверхность [8] в виде сетки (фиг. 2а). Отдельные ветви сетки в свою очередь состоят из квазисферических кластерных образований (фиг. 2б). Такие структуры типичны при получении в результате спонтанного распада на две фазы - спинодального распада. Данное явление имеет место при «химическом» охлаждении золя, т.е. полимеризации, сопровождающейся уменьшением комбинационной энтропии.
2. Приготовление бактериальных суспензий с заданной концентрацией осуществляли в три этапа: 1) приготовление разведений; 2) посев в чашки Петри; 3) подсчет выросших колоний. Количественный учет микроорганизмов осуществляется с помощью чашечного метода Коха, бактерии предварительно хранились в высушенном виде (до остаточной влажности 10-12%).
Разведения были приготовлены в дистиллированной воде, использовались десятикратные последовательные разведения (1:10, 1:100 и 1:1000). Степень разведения зависит от предполагаемого числа микроорганизмов в образце. Чем больше бактерий, тем выше степень разведения.
Посев осуществлялся в чашки Петри с применением специальной питательной среды, стандартной для бактерий вида Pseudomonas putida.
Выросшие колонии бактерий были подсчитаны через двое суток. Подсчет проводился с помощью лупы. Если колонии крупные и в небольшом количестве, то их подсчитывают по всей поверхности чаши, при большом количестве колоний вся чашка делится на секторы. Из чашек Петри бактерии снова помещаются в дистиллированную воду. Было подсчитано, что в одном микролитре находится порядка 30 бактерий.
3. Сенсорный отклик (изменение ЭДС) двухслойной наноструктуры ZnO-ZnO:Fe регистрировали с помощью измерительного устройства при нанесении бактериальной суспензии на поверхность наноматериала с помощью распылительной системы.
На фиг. 3 представлена временная зависимость сенсорного отклика (изменение ЭДС сенсора, ΔU(t)) при взаимодействии поверхности сенсора с суспензией бактерий различной концентрации: кривая 1-10 мкл; кривая 2-500 мкл; кривая 3-1000 мкл. Изменение разности потенциалов двухслойной наноструктуры ZnO-ZnO:Fe связано с двумя основными факторами: действие продуктов метаболизма бактерии на поверхность пленок; взаимодействие поверхности пленок с клеточной мембраной, богатой ОН-группами. В процессе взаимодействия оксида цинка с бактериальной суспензией происходит гибель бактерий, которая описывается следующим механизмом:
Пероксид является сильнейшим ядом для живых клеток, способным повреждать клеточные оболочки.
Под влиянием перекиси водорода происходит расщепление клеточной стенки бактерии, что нарушает бактериальную деятельность. При продолжающемся влиянии пероксида на мембрану происходит удлинение клетки, клеточная стенка больше не поддерживает структурную целостность бактерии и цитоплазма вытекает наружу. В результате бактерия погибает.
Исходя из этого сенсорный отклик двухслойной наноструктуры ZnO-ZnO:Fe пропорционален концентрации живых бактерий, а остаточное значение ЭДС определяется органическим загрязнением мертвыми бактериями. Следовательно, временную зависимость сенсорного отклика наноматериала на основе оксида цинка можно аппроксимировать экспоненциальной зависимостью следующего вида:
где первый член ΔU0 связан с начальным значением ЭДС сенсора, до действия на него бактериальной суспензии; А - предэкспоненциальный множитель, пропорциональный концентрации бактерий в суспензии; Δ - член, связанный с наличием остаточных загрязнений мертвыми бактериями на поверхности пленки. Физический смысл τ - среднее время жизни колонии бактерий, т.е. время, за которое концентрация бактерий уменьшится в е раз за счет их гибели на поверхности пленки.
В таблице 1 приведены значения среднего времени жизни колоний бактерий (τ) при различной концентрации (с).
Представленные в таблице 1 данные показывают, что среднее время жизни колонии бактерий зависит от их концентрации и увеличивается по мере ее роста. Кроме того, очевидно, что зависимость τ от с нелинейна, так, при увеличении концентрации бактерий в 50 раз среднее время их жизни возрастает всего 1,523 раза, а при увеличении с в 100 раз τ становится больше в 2,37 раза. Это, по всей видимости, связано со взаимодействием бактерий друг с другом при высоких концентрациях, а также зависимостью скорости их гибели от концентрации уже мертвых бактерий.
На фиг. 4 представлена концентрационная зависимость чувствительности (T) наноструктуры ZnO-ZnO:Fe. Чувствительность определяли по формуле T=((ΔUair-ΔUbac)/ΔUair)·100%, где ΔUair, ΔUbac - ЭДС структуры на воздухе и при воздействии бактерий заданной концентрации соответственно. Т.е. чувствительность в данном случае равносильна индексу токсичности. Данные, представленные на фиг. 4, показывают, что концентрационная зависимость чувствительности имеет глубоко нелинейный характер и при изменении концентрации бактерий в 2 раза может изменять на несколько десятков или даже 100%. Это приводит к тому, что для оценки цитотоксичности наиболее удобно использовать среднее время жизни колоний бактерий, определенное при достаточно большой их концентрации, например при 1000 мкл, которое не более чем в 3 раза будет отличаться от τ, измеренного при малой концентрации, например 10 мкл.
4. Оценку цитотоксичности наноматериалов на основе оксида цинка, приготовленных в виде двухслойной наноструктуры, в которой верхний слой модифицирован атомами Fe, проводили исходя из данных таблицы 1 при концентрации c=1000 мкл. Определяли величину (τ0=1,63 ч - время удвоения колонии бактерий Pseudomonas putida при оптимальных условиях [9]). Величина T=0.96%<20%, что соответствует сильной токсичности наноматериала на основе оксида цинка.
Заявляемый способ предназначен для использования в научно-исследовательских центрах токсикологии, лабораториях центров гигиены, санитарии и эпидемиологии, а также при разработке и производстве биосенсоров с заданными выходными характеристиками.
Источники информации
1. Данченко Е.О. Оценка цитотоксичности фармацевтических субстанций с использование клеточных культур // Иммунология, аллергология, инфектология. - 2012. - №2. - С. 22-31.
2. Концепция токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов // Постановление Главного государственного санитарного врача Российской Федерации №79 от 31.10.2007.
3. Патент РФ №2437938, C12Q 1/06, C12N 1/13, C12Q 1/02, C12R 1/19. Способ определения биотоксичности наноуглерода / Дерябин Д.Г., Алешина Е.С. // Бюл. №36 от 27.12.2011 г.
4. Патент РФ №2465592, G01N 33/48, C12Q 1/00, C12N 5/07. Способ определения цитотоксичности антигена Burkholderia pseudomallei in vitro / Храпова Н.П., Пименкова Е.В., Ломова Л.В. // Бюл. №30 от 27.10.2012.
5. Патент РФ №2426794, C12Q 1/00, B82B 1/00. Способ определения биологической активности веществ, содержащихся в жидких средах (в том числе наночастиц) / Сухенко Е.П., Лисицын Н.Б., Ночка А.Д., Соловьев А.А., Кудрявцева Н.Б., Шикалова О.А. // Бюл. №23 от 20.08.2011.
6. Патент РФ №2518306, C12Q 1/02, G01N 33/36. Способ оценки токсичности продукции из полимерных и текстильных материалов / Пономарева О.Н., Чепкова И.Ф., Ануфриев М.А., Алферов В.А., Щеглова В.А., Иванова Е.П. // Бюл. №16 от. 10.06.2014.
7. Жабрев В.А., Мошников В.А., Таиров Ю.М., Федотов А.А. Шилова О.А. Золь-гель-технология: учеб. пособие / СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2004. - 156 с.
8. Грачева И.Е., Мошников В.А., Абрашова Е.В. Обобщение результатов фрактальной размерности золь-гель пористых иерархических структур // Материаловедение. - 2013. - №6. - С. 13-22.
9. Wang Q., Nomura Ch.T. Monitoring differences in gene expression levels and polyhydroxyalkanoate (PHA) production in Pseudomonas putida KT2440 grown on different carbon sources // Journal of Bioscience and Bioengineering. - 2010. - V. 110 - №. 6. - P. 653-659.
Способ определения цитотоксичности наноматериалов на основе оксида цинка, заключающийся в том, что наноматериал приготавливают в виде двухслойной наноструктуры, в которой верхний слой модифицирован атомами Fe, нанесенной на диэлектрическую подложку, к которой формируют токопроводящие контактные площадки, соединенные посредством контактных проводников с измерительным устройством, образующие биосенсор, для определения цитотоксичности измеряют временную зависимость сенсорного отклика пленки при взаимодействии ее поверхности с бактериальной суспензией и для оценки цитотоксичности на основании полученной зависимости определяют среднее время жизни колонии бактерий, т.е. время, за которое концентрация бактерий уменьшится в e раз за счет их гибели на поверхности пленки.