Микроорганизм для продуцирования одновременно l-аминокислоты и рибофлавина и способ производства l-аминокислоты и рибофлавина с его применением
Иллюстрации
Показать всеИзобретение относится к способу продуцирования L-лизина и рибофлавина или L-треонина и рибофлавина. Способ включает культивирование модифицированного микроорганизма, который модифицирован путем усиления активности семейства ферментов биосинтеза рибофлавина в микроорганизме рода Corynebacterium, обладающего способностью продуцирования L-лизина или L-треонина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина или L-треонина на высоком уровне; и продуцирование L-лизина и рибофлавина или L-треонина и рибофлавина посредством ферментационного процесса. Изобретение относится также к модифицированному штамму Corynebacterium glutamicum КССМ11223Р, продуцирующему L-лизин и рибофлавин, и к модифицированному микроорганизму рода Corynebacterium для продуцирования одновременно L-лизина и рибофлавина или L-треонина и рибофлавина, который модифицирован путем усиления активности семейства ферментов, экспрессируемого посредством rib-оперона, содержащего семейство генов биосинтеза рибофлавина, в микроорганизме рода Corynebacterium, обладающем способностью продуцирования L-лизина или L-треонина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина или L-треонина на высоком уровне. Изобретение позволяет получать одновременно L-лизин и рибофлавин или L-треонин и рибофлавин с высокой степенью эффективности. 6 н. и 15 з.п. ф-лы, 4 ил., 6 табл., 9 пр.
Реферат
Область техники
Настоящее изобретение относится к способу получения высоких концентраций L-аминокислоты и рибофлавина и к микроорганизму для продуцирования одновременно L-аминокислоты и рибофлавина.
Предшествующий уровень техники
Зерна хлебных злаков, таких как кукуруза, просо обыкновенное, ячмень и пшеница, которые наиболее часто используют в кормах, обычно обеспечивают 30-60% потребности в аминокислотах. Таким образом, с целью удовлетворения остающихся потребностей и сохранения баланса между незаменимыми аминокислотами, требуется дополнительное обеспечение аминокислотами. Также, все корма содержат некоторые количества витаминов, и если какой-либо витамин не предлагается в достаточном количестве, может иметь место дефицит этого витамина. Таким образом, для сохранения их должных уровней витамины должны предлагаться дополнительно, подобно аминокислотам. Аминокислоты являются наиболее дорогостоящими среди компонентов кормовых продуктов, и эффективное обеспечение аминокислотами можно считать одним из факторов, которые определяют суммарную способность в производстве домашнего скота. Конкретно, L-лизин и L-треонин среди аминокислот часто становятся первыми аминокислотами, которые ограничивают рост домашнего скота. L-лизин и L-треонин можно получать ферментационным процессом, используя микроорганизмы, и L-лизин и L-треонин, полученные ферментационным процессом, добавляют в корма после очистки и концентрирования. Микроорганизмы, которые обычно применяют в ферментации L-лизина, представляют собой Corynebacterium sp.или Escherichia coli, и сообщалось о многих примерах, в которых продуцировали L-лизин посредством генноинженерных микроорганизмов (корейские патенты №10-0930203 и №10-0924065, патент US 7871801).
В настоящее время постоянно предпринимаются попытки для увеличения продуцирования L-лизина или L-треонина посредством модифицированных микроорганизмов, используя методы генной инженерии. Однако с ростом промышленности требуется обеспечение увеличивающихся количеств L-лизина или L-треонина, и таким образом предпринимаются попытки создавать способы продуцирования L-лизина или L-треонина более эффективным и экономичным путем.
Хотя витамины требуются в небольших количествах, они являются незаменимыми органическими соединениями, которые должны предлагаться для сохранения нормальных метаболических функций, роста, репродуктивных функций и здоровья домашнего скота. Среди витаминов, рибофлавин (витамин В2) представляет собой водорастворимый витамин, который биосинтезируется в различных видах микроорганизмов и во всех видах растений, но не биосинтезируется в организме позвоночных, включая человека, и, таким образом, необходимо его получение из внешних источников. Дефицит рибофлавина может вызывать отсутствие половой охоты и неспособность к размножению у свиней (Biol. Reprod. (1981) 25:659-665, J. Anim. Sci. (1984) 59:1567-1572). У домашних птиц это может вызывать проблемы в нервах, особенно седалищных нервах и плечевых нервах, и может неблагоприятно влиять на рост эмбрионов, приводя к смерти эмбрионов (Korean Feeding Standard for Poultry, 2002, the Korean Ministry of Agriculture and Forestry). Таким образом, рибофлавин применяли в качестве кормовой добавки для роста домашнего скота и, конкретно, сам концентрированный рибофлавин использовали в качестве корма.
Текущее производство рибофлавина во всем мире составляет 6000 тонн в год, из которых 75% используют в качестве кормовых добавок и оставшуюся часть используют в качестве кормовых продуктов и фармацевтических средств. В производстве рибофлавина применяют способ химического синтеза и способ микробиологической ферментации. В способе химического синтеза производят рибофлавин высокой очистки из предшественника, такого как D-рибоза, путем многостадийного процесса. Способ химического синтеза имеет недостаток в том, что исходное вещество является дорогостоящим и, таким образом, повышается стоимость производства. По этой причине разработали способ продуцирования рибофлавина путем микробиологической ферментации. Способ микробиологической ферментации представляет собой способ, в котором либо микроорганизм, который продуцирует рибофлавин, выделяют из природы, либо микроорганизм, мутированный посредством методов генной инженерии или химическим/физическим способом так, чтобы сверхпродуцировать рибофлавин, культивируют в подходящих условиях и затем выделяют рибофлавин из культуры. В последние годы в основном был изучен способ ферментации, так как он является конкурентным по стоимости и не загрязняет окружающую среду. Рибофлавин, произведенный способом ферментации, добавляют к кормовому продукту после очистки и концентрирования.
Типичный способ продуцирования рибофлавина, используя дрожжи Candida famata, раскрыт в US 5231007. В промышленном продуцировании рибофлавина наиболее часто применяют Eremothecium ashbyii и Ashbya gossypii (WO №95/26406), которые принадлежат Ascomycetes. Кроме того, сообщалось также о бактерии Bacillus subtilis в качестве штамма, который можно применять для продуцирования рибофлавина. Сообщалось о многих примерах, в которых рибофлавин продуцировали при помощи указанной выше бактерии, мутированной посредством генной инженерии (ЕР 0821063, US 5837528 и US 5334510), и авторы настоящего изобретения также производили рибофлавин, применяя указанную выше бактерию (корейский патент №10-0542573). Кроме того, также сообщалось о примере продуцирования 4,5 г/л рибофлавина, используя микроорганизм, сконструированный для сверхэкспрессии гена фермента, связанного с биосинтезом рибофлавина (J. Ind. Microbiol. Biotechnol. (1999), 22:8-8).
Потребности в компонентах кормов для животных составляют примерно 1-5 г/кг L-лизина, примерно 0,6-3,3 г/кг L-треонина и 2-4 мг/кг рибофлавина, что составляет примерно 0,1% потребности в L-лизине (NRC. 1998. National Academy of Sciences-National Research Council, Washington, D.C.). Однако L-лизин и рибофлавин продуцируются отдельно путем ферментационных процессов, подвергаются очистке и концентрированию перед добавлением их к корму, и по отдельности перевозятся на завод кормовых смесей. По этой причине они могут увеличивать затраты на производство корма. Если концентрация рибофлавина в микроорганизме, который продуцирует как L-лизин, так и рибофлавин, достигает примерно 0,1% концентрации L-лизина, добавление микробной культуры может удовлетворять потребностям в кормовых добавках, но о попытках достичь этого еще не сообщалось.
В случае микроорганизмов Corynebacterium sp., рибофлавин биосинтезируют посредством двух путей из рибулозо-5-фосфата (Ru5P), который представляет собой продукт пентозофосфатного пути (РРР), и гуанозинтрифосфата (GTP), который представляет собой продукт пуринового метаболизма. В биосинтез рибофлавина вовлечено семейство генов, состоящее из гена GTP-циклогидролазы II (RibA), гена деаминазы-редуктазы пиримидинов (RibG), гена альфа-субъединицы рибофлавин-синтазы (RibC) и гена бета-субъединицы рибофлавин-синтазы (RibH) (в дальнейшем в этом документе называется "семейством генов биосинтеза рибофлавина"). Семейство генов биосинтеза рибофлавина образует оперон (rib-оперон) с рибулозо-5-фосфат-3-эпимеразой (Rpe, NCgl1536), которая вовлечена в пентозофосфатный путь, и как Rpe, так и RibA конкурируют за использование Ru5P в качестве субстрата (ФИГ. 1). Другими словами, Rpe биосинтезирует D-ксилозо-5-фосфат из Ru5P с опосредованием промежуточного способа, в котором метаболический продукт, произведенный в пентозофосфатном пути, входит в гликолитический путь и RibA биосинтезирует 3,4-дигидрокси-2-бутанон-4-фосфат, который является промежуточным продуктом биосинтеза рибофлавина (KEGG, Kyoto Encyclopedia of Genes and Genomes, [www.genome.jp/kegg]).
Пентозофосфатный путь в Corynebacterium является главным источником восстановительной способности (NADPH), который вовлечен в биосинтез лизина, и в литературе сообщалось о прямой корреляции между регенерацией NADPH и биосинтезом L-лизина (Wittmann and Heinzle, Microbiol 68:5843-5849, 2002; Marx et al., J Biotechnol 104:185-197, 2003; Ohnishi et al., Microbiol Lett 242:265-274, 2005).
Пентозофосфатный путь катализируется посредством глюкозо-6-фосфат дегидрогеназы (G6PDH), 6-фосфоглюконолактоназы, 6-фосфоглюконат дегидрогеназы (6PGD), Rpe, рибозо-5-фосфат изомеразы (RpiA), транскетолазы и трансальдолазы, и конечный метаболический продукт, произведенный посредством этого пути, входит в гликолитический процесс.
В результате исследований по осуществлению пентозофосфатного пути в ЕР 01941065 (июнь, 2001) и ЕР 02781875 (декабрь, 2002) раскрывается вариант фермента, который непосредственно продуцирует NADPH и имеет устойчивость к отрицательной обратной связи. Кроме того, раскрыты изобретения, относящиеся к штаммам Corynebacterium, продуцирующим лизин, которые сверхэкспрессируют транскетолазу и трансальдолазу (ЕР 1109915, ЕР 1179076, и ЕР 1179084). Кроме того, сообщалось об увеличении продуцирования L-лизина в штамме Corynebacterium, который сверхэкспрессирует Rpe или RpiA (DE 10037611 и DE 10037612).
Таким образом, можно видеть, что поскольку продуцирование L-лизина в штамме Corynebacterium увеличивается, то увеличивается зависимость штамма от пентозофосфатного пути. Однако путь биосинтеза рибофлавина, который является ключевым элементом настоящего изобретения, происходит из пентозофосфатного пути, и, таким образом, если поток углерода в пути биосинтеза рибофлавина усиливают, то источник углерода, который вводят в гликолитический путь через пентозофосфатный путь, будет ослабевать, что приводит к снижению производственного выхода L-лизина на единицу поставляемого источника углерода. Другими словами, можно считать, что путь биосинтеза рибофлавина в продуцирующем L-лизин штамме, который требует достаточного потока углерода в пентозофосфатном пути, является конкурирующим с пентозофосфатным путем. Также, если поток углерода, который вводят в путь биосинтеза рибофлавина, увеличивается, то это может неблагоприятно влиять на продуцирование L-лизина.
Таким образом, микроорганизмы, которые одновременно продуцируют L-лизин и рибофлавин, могут присутствовать в природе, но производственные выходы L-лизина и рибофлавина могут конкурировать друг с другом. По этой причине о попытках увеличить производство рибофлавина в промышленном микроорганизме, который продуцирует большое количество L-лизина, до уровня, полезного в промышленном масштабе, до сих пор не сообщалось.
Описание изобретения
Техническая проблема
В этих условиях авторами настоящего изобретения был выполнен большой объем работ по разработке микроорганизма, который одновременно продуцирует L-лизин и рибофлавин. В результате авторами настоящего изобретения штамму Corynebacterium, обладающему способностью к продуцированию L-лизина, путем искусственной мутации была придана адаптивность к высоким концентрациям глюконовой кислоты для увеличения потока углерода в пентозофосфатном пути, разрабатывая таким образом мутантный штамм, который имеет повышенную способность продуцировать рибофлавин по сравнению с родительским штаммом при сохранении продуцирования L-лизина на том же уровне, что и у родительского штамма. Также авторы настоящего изобретения обнаружили, что, даже если промотор семейства генов биосинтеза рибофлавина в продуцирующем L-лизин штамме Corynebacterium заменяют гетерогенным сильным промотором, штамм Corynebacterium может одновременно продуцировать L-лизин и рибофлавин в высоких концентрациях, и этот же эффект также обнаруживается в штамме Corynebacterium, обладающем способностью продуцирования L-треонина, таким образом завершая настоящее изобретение.
Техническое решение
Целью настоящего изобретения является предложение способа продуцирования L-лизина или L-треонина и рибофлавина, включающего: культивирование микроорганизма, который получают путем модификации микроорганизма Corynebacterium sp., обладающего способностью продуцирования L-лизина или L-треонина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина или L-треонина на высоком уровне; и продуцирование L-лизина или L-треонина и рибофлавина посредством ферментационного процесса.
Другой целью настоящего изобретения является предложение модифицированного микроорганизма Corynebacterium glutamicum, который получают посредством индуцирования случайной мутации в микроорганизме Corynebacterium glutamicum, обладающем способностью продуцирования высококонцентрированного L-лизина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина на высоком уровне, где модифицированный микроорганизм Corynebacterium glutamicum депонируют под регистрационным номером КССМ11223Р.
Еще одной целью настоящего изобретения является предложение модифицированного микроорганизма Corynebacterium sp. для продуцирования одновременно L-лизина или L-треонина и рибофлавина, который модифицируют путем усиления активности семейства ферментов, которое экспрессируется посредством rib-оперона, содержащего семейство генов биосинтеза рибофлавина, в микроорганизме Corynebacterium sp., обладающем способностью продуцирования L-лизина или L-треонина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина или L-треонина на высоком уровне.
Еще одной целью настоящего изобретения является предложение композиции или гранулированной композиции, содержащей L-аминокислоту и рибофлавин, которую получают путем культивирования описанного выше микроорганизма и гранулирования L-аминокислоты и рибофлавина.
Еще одной целью настоящего изобретения является предложение кормовой добавки, включающей композицию, содержащую L-аминокислоту и рибофлавин, которую получают путем культивирования описанного выше микроорганизма, или описанную выше гранулированную композицию.
Полезные эффекты
В настоящем изобретении может предлагаться разработанный микроорганизм, который может одновременно продуцировать высокие концентрации L-аминокислоты, такой как L-лизин или L-треонин, которую производят в больших количествах в промышленном масштабе, и рибофлавина, которые используются как незаменимые в кормах для животных, и способ продуцирования L-аминокислоты и рибофлавина. Таким образом, в настоящем изобретении могут предлагаться эффекты удобного изготовления кормов и снижения затрат на производство и может предлагаться эффективный штамм для продуцирования L-аминокислоты и витаминные кормовые добавки.
Описание графических материалов
На ФИГ. 1 показано, что гликолитический путь и путь биосинтеза рибофлавина конкурируют за использование рибулозо-5-фосфата.
На ФИГ. 2 показано, что сильный промотор вставляют выше или внутри rib-оперона для усиления активности либо семейства ферментов, которое кодируется посредством rib-оперона, или семейства ферментов биосинтеза рибофлавина.
На ФИГ. 3 показан вектор pDZ-Pmrb, сконструированный для того, чтобы вставлять промотор SEQ ID NO: 5.
На ФИГ. 4 показан вектор pDZ-lysCP1-ribG, сконструированный для того, чтобы вставлять промотор SEQ ID NO: 6.
Лучший вариант
В дальнейшем в этом документе будут определены термины, используемые в данном описании изобретения.
При использовании в данном описании изобретения термин "rib-оперон" относится к оперону, включающему семейство генов биосинтеза рибофлавина, состоящее из гена ribG, кодирующего деаминазу-редуктазу пиримидина (RibG, NCgl1535), гена ribC, кодирующего альфа-субъединицу рибофлавинсинтазы (RibC, NCgl1534), гена ribA, кодирующего GTP-циклогидролазы II (RibA) и гена ribH, кодирующего бета-субъединицу рибофлавинсинтазы (RibH, NCgl1532) (в дальнейшем в этом документе называется "семейством генов биосинтеза рибофлавина"), и гена rpe, кодирующего рибулозо-5-фосфат-3-эпимеразу (Rpe, NCgl1536), которые вовлечены в пентозофосфатный путь (ФИГ. 2). Информация о генах оперона имеется в общедоступных базах данных (например NCBI GenBank).
При использовании в данном описании изобретения термин "L-аминокислота" относится к аминокислоте, выбранной из группы, состоящей из L-лизина, L-треонина, L-валина, L-изолейцина, L-триптофана и L-метионина. Конкретно, аминокислота представляет собой L-лизин или L-треонин.
Один аспект настоящего изобретения содержит способ продуцирования L-лизина или L-треонина и рибофлавина, включающий:
культивирование микроорганизма, который получают путем модификации микроорганизма Corynebacterium sp., обладающего способностью продуцирования L-лизина или L-треонина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина или L-треонина на высоком уровне; и продуцирование L-лизина или L-треонина и рибофлавина посредством ферментационного процесса.
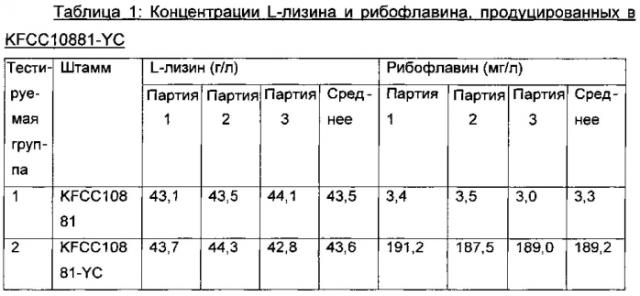
В конкретном примере настоящего изобретения обнаружили, что продуцирование L-лизина или L-треонина в модифицированном микроорганизме сохраняется на том же уровне, что и в родительском штамме, тогда как продуцирование рибофлавина повышено примерно в 70-80 раз и, в частности, соотношение между продуцированием лизина и продуцированием рибофлавина составляло примерно 1:0,005 или соотношение между продуцированием L-треонина и продуцированием рибофлавина составляло примерно 1:0,03 (Таблицы 1-6). Это означает, что L-аминокислота и рибофлавин, продуцируемые одновременно микроорганизмом по настоящему изобретению, являются подходящими для применения в качестве кормовых добавок.
Модифицированный микроорганизм представляет собой микроорганизм Corynebacterium sp., модифицированный для продуцирования одновременно L-аминокислоты и рибофлавина, который получают путем модификации микроорганизма Corynebacterium sp., обладающего способностью продуцирования L-аминокислоты, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-аминокислоты, как результат усиления активности семейства ферментов, которое экспрессируется посредством rib-оперона, включающего семейство генов биосинтеза рибофлавина. Конкретно, он может представлять собой мутантный микроорганизм Corynebacterium sp.для продуцирования одновременно L-лизина или L-треонина и рибофлавина, который получают путем модификации микроорганизма Corynebacterium sp., обладающего способностью продуцирования L-лизина или L-треонина, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина или L-треонина, как результат усиления активности семейства ферментов, которое экспрессируется посредством rib-оперона, включающего семейство генов биосинтеза рибофлавина.
Микроорганизм Corynebacterium sp., применяемый в настоящем изобретении, может представлять собой любой штамм Corynebacterium sp., обладающий способностью продуцирования L-аминокислоты, и примеры этого включают, без ограничения, Corynebacterium glutamicum (АТСС 13032), Corynebacterium ammoniagenes, Corynebacterium thermoaminogenes (FERM BP-1539), Brevibacterium flavum (ATCC 14067) и Brevibacterium fermentum (ATCC 13869). Более конкретно, можно применять Corynebacterium glutamicum, и конкретные примеры этого включают, без ограничения, KFCC10881 (корейский патент №0159812), KFCC11074 (корейский патент №0292299), KFCC11001 (корейский патент №0253424) и КССМ11222Р. В конкретном примере настоящего изобретения мутантный микроорганизм получают путем модифицирования KFCC10881 в качестве родительского штамма для увеличения продуцирования рибофлавина при сохранении продуцирования L-лизина или L-треонина на высоком уровне. В частности, мутантный микроорганизм получали путем модифицирования КССМ11222Р в качестве родительского штамма для увеличения продуцирования рибофлавина при сохранении продуцирования L-треонина на высоком уровне.
Микроорганизм Corynebacterium sp., обладающий способностью продуцирования L-лизина, может представлять собой микроорганизм, который продуцирует L-лизин с повышенной эффективностью. Способы повышения эффективности продуцирования L-лизина включают способ амплификации гена, который вовлечен в путь биосинтеза L-лизина, или модифицирования промотора гена для увеличения ферментной активности. Примеры ферментов, вовлеченных в биосинтез L-лизина, включают аспартатаминотрансферазу, аспартокиназу, аспартат полуальдегиддегидрогеназу, пируваткарбоксилазу, дигидродипиколатредуктазу, дигидродипиколинатсинтазу, диаминопимелатдекарбоксилазу и тому подобные. Предыдущий патент, связанный с промоторами, произведенными коринебактерией, включает WO 09/096690, относящуюся к улучшенному промотору дигидродипиколинатредуктазы, и выданный корейский патент №0930203 раскрывают улучшенные промоторы аспартокиназы и аспартат-полуальдегид-дегидрогеназы. Также, выданный корейский патент №0924065 раскрывает способ улучшения продуцирования L-лизина путем включения одной или более копий генов, связанных с вышеупомянутым биосинтезом, и замены промоторов генов экзогенными сильными промоторами.
Микроорганизм Corynebacterium sp., обладающий способностью продуцировать L-треонин, может представлять собой микроорганизм, который продуцирует L-треонин с повышенной эффективностью. Для того чтобы улучшить способность продуцировать L-треонин, специалист в данной области техники может использовать обычные способы, такие как не только приобретение ауксотрофных мутантов, аналого-резистентных мутантов, мутантов с регулируемым метаболизмом, но также конструкцию рекомбинантных штаммов, имеющих повышенную активность фермента биосинтеза L-треонина. Например, мутантный штамм или рекомбинантный штамм можно модифицировать так, чтобы фермент биосинтеза L-треонина не подвергался ингибированию по типу обратной связи, или рекомбинантный штамм можно модифицировать для увеличения экспрессии гена фермента биосинтеза L-треонина. При модификации продуцирующего L-треонин штамма посредством этих способов, можно получать одно из свойств или комбинацию свойств, таких как ауксотрофия, аналого-резистентность и мутации, регулирующие метаболизм. Если активность фермента биосинтеза L-треонина является усиленной, можно усилить активность одного или более из этих ферментов. Примеры гена, кодирующего фермент биосинтеза L-треонина, включают ген аспартокиназы III (lysC), ген аспартат-полуальдегид-дегидрогеназы (asd), ген аспартокиназы I (thrA), ген гомосеринкиназы (thrB) и ген треонин-синтазы (thrC), которые включены в thr-оперон. Активность фермента биосинтеза L-треонина можно повышать путем включения мутации в ген, кодирующий фермент, или амплификацией гена для увеличения внутриклеточной активности фермента. Этого можно добиться, используя технологию генетической рекомбинации. Также, продуцирование L-треонина можно повышать посредством инактивации L-треониндегидрогеназы, связанной с деградацией треонина. В дополнение к ферментам системы деградации L-треонина, продуцирование L-треонина можно повышать посредством редуцирующих или разрушающих ферментов, которые вовлечены в гликолитический путь, цикл трикарбоновых кислот, или способом дыхательной цепи, которые неблагоприятно влияют на продуцирование L-треонина, ферментов, которые регулируют экспрессию генов, или ферментов системы биосинтеза побочных продуктов. Примеры способа улучшения эффективности продуцирования L-треонина включают способ модифицирования микроорганизма для усиления экспрессии ферментов, которые вовлечены в путь биосинтеза L-треонина. Ферменты, которые вовлечены в биосинтез L-треонина, включают гомосерин-дегидрогеназу, гомосерин-киназу, треонин-синтазу и экспортер треонина. Другие примеры способа придания или усиления способности продуцировать L-треонин включают способ ввода мутации для создания гомосерин-дегидрогеназы, устойчивой к обратной связи посредством треонина (US 6649379). В конкретном примере настоящего изобретения мутантный микроорганизм KFCC10881-THR (регистрационный номер: КССМ11222Р) создавали путем модифицирования KFCC10881 для получения резистентности к аналогу L-треонина AHV (2-амино-3-гидроксивалерат).
Конкретно, модифицированный микроорганизм Corynebacterium sp. может представлять собой модифицированный микроорганизм Corynebacterium sp. для продуцирования L-аминокислоты и рибофлавина с высокими концентрациями, который получают путем модифицирования микроорганизма Corynebacterium sp., обладающего способностью продуцирования L-аминокислоты на высоком уровне, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-аминокислоты на высоком уровне, как результат усиления активности ферментов, которые экспрессируются посредством rib-оперона. Кроме того, он может представлять собой микроорганизм, полученный путем усиления активности фермента, который экспрессируется семейством генов биосинтеза рибофлавина rib-оперона.
Способ усиления активности фермента может представлять собой, например, один или более способов, выбранных из группы, состоящей из способа увеличения числа внутриклеточных копий гена, кодирующего каждый фермент "оперона или семейства ферментов" (в дальнейшем в этом документе называется "семейством ферментов"), способа введения мутации в регулирующую экспрессию последовательность для хромосомного гена, кодирующего каждый фермент указанного семейства ферментов, способа замены регулирующей экспрессию последовательности для хромосомного гена, кодирующего каждый фермент указанного семейства ферментов, на последовательность, имеющую сильную активность, способа замещения хромосомного гена, кодирующего фермент, мутированным геном для увеличения активности указанного семейства ферментов, и способа введения мутации в хромосомный ген, кодирующий каждый фермент указанного семейства ферментов, для усиления активности указанного семейства генов, но не ограничиваются этим. Такой способ можно выполнять посредством разных способов, известных в данной области техники. Конкретно, способ может представлять собой способ замены регуляторной последовательности для хромосомного гена, кодирующего семейство ферментов, которое экспрессируется посредством rib-оперона, на сильный промотор, способ вставки сильного промотора выше хромосомного гена, кодирующего RibG (пиримидиндеаминазу-редуктазу), расположенного перед семейством генов биосинтеза рибофлавина, или способ увеличения числа внутриклеточных копий гена, кодирующего либо семейство ферментов, которое экспрессируется посредством rib-оперона, либо семейство ферментов, которое экспрессируется семейством генов биосинтеза рибофлавина.
Выражение "увеличение числа внутриклеточных копий" может включать случай, при котором ген, кодирующий фермент, функционально связывают с хромосомой для стабильной экспрессии фермента или случай, при котором вектор, содержащий ген, кодирующий фермент, функционально трансформируют в хромосому для стабильной экспрессии фермента. При использовании в данном описании изобретения термин "вектор" относится к ДНК-конструкции, содержащей нуклеотидную последовательность гена, функционально связанного с подходящей регуляторной последовательностью, чтобы экспрессировать целевой ген в подходящей клетке-хозяине.
На основе результатов, полученных путем увеличения числа копий гена, кодирующего фермент, который экспрессируется посредством rib-оперона, в хромосомной ДНК, любому специалисту в данной области техники будет очевидно, что увеличением числа копий гена, кодирующего фермент, который экспрессируется посредством rib-оперона, за пределами хромосомы посредством вектора, модификацией регуляторного участка гена, кодирующего фермент, который экспрессируется посредством rib-оперона, внутри или вне хромосомы, или модификаций самого гена для увеличения экспрессии можно достигать одного и того же результата.
При использовании вектора можно получать микроорганизм, имеющий усиленную активность фермента, который экспрессируется посредством rib-оперона, путем трансформации микроорганизма Corynebacterium sp., обладающего способностью продуцирования L-аминокислоты, при помощи рекомбинантного вектора, имеющего нуклеотидную последовательность, включенную в него. Вектор, который можно использовать в настоящем изобретении, не ограничен конкретно, и можно использовать в настоящем изобретении известный вектор. Примеры векторов, которые можно использовать в настоящем изобретении, включают векторы pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322 и pMW118. В конкретном примере настоящего изобретения использовали pECCG117.
У прокариот регуляторная последовательность включает промотор, способный к инициации транскрипции, любой оператор для регуляции этой транскрипции, подходящий участок связывания рибосомы (RBS), кодирующий подходящий участок связывания рибосомы мРНК, последовательность регуляции терминации транскрипции и последовательность регуляции терминации трансляции.
Вместо свойственного организму промотора, расположенного выше гена, кодирующего фермент, можно применять улучшенный промотор, имеющий мутацию замены нуклеотида, образованный из свойственного организму промотора или гетерогенного промотора. Примеры гетерогенного промотора включают промотор pcj7, промотор lysCP1, промотор EF-Tu, промотор groEL, промотор асеА, промотор асеВ и тому подобные. Конкретно, можно применять промотор pcj7 или промотор lysCP1 из Corynebacterium. Наиболее конкретно, можно применять промотор lysCP1.
При использовании в данном описании изобретения термин "промотор lysCP1" обозначает промотор, улучшенный путем замены нуклеотида на участке промотора гена, кодирующего аспартаткиназу и аспартат полуальдегид дегидрогеназу, и сильный промотор, который увеличивает уровень экспрессии гена аспартаткиназы для ферментной активности приблизительно в 5 раз выше, чем у дикого типа (WO 2009/096689). Промотор lysCP1 может представлять собой нуклеотидные остатки 1-353 (SEQ ID NO: 6) последовательности SEQ ID NO: 17, которая содержит последовательность промотора lysCP1 и часть гена lysC-asd. Конкретно, вектор конструировали так, чтобы улучшенный промотор SEQ ID NO: 5, содержащий мутацию замены нуклеотида, или улучшенный промотор гена lycC, lysCP1 из SEQ ID NO: 6, имеющий сильную активность индуцирования экспрессии, можно было вводить в хромосому клетки-хозяина. Способы сверхэкспрессирования целевого гена включают способ улучшения промотора путем замещения некоторых нуклеотидов последовательности свойственного организму промотора на другие нуклеотиды для увеличения уровня экспрессии, или способ замещения промотора на промотор другого гена, имеющего высокий уровень экспрессии (WO 2009/096689).
При использовании в данном описании изобретения, термин "трансформация" означает полную операцию включения гена в клетку-хозяина, Corynebacterium sp., для его экспрессии в клетке-хозяине. В этом смысле, промотор и ген представляют собой полинуклеотиды, включая ДНК и РНК. Поскольку ген можно вводить в клетку-хозяина и экспрессировать в ней, можно использовать любой тип гена. Например, можно вводить ген в клетку-хозяина в форме кассеты экспрессии, которая представляет собой полинуклеотидную конструкцию, включающую все элементы для экспрессии гена. Кассета экспрессии включает промотор, который функционально связывают с геном, сигнал терминации транскрипции, RBS и сигнал терминации трансляции. Кассета экспрессии может иметь форму экспрессионного вектора, способного к саморепликации. Ген также можно вводить в клетку-хозяина отдельно или в полинуклеотидной конструкции, подлежащей функциональному соединению с последовательностью, необходимой для экспрессии в клетке-хозяине.
Способы трансформации вектора по настоящему изобретению включают любой способ включения нуклеиновой кислоты в клетку, и в зависимости от клетки-хозяина может быть выбрана подходящая стандартная методика трансформации, известная в данной области техники. Примеры способа трансформации включают электропорацию, осаждение фосфата кальция (Са3(PO4)2), осаждение хлорида кальция (CaCl2), микроинъекцию, способ с полиэтиленгликолем (ПЭГ), способ с диэтиламиноэтил-декстраном (ДЭАЭ-декстран), катионно-липосомный способ, способ с ацетатом лития-ДМСО (диметилсульфоксид) и тому подобные.
Клетка-хозяин по настоящему изобретению может представлять собой хозяина, в который ДНК вводится с высокой эффективностью и экспрессируется с высокой эффективностью. Конкретно, можно использовать микроорганизм Corynebacterium sp., как описано выше. Более конкретно, можно использовать Corynebacterium glutamicum, в частности, Corynebacterium glutamicum KFCC10881. В качестве микроорганизма, обладающего способностью продуцирования L-треонина, можно использовать любой микроорганизм, способный продуцировать L-треонин, без ограничения. Конкретно, можно использовать KFCC10881-THR (регистрационный номер: КССМ11222Р).
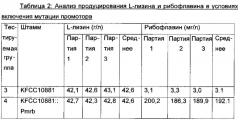
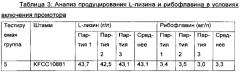
Конкретно, микроорганизм можно получать путем замены промотора, расположенного выше хромосомного участка, кодирующего семейство ферментов, которое экспрессируется посредством rib-оперона, на промотор SEQ ID NO: 5, или путем замены вышележащего промотора гена ribG на промотор SEQ ID NO: 6. В конкретном примере настоящего изобретения промотор штамма KFCC10881 заменяли на промотор SEQ ID NO: 5 и, в результате, было показано, что средняя концентрация L-лизина не изменяется, но средняя концентрация рибофлавина повышается примерно в 61 раз (Таблица 2). Также обнаружили что, если вышележащий промотор гена ribG заменяли на промотор SEQ ID NO: 6, то средняя концентрация рибофлавина повышалась примерно в 73 раза (Таблица 3), и если повышали число копий rib-оперона, то средняя концентрация рибофлавина повышалась в 66 раз (Таблица 4). Кроме того, было показано, что, если промотор штамма KFCC10881-THR, продуцирующего L-треонин, заменяли на промотор SEQ ID NO: 5 или 6, то средняя концентрация L-треонина изменялась редко, но концентрации рибофлавина повышались в 56 раз и в 66 раз, соответственно (Таблица 6).
Конкретно, микроорганизм Corynebacterium sp., обладающий способностью продуцировать L-лизин или L-треонин, можно модифицировать для продуцирования рибофлавина в высокой концентрации вместе с L-лизином или L-треонином в высокой концентрации посредством вставки сильного промотора перед геном, кодирующим Rpe (рибулозо-5-фосфат-3-эпимеразу), расположенным выше rib-оперона, или посредством вставки сильного промотора выше гена, кодирующего RibG (деаминазу-редуктазу пиримидинов), расположенного перед семейством генов биосинтеза рибофлавина (ФИГ. 2), для усиления активности семейства ферментов, кодируемого посредством rib-оперона или семейством генов биосинтеза рибофлавина. В конкретном примере настоящего изобретения было обнаружено, что в нуклеотидной последовательности с -10го до -16го нуклеотидного остатка нуклеотидной последовательности rpe, расположенной выше rib-оперона штамма КССМ11223Р, имели место мутации. Таким образом, предполагаемый участок промотора (SEQ ID NO: 5) rib-оперона штамма КССМ11223Р клонировали и затем вводили в хромосому родительского штамма, обладающего способностью продуцировать L-лизин, и в результате было обнаружено, что продуцирование рибофлавина в штамме увеличивалось до уровня, аналогичного уровню в штамме КССМ11223Р, при сохранении продуцирования L-лизина (Таблица 2). Таким образом, предположили, что продуцирование рибофлавина может быть повышено путем усиления rib-оперона, и вводили сильный промотор выше ribG, расположенного перед семейством генов биосинтеза рибофлавина в rib-оперона, и в результате было показано, что продуцирование рибофлавина в модифицированном штамме повышалось примерно в 73 раза по сравнению с родительским штаммом (Таблица 3). Кроме того обнаружили, что даже если повышали число копий rib-оперон, продуцирование рибофлавина повышалось до уровня, аналогичного уровню при применении сильного промотора (Таблица 4). Кроме того, когда промотор выше rpe в родительском штамме, обладающем способностью продуцирования L-треонина, заменяли на промотор SEQ ID NO: 5 согласно настоящему изобретению, и когда сильный промотор вводили выше ribG, обнаружили, что продуцирование рибофлавина увеличивалось примерно в 60-70 раз при сохранении продуцирования L-треонина на уровне, аналогичном родительскому штамму (Таблица 6). Таким образом, обнаружили, что изобретательский микроорганизм Corynebacterium sp., полученный путем модификации родительского штамма для увеличения продуцирования рибофлавина при сохранении продуцирования аминокислоты на высоком уровне, может продуцировать L-аминокислоту и рибофлавин в высоких концентрациях в одно и то же время.
Конкретно, модифицированный микроорганизм Corynebacterium sp., который одновременно продуцирует L-лизин и рибофлавин, может представлять собой Corynebacterium glutamicum (регистрационный номер: КССМ11223Р), модифицированный путем индуцирования случайной мутации в Corynebacterium glutamicum, обладающем способностью продуцирования L-лизина на высоком уровне, чтобы увеличивать продуцирование рибофлавина при сохранении продуцирования L-лизина на высоком уровне. Кроме того, это может быть модифицированный Corynebacterium glutamicum (регистрационный номер: КССМ11220Р, КССМ11221Р или КССМ11223Р), полученны