Липосомы с липидами, имеющими преимущественное значение рка, для доставки рнк
Иллюстрации
Показать всеПредложенная группа изобретений относится к области невирусной доставки РНК для иммунизации. Предложена липосома для доставки in vivo РНК в клетку позвоночного животного, имеющая липидный бислой, содержащий липид, имеющий третичный амин и значение рКа от 5,0 до 6,8, который инкапсулирует водное ядро, включающее РНК, кодирующую иммуноген. Предложены также фармацевтическая композиция, содержащая указанную липосому, способ получения липосомы, способ индукции защитного иммунного ответа у позвоночного животного и применение липосомы или фармацевтической композиции для индукции защитного иммунного ответа у позвоночного животного. Предложенная группа изобретений обеспечивает эффективную доставку in vivo РНК для индукции защитного иммунного ответа у позвоночного животного. 5 н. и 10 з.п. ф-лы, 21 ил., 18 табл., 1 пр.
Реферат
Данная заявка заявляет приоритет предварительных заявок на патент США 61/361830 (поданной 6 июля 2010) и 61/378837 (поданной 31 августа 2010), полное содержание обеих заявок включено в данный документ для сведения для всех целей.
Область техники, к которой относится изобретение
Данное изобретение относится к области невирусной доставки РНК для иммунизации.
Уровень техники
В течение нескольких лет доставка нуклеиновых кислот для иммунизации животных является целью научных исследований. Тестировались различные подходы, при применении ДНК или РНК, такие как доставка с использованием вирусных и невирусных носителей (даже доставка без носителя в «голой» вакцине) реплицирующихся или нереплицирующихся векторов или вирусных, или невирусных векторов.
Остается потребность в дополнительных и улучшенных нуклеиновокислотных вакцинах.
Раскрытие изобретения
Согласно изобретению РНК, кодирующую иммуноген, доставляют в липосоме в целях иммунизации. Липосома включает липиды, которые имеют значение pKa в пределах от 5,0 до 7,6. В идеальном варианте липид со значением pKa в данных пределах содержит третичный амин; такие липиды ведут себя иначе по сравнению с липидами, такими как DOTAP или DC-Chol, которые содержат группу четвертичного амина. При физиологических значениях рН амины с pKa в пределах от 5,0 до 7,6 имеют нейтральный или пониженный поверхностный заряд, в то время как липид, такой как DOTAP, является сильно катионным. Заявители настоящего изобретения установили, что липосомы, образованные липидами с четвертичным амином (например, DOTAP), являются менее подходящими для доставки иммуноген-кодирующей РНК, чем липосомы, образованные липидами с третичным амином (например, DLinDMA).
Таким образом, изобретение относится к липосоме, имеющей липидный бислой, инкапсулирующий водное ядро, где (i) липидный бислой содержит липид, имеющий значение pKa от 5,0 до 7,6, и предпочтительно содержащий третичный амин, и (ii) водное ядро включает РНК, которая кодирует иммуноген. Такие липосомы подходят для доставки в условиях in vivo РНК в клетку позвоночных животных и, таким образом, они пригодны в качестве компонентов в фармацевтических композициях для иммунизации субъектов против вирусных заболеваний.
Изобретение также относится к способу получения РНК-содержащей липосомы, включающему стадии: (а) смешивание РНК с липидом при рН, который ниже pKa липида, но который выше 4,5, с образованием липосомы, в которой инкапсулирована РНК; и (b) повышение рН полученной липосома-содержащей смеси до значения, которое выше pKa липида.
Липосома
В изобретении используются липосомы, в которых инкапсулирована РНК, кодирующая иммуноген. Таким образом, РНК отделена (как и в природном вирусе) от внешней среды липидным бислоем липосомы, и было установлено, что такое инкапсулирование защищает РНК от расщепления РНКазой. Липосомы могут включать некоторое количество внешней РНК (например, на их поверхности), но, по меньшей мере, половина РНК (и в идеальном варианте вся РНК) инкапсулирована в ядре липосомы. Инкапсулирование в липосомах отличается, например, от комплексов липид/РНК, раскрытых в источнике 1.
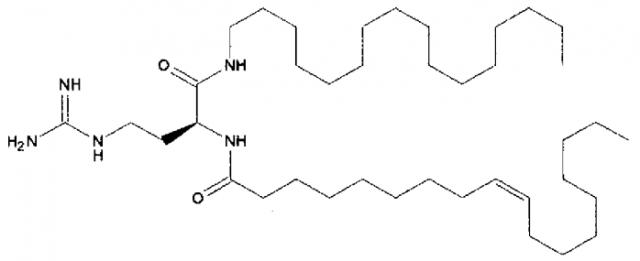
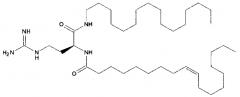
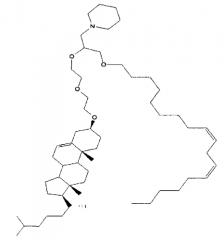
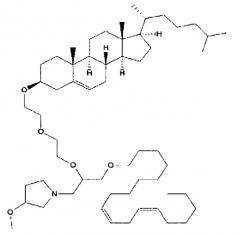
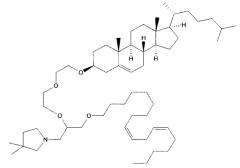
Различные амфифильные липиды могут образовать бислои в водной среде с инкапсулированием РНК-содержащего водного ядра в виде липосомы. Такие липиды содержат анионную, катионную или цвитерионную гидрофильную «головку». Липосомы по изобретению содержат липид, имеющий значение pKa в пределах от 5,0 до 7,6, и предпочтительные липиды с pKa в этих пределах содержат третичный амин. Например, они могут содержать 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DLinDMA; pKa 5,8) и/или 1,2-дилиноленилокси-N,N-диметил-3-аминопропан (DLenDMA). Другим подходящим липидом, содержащим третичный амин, является 1,2-диолеилокси-N,N-диметил-3-аминопропан (DODMA). Смотри фиг.3 и источник 2. Также можно использовать некоторые аминолипиды из источника 3, а также некоторые аминолипиды из источника 4. Дополнительные подходящие липиды с третичными аминами в их «головках» раскрыты в источнике 5, полное содержание которого включено в данный документ для сведения.
Липосомы по изобретению также можно получить из одного липида или из смеси липидов, при условии, что, по меньшей мере, один из липидов имеет значение pKa в пределах от 5,0 до 7,6 (и предпочтительно содержит третичный амин). В данных пределах значений pKa предпочтительные липиды имеют pKa от 5,5 до 6,7, например, в пределах от 5,6 до 6,8, от 5,6 до 6,3, от 5,6 до 6,0, от 5,5 до 6,2 или от 5,7 до 5,9. pKa представляет рН, при котором 50% липидов заряжено, находясь в середине между точкой, при которой липиды полностью заряжены, и точкой, при которой липиды полностью не заряжены. Этот показатель можно определить различными путями, но предпочтительно с использованием способа, раскрытого ниже в разделе под заголовком «Определение pKa». Как правило, pKa следует определять для одного липида в большей степени, чем для липида в контексте смеси, которая также включает другие липиды (например, отлично от того, как описано в источнике 6, который в большей степени относится к pKa SNALP, чем для отдельных липидов).
Когда липосому по изобретению получают из смеси липидов, то предпочтительно, чтобы относительное количество липидов, которые имеют pKa в требуемых пределах, составляло 20-80% от общего содержания липидов в смеси, например, находилось в пределах 30-70% или 40-60%. Например, ниже показаны подходящие липосомы, в которых 40% или 60% от общего содержания липидов представлял липид с pKa в требуемых пределах. Остальная часть может представлять, например, холестерин (например, в смеси может находиться 35-50% холестерина) и/или DMG (необязательно ПЭГилированного), и/или DSPC. Такие смеси используются ниже. Такие % значения являются моль процентами.
Липосома может содержать амфифильный липид, в котором гидрофильный фрагмент ПЭГилирован (т.е. модифицирован ковалентным присоединением полиэтиленгликоля). Такая модификация может повысить стабильность и предупредить неспецифическую адсорбцию липосом. Например, липиды можно конъюгировать с ПЭГом с использованием методов, которые раскрыты в источниках 6 и 7. ПЭГ обеспечивает липосомы с оболочкой, которая придает ей благоприятные фармакокинетические свойства. Сочетание эффективного инкапсулирования РНК (в частности, самореплицирующейся РНК), катионного липида, имеющего значение pKa в пределах 5,0-7,6 и ПЭГилированной поверхности обеспечивают эффективную доставку к многочисленным типам клеток (включая иммунные и неиммунные клетки), тем самым вызывая более сильный и лучший иммунный ответ по сравнению с тем, когда используются четвертичные амины без ПЭГилирования. Можно использовать ПЭГ молекулярной массы, например, 0,5-8 kDa.
Липиды, используемые по изобретению, могут быть насыщенными или ненасыщенными. Применение, по меньшей мере, одного ненасыщенного липида для получения липосом является предпочтительным. На фиг.3 показано три подходящих ненасыщенных липида. Если ненасыщенный липид имеет два «хвоста», то оба «хвоста» могут быть ненасыщенными, или он может иметь один насыщенный «хвост» или ненасыщенный «хвост».
В примерах используется смесь DSPC, DLinDMA, PEG-DMG и холестерина. Независимым аспектом изобретения является липосома, содержащая DSPC, DLinDMA, ПЭГ-DMG и холестерин. Такая липосома предпочтительно инкапсулирует РНК, такую как самореплицирующаяся РНК, например, кодирующая иммуноген.
Липосомальные частицы обычно разделяют на три группы: мультиламеллярные везикулы (MLV); небольшие униламеллярные везикулы (SUV) и крупные униламеллярные везикулы (LUV). MLV имеют многочисленные бислои в каждой везикуле, образуя несколько отдельных водных компартментов. SUV и LUV имеют один бислой, инкапсулирующий водное ядро; как правило, SUV имеют диаметр ≤50 нм, и LUV имеют диаметр >50 нм. В идеальном варианте липосомальные частицы по изобретению являются LUV с диаметром в пределах 50-220 нм. Для композиции, содержащей популяцию LUV с различными диаметрами, имеются следующие условия: (i) по меньшей мере, 80% по количеству должно иметь диаметры в пределах 20-220 нм, (ii) в идеальном варианте средний диаметр (Zav по интенсивности) в популяции находится в пределах 40-200 нм и/или (iii) диаметры должны иметь показатель полидисперсности <2. Полагают, что комплексы липосома/РНК из источника 1 имеют диаметр в пределах 600-800 нм, и для них характерна высокая полидисперсность. Липосома должна быть по существу сферической.
Способы приготовления подходящих липосом являются хорошо известными в данной области, например, смотри источники 8-10. Один подходящий способ описан в источнике 11, и он включает смешивание (i) этанольного раствора липидов, (ii) водного раствора нуклеиновой кислоты и (iii) буфера с последующим перемешиванием, уравновешиванием, разведением и выделением. Предпочтительные липосомы по изобретению получают данным способом смешивания.
Способ смешивания
Как уже указывалось выше, изобретение относится к способу получения РНК-содержащей липосомы, включающему стадии: (а) смешивания РНК с липидом при рН, который ниже значения pKa липида, но выше 4,5; затем (b) повышение рН до значения, которое выше pKa липида.
Таким образом, катионный липид положительно заряжен во время образования липосомы на стадии (а), но затем изменение рН означает, что большинство (или все) положительно заряженные группы становятся нейтральными. Такой способ является преимущественным для приготовления липосом по изобретению, и избегая достичь рН ниже 4,5 на стадии (а), повышается стабильность инкапсулированной РНК.
Значения рН на стадии (а) находятся выше 4,5, и в идеальном варианте выше 4,8. Используя рН в пределах от 5,0 до 6,0 или в пределах 5,0 до 5,5, можно получить подходящие липосомы.
Повышенное значение рН на стадии (b) выше значения pKa липида. В идеальном варианте рН повышают до рН ниже 9 и предпочтительно ниже 8. В зависимости от pKa липида рН на стадии (b) можно, таким образом, повысить до пределов 6-8, например, до рН, равного 6,5±0,3. Повышения рН на стадии (b) можно достичь переносом липосом в подходящий буфер, например, забуференный фосфатом физиологический раствор. В идеальном варианте повышение рН на стадии (b) моно провести после образования липосом.
РНК, используемая на стадии (а), может находиться в водном растворе, который смешивают с органическим раствором липида (например, этанольным раствором, как описано в источнике (11)). Затем смесь разводят с получением липосом, после чего рН можно повысить на стадии (b).
РНК
Изобретение является подходящим для доставки в условиях in vivo РНК, которая кодирует иммуноген. РНК транслируется неиммунными клетками в месте доставки, приводя к экспрессии иммуногена, и она также стимулирует иммунные клетки к секреции интерферонов I и/или провоспалительных цитокинов, которые обеспечивают местный адъювантный эффект. Неиммунные клетки также могут секретировать интерфероны типа I и/или провоспалительные цитокины в ответ на РНК.
РНК является плюс-цепочечной и, таким образом, может транслироваться неиммунными клетками без необходимости в каких-либо промежуточных стадиях репликации, таких как обратная транскрипция. Она также может связываться с рецепторами TLR7, которые экспрессируются иммунными клетками, тем самым инициируя адъювантный эффект.
Предпочтительные плюс-цепочечные РНК являются самореплицирующимися молекулами. Молекула самореплицирующейся РНК (репликон), когда доставляется в клетки позвоночных животных даже без каких-либо белков, приводит к продукции многочисленных дочерних РНК транскрипцией из нее самой (посредством антисмысловой копии, которую она генерирует из себя самой). Таким образом, молекула самореплицирующейся РНК обычно представляет плюс-цепочечную молекулу, которая может непосредственно транслироваться после доставки в клетку, и такая трансляция обеспечивает РНК-зависимую РНК-полимеразу, которая затем продуцирует антисмысловые и смысловые транскрипты из доставленной РНК. Таким образом, доставленная РНК приводит к продукции многочисленных дочерних копий РНК. Такие дочерние РНК, а также коллинеарные субгеномные транскрипты, могут транслировать самих себя с обеспечением экспрессии in situ кодированного иммуногена, или могут транскрибироваться с обеспечением дополнительных транскриптов с тем же смыслом, что и доставленная РНК, которые транслируются с обеспечением экспрессии in situ иммуногена. В целом результаты данной последовательности транскрипций представляют высокую амплификацию копий введенных РНК-репликонов и, таким образом, кодированный иммуноген становится основным полипептидным продуктом клеток.
Как показано ниже, для РНК не требуется самореплицирующейся активности для обеспечения адъювантного эффекта, хотя, она может повысить секрецию цитокинов после трансфекции. Самореплицирующаяся активность является особенно пригодной для достижения высокого уровня экспрессии иммуногена неиммунными клетками. Она также может повысить апоптоз неиммунных клеток.
Одной подходящей системой для достижения саморепликации является применение РНК-репликона на основе альфа-вируса. Такие плюс-цепочечные репликоны транслируются после доставки в клетку с получением репликазы (или репликазы-транскриптазы). Репликаза транслируется в виде полипротеина, который саморасщепляется с обеспечением комплекса репликации, который продуцирует геномные минус-цепочечные копии плюс-цепочечной доставленной РНК. Такие минус-цепочечные транскрипты могут транскрибировать их самих с образованием дополнительных копий плюс-цепочечной исходной РНК и также могут генерировать субгеномный транскрипт, который кодирует иммуноген. Трансляция субгеномного транскрипта, таким образом, приводит к экспрессии in situ иммуногена инфицированной клеткой. В подходящих репликонах на основе альфа-вирусов можно использовать репликазу из вируса Синдбис, вируса леса Семлики, вируса восточного энцефалита лошадей, вируса венесуэльского энцефалита лошадей и т.д. В репликонах могут использоваться последовательности мутантных вирусов или вирусов дикого типа, например, аттенуированный мутант TC83 VEEV [12].
Таким образом, предпочтительная молекула самореплицирующейся РНК кодирует (i) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК из молекулы самореплицирующейся РНК, и (ii) иммуноген. Полимераза может представлять репликазу альфа-вируса, например, включающую один или более альфа-вирусных белков nsP1, nsP2, nsP3 и nsP4.
Несмотря на то, что геномы природных альфа-вирусов кодируют структурные белки вирионов в дополнении к неструктурному полибелку репликазы, предпочтительно, чтобы молекула самореплицирующейся РНК по изобретению не кодировала структурные белки альфавирусов. Таким образом, предпочтительная самореплицирующаяся РНК может приводить к продукции копий геномной РНК ее самой в клетке, но не продуцировать РНК-содержащие вирионы. Отсутствие способности продуцировать такие вирионы означает, что в отличие от альфа-вируса дикого типа, молекула самореплицирующейся РНК не может сохранять себя в инфекционной форме. Структурные белки альфа-вируса, которые необходимы для сохранения в вирусах дикого типа, отсутствуют из самореплицирующихся РНК по изобретению и их место занято геном(и), кодирующими интересующих иммуноген, так, что субгеномный транскрипт кодирует иммуноген в большей степени, чем структурные белки альфа-вирусного вириона.
Таким образом, молекула самореплицирующейся РНК, подходящая для изобретения, может иметь две открытых рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу; вторая (3') открытая рамка считывания кодирует иммуноген. В некоторых вариантах осуществления РНК может иметь дополнительные (например, даунстрим) открытые рамки считывания, например, для кодирования дополнительных иммуногенов (смотри ниже) или для кодирования вспомогательных полипептидов.
Молекула самореплицирующейся РНК может содержать 5'-последовательность, которая совместима с кодированной репликазой.
Молекулы самореплицирующейся РНК могут иметь различную длину, но, как правило, их длина составляет 5000-25000 нуклеотидов, например, 8000-15000 нуклеотидов или 9000-12000 нуклеотидов. Таким образом, РНК длиннее, чем длина, наблюдаемая в системе siPHK доставки.
Молекула РНК, подходящая для изобретения, может содержать 5'-кэп (например, 7-метилгуанозин). Такая кэп-структура может повышать трансляцию РНК in vitro.
5'-нуклеотид молекулы РНК, подходящей для изобретения, содержит 5'-трифосфатную группу. В кэпированной РНК она может быть связана с 7-метилгуанозином посредством 5'-5' мостика. 5'-трифосфат может повышать связывание с RIG-I и, таким образом, стимулировать адъювантные эффекты.
Молекула РНК может содержать 3'-поли-А-хвост. Она также может содержать последовательность распознавания поли-А-полимеразы (например, AAUAAA) около 3'-конца.
Молекула РНК, подходящая для изобретения, как правило, является одноцепочечной. Одноцепочечные РНК обычно инициируют адъювантный эффект посредством связывания с TLR7, TLR8, РНК-геликазами и/или PKR. Доставленная в двухцепочечной форме РНК (dsPHK) может связываться c TLR3, и этот рецептор также может запускаться dsPHK, которая образуется во время репликации одноцепочечной РНК или находится во вторичной структуре одноцепочечной РНК.
Молекулу РНК, подходящую для изобретения, можно соответственно получить транскрипцией в условиях in vitro (IVT). При IVT можно использовать матрицу (кДНК), полученную и размноженную в плазмидной форме в бактериях, или получить синтетически (например, методами генной инженерии, синтезом гена и/или полимеразной цепной реакцией (ПЦР)). Например, ДНК-зависимую РНК-полимеразу (такую как РНК-полимеразы бактериофага Т7, Т3 или SP6) можно использовать для транскрибирования РНК с ДНК-матрицы. Можно использовать соответствующие реакции кэпирования и поли-А-добавления, в зависимости от того, что требуется (хотя, поли-А-хвост репликона обычно кодирован в ДНК-матрице). Такие РНК-полимеразы могут иметь строгие требования для транскрибированного 5'-нуклеотида(в), и в некоторых вариантах осуществления такие требования должны соответствовать требованиям кодированной репликазы для гарантии того, что транскрибированная IVT РНК может эффективно функционировать в качестве субстрата для ее самокодированной репликазы.
Как обсуждается в источнике 13, самореплицирующаяся РНК может содержать (в дополнении к 5'-кэпированной структуре) один или более модифицированных азотистых оснований. Таким образом, РНК может включать m5C (5-метилцитидин), m5U (метилуридин), m6A (N6-метиладенозин), s2U (2-тиоуридин), Um (2'-О-метилуридин), m1A (1-метиладенозин); m2A (2-метиладенозин); Am (2'-О-метиладенозин); ms2m6A (2-метилтио-N6-метиладенозин); i6A (N6-изопентениладенозин); ms2i6A (2-метилтио-N6-изопентениладенозин); io6A (N6-(цис-гидроксиизопентенил)аденозин); ms2io6A (2-метилтио-N6-(цис-гидроксиизопентенил)аденозин); g6A (N6-глицинилкарбамоиладенозин); t6A (N6-треонилкарбамоиладенозин); ms2t6A (2-метилтио-N6-треонилкарбамоиладенозин); m6t6A (N6-метил-N6-треонилкарбамоиладенозин); hn6A (N6-гидроксинорвалилкарбамоиладенозин); ms2hn6A (2-метилтио-N6-гидроксинорвалилкарбамоиладенозин); Ar(p) (2'-О-рибозиладенозин (фосфат)); I (инозин); m11 (1-метилинозин); m'Im (1,2'-О-диметилинозин); m3C (3-метилцитидин); Cm (2Т-О-метилцитидин); s2C (2-тиоцитидин); ас4С (N4-ацетилцитидин); f5C (5-фоннилцитидин); m5Cm (5,2-О-диметилцитидин); ac4Cm (N4-ацетил-2ТО-метилцитидин); k2C (лизидин); m1G (1-метилгуанозин); m2G (N2-метилгуанозин); m7G (7-метилгуанозин); Gm (2'-О-метилгуанозин); m22G (N2,N2-диметилгуанозин); m2Gm (N2,2'-O-диметилгуанозин); m22Gm (N2,N2,2'-O-триметилгуанозин); Gr(p)(2'-O-рибозилгуанозин (фосфат)); yW (вибутозин); o2yW (пероксивибутозин); OHyW (гидроксивибутозин); OHyW* (немодифицированный гидроксивибутозин); imG (виозин); mimG (метилгуанозин); Q (квеозин); oQ (эпоксиквеозин); galQ (галтактозилквеозин); manQ (маннозилквеозин); preQ (7-циано-7-деазагуанозин); preQi (7-аминометил-7-деазагуанозин); G (археозин); D (дигидроуридин); m5Um (5,2'-О-диметилуридин); s4U (4-тиоуридин); m5s2U (5-метил-2-тиоуридин); s2Um (2-тио-2'-О-метилуридин); acp3U (3-(3-амино-3-карбоксипропил)уридин); ho5U (5-гидроксиуридин); mo5U (5-метоксиуридин); cmo5U (уридин-5-оксиуксусную кислоту); mcmo5U (метиловый эфир уридин-5-оксиуксусной кислоты); chm5U (5-(карбоксигидроксиметил)уридин)); mchm5U (метиловый эфир 5-(карбоксигидроксиметил)уридина)); mcm5U (5-метоксикарбонилметилуридин); mcm5Um (S-метоксикарбонилметил-2-О-метилуридин); mcm5s2U (5-метоксикарбонилметил-2-тиоуридин); nm5s2U (5-аминометил-2-тиоуридин); mnm5U (5-метиламинометилуридин); mnm5s2U (5-метиламинометил-2-тиоуридин); mnm5se2U (5-метиламинометил-2-селеноуридин); ncm5U (5-карбамоилметилуридин); ncn5Um (5-карбамоилметилуридин); ncm5Um (5-карбамоилметил-2'-О-метилуридин); cmnm5U (5-карбоксиметиламинометилуридин); cnmm5Um (5-карбоксиметиламинометил-2-L-О-метилуридин); cmnm5s2U (5-карбоксиметиламинометил-2-тиоуридин); m62A (N6,N6-диметиладенозин); Tm (2'-О-метилинозин); m4C (N4-метилцитидин); m4Cm (N4,2-O-диметилцитидин); hm5C (5-гидроксиметилцитидин); m3U (3-метилуридин); cm5U (5-карбоксиметилуридин); m6Am (N6,T-O-диметиладенозин); rn62Am (N6,N6,О-2-триметиладенозин); m2'7G (N2,7-диметилгуанозин); m2'2'7G (N2,N2,7-триметилгуанозин); m3Um (3,2Т-О-диметилуридин); m5D (5-метилдигидроуридин); f5Cm (5-формил-2'-О-метилцитидин); m1Gm (1,2'-О-диметилгуанозин); m'Am (1,2-О-диметиладенозин)иринометилуридин); tm5s2U (S-тауринометил-2-тиоуридин); imG-14 (4-деметилгуанозин); imG2 (изогуанозин) или ас6А (N6-ацетиладенозин), гипоксантин, инозин, 8-оксоаденин, его 7-замещенные производные, дигидроурацил, псевдоурацил, 2-тиоурацил, 4-тиоурацил, 5-аминоурацил, 5-(С1-С6)алкилурацил, 5-метилурацил, 5-(С2-С6)алкенилурацил, 5-(С2-С6)алкинилурацил, 5-(гидроксиметил)урацил, 5-хлорурацил, 5-фторурацил, 5-бромурацил, 5-гидроксицитозин, 5-(С1-С6)алкилцитозин, 5-метилцитозин, 5-(С2-С6)алкенилцитозин, 5-(С2-С6)алкинилцитозин, 5-хлорцитозин, 5-фторцитозин, 5-бромцитозин, N2-диметилгуанин, 7-деазагуанин, 8-азагуанин, 7-деаза-7-замещенный гуанин, 7-деаза-7-(С2-С6)алкинилгуанин, 7-деаза-8-замещенный гуанин, 8-гидроксигуанин, 6-тиогуанин, 8-оксогуанин, 2-аминопурин, 2-амино-6-хлорпурин, 2,4-диаминопурин, 2,6-диаминопурин, 8-азапурин, замещенный 7-деазапурин, 7-деаза-7-замещенный пурин, 7-деаза-8-замещенный пурин или абазический нуклеотид. Например, самореплицирующаяся РНК может содержать одно или более модифицированных пиримидиновых азотистых оснований, таких как остатки псевдоуридина и/или 5-метилцитозина. Однако в некоторых вариантах осуществления РНК включает немодифицированные азотистые основания, и может включать немодифицированные нуклеотиды, т.е. все нуклеотиды в РНК являются обычными А, С, G и U рибонуклеотидами (за исключением 5'-кэпированной структуры, которая может содержать 7'-метилгуанозин). В других вариантах осуществления РНК может включать 5'-кэп, содержащий 7'-метилгуанозин, и первые 1, 2 или 3 5'-рибонуклеотида могут быть метилированными в 2'-положении рибозы.
В идеальном варианте РНК, используемая в изобретении, включает только фосфодиэфирные связи между нуклеотидами, но в некоторых вариантах осуществления она может содержать фосфорамидатные, фосфоротиоатные и/или метилфосфонатные связи.
В идеальном варианте липосома включает менее 10 различных видов РНК, например, 5, 4, 3 или 2 различных вида; наиболее предпочтительно липосома включает один вид РНК, т.е. молекулы РНК в липосоме имеют одинаковую последовательность и длину.
Количество РНК на липосому может варьировать. Как правило, число отдельных молекул самореплицирующихся РНК на липосому составляет ≤50, например, <20, <10, <5 или 1-4 на липосому.
Иммуноген
Молекулы РНК, используемые в изобретении, кодируют полипептидный иммуноген. После введения в липосомах РНК транслируется в условиях in vivo, и иммуноген может вызывать иммунный ответ у реципиента. Иммуноген может вызывать иммунный ответ против бактерии, вируса, гриба или паразита (или в некоторых вариантах осуществления против аллергена, и в других вариантах осуществления против опухолевого антигена). Иммунный ответ может включать ответную продукцию антител (обычно представляющих собой IgG) и/или опосредованный клетками иммунный ответ. Полипептидный иммуноген, как правило, будет вызывать иммунный ответ, в результате которого распознается соответствующий бактериальный, вирусный, грибковый или паразитарный (или аллерген или опухолевый) полипептид, но в некоторых вариантах осуществления полипептид может функционировать в качестве мимотопа для индукции иммунного ответа, который распознает бактериальный, вирусный, грибковый или паразитарный сахарид. Как правило, иммуноген является поверхностным полипептидом, например, адгезином, гемагглютинином, гликопротеином оболочки, гликопротеином шипов и т.д.
Молекулы самореплицирующейся РНК могут кодировать единичный полипептидный иммуноген или многочисленные полипептиды. Многочисленные иммуногены могут находиться в виде одного полипептидного иммуногена (слитого полипептида) или в виде отдельных полипептидов. Если иммуногены экспрессируются в виде отдельных полипептидов, то тогда один или более из них может обеспечиваться с апстрим IRE или дополнительным вирусным промоторным элементом. Альтернативно многочисленные иммуногены могут экспрессироваться из полипротеина, который кодирует отдельные иммуногены, слитые с короткой аутокаталитический протеазой (например, белок 2А вируса ящура), или в виде интеинов.
В отличие от источников 1 и 14, РНК кодирует иммуноген. Во избежание разночтений изобретение не включает РНК, которая кодирует люциферазу светляков или которая кодирует слитый белок β-галактозидазу E. coli, или которая кодирует зеленый флуоресцентный белок (GFP). Также РНК не является общей мышиной РНК тимуса.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ против одной из следующих бактерий:
Nesseria meningitides: подходящие иммуногены включают, не ограничиваясь этим, мембранные белки, такие как адгезины, аутотранспортеры, токсины, белки захвата железа и белок, связывающийся с фактором Н.
Streptococcus pneumoniae: подходящие полипептидные иммуногены описаны в источнике 16. Они включают, не ограничиваясь этим, субъединицу фимбрии RrgB, предшественник бета-N-ацетилгексозаминидазы (spr0057), spr0096, общий стресс-белок GSP-781 (spr2021, SP2216), серин-треониновую протеинкиназу StkP (SP1732) и поверхностный адгезин PsaA пневмококков.
Streptococcus pyogenes: подходящие иммуногены включают, не ограничиваясь этим, полипептиды раскрытые в источниках 17 и 18.
Moraxella catarrhalis.
Bordetella pertussis: подходящие столбнячные иммуногены включают, не ограничиваясь этим, столбнячный токсин или токсоид (РТ), нитчатый гемагглютинин (FHA), пертактин и агглютиногены 2 и 3.
Staphylococcus aureus: подходящие иммуногены включают, не ограничиваясь этим, полипептиды, раскрытые в источнике 19, такие как гемолизин, esxA, esxB, феррихром-связывающий белок (sta006) и/или липопротеин sta011.
Clostridium tetani: типичным иммуногеном является столбнячный токсоид.
Cornynebacterium diphtheriae: типичным иммуногеном является дифтерийный токсоид.
Haemophilus influenzae: подходящие иммуногены включают, не ограничиваясь этим, полипептиды, раскрытые в источниках 20 и 21.
Pseudomonas aeruginosa.
Streptococcus agalactiae: подходящие иммуногены включают, не ограничиваясь этим, полипептиды раскрытые в источнике 17.
Chlamydia trachomatis: подходящие иммуногены включают, не ограничиваясь этим, PepA, LcrE, ArtJ, DnaK, CT398, OmpH-подобный, AtoS, CT547, Eno, HtrA и MurG (например, смотри раскрытые в источнике 22. LcrE [23] и HtrA [24] являются двумя предпочтительными иммуногенами.
Chlamydia pneumoniae: подходящие иммуногены включают, не ограничиваясь этим, полипептиды раскрытые в источнике 25.
Helicobacter pylori: подходящие иммуногены включают, не ограничиваясь этим, CagA, VacA, NAP и/или уреазу [26].
Escherichia coli: подходящие иммуногены включают, не ограничиваясь этим, иммуногены, полученные из энтеротоксигенных E. coli (ETEC), энтероаггрегативных E. coli (EAggEC), диффузноадгезирующих E. coli (DAEC), энтеропатогенных E. coli (EPEC), внекишечных патогенных E. coli (ExPEC) и/или энтерогеморрагических E. coli (EHEC). Штаммы ExPEC включают уропатогенные E. coli (UPEC) и менингит/сепсис-ассоциированные E. coli (MNEC). Подходящие полипептидные иммуногены раскрыты в источниках 27 и 28. Подходящие иммуногены MNEC раскрыты в источнике 29. Подходящим иммуногеном для некоторых типов E. coli является AcfD [30].
Bacillus anthracis
Yersinia pestis: подходящие иммуногены включают, не ограничиваясь этим, полипептиды раскрытые в источниках 31 и 32.
Staphylococccus epidermis
Clostridium perfringens или Clostridium botulinums
Leggionella pneumophila
Coxiella burnetii
Brucella, такие как B. abortis, B. canis, B. melitensis, B. neotomae, B. ovis, B. suis, B. Pinnipediae.
Francisella, такие как F. novicida, F. philomiragia, F. tularensis
Neisseria gonorrhoeae
Treponema pallidum
Haemophilus ducreyi
Enterococcus faecalis или Enterococcus faecium
Staphylococcus saprophyticus
Yersinia enterocolitica
Mycobacterium tuberculosis
Rickettsia
Listeria monocytogenes
Vibrio cholerae
Salmonella typhi
Borrelia burgdorferi
Porphyrominas gingivalis
Klebsiella
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ против одного из следующих вирусов:
Ортомиксовирус: подходящие иммуногены могут происходить из вируса гриппа А, В и С, такие как гемагглютинин, нейраминидаза или матричные белки М2. В том случае, когда иммуноген представляет собой гемагглютинин вируса гриппа А, то он может происходить из любого субтипа, например, Н1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, Н11, Н12, Н13, Н14, Н15 или Н16.
Парамиксовирусы: вирусные иммуногены включают, не ограничиваясь этим, полученные из пневмовирусов (например, респираторный синцитиальный вирус, RSV), рубулавирусов (например, вирус свинки), парамиксовирусов (например, вирус парагриппа), метапневмовирусов и морбилливирусов (например, кори).
Поксвирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из ортопоксвируса, такого как Variola vera, включая, не ограничиваясь этим, Variola major и Variola minor.
Пикорнавирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из пикорнавирусов, таких как энтеровирусы, риновирусы, гепарнавирусы, кардиовирусы и афтоловирусы. В одном варианте осуществления энтеровирус является полиовирусом, например, полиовирусом типа 1, типа 2 и/или типа 3. В еще одном варианте осуществления энтеровирус представляет энтеровирус EV71. В еще одном варианте осуществления энтеровирус представляет вирус Коксаки А или В.
Буньявирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из ортобуньявируса, такого как вирус калифорнийского энцефалита, флебовируса, такого как вирус лихорадки долины Рифт, или наировируса, такого как вирус геморрагической лихорадки Крым-Конго.
Гепарнавирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из гепарнавируса, такого как вирус гепатита А (HAV).
Филовирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из филовируса, такого как вирус Эбола (включая подтипы вируса Эбола заирский, побережья Ивори, рестонский или суданский) или вирус Марбурга.
Тогавирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из тогавируса, такого как рубивирус, альфа-вирус или артеривирус. Они включают вирус краснухи. rubella
Флавивирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из флавивируса, такого как вирус клещевого энцефалита (TBE), вирус Денге (тип 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус болезни кьясанурского леса, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луис, вирус русского весеннего-летнего энцефалита, вирус энцефалита Повассан.
Пестивирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из пестивирусов, вызывающих вирусную диарею крупного рогатого скота (BVDV), классическую лихорадку свиней (CSFV) или пограничную болезнь (BDV).
Гепаднавирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из гепаднавируса, такого как вирус гепатита В. Композиция может включать поверхностный антиген вирус гепатита В (HBsAg).
Другие вирусы гепатита: композиция может включать иммуноген из вируса гепатита С, вируса гепатита-дельта, вируса гепатита Е или вируса гепатита G.
Рабдовирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из рабдовирусов, таких как лиссавирус (например, вирус бешенства) и везикуловирус (VSV).
Калицивирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из калицивируса, такого как вирус Норуолк (Norovirus) и Норуолк-подобные вирусы, такие как вирус Гавайи и вирус Снежных Гор.
Коронавирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из коронавируса SARS, вируса инфекционного бронхита птиц (IBV), вируса гепатита мышей (MHV) и вируса трансмиссивного гастроэнтерита свиней (TGEV). Иммуноген коронавируса может быть полипептидом шипов.
Ретровирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из онковируса, лентивируса (например, HIV-1 или HIV-2) или спумавируса.
Реовирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из ортореовируса, ротавируса, орбивируса или колтивируса.
Парвовирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из парвовируса B19.
Герпесвирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из герпесвирусов человека, таких как, например, приводимые только в качестве примера, вирус герпеса простого (HSV) (например, HSV типов 1 и 2), вирус опоясывающего лишая (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), герпесвирус человека типа 6 (HHV6), герпесвирус человека типа 7 (HHV7) и герпесвирус человека типа 8 (HHV8).
Паповавирусы: вирусные иммуногены включают, не ограничиваясь этим, полученные из папилломавирусов и полиомавирусов. Папилломавирус (человека) может представлять серотип 1, 2, 3, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 или 65, например, одного или более серотипов 6, 11, 16 и/или 18.
Аденовирус: вирусные иммуногены включают, не ограничиваясь этим, полученные из аденовируса серотипа 36 (Ad-36).
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ против вируса, который заражает рыб, такого как вирус инфекционной анемии лососевых (ISAV), вирус болезни поджелудочной железы лососевых (SPDV), вирус инфекционного некроза поджелудочной железы (IPNV), возбудитель вирусной болезни канального сома (CCV), вирус лимфоцистиса рыб (FLDV), вирус инфекционного гематопоэтического некроза (IHNV), кои-герпесвирус, вирус, подобный пикорнавирусам у лососевых (также известный, как вирус, подобный пикорнавирусам у атлантического лосося), вирус пресноводного лосося (LSV), ротавирус атлантического лосося (ASR), вирус земляничной форели (TSD), вирус папилломатоза лосося кижуча (CSTV) или вирус геморрагической септицемии (VHSV).
Грибковые иммуногены могут быть получены из Dermatophytres, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distorum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concetricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoeleini, Trichophyton tonsurans, Trichophyton verrucosum, Trichophyton verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum и/или Trichophyton faviforme; или из Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidiodes immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, Encephalitozoon spp., Septata interstinalis и Enterocytozoon bieneusi; реже Brachiola sp., Microsporidium sp., Nosema sp., Pleistophora sp., Trachipleistophora sp., Vittaforma sp., Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Sacharomyces boulardii, Sacharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp., Mucor spp., Absidia spp., Mortierella spp., Cunninghamella spp., Saksenaea spp., Alternaria spp., Curvularia spp., Helminthosporium spp., Fusarium spp., Aspergillus spp., Penicillium spp., Monolinia spp., Rhizoctonia spp., Paecilomyces spp., Pithomyces spp. и Cladosporium spp.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ против паразита из рода Plasmodium, такого как P. falciparum, P. vivax, P. malariae или P. ovale. Таким образом, изобретение можно использовать для иммунизации против малярии. В некоторых вариантах осуществления иммуноген вызывает иммунный ответ против паразита семейства Caligidae, в частности, родов Lepeophtheirus и Caligus, например, это морская вошь, такая как Lepeophtheirus salmonis и Caligus rogercresseyi.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ против: аллергенов пыльцы (аллергенов пыльцы деревьев, травянистых растений, сорных растений и злаковых трав); аллергенов насекомых или клещей (воздушных аллергенов, аллергенов слюны и яда, например, аллергенов клещей, аллергенов тараканов и мошек, аллергенов яда отряда перепончатокрылых); аллергенов волос и перхоти животных (например, собак, кошек, лошади, крысы мыши и т.д.) и пищевых аллергенов (например, глиа