Использование производных 2-карбоксамид-циклоамино мочевины в лечении egfr-зависимых заболеваний или заболеваний с приобретенной резистентностью к агентам, нацеленным на члены egfr-семейства
Иллюстрации
Показать всеПредложена группа изобретений, касающихся лечения злокачественных опухолей. Заявлены: применение 2-амид-1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты или её соли для производства фармацевтических композиций для лечения злокачественной опухоли, комбинация данного соединения с EGFR-модуляторами в целях указанного использования, способ лечения указанного заболевания с помощью этого соединения, и фармацевтические композиции для лечения указанного заболевания. Технический результат: показана регрессия опухоли под действием заявленного соединения, показан синергизм противоопухолевого действия указанного соединения в комбинации с EGFR-модулятором. 4 н. и 6 з.п. ф-лы, 7 ил., 3 табл., 6 пр.
Реферат
Область изобретения
Настоящее изобретение относится к новому применению конкретных производных 2-карбоксамид-циклоамино-мочевины для лечения заболеваний, зависимых от рецептора эпидермального фактора роста (EGFR) (включающего в себя EGFR1, также называемого HER1 или Erb-B1; EGFR2, также называемого HER2 или Erb-B2; EGFR3, также называемого HER3 или Erb-B3, или EGFR4), или заболеваний с приобретенной резистентностью к агентам, нацеленным на члены семейства EGFR, также настоящее изобретение относится к использованию указанных соединений для производства фармацевтической композиции для лечения указанных заболеваний, к комбинациям указанных соединений с EGFR-модуляторами в целях указанного использования, к способам лечения указанных заболеваний с помощью указанных соединений, и к фармацевтическим композициям для лечения указанных заболеваний, которые содержат указанные соединения в качестве единственных агентов или в комбинации, в частности, с EGFR-модулятором.
Уровень изобретения
Соматические мутации в тирозинкиназовом домене EGFR связывают с клиническим ответом на ингибитор тирозинкиназы EGFR, например, на гефитиниб (Иресса®) или эрлотиниб (Тарцева®) (Paez et al., 2004, EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy, Science, vol.304, 1497-1500). Семейство рецепторов эпидермального фактора роста состоит из четырех подтипов, включающих в себя подтип, являющийся членом семейства ErbB-рецепторов, которые включают в себя EGFR1 (также называемый HER1 или Erb-B1); EGFR2 (также называемый HER2 или Erb-B2); и EGFR3 (также называемый HER3 или Erb-B3); и EGFR4, которые представляют собой трансмембранные белки. Приобретенная резистентность к EGFR-модуляторам возникает у тех пациентов, у которых изначально наблюдался клинический ответ на лечение, но впоследствии выявлено прогрессирование опухолей. Рефракторный ответ на ингибиторы киназы EGFR является примером вторичной мутации резистентности T790M (Kobayashi et al., 2005; EGFR mutation and resistance of non-small cell lung cancer to gefitinib, N. Engl. J. Med., Vol.352, 786-792), что сопоставимо с мутацией (мутациями) резистентности, наблюдаемыми с препаратами Gleevec/Гливек или дазатиниб при хроническом миелолейкозе (ХМЛ) (Gorre et al.; 2002; Bcr-Abl point mutants isolated from patients with imatinib mesylate resistant chronic leukemia remain sensitive to inhibitors of the Bcr-Abl chaperone heat shock protein 90, Blood, vol.100, 3041-3044), или у больных с гастроинтестинальными стромальными опухолями (GIST) (Antonescu et al.; 2005; Acquired resistance to Imatinib in gastrointestinal stromal tumors occurs through secondary gene mutation, Clin. Cancer Res., Vol.11, 4182-4190).
В литературе существуют доказательства наличия активации пути PI3K ниже по отношению к активированному EGFR. Таким образом, генетическая абляция каталитической субъединицы PI3K (p110) в мышиных эмбриональных фибробластах делает клетки устойчивыми к трансформации посредством активированных форм EGFR (Zhao et al.; 2006; The p110 alpha isoform of PI3K is essential for proper growth factor signaling and oncogenic transformation, PNAS, vol.103, 16296-16300). В опухолях, чувствительных к ингибиторам EGFR, часто выявляют сверхэкспрессию партнера HER1 (EGFR1) и HER3 (ErbB-3), одного из четырех членов семейства EGFR, и это коррелирует с конститутивным рекрутингом и активацией PI3K (Engelman et al.; 2005; ErbB-3 mediates phosphoinositide 3-kinase activity in gefitinib-sensitive non small cell lung cancer cell lines, PNAS vol.102, 3788-3793; Sergina et al.; 2007; Escape from HER-family tyrosine kinase inhibitor therapy by the kinase-inactive HER 3; Nature; vol.445, 437-41). Генетические и биохимические характеристики опухолевых биопсий и опухолевых клеточных линий, несущих амплификацию EGFR и резистентность к ингибитору EGFR, выявили состояние конститутивной активации пути PI3K (Engelman et al.; 2006; Allelic dilution obscures detection of a biologically significant resistance mutation in EGFR amplified lung cancer, The Journal of Clinical Investigation, vol.116, 2695-2706).
Было неожиданно обнаружено, что описанные в патенте WO 2010/029082 конкретные производные 2-карбоксамид-циклоамино-мочевины в качестве единственного агента и в комбинации с модуляторами киназы EGFR провоцируют сильное анти-пролиферативное действие и in vivo противоопухолевый ответ клеточных линий раковых клеток молочной железы и желудка с амплифицированными рецепторами EGFR и/или мутантными EGFR1. Таким образом, указанные соединения являются полезными при лечении EGFR-зависимого заболевания.
Сущность изобретения
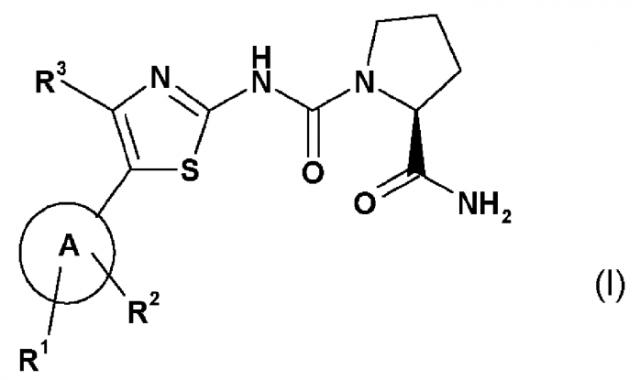
Настоящее изобретение относится к использованию соединения формулы I (называемого в изобретении "Соединение I",
или его соли, где
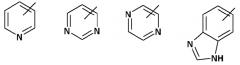
А обозначает гетероарил, который выбирают из группы, состоящей из:
R1 представляет собой один из следующих заместителей: (1) незамещенный или замещенный, предпочтительно замещенный C1-C7-алкил, при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до девяти: дейтерий, фтор или из следующих остатков от одного до двух C3-C5-циклоалкил; (2) необязательно замещенный C3-C5-циклоалкил, при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до четырех: дейтерий, C1-C4-алкил (предпочтительно метил), фтор, циано, аминокарбонил; (3) необязательно замещенный фенил, при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до двух: дейтерий, галоген, циано, C1-C7-алкил, C1-C7-алкиламино, ди(C1-C7-алкил)амино, C1-C7-алкиламинокарбонил, ди(C1-C7-алкил)аминокарбонил, C1-C7-алкокси; (4) необязательно моно- или ди-замещенные амины, при этом указанные заместители независимо выбирают из следующих функциональных остатков: дейтерий, C1-C7-алкил (который является незамещенным или замещен одним или несколькими заместителями, выбираемыми из группы дейтерия, фтора, хлора, гидрокси), фенилсульфонил (который является незамещенным или замещен одним или несколькими, предпочтительно одним C1-C7-алкилом, C1-C7-алкокси, ди(C1-C7-алкил)амино-C1-C7-алкокси); (5) замещенный сульфонил, при этом указанный заместитель выбирают из следующих функциональных групп: C1-C7-алкил (который является незамещенным или замещен одним или несколькими заместителями, выбираемыми из группы дейтерия, фтора), пирролидино (который является незамещенным или замещен одним или несколькими заместителями, выбираемыми из группы дейтерия, гидрокси, оксо; в частности, замещен одной оксо-группой); (6) фтор, хлор;
R2 представляет собой водород;
R3 представляет собой (1) водород, (2) фтор, хлор, (3) необязательно замещенный метил,
при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до трех: дейтерий, фтор, хлор, диметиламино;
за исключением 2-амид 1-({5-[2-(трет-бутил)пиримидин-4-ил]-4-метил-тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты,
для лечения EGFR-зависимых заболеваний, в особенности злокачественных опухолей, или заболеваний, обусловленных приобретенной резистентностью к EGFR.
Настоящее изобретение также относится к применению соединения формулы I, определение которого приведено выше, или его соли для производства фармацевтической композиции для лечения EGFR-зависимого заболевания, или злокачественного новообразования, или заболевания с приобретенной резистентностью к EGFR-модулятору.
Настоящее изобретение дополнительно относится к применению соединения формулы I для лечения EGFR-зависимых заболеваний, или злокачественных новообразований, или заболеваний с приобретенной резистентностью к EGFR-модулятору, в комбинации с другими активными соединениями, например, с комбинационными партнерами, как описано в WO 2010/029082. Наиболее предпочтительными являются нацеливающие агенты семейства EGFR.
Настоящее изобретение также относится к комбинации, содержащей соединение формулы I и EGFR-модулятор, выбираемый из группы, состоящей из следующих агентов: гефитиниб, эрлотиниб, лапатиниб, NVP-AEE778, ARRY334543, BIRW2992, BMS690514, пелитиниб, вандетаниб, AV412, анти-EGFR моноклональное антитело 806, анти-EGFR моноклональное антитело Y90/Re-188, цетуксимаб, панитумумаб, матузумаб, нимотузумаб, залутумумаб, MDX-214, Cdx110, IMC11F8, пертузумаб, трастузумаб, TDM1, Земаб®, Her2 вакцина PX 1041 и HSP90-ингибиторы CNF1010, CNF2024, танеспимицин, алвеспимицин, IPI504, SNX5422 и NVP-AUY922, и в каждом случае в упомянутой комбинации присутствуют активные ингредиенты в свободной форме или в форме соли, и необязательно присутствует по меньшей мере один фармацевтически приемлемый носитель, и упомянутая комбинация предназначена для одновременного, раздельного или последовательного применения в целях лечения EGFR-зависимых заболеваний, включающих в себя, например, немелкоклеточный рак легкого, рак головы и шеи, колоректальную карциному, рак молочной железы, злокачественные новообразования головного мозга, включающие в себя глиобластому, рак предстательной железы, рак мочевого пузыря, почечно-клеточную карциному, рак поджелудочной железы, рак шейки матки, рак пищевода, рак желудка и/или рак яичников.
В другом варианте осуществления настоящее изобретение относится к способу лечения EGFR-зависимых заболеваний или злокачественных опухолей, предпочтительно злокачественных опухолей, которые стали резистентными к модуляторам EGFR-киназы в ходе лечения указанным EGFR-модулятором, и упомянутый способ содержит введение теплокровным животным, нуждающимся в таком введении, терапевтически эффективного количества конкретного производного 2-карбоксамид-циклоамино-мочевины с формулой I, в особенности предпочтительного соединения 2-амид 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты (соединение А) или его фармацевтически приемлемой соли, в качестве единственного препарата или в комбинации с EGFR-модулятором.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции для лечения EGFR-зависимых заболеваний или заболеваний, которые стали резистентными в ходе лечения EGFR-модулятором, содержащим соединение формулы I, в особенности предпочтительное соединение 2-амид 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты (соединение А) или его соль, и по меньшей мере один фармацевтически приемлемый носитель, в качестве единственного препарата или в комбинации с EGFR-модулятором.
В другом варианте осуществления настоящее изобретение относится к применению соединения формулы I, в особенности предпочтительного соединения 2-амид 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)пиридин-4-ил]тиазол-2-ил}амид) (S)-пирролидин-1,2-дикарбоновой кислоты (соединение А) или его соли для лечения EGFR-зависимых заболеваний или заболеваний с приобретенной резистентностью в ходе лечения EGFR-модулятором.
Описание фигур
Фиг.1 показывает противоопухолевую активность соединений против мутантных PIK3CA и амплифицированных ErbB2 клеточной линии ВТ474 раковых клеток молочной железы.
Фиг.2 показывает среднюю массу тела мышей, несущих ортотопические мутантные PIK3CA и амплифицированные ErbB2 клеточной линии ВТ474 раковых клеток молочной железы, в группах мышей, которых лечили носителем и соединением А.
Для тестирования in vivo, показанного на фиг.1 и 2, самкам бестимусных мышей, несущих ортотопические ксенотрансплантаты ВТ474, вводили соединение А или носитель по указанным схемам в указанных дозах. Лечение начинали через 16 дней после имплантации опухолевых клеток и продолжали 11 дней подряд. Статистику по изменению объемов опухолей проводили в одностороннем ANOVA-анализе с апостериорным тестом Даннетта (*р<0,05 по сравнению с контрольным носителем).
Фиг.3 показывает дозозависимую противоопухолевую активность соединения А в дозе 12,5 мг/кг, 25 мг/кг и 50 мг/кг, которые вводили перорально (п/о) через 24 часа (т.е. каждые 24 часа), по отношению к мутантным PIK3CA и амплифицированным ErbB2 клеточной линии ВТ474 раковых клеток молочной железы.
Для тестирования in vivo, показанного на фиг.3, самкам бестимусных мышей, несущих ортотопические ксенотрансплантаты ВТ474, вводили соединение А или носитель по схеме в дозе 12,5 мг/кг п/о, 25 мг/кг п/о или 50 мг/кг п/о. Лечение начинали через 14 дней после имплантации опухолевых клеток и продолжали 14 дней подряд. Статистику по изменению объемов опухолей проводили в одностороннем ANOVA-анализе с апостериорным тестом Даннетта (*р<0,05 по сравнению с контрольным носителем).
Фиг.4 показывает противоопухолевую активность соединения А по отношению к амплифицированным ErbB2 клеточной линии NCI-N87 клеток рака желудка.
Фиг.5 показывает среднюю массу тела мышей, несущих подкожные амплифицированные ErbB2 клеточной линии NCI-N87 рака желудка, в группах мышей, которых лечили носителем и соединением А.
Для тестирования in vivo, показанного на фиг.3 и 4, самкам бестимусных мышей, несущих подкожные ксенотрансплантаты NCI-N87, вводили соединение А или носитель по указанным схемам в указанных дозах. Лечение начинали через 25 дней после имплантации опухолевых клеток и продолжали 21 день подряд. Статистику по изменению объемов опухолей проводили в одностороннем ANOVA-анализе с апостериорным тестом Даннетта (*р<0,05 по сравнению с контрольным носителем).
Фиг.6 показывает противоопухолевую активность носителя, соединения А в дозе 12,5 мг/кг п/о один раз в сутки в качестве единственного агента, трастузумаба в дозе 3 мг/кг внутрибрюшинно три раза в неделю в качестве единственного агента и комбинации соединения А и трастузумаба против мутантных PIK3CA и амплифицированных ErbB2 клеточной линии ВТ474 клеток рака молочной железы, и средние корректированные изменения массы тела (представленные как соотношение массы тела в день измерения и исходной массы тела на 11-й день [оба значения корректируются вычитанием начальной массы опухоли], выраженные в процентах для каждого отдельного животного) в группах мышей, получавших носитель, соединение А в качестве единственного агента, трастузумаб в качестве единственного агента и комбинацию соединения А и трастузумаба, при этом мыши имели ортотопические мутантные PIK3CA и амплифицированные ErbB2 клеточных линий ВТ474 клеток рака молочной железы. Значения представляют собой среднее значение ± SEM (стандартная погрешность средней величины); размер выборки (n=7-10 мышей в группе). (*p<0,05, значительное подавление по сравнению с контрольной группой носителя; #: р<0,05, значительное подавление по сравнению с лечением единственным агентом (критерий суммы рангов Манна-Уитни; ns: статистически не значим).
Фиг.7 показывает противоопухолевую активность носителя, соединения А в дозе 50 мг/кг п/о один раз в сутки в качестве единственного агента, трастузумаба в дозе 10 мг/кг внутрибрюшинно три раза в сутки в качестве единственного агента и комбинации соединения А и трастузумаба против мутантных PIK3CA и амплифицированных ErbB2 клеточной линии ВТ474 клеток рака молочной железы, и средние корректированные изменения массы тела (представленные как соотношение массы тела в день измерения и исходной массы тела на 12-й день [оба значения корректируются вычитанием начальной массы опухоли], выраженные в процентах для каждого отдельного животного) в группах мышей, получавших носитель, соединение А в качестве единственного агента, трастузумаб в качестве единственного агента и комбинацию соединения А и трастузумаба, при этом мыши имели ортотопические мутантные PIK3CA и амплифицированные ErbB2 клеточных линий ВТ474 клеток рака молочной железы. Значения представляют собой среднее значение ± SEM; размер выборки (n=9-10 мышей в группе). (*p<0,05, значительное подавление по сравнению с контрольной группой носителя; #: р<0,05, значительное подавление по сравнению с лечением единственным агентом (критерий суммы рангов Манна-Уитни; ns: статистически не значим).
Подробное описание изобретения
В данном описании использованы следующие общепринятые определения, если не указано иное:
"Галоген" (или "гало") обозначает фтор, бром, хлор или йод, в частности, фтор, хлор. Галогензамещенные группы и функциональные остатки, такие как алкил, замещенный галогеном (галогеналкил), могут быть моно-, поли- или пер-галогенированными.
"Гетероатомы" представляют собой атомы, отличные от углерода и водорода, предпочтительно атомы азота (N), кислорода (O) и серы (S), в частности, атом азота.
Углеродсодержащие группы, функциональные остатки или молекулы содержат атомы углерода в количестве от 1 до 7, предпочтительно от 1 до 6, более предпочтительно от 1 до 4, наиболее предпочтительно 1 или 2 атома углерода. Любая нециклическая углеродсодержащая группа или остаток, имеющий более одного атома углерода, представляет собой прямую или разветвленную цепь.
Понятие "низший" или "C1-C7" обозначает радикал, имеющий атомы углерода в количестве включительно до максимум 7, в частности, включительно до максимум 4 атомов углерода, и рассматриваемые радикалы являются или линейными или разветвленными, с одним или несколькими ветвлениями.
"Алкил" относится к алкильной группе с прямой цепью или разветвленной цепью, предпочтительно представляет собой C1-12-алкил с прямой цепью или разветвленной цепью; в частности, предпочтительно представляет собой C1-7-алкил с прямой цепью или разветвленной цепью; например, метил, этил, н- или изо-пропил, н-, изо-, втор- или трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил, н-додецил, при этом особо предпочтительным является метил, этил, н-пропил, изо-пропил, и н-бутил и изо-бутил. Алкил может быть незамещенным или замещенным. Примеры заместителей включают в себя без ограничения дейтерий, гидрокси, алкокси, гало и амино. Примером замещенного алкила является трифторметил. Также заместителем алкила может являться циклоалкил. В этом случае примером является функциональная группа (алкил)циклопропил или алкандиил-циклопропил, например, -CH2-циклопропил. C1-C7-алкил предпочтительно представляет собой алкил, имеющий включительно от 1 включительно до 7, предпочтительно включительно от 1 включительно до 4, и является линейным или разветвленным; предпочтительно, низший алкил представляет собой бутил, такой как н-бутил, втор-бутил, изобутил, трет-бутил, пропил, такой как н-пропил или изопропил, этил или, предпочтительно, метил.
Каждая алкильная часть других групп, таких как "алкокси", "алкоксиалкил", "алкоксикарбонил", "алкокси-карбонилалкил", "алкилсульфонил", "алкилсульфоксил", "алкиламино", "галогеналкил", имеют такое же значение, как описано для вышеупомянутого определения "алкила".
"Алкандиил" относится к прямой или разветвленной цепи группы алкандиила, связанной двумя разными атомами углерода с функциональной группой, и предпочтительно представляет собой C1-12 алкандиил с прямой цепью или разветвленной цепью, в частности, предпочтительно представляет собой C1-6 алкандиил с прямой цепью или разветвленной цепью; например, метандиил (-CH2-), 1,2-этандиил (-CH2-CH2-), 1,1-этандиил ((-CH(CH3)-), 1,1-, 1,2-, 1,3-пропандиил и 1,1-, 1,2-, 1,3-, 1,4-бутандиил, при этом особо предпочтительным является метандиил, 1,1-этандиил, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил.
"Алкендиил" относится к группе алкендиила с прямой цепью или разветвленной цепью, связанной с молекулой двумя разными атомами углерода, и предпочтительно представляет собой C2-6 алкендиил с прямой цепью или разветвленной цепью, например, -CH =CH-, -CH=C(CH3)-, -CH=CH-CH2-, -C(CH3)=CH-CH2-, -CH=C(CH3)-CH2-, -CH=CH-C(CH3)H-, -CH=CH-CH=CH-, -C(CH3)=CH-CH=CH-, -CH=C(CH3)-CH=CH-, и особо предпочтительными являются -CH=CH-CH2-, -CH=CH-CH=CH-. Алкендиил может быть замещенным или незамещенным.
"Циклоалкил" относится к насыщенному или частично насыщенному, моноциклическому, конденсированному полициклическому, или спиро-полициклическому углеродному кольцу, имеющему в карбоцикле от 3 до 12 кольцевых атомов. Иллюстративные примеры циклоалкильных групп включают в себя следующие функциональные группы: циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкил может быть незамещенным или замещенным; в определении алкила приведены примеры заместителей, которые также включают в себя непосредственно алкил (например, метил). Такая функциональная группа, как -(CH3)циклопропил, считается замещенным циклоалкилом.
"Арил" относится к ароматической гомоциклической кольцевой системе (т.е. в качестве атомов, образующих кольцо, имеются только атомы углерода) с 6 атомами углерода или больше; арил предпочтительно представляет собой ароматическую функциональную группу, имеющую от 6 до 14 атомов углерода в кольце, более предпочтительно от 6 до 10 атомов углерода в кольце, такую как фенил или нафтил, предпочтительно фенил. Арил может быть незамещенным или замещен одним или несколькими заместителями, предпочтительно до трех, более предпочтительно до двух заместителей, независимо выбираемых из группы, состоящей из незамещенного или замещенного гетероциклила, как описано ниже, в частности, из следующих групп: пирролидинил, например, пирролидино, оксопирролидинил, такой как оксопирролидино, C1-C7-алкил-пирролидинил, 2,5-ди-(C1-C7-алкил)пирролидинил, например, 2,5-ди-(C1-C7-алкил)пирролидино, тетрагидрофуранил, тиофенил, C1-C7-алкилпиразолидинил, пиридинил, C1-C7-алкилпиперидинил, пиперидино, пиперидино, замещенный амино-, или N-моно-, или N,N-ди-[низший алкил, фенил, C1-C7-алканоил и/или фенил-низший алкил)амино, незамещенный или N-низший алкил, замещенный пиперидинолом, связанным посредством кольцевого атома углерода, пиперазино, низший алкилпиперазино, морфолино, тиоморфолино, S-оксотиоморфолино или S,S-диоксотиоморфолино; C1-C7-алкил, амино-C1-C7-алкил, N-C1-C7-алканоиламино-C1-C7-алкил, N-C1-C7-алкансульфонил-амино-C1-C7-алкил, карбамоил-C1-C7-алкил, [N-моно-или N,N-ди-(C1-C7-алкил)карбамоил]-C1-C7-алкил, C1-C7-алкансульфонил-C1-C7-алкил, C1-C7-алкансульфонил-C1-C7-алкил, фенил, нафтил, от моно- до три-[C1-C7-алкил, гало и/или циано]фенил или от моно- до три-[C1-C7-алкил, гало и/или циано]нафтил; C3-C8-циклоалкил, от моно- до три-[C1-C7-алкил и/или гидрокси]-C3-C8-циклоалкил; гало, гидрокси, низший алкокси, низший алкокси-низший алкокси, (низший алкокси)-низший алкокси-низший алкокси, гало-C1-C7-алкокси, фенокси, нафтилокси, фенил- или нафтил-низший алкокси; амино-C1-C7-алкокси, низший-алканоилокси, бензоилокси, нафтоилокси, формил(СНО), амино-, N-моно- или N,N-ди-(C1-C7-алкил)амино-, C1-C7-алканоиламино, C1-C7-алкансульфониламино, карбокси, низший алкоксикарбонил, например, фенил- или нафтил-низший алкоксикарбонил, такой как бензилоксикарбонил; C1-C7-алканоил, такой как ацетил, бензоил, нафтоил, карбамоил, N-моно- или N,N-дизамещенный карбамоил, например, N-моно- или N,N-ди-замещенный карбамоил, в которых заместители выбирают из следующих групп: низший алкил, (низший алкокси)-низший алкил и гидрокси-низший алкил; амидино, гуанидино, уреидо, меркапто, низший алкилтио, фенил- или нафтилтио, фенил- или нафтил-низший алкилтио, низший алкил-фенилтио, низший алкил-нафтилтио, гало-низший алкилмеркапто, сульфо-(-SO3H), низший алкансульфонил, фенил- или нафтил-сульфонил, фенил- или нафтил-низший алкилсульфонил, алкилфенилсульфонил, гало-низший алкилсульфонил, например, трифторметансульфонил; сульфонамидо, бензосульфонамидо, азидо, азидо-C1-C7-алкил, в частности, азидометил, C1-C7-алкансульфонил, сульфамоил, N-моно- или N,N-ди-(C1-C7-алкил)сульфамоил, морфолинсульфонил, тиоморфолинсульфонил, циано и нитро; при этом каждый фенил или нафтил (а также в фенокси или нафтокси), упомянутые выше в качестве заместителя или в качестве части заместителя замещенного алкила (или также замещенного арила, гетероциклила и т.п., упомянутых в изобретении) сами по себе являются незамещенными или замещены одним или несколькими заместителями, например, до трех, предпочтительно 1 или 2 заместителями, независимо выбираемыми из гало, гало-низшего алкила, например, трифторметила, гидрокси, низшего алкокси, азидо, амино, N-моно- или N,N-ди-(низший алкил и/или C1-C7-алканоил)-амино, нитро, карбокси, низшего алкокси-карбонила, карбамоила, циано и/или сульфамоила.
"Гетероциклил" относится к гетероциклическому радикалу, который является ненасыщенным (то есть, имеет максимально возможное число сопряженных двойных связей в кольце (кольцах)), насыщенным или частично насыщенным и, предпочтительно, представляет собой моноциклическое, или, в более широком аспекте изобретения, бициклическое, трициклическое или спироциклическое кольцо, и имеет от 3 до 24, более предпочтительно от 4 до 16, наиболее предпочтительно от 5 до 10, и наиболее предпочтительно 5 или 6 кольцевых атомов; при этом один или несколько, предпочтительно от одного до четырех, в частности, один или два кольцевых атома представляют собой гетероатом (таким образом, остальные кольцевые атомы являются углеродом). Связывающее кольцо (т.е. кольцо, присоединенное к молекуле) предпочтительно имеет от 4 до 12, в частности, от 5 до 7 атомов в кольце. Термин «гетероциклил» также включает в себя гетероарил. Гетероциклический радикал (гетероциклил) может быть незамещенным или замещен одним или несколькими заместителями, предпочтительно имеет от 1 до 3 заместителей, независимо выбираемых из группы, состоящей из заместителей, определенных выше для замещенного алкила, и/или замещен одним или несколькими из следующих заместителей: оксо (=О), тиокарбонил (=S), имино (=NH), имино-низший алкил. Дополнительно, гетероциклил, в частности, представляет собой гетероциклильный радикал, выбираемый из группы, состоящей из следующего: оксиранил, азиринил, азиридинил, 1,2-оксатио-ланил, тиенил (=тиофенил), фуранил, тетрагидрофурил, пиранил, тиопиранил, тиантренил, изобензофуранил, бензофуранил, хроменил, 2H-пирролил, пирролил, пирролинил, пирролидинил, имидазолил, имидазолидинил, бензимидазолил, пиразолил, пиразинил, пиразолидинил, тиазолил, изотиазолил, дитиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиперидинил, пиперазинил, пиридазинил, морфолинил, тиоморфолинил, (S-оксо- или S,S-диоксо)тиоморфолинил, индолизинил, азепанил, диазепанил, в частности, 1,4-диазепанил, изоиндолил, 3Н-индолил, индолил, бензимидазолил, кумарил, индазолил, триазолил, тетразолил, пуринил, 4H-хинолизинил, изохинолил, хинолил, тетрагидрохинолил, тетрагидроизохинолил, декагидрохинолил, октагидроизохинолил, бензофуранил, дибензофуранил, бензотиофенил, дибензотиопентил, фталазинил, нафтиридинил, хиноксалил, хиназолинил, циннолинил, птеридинил, карбазолил, бета-карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, фуразанил, феназинил, фенотиазинил, феноксазинил, хроменил, изохроманил, хроманил, бензо[1,3]диоксол-5-ил и 2,3-дигидробензо[1,4]диоксин-6-ил, и каждый из указанных радикалов может быть незамещенным или замещен одним или несколькими заместителями, предпочтительно до трех, выбираемых из вышеупомянутых заместителей для замещенного арила, и/или одним или несколькими из следующих заместителей: оксо (=О), тиокарбонил (=S), имино (=NH), имино-низший алкил.
"Арилалкил" относится к арильной группе, связанной с молекулой через алкильную группу, такую как метильная или этильная группа, предпочтительно фенэтил или бензил, в частности, бензил. Аналогично, циклоалкил-алкил и гетероциклил-алкил представляют собой циклоалкильную группу, связанную с молекулой через алкильную группу, или представляют собой гетероциклическую группу, связанную с молекулой через алкильную группу. В каждом случае арил, гетероциклил, циклоалкил и алкил могут быть замещенными, как указано выше.
«Лечение» включает в себя профилактическое (превентивное) и терапевтическое лечение, а также замедление прогрессирования заболевания или нарушения. Используемый в изобретении термин «замедление прогрессирования» означает введение комбинации пациентам, находящимся на предварительной стадии или на ранней стадии пролиферативного заболевания, подлежащего лечению, и у этих пациентов диагностирована, например, предварительная форма соответствующего заболевания, или эти пациенты находятся, например, в состоянии лечения или в состоянии, возникшем в результате острого случая, на фоне которого существует вероятность развития соответствующего заболевания.
"Заболевания, зависимые от рецептора эпидермального фактора роста" или "EGFR-зависимые заболевания» представляют собой, в частности такие патологии или злокачественные новообразования, при которых наблюдается полезная реакция (например, улучшение одного или нескольких симптомов, отсрочка начала заболевания, вплоть до временного или полного излечения заболевания) на подавление члена семейства рецептора эпидермального фактора роста (при этом заболевания, подлежащие лечению, могут включать в себя пролиферативные заболевания, такие как раковые или опухолевые заболевания). Семейство рецептора эпидермального фактора роста состоит из четырех членов: EGFR1 (также называемый HER1 или Erb-B1); EGFR2 (также называемый HER2 или Erb-B2); EGFR3 (также называемый HER3 или Erb-B3); и EGFR4.
Понятия "фармацевтический препарат" или "фармацевтическая композиция" относятся к смеси или раствору, содержащему по меньшей мере одно терапевтическое соединение для введения млекопитающему, например, человеку, с целью предотвращения, лечения и контроля конкретного заболевания или состояния, поражающего этого млекопитающего.
Понятие "фармацевтически приемлемый" относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые, в рамках обоснованного медицинского заключения, подходят для контакта с тканями млекопитающих, в частности, человека, без чрезмерной токсичности, раздражения, аллергической реакции и других проблем и осложнений, соразмерно с разумным соотношением польза/риск.
"Соли" (которые подразумеваются при упоминании "или их соли" или "или его соли), могут присутствовать в качестве единственного агента или в смеси со свободным соединением формулы (I) и предпочтительно представляют собой фармацевтически приемлемые соли. Такие соли, в частности, фармацевтически приемлемые соли, образованы из соединений формулы (I) с основным атомом азота, например, кислотно-аддитивные соли, предпочтительно с органическими или неорганическими кислотами. Подходящими неорганическими кислотами, например, являются кислоты галогенов, таких как соляная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновые кислоты или сульфокислоты, такие как фумаровая кислота или метансульфоновая кислота. В целях выделения или очистки также можно использовать фармацевтически неприемлемые соли, например, пикраты или перхлораты. Для терапевтического применения используют только фармацевтически приемлемые соли или свободные соединения (если они применимы в виде фармацевтических композиций), и поэтому они являются предпочтительными. Учитывая тесную взаимосвязь между новыми соединениями в свободной форме, и новыми соединениями в форме их солей, включающих в себя соли, которые могут быть использованы в качестве промежуточных продуктов, например, при очистке или идентификации новых соединений, любое упоминание о свободных соединениях выше и ниже в настоящем изобретении также следует понимать как относящееся к соответствующим солям, по мере необходимости и целесообразности. Соли соединений формулы (I) предпочтительно являются фармацевтически приемлемыми солями; в данной области техники известны подходящие противоионы, образующие фармацевтически приемлемые соли.
Понятие "комбинация" относится или к фиксированной комбинации в одной лекарственной форме или к нефиксированной комбинации (или набору частей) для совместного введения, при этом соединение формулы (I) и комбинационный партнер (например, другое лекарство, как описано ниже, также называемое "терапевтическим агентом» или «ко-агентом") можно вводить независимо одновременно или раздельно с интервалами времени, в особенности в случаях, когда эти интервалы времени позволяют комбинационным партнерам проявлять совместный эффект, например, синергетический эффект. Подразумевается, что термин "совместное введение" или подобные понятия, используемые в изобретении, охватывают введение выбранного комбинационного партнера одному нуждающемуся в этом введении субъекту (например, пациенту), и подразумевается, что эти понятия включают в себя схемы лечения, согласно которым агенты не обязательно вводятся одним и тем же путем введения или в одно и то же время. Термин "фиксированная комбинация" означает, что активные ингредиенты, например, и соединение формулы (I) и комбинационный партнер, вводятся пациенту одновременно в виде монолитной формы или дозы. Термины "нефиксированная комбинация" или "набор частей" означают, что активные ингредиенты, например, и соединение формулы (I) и комбинационный партнер вводятся пациенту в виде раздельных форм или одновременно, параллельно или последовательно, при отсутствии конкретных ограничений по времени, при этом такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также относится к терапевтической смеси, например, к введению трех или более активных ингредиентов.
"Терапевтически эффективный" предпочтительно относится к количеству, которое является терапевтически эффективным, или в более широком смысле, также профилактически эффективным в отношении прогрессирования пролиферативного заболевания.
Настоящее изобретение относится к использованию конкретных производных 2-карбоксамид-циклоамино-мочевины в качестве единственных агентов или в комбинации, для лечения заболеваний, зависимых от членов семейства рецептора эпидермального фактора роста (EGFR) (включающих в себя EGFR1, также называемый HER1 или Erb-B1; EGFR2 также называемый HER2 или Erb-B2; EGFR3 также называемый HER3 или Erb-B3; и EGFR4).
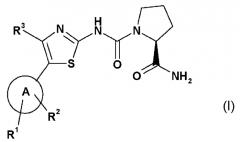
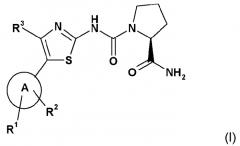
Конкретные производные 2-карбоксамид-циклоамино мочевины, которые подходят для настоящего изобретения, их получение и подходящие фармацевтические композиции, содержащие указанные производные, описаны в WO 2010/029082 и включают в себя соединения формулы I
или его соль, где
А обозначает гетероарил, который выбирают из группы, состоящей из:
R1 представляет собой один из следующих заместителей: (1) незамещенный или замещенный, предпочтительно замещенный C1-C7-алкил, при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до девяти: дейтерий, фтор или из следующих остатков от одного до двух C3-C5-циклоалкил; (2) необязательно замещенный C3-C5-циклоалкил, при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до четырех: дейтерий, C1-C4-алкил (предпочтительно метил), фтор, циано, аминокарбонил; (3) необязательно замещенный фенил, при этом указанные заместители независимо выбирают из одного или более одного функционального остатка, предпочтительно из следующих остатков в количестве от одного до двух: дейтерий, галоген, циано, C1-C7-алкил, C1-C7-алкиламино, ди(C1-C7-алкил)амино, C1-C7-алкиламинокарбонил, ди(C1-C7-алкил)аминокарбонил, C1-C7-алкокси; (4) необязательно моно- или ди-замещенные амины, при этом указанные заместители независимо выбирают из следующих функциональных остатков: дейтерий, C1-C7-алкил (который является незамещенным или замещен одним или несколькими заместителями, выбираемыми из группы дейтерия, фтора, хлора, гидрокси), фенилсульфонил (который является незамещенным или замещен одним или несколькими, предпочтительно одним C1-C7-алкилом, C1-C7-алкокси, ди(C1-C7-алкил)амино-C1-C7-алкокси); (5) замещенный сульфонил, при этом указанный заме