Оптимизированный метод захвата антител хроматографией смешанного типа
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описано изобретение, включающее способ получения антитела против IGF-1R при помощи катионной хроматографии. Способ включает стадии нанесения буферизованного раствора, содержащего неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество, нанесение неочищенного культивационного супернатанта культуры клеток млекопитающих и выделение антитела. Изобретение расширяет арсенал средств, обеспечивающих получение антител при помощи хроматографии. 6 з.п. ф-лы, 5 ил., 5 табл., 6 пр.
Реферат
Здесь приведен способ очистки антитела, непосредственно захваченного из осветленных супернатантов культуры клеток, с использованием Streamline CST и/или Capto ММС, в котором могли быть эффективно удалены примеси, особенно имеющие отношение к продукту (агрегаты и фрагменты) и имеющие отношение к способу (белок клетки-хозяина, ДНК, компоненты сред), приводящий к получению препарата с чистотой, сопоставимой с классической аффинной хроматографией на белке А.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Хроматографию на белке А традиционно используют в качестве первой захватывающей стадии в способах промышленной очистки моноклональных антител из-за ее высокой селективности, приводящей к хорошим общим выходам и чистоте. Однако главным недостатком данной аффинной хроматографии является ее высокая цена, что особенно в случае терапевтических антител, требующихся в высоких дозах, и/или хронического введения может объяснять значительную стоимость готового продукта. Кроме того, лиганд - белок А, подвергающийся утечке из аффинной матрицы, должен быть удален дополнительными стадиями хроматографии из-за его потенциальной иммуногенности.
Хроматография смешанного типа на комбинированных смолах, имеющих ионные и гидрофобные функциональные группы, может предложить ценную альтернативу классическому аффинному подходу. Из-за солеустойчивости гидрофобного компонента в большинстве случаев возможна прямая загрузка осветленного супернатанта культуры клеток на матрицу, приводящая к эффективному захвату моноклонального антитела. Однако из-за комбинированной природы смолы возможны разные типы взаимодействия лиганда с конкретным моноклональным антителом, требующие уникальных условий промывки и элюции, отличающихся от традиционной хроматографии на основе ионообменных или гидрофобных взаимодействий.
В WO 2010/080062 сообщается о способе разделения с использованием систем на основе одной полимерной фазы. Способ изготовления для получения полипептидов, экспрессируемых в линиях клеток насекомых, приведен в WO 2008/073620.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Обнаружили, что комбинированное слабо катионообменное хроматографическое вещество можно использовать с неочищенным культивационным супернатантом культуры клеток в качестве первой стадии в способе очистки колоночной хроматографией.
Одним приведенным здесь аспектом является способ получения антитела против IGF-1R (рецептор инсулиноподобного фактора роста 1), включающий следующие стадии:
а) нанесение неочищенного культивационного супернатанта культуры клеток млекопитающих на комбинированное слабо катионообменное хроматографическое вещество,
б) выделение антитела против IGF-1R путем нанесения буферизованного раствора, содержащего этиленгликоль и неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество и получение, посредством этого, антитела против IGF-1R.
В одном воплощении данный способ включает следующую дополнительную стадию а-1) до стадии а):
а-1) нанесение на комбинированное слабо катионообменное хроматографическое вещество буферизованного раствора, содержащего неорганическую соль.
В одном воплощении данный способ включает следующую дополнительную стадию а-б) после стадии а) и до стадии б):
а-б) нанесение буферизованного раствора на комбинированное слабо катионообменное хроматографическое вещество, посредством чего антитело против IGF-1R не выделяется из комбинированного слабо катионообменного хроматографического вещества.
В одном воплощении стадия а-б) включает две стадии а-б1) и а-б2):
а-б1) нанесение буферизованного раствора, содержащего неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество и
а-б2) нанесение буферизованного раствора, содержащего денатурирующее вещество, на комбинированное слабо катионообменное хроматографическое вещество,
посредством чего антитело против IGF-1R не выделяется из комбинированного слабо катионообменного хроматографического вещества.
В одном воплощении денатурирующее вещество выбрано из гидрохлорида гуанидиния и мочевины.
В одном воплощении неорганическая соль выбрана из хлорида натрия, хлорида калия и хлорида аммония.
В одном воплощении буферизованный раствор на стадии б) содержит от 20 мМ до 30 мМ Tris, от 1050 мМ до 1350 мМ хлорида натрия и примерно 20% (масс./об.) этиленгликоля при значении pH от pH 7,1 до pH 7,3.
В одном воплощении буферизованный раствор на стадии а-1) содержит от 20 мМ до 30 мМ Tris и от 80 мМ до 120 мМ хлорида натрия при значении pH от pH 7,1 до pH 7,3. В одном воплощении буферизованный раствор на стадии а-б1) содержит от 20 мМ до 30 мМ Tris и от 80 мМ до 120 мМ хлорида натрия при значении pH от pH 7,1 до pH 7,3. В одном воплощении буферизованный раствор на стадии а-б2) содержит от 110 мМ до 140 мМ Tris, от 80 мМ до 120 мМ хлорида натрия и от 30 мМ до 40 мМ аргинина при значении pH от pH 7,1 до pH 7,3.
В одном воплощении комбинированное слабо катионообменное хроматографическое вещество содержит поперечно связанную агарозу, к которой ковалентно присоединен комбинированный слабо катионообменный лиганд, содержащий функциональную группу карбоновой кислоты, эфира, тиоэфира и ароматическую функциональную группу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Здесь приведен способ очистки моноклонального антитела, захваченного из осветленных супернатантов культуры клеток, с использованием Streamline CST и/или Capto ММС, включающий оптимизированные условия элюции и промывки. Могут быть эффективно удалены примеси, особенно имеющие отношение к продукту (агрегаты и фрагменты) и имеющие отношение к способу (белок клетки-хозяина, компоненты сред), что приводит к получению препарата с чистотой, сопоставимой с классической аффинной хроматографией. Таким образом, приведенным здесь способом можно заменять классическую аффинную хроматографию на белке А.
В одном воплощении данный способ не включает стадию аффинной хроматографии на белке А.
Обычные хроматографические способы и их применение известны специалисту в данной области. Смотрите, например, Chromatography, 5th edition, Part A: Fundamentals and Techniques, Heftmann, E. (ed.), Elsevier Science Publishing Company, New York (1992); Advanced Chromatographic and Electromigration Methods in Biosciences, Deyl, Z. (ed.), Elsevier Science BV, Amsterdam, The Netherlands (1998); Chromatography Today, Poole, C.F., and Poole, S.K., Elsevier Science Publishing Company, New York (1991); Scopes, Protein Purification: Principles and Practice (1982); Sambrook, J., et al. (ed.), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989 или Current Protocols in Molecular Biology, Ausubel, F.M., et al. (eds.), John Wiley & Sons, Inc., New York (1987).
Термин «нанесение на» обозначает часть стадии способа очистки, на которой раствор приводится в контакт с хроматографическим веществом. Это обозначает то, что либо а) раствор добавляют в хроматографическое устройство, в котором содержится хроматографическое вещество, либо б) что хроматографическое вещество добавляют в раствор. В случае а) раствор проходит через устройство, обеспечивая взаимодействие между хроматографическим веществом и веществами, содержащимися в растворе. В зависимости от условий, таких как, например, pH, проводимость, концентрация соли, температура и/или скорость тока, некоторые вещества раствора могут связываться с хроматографическим веществом и другие вещества могут выделяться из хроматографического вещества. Вещества, остающиеся в растворе или выделенные из хроматографического вещества, можно обнаружить в фильтрате. Термин «фильтрат» обозначает раствор, полученный после прохождения через устройство, который может представлять собой либо нанесенный раствор, либо буферизованный раствор, который используют для промывки колонки или вызова элюции веществ, связанных с хроматографическим веществом. В одном воплощении устройство представляет собой колонку или кассету. В случае б) хроматографическое вещество можно добавлять, например, в виде твердого вещества, в раствор, например, содержащий интересующее вещество, подлежащее очистке, обеспечивая взаимодействие между хроматографическим веществом и веществами в растворе. После взаимодействия хроматографическое вещество удаляют, например, фильтрованием, и вещество, связавшееся с хроматографическим веществом, также удаляют вместе с ним из раствора, тогда как вещества, не связавшиеся с хроматографическим веществом, остаются в растворе.
Термин «режим связывания и элюции» обозначает режим работы хроматографической стадии, при котором раствор, содержащий интересующее вещество, подлежащее очистке, наносят на хроматографическое вещество, посредством чего интересующее вещество связывается с хроматографическим веществом. Таким образом, интересующее вещество удерживается на хроматографическом веществе, тогда как неинтересующие вещества удаляются с фильтратом или супернатантом. Интересующее вещество затем выделяют из хроматографического вещества на второй стадии элюционным раствором. В одном воплощении приведенный здесь способ работает в режиме связывания и элюции.
Термин «буферизованный раствор» обозначает раствор, в котором изменения pH, обусловленные добавлением или высвобождением кислотных или щелочных веществ, нивелируются растворенным буферным веществом. Можно использовать любое буферное вещество с такими свойствами. Обычно используются фармацевтически приемлемые буферные вещества. В одном воплощении буферизованный раствор выбран из фосфатного буферизованного раствора, состоящего из фосфорной кислоты и/или ее солей, или ацетатного буферизованного раствора, состоящего из уксусной кислоты и ее солей, или цитратного буферизованного раствора, состоящего из лимонной кислоты и/или ее солей, или морфолинового буферизованного раствора, или 2-(N-морфолино)этансульфонового буферизованного раствора, или гистидинового буферизованного раствора, или глицинового буферизованного раствора, или трис(гидроксиметил)аминометанового (Tris) буферизованного раствора. В другом воплощении буферизованный раствор выбран из раствора, буферизованного Tris, или цитратного буферизованного раствора, или гистидинового буферизованного раствора. Буферизованный раствор может содержать неорганическую кислоту, такую как, например, хлорид натрия, сульфат натрия, хлорид калия, сульфат калия, хлорид аммония или сульфат аммония.
Термины «непрерывная элюция» и «способ непрерывной элюции», которые в пределах данной заявки используются взаимозаменяемо, обозначают способ, в котором проводимость раствора, вызывающего элюцию, т.е. выделение связавшегося соединения из хроматографического вещества, изменяется, т.е. повышается или снижается непрерывно, т.е. концентрация изменяется посредством последовательности маленьких стадий, каждая из которых не больше, чем изменение концентрации вещества, вызывающего элюцию, на 2% или на 1%. В данной «непрерывной элюции» одно или более чем одно из условий, например pH, ионная сила, концентрация соли и/или ток хроматографии, может изменяться линейно, или экспоненциально, или асимптоматически. В одном воплощении изменение является линейным.
Термин «ступенчатая элюция» обозначает способ, при котором, например, концентрация вещества, вызывающего элюцию, т.е. выделение связавшегося вещества из хроматографического вещества, повышается или снижается сразу, т.е. непосредственно от одного значения/уровня до следующего значения/уровня. В данной «ступенчатой элюции» одно или более чем одно условие, например pH, ионная сила, концентрация соли и/или ток хроматографии, может изменяться сразу от первого, например, исходного значения, до второго, например, конечного значения. Таким образом, условия изменяются инкрементально, т.е. ступенчато, в отличие от линейного изменения.
Термин «комбинированное слабо катионообменное хроматографическое вещество» обозначает неподвижную высокомолекулярную матрицу, такую как химически поперечно связанная агароза, которая несет ковалентно связанные заряженные заместители, используемую в качестве неподвижной фазы в ионообменной хроматографии. Для общей нейтральности заряда с ней связаны не ковалентно связанные противоионы. «Комбинированное слабо катионообменное хроматографическое вещество» имеет способность к обмену его не ковалентно связанных катионных противоионов на ионы аналогичного заряда из окружающего раствора. «Комбинированное слабо катионообменное хроматографическое вещество» содержит ковалентно связанные лиганды, которые способны осуществлять ионные взаимодействия, гидрофобные взаимодействия, Ван-дер-Ваальсовы взаимодействия, а также образование водородных связей с молекулами, содержащимися в окружающем растворе.
Специалисту в данной области хорошо известны методики и способы для превращения аминокислотной последовательности, например полипептида, в соответствующую последовательность нуклеиновой кислоты, кодирующую данную аминокислотную последовательность. Следовательно, нуклеиновая кислота характеризуется ее последовательностью нуклеиновой кислоты, состоящей из индивидуальных нуклеотидов, и, подобным образом, аминокислотной последовательностью полипептида, кодируемого посредством нее.
Термин «при условиях, подходящих для связывания» и его грамматические эквиваленты в том виде, как он используется в данной заявке, обозначают то, что интересующее вещество, например антитело против IGF-1R, связывается с неподвижной фазой при приведении с ней в контакт, например, с ионообменным веществом. Это не обязательно обозначает, что связывается 100% интересующего вещества, но связывается по существу 100% интересующего вещества, т.е. связывается по меньшей мере 50% интересующего вещества, предпочтительно связывается по меньшей мере 75% интересующего вещества, предпочтительно связывается по меньшей мере 85% интересующего вещества, более предпочтительно с неподвижной фазой связывается больше чем 95% интересующего вещества.
Термин «антитело» здесь используется в самом широком смысле и охватывает разные структуры антител, включающие, но не ограничивающиеся, моноклинальными антителами, поликлональными антителами, мультиспецифичными антителами (например, биспецифичными антителами) и фрагментами антител, при условии, что они демонстрируют желательную антигенсвязывающую активность. Встречающиеся в природе антитела представляют собой молекулы с варьирующими структурами. Например, нативные антитела IgG представляют собой гетеротетра мерные гликопротеины с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными связями. От N- до C-конца каждая тяжелая цепь имеет вариабельный домен (VH), также именуемый как вариабельный тяжелый домен или вариабельный домен тяжелой цепи, с последующими тремя или четырьмя константными доменами (CH1, CH2, CH3 и возможно CH4). Аналогично от N- до C-конца каждая легкая цепь имеет вариабельный домен (VL), также именуемый как вариабельный легкий домен или вариабельный домен легкой цепи, с последующим константным доменом легкой цепи (CL). Легкую цепь антитела можно приписать к одному из двух типов, именуемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
Рецептор человеческого инсулиноподобного фактора роста I (IGF-IR, EC 2.7.112, антиген CD 221) принадлежит к семейству трансмембранных протеинтирозинкиназ (LeRoith, D., et al., Endocrin. Rev. 16 (1995) 143-163; Adams, Т.Е., et al., Cell. Mol. Life Sci. 57 (2000) 1050-1063). IGF-IR связывает IGF-I с высокой аффинностью и инициирует физиологический ответ на данный лиганд in vivo. IGF-IR также связывает IGF-II, однако со слегка меньшей аффинностью. Сверхэкспрессия IGF-IR стимулирует неопластическую трансформацию клеток, и существует доказательство того, что IGF-IR участвует в злокачественной трансформации клеток и, следовательно, является полезной мишенью для разработки терапевтических агентов для лечения рака (Adams, Т.Е., et al., Cell. Mol. Life Sci. 57 (2000), 1050-1063). Типичные антитела против IGF-1R, их кодирующие последовательности и способы получения приведены в WO 2004/087756, WO 2007/045456 и WO 2007/115814.
Для очистки иммуноглобулинов или фрагментов иммуноглобулинов, которые были получены, например, способами культивирования клеток, обычно используется комбинация разных хроматографических стадий. Обычно после аффинной хроматографии на белке А следует одна или две дополнительные стадии разделения. В одном воплощении указанные дополнительные хроматографические стадии представляют собой стадию катионо- и анионообменной хроматографии или наоборот. Конечной стадией очистки является так называемая «полировочная стадия» для удаления следовых примесей и загрязнителей, подобных агрегированным иммуноглобулинам, остаточному HCP (белок клетки-хозяина), ДНК (нуклеиновая кислота клетки-хозяина), вирусам или эндотоксинам. В одном воплощении конечной стадией очистки является анионообменная хроматография в режиме фильтрации.
Обнаружили, что комбинированное слабо катионообменное хроматографическое вещество можно использовать в качестве первой стадии в способе очистки колоночной хроматографией непосредственно с неочищенным культивационным супернатантом культуры клеток, вместо обычно используемой аффинной хроматографии на белке А.
Одним приведенным здесь аспектом является способ получения антитела против IGF-1R, включающий следующие стадии:
а) нанесение неочищенного культивационного супернатанта культуры клеток млекопитающих на комбинированное слабо катионообменное хроматографическое вещество,
б) выделение антитела против IGF-1R путем нанесения буферизованного раствора, содержащего этиленгликоль и неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество и получение, посредством этого, антитела против IGF-1R.
Для приведенного здесь способа не требуется предварительная обработка неочищенного культивационного супернатанта. Это было неожиданным, поскольку для культивационных супернатантов, полученных от культивирований, в которых продуцировалось другое антитело, требовалось по меньшей мере уменьшение проводимости для того, чтобы обеспечивать захват антитела непосредственно из супернатанта культуры. Кроме того, захват антитела против IGF-1R из неочищенного культивационного супернатанта клеток является почти количественным. Поскольку общеприменимые условия для выделения полипептидов из катионообменных хроматографических веществ и условия для связывания с комбинированным слабо катионообменным хроматографическим веществом посредством гидрофобных взаимодействий являются противоположно направленными, для выделения антитела из комбинированного слабо катионообменного хроматографического вещества требуются новые условия.
В одном воплощении способ включает следующую дополнительную стадию а-1) до стадии а):
а-1) нанесение на комбинированное слабо катионообменное хроматографическое вещество буферизованного раствора, содержащего неорганическую соль.
В другом воплощении данный способ включает следующую дополнительную стадию а-б) после стадии а) и до стадии б):
а-б) нанесение буферизованного раствора на комбинированное слабо катионообменное хроматографическое вещество, посредством чего антитело против IGF-1R не выделяется из комбинированного слабо катионообменного хроматографического вещества.
В другом воплощении стадия а-б) включает две стадии а-б1) и а-б2):
а-б1) нанесение буферизованного раствора, содержащего неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество и
а-б2) нанесение буферизованного раствора, содержащего денатурирующее вещество, на комбинированное слабо катионообменное хроматографическое вещество,
посредством чего антитело против IGF-1R не выделяется из комбинированного слабо катионообменного хроматографического вещества.
В еще одном другом воплощении денатурирующее вещество выбрано из гидрохлорида гуанидиния, мочевины и аргинина. В одном воплощении неорганическая соль выбрана из хлорида натрия, хлорида калия и хлорида аммония. В еще одном другом воплощении буферизованный раствор на стадии б) содержит от 20 мМ до 30 мМ Tris, от 1050 мМ до 1350 мМ хлорида натрия и примерно 20% (масс./об.) этиленгликоля при значении pH от pH 7,1 до pH 7,3. В одном воплощении буферизованный раствор на стадии а-1) содержит от 20 мМ до 30 мМ Tris и от 80 мМ до 120 мМ хлорида натрия при значении pH от pH 7,1 до pH 7,3. В другом воплощении буферизованный раствор на стадии а-б1) содержит от 20 мМ до 30 мМ Tris и от 80 мМ до 120 мМ хлорида натрия при значении pH от pH 7,1 до pH 7,3. В другом воплощении буферизованный раствор на стадии а-б2) содержит от 110 мМ до 140 мМ Tris, от 80 мМ до 120 мМ хлорида натрия и от 30 мМ до 40 мМ аргинина при значении pH от pH 7,1 до pH 7,3. В еще одном другом воплощении комбинированное слабо катионообменное хроматографическое вещество содержит поперечно связанную агарозу, к которой ковалентно присоединен комбинированный слабо катионообменный лиганд, содержащий функциональную группу карбоновой кислоты, эфира, тиоэфира и ароматическую функциональную группу. В одном воплощении на стадии а-1) на комбинированное слабо катионообменное хроматографическое вещество наносится общий объем буферизованного раствора, составляющий пять объемов колонки. В другом воплощении на стадии а-б1) на комбинированное слабо катионообменное хроматографическое вещество наносится общий объем буферизованного раствора, составляющий пять объемов колонки. В еще одном другом воплощении на стадии а-б2) на комбинированное слабо катионообменное хроматографическое вещество наносится общий объем буферизованного раствора, составляющий десять объемов колонки. В еще одном воплощении на стадии б) на комбинированное слабо катионообменное хроматографическое вещество наносится общий объем буферизованного раствора, составляющий десять объемов колонки.
Обнаружили, что индивидуальные компоненты буферизованных растворов имеют следующие эффекты:
| Выход | Низкомолекулярные | Высокомолекулярные | Чистота | ||
| Соль | NaCl | - | - | 0 | + |
| NH4Cl | - | - | + | + | |
| Этиленгликоль | - | 0 | 0 | 0 | |
| Денатурирующее вещество | Мочевина | - | - | 0 | + |
| Аргинин | - | - | 0 | + | |
| +: увеличение; -:снижение; 0: нет эффекта |
Следующие примеры и графические материалы приведены для того, чтобы помочь пониманию настоящего изобретения, истинный объем которого изложен в приложенной формуле изобретения. Понятно, что в изложенных методиках можно сделать модификации, не отступая от сущности изобретения.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
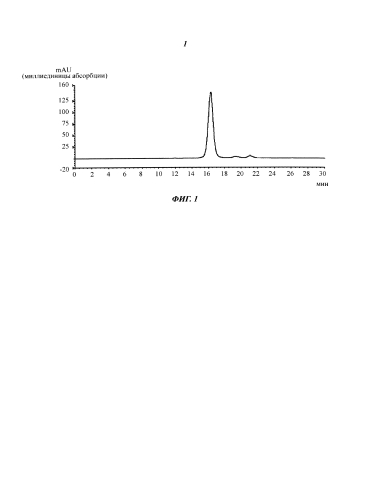
Фиг.1. Аналитическая гель-фильтрационная хроматограмма элюата хроматографии антитела против IGF-1R, полученного на стадии б) Примера 1.
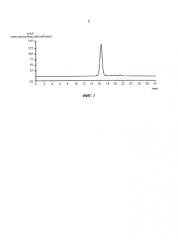
Фиг.2. Хроматограмма элюции антитела против IGF-1R, полученного приведенным здесь способом согласно условиям, указанным в Примере 3.
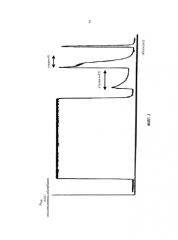
Фиг.3. Аналитическая гель-фильтрационная хроматограмма элюата хроматографии антитела против IGF-1R, полученного на стадии б) (а), и для элюата, полученного на стадии а-б2) (б).
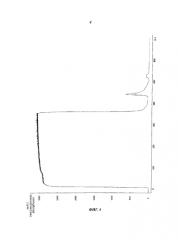
Фиг.4. Хроматограмма элюции нанесения неочищенного культивационного супернатанта, содержащего антитело против IL13R (рецептор интерлейкина 13).
Фиг.5 Хроматограмма элюции нанесения предварительно обработанного культивационного супернатанта, содержащего антитело против IL13R.
ПРИМЕРЫ
Материалы и способы
Если не указано иначе, другие способы осуществляли согласно руководству изготовителя материалов.
Методики генной инженерии:
Для манипуляции с ДНК использовали стандартные способы, как описано в Sambrook, J., et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реактивы использовали согласно инструкциям производителя.
Определение белка
Концентрацию белка определяли определением оптической плотности (ОП) при 280 нм с контрольной длиной волны 320 нм, используя коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности.
Гель-фильтрационная ВЭЖХ (высокоэффективная жидкостная хроматография)
Хроматографию проводили с использованием колонки Tosoh Haas TSK 3000 SWXL на системе ASI-100 HPLC (Dionex, Idstein, Германия). Пики элюции отслеживали при 280 нм посредством УФ (ультрафиолетовый) детектора на диодной матрице (Dionex). После разведения концентрированных образцов до 1 мг/мл колонку промывали буфером, состоящим из 200 мМ дигидрофосфата калия и 250 мМ хлорида калия, pH 7,0, до достижения стабильного исходного уровня. Аналитические разделения проводили при изократических условиях с использованием скорости тока 0,5 мл/мин в течение 30 минут при комнатной температуре. Хроматограммы интегрировали вручную посредством Chromeleon (Dionex, Idstein, Германия).
ВЭЖХ с обращенной фазой (ВЭЖХ-ОФ)
Чистоту анализировали ВЭЖХ-ОФ. Анализ проводили на колонке Poroshell с использованием градиента ацетонитрила/водной TFA (трифторуксусная кислота). Профиль элюции отслеживается как погложение в УФ при 215 нм. Процентные доли элюированных веществ рассчитываются на основе общей площади пиков элюированных белков.
Система пороговой ДНК
Смотрите, например, Merrick, Н., and Hawlitschek, G., Biotech Forum Europe 9 (1992) 398-403.
Определение белка клетки-хозяина
Стенки лунок планшета микротитрования покрывают смесью сывороточного альбумина и стрептавидина. Со стенками лунок планшета микротитрования связывается поликлональное антитело против HCP, полученное от козы. После стадии промывки разные лунки планшета микротитрования инкубируют с калибровочной последовательностью HCP в разных концентрациях и раствором образца. После инкубации не связавшееся вещество образца удаляют посредством промывки буферным раствором. Для детекции лунки инкубируют с конъюгатом антитела с пероксидазой для детекции связавшегося белка клетки-хозяина. Фиксированную пероксидазную активность детектируют путем инкубации с ABTS (2,2'-азинобис[3-этилбензтиазолин-6-сульфониевая кислота) и детекции при 405 нм.
Пример 1
Хроматография антитела против IGF-1R посредством приведенного здесь способа на комбинированном слабо катионообменном хроматографическом веществе Capto™ ММС
Хроматографию проводили со следующими параметрами:
| смола | Capto™ ММС |
| диаметр колонки | 1 см |
| высота слоя | 14,6 см |
| нанесенный раствор | неочищенный культивационный супернатант клеток |
| загрузка | 30 мг антитела на мл вещества |
| стадия а-1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия а-б1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия б) | 25 мМ Tris-HCl, 1200 мМ NaCl, 20% (масс./об.) этилен гликоль, pH 7,2 |
| способ элюции | ступенчатая элюция |
| скорость тока | 250 см/ч |
Хроматограмма аналитической гель-фильтрации полученного антитела показана на Фиг.1.
| буферизованный раствор стадии б) | результаты аналитической гель-фильтрации выделенного антитела | ||||||
| Tris [мМ] | NaCl [мМ] | этиленгликоль [% масс.] | pH | общие высокомолекулярные [%] | антитело [%] | общие высокомолекулярные [%] | выход [%] |
| 25 | 1200 | 20 | 7,2 | 1,6 | 91,8 | 6,7 |
Пример 2
Сравнительные хроматографии антитела против IGF-1R относительно Примера 1 с условиями, отличными от приведенного здесь способа, на комбинированном слабо катионообменном хроматографическом веществе Capto™ ММС
Хроматографию проводили со следующими параметрами:
| смола | Capto™ ММС |
| диаметр колонки | 1 см |
| высота слоя | 14,6 см |
| нанесенный раствор | неочищенный культивационный супернатант клеток |
| загрузка | 30 мг антитела на мл вещества |
| стадия а-1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия а-б1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия б) | варьирующая - смотрите таблицу ниже |
| способ элюции | ступенчатая элюция |
| скорость тока | 250 см/ч |
Из представленной ниже таблицы можно увидеть, что при слегка отличных условиях стадии б) очистка могла быть проведена менее эффективно.
| буферизованный раствор стадии б) | результаты аналитической гель-фильтрации выделенного антитела | ||||||
| Tris [мМ] | NaCl [мМ] | этиленгликоль [% масс.] | pH | общие высокомолекулярные [%] | антитело [%] | общие высокомолекулярные [%] | выход[%] |
| 300 | 1500 | 20 | 8,9 | 5,1 | 85,4 | 9,5 | 93 |
| 300 | 1500 | 20 | 7,1 | 4,7 | 85,6 | 9,7 | 95 |
| 300 | 1500 | 0 | 7,1 | 3,4 | 87,0 | 3,8 | 90 |
| 25 | 1500 | 20 | 8,9 | 4,6 | 86,3 | 9,2 | 101 |
| 25 | 1500 | 20 | 7,1 | 3,7 | 86,8 | 9,5 | 95 |
| 25 | 250 | 20 | 7,1 | 2,4 | 56,4 | 41,3 | 8 |
| 25 | 250 | 0 | 7,1 | 3,5 | 41,0 | 45,6 | 3 |
Пример 3
Хроматография антитела против IGF-1R посредством приведенного здесь способа на комбинированном слабо катионообменном хроматографическом веществе Capto™ MMC
Хроматографию проводили со следующими параметрами:
| смола | Capto™ MMC |
| диаметр колонки | 1 см |
| высота слоя | 14,6 см |
| нанесенный раствор | неочищенный культивационный супернатант клеток |
| загрузка | 30 мг антитела на мл вещества |
| стадия а-1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия а-б1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия а-б2) | 125 мМ Tris-HCl, 100 мМ NaCl, 38 мМ аргинин, pH 8,7 |
| стадия б) | 25 мМ Tris-HCl, 1200 мМ NaCl, 20% (масс./об.) этиленгликоль, pH 7,2 |
| способ элюции | ступенчатая элюция |
| скорость тока | 250 см/ч |
Соответствующая диаграмма элюции показана на Фиг.2, и хроматограмма аналитической гель-фильтрации для стадии б) - на Фиг.3а, и для стадии а-б2) - на Фиг.3б.
| буферизованный раствор стадии а-б2) | результаты аналитической гель-фильтрации выделенного антитела | ||||||
| Tris [мМ] | NaCl [мМ] | аргинин [% масс.] | pH | общие низко-молекулярные [%] | антитело [%] | общие высокомолекулярные [%] | выход [%] |
| 125 | 100 | 38 | 8,7 | 1,6 | 95,7 | 2,7 | 93 |
Пример 4
Сравнительные хроматографии антитела против IGF-1R относительно Примера 3 с условиями, отличными от приведенного здесь способа, на комбинированном слабо катионообменном хроматографическом веществе Capto™ ММС
Хроматографию проводили со следующими параметрами:
| смола | Capto™ ММС |
| диаметр колонки | 1 см |
| высота слоя | 14,6 см |
| нанесенный раствор | неочищенный культивационный супернатант клеток |
| загрузка | 30 мг антитела на мл вещества |
| стадия а-1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия а-б1) | 25 мМ Tris-HCl, 100 мМ NaCl, pH 7,1 |
| стадия а-б2) | варьирующая - смотрите таблицу ниже |
| стадия б) | 25 мМ Tris-HCl, 1200 мМ NaCl, 20% (масс./об.) этиленгликоль, pH 7,2 |
| способ элюции: | ступенчатая элюция |
| скорость тока: | 250 см/ч |
Из представленной ниже таблицы можно увидеть, что при слегка отличных условиях стадии б) очистка могла быть проведена менее эффективно.
| буферизованный раствор стадии а-б2) | результаты аналитической гель-фильтрации выделенного антитела | ||||||
| Tris [мМ] | NaCI [мМ] | аргинин [% масс.] | pH | общие высокомолекулярные [%] | антитело [%] | общие высокомолекулярные [%] | выход [%] |
| 25 | 100 | 40 | 8,0 | 4,4 | 93,7 | 1,9 | 100 |
| 25 | 250 | 40 | 8,0 | 1,4 | 97,2 | 1,4 | 81 |
| 25 | 175 | 40 | 8,9 | 2,2 | 96,5 | 1,3 | 84 |
| 162,5 | 100 | 40 | 8,9 | 2,8 | 95,4 | 1,9 | 95 |
| 162,5 | 250 | 40 | 7,1 | 1,2 | 96,9 | 2,0 | 57 |
| 162,5 | 175 | 40 | 8,0 | 1,3 | 97,0 | 1,7 | 74 |
| 162,5 | 100 | 40 | 7,1 | 2,8 | 96,1 | 1,0 | 80 |
Пример 5
Сравнительный пример антитела против IL13R без предварительной обработки неочищенного культивационного супернатанта
Хроматографию проводили со следующими параметрами:
| смола | Capto™ ММС |
| диаметр колонки | 1 см |
| высота слоя | 10 см |
| нанесенный раствор | неочищенный культивационный супернатант клеток |
| загрузка | 21 мг антитела на мл вещества |
| стадия а-1) | 70 мМ фосфат калия, pH 7,3, 10,9 мСм/см |
| стадия а-б) | 70 мМ фосфат калия, pH 7,3, 10,9 мСм/см |
| стадия б) | 1 М KCl, pH 3,0, 105,6 мСм/см |
| способ элюции | ступенчатая элюция |
| скорость тока | 150 см/ч |
88% нанесенного антитела не связывалось с хроматографическим веществом и было обнаружено в фильтрате (Фиг.4).
Пример 6
Сравнительный пример антитела против IL13R с предварительной обработкой неочищенного культивационного супернатанта
Хроматографию проводили со следующими параметрами:
| смола | Capto™ ММС |
| диаметр колонки | 1 см |
| высота слоя | 11 см |
| нанесенный раствор | культивационный супернатант клеток, доведенный до 1,4 мСм/см |
| загрузка | 20 мг антитела на мл вещества |
| стадия а-1) | 10 мМ фосфат калия, pH 6,5, 1,4 мСм/см |
| стадия а-б) | 10 мМ фосфат калия, pH 6,5, 1,4 мСм/см |
| стадия б) | 100 мМ фосфат калия, pH 7,5, 14,9 мСм/см |
| способ элюции | линейный градиент |
| скорость тока | 150 см/ч |
На хроматограмме (Фиг.5) можно увидеть острый пик. Полученное антитело имело чистоту 96,6% с выходом 68%.
1. Способ получения антитела против IGF-1R (рецептор инсулиноподобного фактора роста 1), включающий следующие стадии:а-1) нанесение на комбинированное слабо катионообменное хроматографическое вещество буферизованного раствора, содержащего неорганическую соль,а) нанесение неочищенного культивационного супернатанта культуры клеток млекопитающих на комбинированное слабо катионообменное хроматографическое вещество, содержащее поперечно связанную агарозу, к которой ковалентно присоединен комбинированный слабо катионообменный лиганд, содержащий функциональную группу карбоновой кислоты, эфира, тиоэфира и ароматическую функциональную группу,б) выделение антитела против IGF-1R путем нанесения буферизованного раствора, содержащего этиленгликоль и неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество и получение, посредством этого, антитела против IGF-1R,где комбинированное слабо катионообменное хроматографическое вещество используют в качестве первой стадии в способе очистки колоночной хроматографией непосредственно с неочищенным культивационным супернатантом культуры клеток, вместо обычно используемой аффинной хроматографии на белке А,где буферизованный раствор на стадии б) содержит от 20 мМ до 30 мМ Tris, от 1050 мМ до 1350 мМ хлорида натрия и примерно 20% (масс./об.) этиленгликоля при значении pH от pH 7,1 до pH 7,3, игде буферизованный раствор на стадии а-1) содержит от 20 мМ до 30 мМ Tris и от 80 мМ до 120 мМ хлорида натрия при значении pH от pH 7,1 до pH 7,3.
2. Способ по п.1, характеризующийся тем, что указанный способ включает следующую дополнительную стадию а-б) после стадии а) и до стадии б):а-б) нанесение буферизованного раствора на комбинированное слабо катионообменное хроматографическое вещество, посредством чего антитело против IGF-1R не выделяется из комбинированного слабо катионообменного хроматографического вещества.
3. Способ по п.2, характеризующийся тем, что стадия а-б) включает две стадии а-б1) и а-б2:а-б1) нанесение буферизованного раствора, содержащего неорганическую соль, на комбинированное слабо катионообменное хроматографическое вещество иа-б2) нанесение буферизованного раствора, содержащего денатурирующее вещество, на комбинированное слабо катионообменное хроматографическое вещество,посредством чего антитело против IGF-1R не выделяется из комбинированного слабо катионообменного хроматографического вещества.
4. Способ по п.1, характеризующийся тем, что денатурирующее вещество выбрано из гидрохлорида гуанидиния и мочевины.
5. Способ по п.1, характеризующийся тем, что неорганическая соль выбрана из хлорида натрия, хлорида калия и хлорида аммония.
6. С