Способ прогнозирования риска развития хронического калькулезного холецистита у женщин
Иллюстрации
Показать всеИзобретение относится к области медицинской диагностики и предназначено для прогнозирования риска развития хронического калькулезного холецистита (ХКХ). У женщин русской национальности, являющихся уроженками Центрального Черноземья России, осуществляют забор крови, выделение ДНК и анализ полиморфизмов генов интерлейкинов. В случае выявления генетического варианта -511Т IL-1В, либо сочетания аллелей и генотипов -889ТT IL-1А, -511Т IL-1В и -113Т IL-9, либо сочетания аллелей и генотипов -511Т IL-1В и -113ТТ IL-9, либо сочетания аллелей -511Т IL-1B, -113Т IL-9, -592C IL-10 и -251Т IL-8, либо сочетания аллелей -511Т IL-1B, -703Т IL-5 и -584C IL-4 прогнозируют повышенный риск развития ХКХ. В случае выявления сочетания аллелей -889С IL-1А, -511С IL-1B и -703С IL-5, либо сочетания аллелей -511C IL-1B и -703С IL-5 прогнозируют низкий риск развития ХКХ. Изобретение обеспечивает получение новых критериев оценки риска развития ХКХ у женщин. 8 ил., 7 пр.
Реферат
Изобретение относится к области медицинской диагностики и может быть использовано для прогнозирования риска развития хронического калькулезного холецистита у женщин.
Хронический калькулезный холецистит (далее ХКХ) - одно из наиболее распространенных заболеваний человека, занимающее третье место после сердечно-сосудистых заболеваний и сахарного диабета [Лейшнер, У. Практическое руководство по заболеваниям желчных путей: пер. с нем. /У. Лейшнер. - Москва: Гэотар-Медиа, 2001. - 264 с.]. В России распространенность данной патологии колеблется в пределах 10-15% и выявляется в среднем у каждой пятой женщины и у каждого десятого мужчины. По количеству хирургических вмешательств желчнокаменная болезнь (далее ЖКБ) вышла на второе место в мире после аппендэктомии [Коханенко, Н. Желчнокаменная болезнь /Н. Коханенко, А. Глебова //Медицинская газета. - 2011. - 2 марта. - С. 8-9].
В формировании ХКХ участвуют такие факторы как: избыточная масса тела, возраст, женский пол, ятрогенные факторы и др. Значимую роль в формировании ЖКБ играют генетические факторы [Григорьева, И. Основные факторы риска желчнокаменной болезни /И. Григорьева //Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2007. - Т. 17, №6. - С. 17-21]. Показана роль отдельных генетических полиморфизмов, участвующих в регуляции воспаления, клеточной пролиферации, метаболизма липидов и желчных кислот в формировании ЖКБ [Lammert, F. Mechanisms of disease: the genetic epidemiology of gallbladder stones /F. Lammert, T. Sauerbruch //Nat. Сlin. Pract. Gastroenterol. Hepatol. - 2005. - Vol. 2, №9. - P. 423-433]. Среди генов-кандитатов, регулирующих преимущественно процессы воспаления, важное значение имеют интерлейкины. Интерлейкины, взаимодействуя со специфическими рецепторами, являются одними из главных звеньев в воспалительном каскаде при ЖКБ, изменяя интенсивность и длительность воспалительных, склеротических и литогенных процессов в желчном пузыре [Царегородцева, Т.М. Цитокины при заболеваниях органов пищеварения [Электронный ресурс] /Т.М. Царегородцева //Регистр лекарственных средств России: энцикл. лекарств и товаров аптечного ассортимента: офиц. сайт /группа компаний РЛС. - Москва, 2009. - 28 апр. - Режим доступа: http://www.rlsnet.ru/articles_426.htm.].
IL-1А - белок, кодируемый геном IL-1А, который располагается на второй хромосоме (2q14). IL-1А - провоспалительный цитокин, обладающий широким спектром метаболической, физиологической, кроветворной деятельности, а также играет одну из центральных ролей в регуляции иммунного ответа. После попадания инфекции в организм, IL-1А активизирует множество процессов системы иммунного ответа. В частности: стимулирует распространение фибробластов, индуцирует синтез протеаз и белков острой фазы, влияет на увеличение числа нейтрофилов крови, активизирует распространение лимфоцитов и вызывает лихорадку [Dinarello, С.А. Induction of interleukin-1 and interleukin-1 receptor antagonist /С.А. Dinarello //Semin. Оnсоl. - 1997. - №24, №3, suppl. 9. - P. S981-S993].
Ген IL-1А содержит 7 экзонов и 6 интронов, на 3 и 5 концах он имеет нетранслируемые области. Кроме того, он обладает высокой степенью гомологии интронных последовательностей, что, возможно, регулирует экспрессию этого гена [Громова, А.Ю. Полиморфизм генов семейства IL-1 человека /А.Ю. Громова, А.С. Симбирцев //Цитокины и воспаление. - 2005. - Т. 4, №2. - С. 3-12].
IL-1B - белок, кодируемый геном IL-1B, который располагается на второй хромосоме (2q13-q21). IL-1 В является многофункциональным цитокином с широким спектром действия. При действии патогенных факторов, он играет важную роль в формировании и поддержании защитной реакции организма. Продуцируется IL-1 В, в основном, макрофагами и моноцитами [Schönbeck, U. Generation of biologically active IL-1 beta by matrix metalloproteinases: а novel caspase-1-independent pathway of IL-1 beta processing /U. Schönbeck, F. Mach, P. Libby //J. Immunol. - 1998. - Vol. 161, №7. - P. 3340-3346].
IL-1 В участвует в инициации и регуляции воспалительных, иммунных процессов, активации нейтрофилов, Т- и В-лимфоцитов, стимуляции синтеза белков острой фазы. За счет IL-1 В происходит повышение хемотаксиса, фагоцитоза, гемопоэза, проницаемости сосудистой стенки, цитотоксической и бактерицидной активности. Отмечается повышение уровня данного цитокина в крови у пациентов с язвенной болезнью желудка, панкреатитом и желчнокаменной болезнью до 1100-3200 пг/мл, по сравнению с контрольной группой (до 40 пг/мл) [Царегородцева, Т.М. Цитокины при заболеваниях органов пищеварения /Т.М. Царегородцева //Регистр лекарственных средств России: энцикл. лекарств и товаров аптечного ассортимента: офиц. сайт /группа компаний РЛС. - Москва, 2009. - 28 апр. - Режим доступа: http://www.rlsnet.ru/articles_426.htm].
IL-4 - лимфокин, массой 15-20 kDa. Ген IL-4 располагается на пятой хромосоме. Основными продуцентами IL-4 являются Т-клетки (Th2). Данный цитокин принимает участие в дифференцировке Т- и В-лимфоцитов. Наиболее мощный эффект интерлейкина-4 связывают с регуляцией синтеза других цитокинов. Он принимает участие в многочисленных биологических процессах, таких как воспалительные реакции и иммунный ответ [Характер распределения аллелей генов ARIL-1 и IL-4 у больных ревматоидным артритом русской национальности, проживающих в Челябинской области /Д.С. Сташкевич, А.Л. Бурмистрова, Т.А. Суслова [и др.] //Успехи современного естествознания. - 2006. - №3. - С. 52-53].
Повышение уровня IL-4 отмечается и при регенераторно-восстановительных процессах хронических рецидивирующих заболеваний органов пищеварения, таких как: язвенная болезнь желудка, панкреатит, желчнокаменная болезнь [Царегородцева, Т.М. Цитокины при заболеваниях органов пищеварения /Т.М. Царегородцева //Регистр лекарственных средств России: энцикл. лекарств и товаров аптечного ассортимента: офиц. сайт /группа компаний РЛС. - Москва, 2009. - 28 апр. - Режим доступа: http://www.rlsnet.ru/articles_426.htm].
IL-5 - димерный белок, массой 50-60 kDa. Ген IL-5 располагается на пятой хромосоме 5q23 -q31. Продуцируется IL-5 Т-клетками (Th 2). В пептидной части одной цепи IL-5 содержатся 115 аминокислотных остатков. Сходной функциональной активностью обладают его мономерная и димерная формы. IL-5 инициирует продукцию иммуноглобулинов и стимулирует синтез IgA [Murphy, J.M. IL-3, IL-5, and GM-CSF signaling: crystal structure of the human beta-common receptor /J.M. Murphy, I.G. Уоung //Vitam. Horm. - 2006. - Vol. 74. - P. 1-30].
Помимо клеток иммунной системы, данный цитокин оказывает влияние и на миелоидные клетки. IL-5 оказывает избирательное действие на костномозговых предшественников эозинофилов, регулируя их пролиферацию и дифференцировку. Наряду с этим, IL-5 увеличивает продукцию супероксидантов и усиливает хемотаксис данных типов клеток [База знаний по биологии человека /разраб. А.А. Александров. - Москва, 1990-2011. - Режим доступа: http://humbio.ru].
IL-8 - хемокин, обладающий провоспалительным действием. Синтезируют IL-8 макрофаги, эпителиальные и эндотелиальные клетки. Ген IL-8 располагается на четвертой хромосоме 4q12 -q13. IL-8 образуется из предшественника, содержит 72 аминокислотных остатка и имеет молекулярную массу 8,8 кДа. Данный цитокин вызывает хемотаксис нейтрофилов, эозинофилов, макрофагов и лимфоцитов и стимулирует их миграцию к месту инфицирования [Шубич, М.Г. Медиаторные аспекты воспалительного процесса /М.Г. Шубич, М.Г. Авдеева //Архив патологии. - 1997. - Т. 59, №2. - С. 3-8].
Высокая концентрация IL-8 отмечается при хронических и острых воспалительных состояниях организма, в том числе при заболеваниях органов пищеварения [Rapid secretion of prestored interleukin-8 from Weibel-Palade bodies of microvascular endothelial cells /J.О. Utgaard, F.L. Jahnsen, А. Bаkkа [et аl.] //J. Еxp. Med. - 1998. - Vol. 188, №9. - P. 1751-1756].
IL-9 - цитокин, основной лимфопоэтический фактор. Белок с молекулярной массой 20-30 кДа, кодируемый геном IL-9, синтезируется Т-лимфоцитами. Этот цитокин активирует деление клеток и предотвращает апоптоз. Ген IL-9 локализуется в регионе 5q31.1. [Фрейдлин, И.С. Паракринные и аутокринные механизмы цитокиновой иммунорегуляции /И.С. Фрейдлин //Иммунология. - 2001. - №5. - С. 4-7].
IL-9 активирует рост тучных клеток и оказывает влияние на формирование иммунного ответа при воздействии аллергенов [Zintzaras, Е. Synopsis and synthesis of candidate-gene association studies in chronic lymphocytic leukemia: the CUMAGAS-CLL information system /Е. Zintzaras, G. D. Kitsios //Am. J. Epidemiol. - 2009. - Vol. 170, №6. - P. 671-678].
IL-10 - лимфокин, массой 17-21 kDa, который продуцируется Т-клетками (Th2). IL-10 кодируется одноименным геном, который расположен на первой хромосоме и состоит из 5 экзонов. Этот интерлейкин является гомодимером, каждая субъединица которого состоит из 178 аминокислот. IL-10 играет важную роль в регуляции иммунного ответа, угнетает действие макрофагов и Th1-клеток и, соответственно, уменьшает цитотоксический ответ организма, а также способствует реализации биологических эффектов Th2-клеток, что обеспечивает развитие гуморальной составляющей иммунного ответа [Mapping of the human IL10 gene and further characterization of the 5'flanking sequence /J. Eskdale, D. Kube, H.Tesch[et аl.] //Immunogenetics. - 1997. - Vol. 46, №2. - 120-128].
Отмечается повышение уровня IL-10 в крови у пациентов с язвенной болезнью желудка, панкреатитом и желчнокаменной болезнью до 1100-3200 пг/мл, по сравнению с контрольной группой (до 40 пг/мл) [Царегородцева, Т.М. Цитокины при заболеваниях органов пищеварения /Т.М. Царегородцева //Регистр лекарственных средств России: энцикл. лекарств и товаров аптечного ассортимента: офиц. сайт /группа компаний РЛС. - Москва, 2009. - 28 апр. - Режим доступа: http://www.rlsnet.ru/articles_426.htm].
Для оценки сложившейся патентной ситуации был выполнен поиск по охранным документам за период с 1990 по 2014 гг. Анализ документов производился по направлению: способ прогнозирования риска развития хронического калькулезного холецистита у женщин на основе молекулярно-генетических данных в зависимости от полиморфных маркеров генов интерлейкинов.
Источники информации: сайт Федерального института промышленной собственности http://fips.ru.
За аналог был выбран патент РФ №2406089 по заявке РФ №2009124685/15, 29.06.2009, «Способ прогнозирования характера течения хронического калькулезного холецистита», где предложен способ прогнозирования характера течения хронического калькулезного холецистита путем выделения ДНК из периферической венозной крови больных и выявления полиморфизма гена TNF. При выявлении генотипов -308GA и -308АА прогнозируют тяжелое течение хронического калькулезного холецистита с частыми обострениями перемежающегося характера. При выявлении генотипа -308GG прогнозируют среднетяжелое и легкое течение хронического калькулезного холецистита, носящего рецидивирующий или монотонный характер. Его недостатком является то, что его невозможно использовать для прогнозирования риска развития хронического калькулезного холецистита у женщин.
Известен способ прогнозирования хронического холецистита по патенту РФ №2014614 (Опубликовано: 15.06.1994), согласно которому в пробе крови определяют группу крови ABO, тип Hp и HIA-антигены. При наличии в фенотипе маркеров из числа характерных для хронического холецистита (B (III), Hp 1 - 1, HIA A3, A28, A30, B5, B13, b35, B40) суммируют их общие прогностические коэффициенты и при значении суммы 13 и более прогнозируют риск развития хронического холецистита. Для уточнения клинической формы холецистита выявляют в фенотипе наличие дифференциальных генетических маркеров форм заболевания (O(1), Hp 1 - 1, HIA B5, B7, B18, B35), суммируют их дифференциальные прогностические коэффициенты и при сумме, равной 6 и более, прогнозируют риск развития бескаменного холецистита, а при сумме, равной -6 и менее, - риск развития каменного холецистита.
Его недостатком является то, что не используются данные о генетических полиморфизмах интерлейкинов и их сочетаний для прогнозирования риска развития хронического калькулезного холецистита у женщин.
В изученной научно-медицинской и доступной патентной литературе авторами не было обнаружено способа прогнозирования риска развития хронического калькулезного холецистита у женщин на основе данных о генетических полиморфизмах интерлейкинов и их сочетаний IL-1А -889Т>С, IL-1 В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т, IL-8 -251А>Т, IL-9 Т113М, IL-10 -592С>А.
Задачей настоящего исследования является расширение арсенала средств прогнозирования хронического калькулезного холецистита у пациенток женского пола.
Технический результат использования изобретения - получение критериев оценки риска развития ХКХ у индивидуумов женского пола русской национальности, являющихся уроженками Центрального Черноземья России, в зависимости от наличия генетических вариантов полиморфных маркеров IL-1А -889Т>С, IL-1 В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т, IL-8 -251А>Т, IL-9 Т113М, IL-10 -592С>А и их сочетаний.
В соответствии с поставленной задачей был разработан способ прогнозирования риска развития ХКХ у женщин русской национальности, являющихся уроженками Центрального Черноземья России, по наличию генетических вариантов полиморфных маркеров IL-1А -889Т>С, IL-1 В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т, IL-8 -251А>Т, IL-9 Т113М, IL-10 -592С>А и их сочетаний, включающий:
- выделение ДНК из периферической венозной крови методом фенольно-хлороформной экстракции;
- генотипирование образцов ДНК с использованием стандартных олигонуклеотидных праймеров;
- прогнозирование повышенного риска развития ХКХ среди индивидуумов женского пола русской национальности, являющихся уроженками Центрального Черноземья России, в случае выявления генетического варианта -511Т IL-1 В, либо сочетания аллелей и генотипов -889ТT IL-1А, -511Т IL-1 В и -113Т IL-9 либо сочетания аллелей и генотипов -511Т IL-1 В и -113ТТ IL-9; либо сочетания аллелей -511Т IL-1B, -113Т IL-9, -592C IL-10 и -251Т IL-8 либо сочетания аллелей -511Т IL-1B, -703Т IL-5 и -584C IL-4;
- прогнозирование низкого риска развития данного заболевания у женщин русской национальности, являющихся уроженками Центрального Черноземья России, в случае выявления сочетания аллелей -889С IL-1А, -511С IL-1B и -703С IL-5 либо сочетания аллелей -511C IL-1B и -703С IL-5.
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогнозирования риска развития ХКХ у женщин по наличию генетических вариантов полиморфных маркеров IL-1А -889Т>С, IL-1 В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т, IL-8 -251А>Т, IL-9 Т113М, IL-10 -592С>А и их сочетаний.
Изобретение охарактеризовано на следующих фигурах:
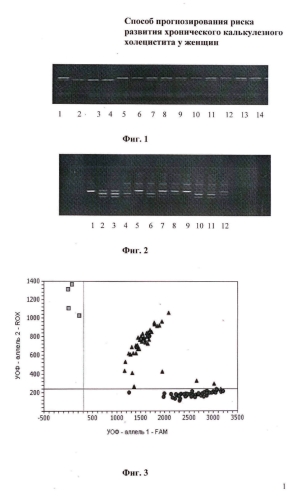
На фиг. 1 представлена дискриминация аллелей по локусу IL-1А -889 Т>С (rs 1800587), где 2, 3, 4 - -889ТТ IL-1А; 5, 6, 10 - -889СС IL-1А; 1, 7-9, 11-14 - -889СТ IL-1А;
На фиг. 2 представлена дискриминация аллелей по локусу IL-1 В -511С>Т (rs 419598), где 1, 9 - гомозиготы -511ТТ; 2, 3, 5, 7, 8, 12 - гетерозиготы -511СТ; 4, 6, 10-11 - гомозиготы -511СС;
На фиг. 3 представлена дискриминация аллелей по локусу IL-4 -584С>Т (rs 2243250), где- -584СС IL-4, - -584ТТ IL-4, - -584СТ IL-4, - отрицательный контроль;
На фиг. 4 представлена дискриминация аллелей по локусу IL-5 -703С>Т (rs12704795), где 1, 3-8, 12, 15 - гомозиготы -703СС; 10, 11, 13, 14 - гетерозиготы -703СТ; 2, 9 - гомозиготы -703ТТ;
На фиг. 5 представлена дискриминация аллелей по локусу IL-8 -251А>Т (rs4073), где - гомозиготы по аллелю -251Т IL-8, - гомозиготы по аллелю -251А, - гетерозиготы -251АТ, - отрицательный контроль);
На фиг. 6 представлена дискриминация аллелей по локусу IL-9 Т113М (rs 2069885), где 2, 4, 8, 10-11 - гетерозиготы 113ТМ; 1, 5-7, 9 - гомозиготы 113ТТ; 3 - гомозигота 113ММ);
На фиг. 7 представлена дискриминация аллелей по локусу IL-10 -592С>А (rs 1800872), где 1, 8-10, 13-14 - гомозиготы -592СС; 4-7, 11-12 - гетерозиготы -592СА; 2 - гомозигота -592АА;
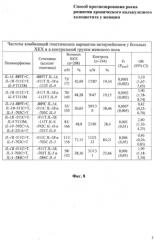
На фиг. 8 показаны частоты комбинаций генетических вариантов интерлейкинов у больных хроническим калькулезным холециститом и в контрольной группе женского пола;
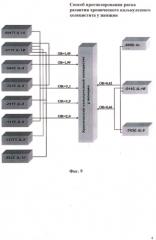
На фиг. 9 показана роль генов интерлейкинов в развитии хронического калькулезного холецистита у женщин.
На фигурах 3 и 5 две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием уровня относительной флуоресценции (далее УОФ) для одного флуорофора на оси x, относительно УОФ для другого флуорофора на оси y на диаграмме дискриминации аллелей. Зонд с флуоресцентным красителем ROX соответствует аллелям Т и А, зонд с красителем FAM - аллелям С и Т.
• Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (-584СТ, -251АТ).
• Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелям -584Т, -251А (УОФ аллелей Т и А отложены по оси y).
• Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелям -584С, -251Т (УОФ аллелей С и Т отложены по оси x).
• Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно: в данном случае неопределенный образец - отрицательный контроль.
Способ осуществляют следующим образом.
Выделение геномной ДНК из периферической крови осуществляют методом фенольно-хлороформной экстракции в два этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (pH=7,6). Полученную смесь перемешивают и центрифугируют при 4ºС, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН=8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37ºС в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°С. Выделенную ДНК используют для проведения полимеразной цепной реакции синтеза ДНК.
Анализ всех генетических полиморфизмов интерлейкинов проводят методом полимеразной цепной реакции (ПЦР) синтеза ДНК. Для ПЦР используют: ДНК-полимераза Thermus aquaticus производства фирмы «Силекс-М», олигонуклеотидные праймеры и зонды, синтезированные фирмой «Синтол». Полимеразную цепную реакцию выполняют на амплификаторах «Терцик-МС4» (ДНК-технология) и IQ5 (Bio-Rad).
Генотипирование ДНК-маркеров производят следующими методами.
1. Метод полиморфизма длин рестрикционных фрагментов (локусы IL-1А -889Т>С, IL-1 В -511С>Т, IL-5 -703С>T, IL-9 Т113М, IL-10 -592С>А). Генотипирование производят с помощью соответствующих эндонуклеаз. Реакция протекает в присутствии буферов и при температурных условиях, рекомендованных производителями эндонуклеаз - ООО «Сибэнзим» (Новосибирск). Продукты рестрикции фракционируют с помощью электрофореза в агарозных гелях различной концентрации и окрашивали в этидиум бромиде (фиг. 1, 2, 4, 6, 7).
2. Метод дискриминации аллелей согласно значениям величин уровня относительной флуоресценции (УОФ) каждого зонда проводят на амплификаторе «СFХ96» (локусы IL-4 -584С>T, IL-8 -251А>Т) (фиг. 3, 5).
Возможность использования предложенного способа для оценки риска развития ХКХ у женщин подтверждает анализ результатов наблюдений 249 больных хроническим калькулезным холециститом и 294 человек популяционного контроля. Общий объем исследуемой выборки составил 543 человека. Среди больных ХКХ 16,80% составили мужчины (41 человек), 83,20% - женщины (208 человек). В контрольной выборке (n=294) процентное соотношение было аналогичным: мужчины - 17,00% (50 человек), женщины - 83,00% (244 человек) (p>0,05).
В выборки больных и контроля включались индивидуумы русской национальности Центрального Черноземья России, не связанные между собой родственными связями. Пациентов относили к соответствующей группе больных ХКХ после подтверждения установленного диагноза с помощью клинических и лабораторно-инструментальных методов обследования, в соответствии с обязательными диагностическими стандартами. Контрольная группа была сформирована при экспедиционном обследовании населения областей Центрально-Черноземного региона России: Красненского и Прохоровского районов Белгородской области, Репьевского района Воронежской области и Черемисиновского района Курской области.
Типирование молекулярно-генетических маркеров осуществляли в лаборатории «Молекулярной генетики человека» медицинского института Белгородского государственного национального исследовательского университета.
Формирование базы данных и статистические расчеты осуществляли с использованием программы «STATISTICA 6.0».
Выявление ассоциаций генетических вариантов анализируемых локусов с развитием ХКХ у женщин проводили с помощью таблиц сопряженности 2х2, на основе вычисления критерия χ2 (хи-квадрат) с поправкой Йетса на непрерывность.
Характер ассоциаций различных аллелей и генотипов с ХКХ у лиц женского пола оценивали при помощи показателя отношения шансов (OR) [Реброва, О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA /О.Ю. Реброва. - [3-е изд.]. - Москва: Медиа Сфера, 2006. - 305 с.]. При проведении множественных сравнений использовали поправку Бонферрони - производили перерасчет уровня значимости р для множественных парных сравнений по формуле: рcor=р×n, где р - полученный уровень статистической значимости, n - количество парных сравнений. За статистически значимый уровень принимали рbonf ≤ 0,05.
Изучение роли комбинаций генетических вариантов IL-1А -889Т>С, IL-1 В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т в развитии ХКХ у женщин проводили с помощью программного обеспечения APSampler [http://sources.redhat.com/cygwin/], использующего метод Монте-Карло марковскими цепями и байесовскую непараметрическую статистику. Для валидации найденных ассоциаций использовался точный критерий Фишера (Pf) и пермутационный анализ (Pperm). Значение Pperm для аллеля или аллельного сочетания определяется как вероятность того, что после сбалансированного перемешивания меток «больной ХКХ» - «контроль» (100 пермутаций) и нового поиска с помощью APSampler оценка значимости ассоциации с ХКХ произвольно найденного аллеля или аллельного сочетания будет не хуже, чем эта оценка для исходного [Царева, E.Ю. Фармакогеномные исследования эффективности лечения рассеянного склероза иммуномодулирующими препаратами: диссертация... кандидата биологических наук: 03.01.03 /Царева Екатерина Юрьевна //- Москва, 2012. - 140 с.]. Значимыми считали различия сравниваемых частот, если Pf<0,05 и Pperm ≤ 0,005, при условии, что значения 95% CI для OR не пересекают 1.
Установлена более высокая концентрация аллеля -511Т IL-1 В (41,71%) по сравнению с группой контроля (32,40%, χ2=6,73, р=0,01). Таким образом, наличие у женщин генетического варианта -511Т IL-1 В определяет повышенный риск формирования ХКХ (OR=1,49; 95% CI=1,10-2,03).
Выявлено, что среди женщин с ХКХ, сочетание генотипа -889ТT IL-1А с аллелями -511Т IL-1 В, -113Т IL-9 отмечается в 42,69% случаев, что в 2,2 раз чаще, чем в контрольной группе (19,54%). Данная комбинация определяет повышенный риск развития хронического калькулезного холецистита у женщин (рf=0,0001; ррerm=0,002; OR=3,1; 95% CI 1,67-5,65).
Установлена ассоциация сочетания аллеля -511Т IL-1 В и генотипа -113ТТ IL-9 с риском развития хронического калькулезного холецистита у женщин. У 48,28% больных ХКХ имеется данная комбинация генетических маркеров, тогда как в контрольной группе она выявлена у 19,15% (рf=0,0002; ррerm=0,002; OR=3,9; 95% CI 1,78-8,74).
Сочетание трех генетических маркеров -889С IL-1А, -511С IL-1B и -703С IL-5, которое отмечается у 20,65% женщин больных ХКХ и у 38,46% контрольной группы, служит протективным фактором формирования данного заболевания (рf=0,0007; ррerm=0,005; OR=0,42; 95% CI 0,25-0,7).
Наряду с этим, установлены различия в распространенности сочетания аллелей -511Т IL-1B, -113Т IL-9, -592C IL-10 и -251Т IL-8 между группой больных ХКХ и контролем. Эта комбинация отмечается у 48,8% женщин с ХКХ и у 28,4% лиц контрольной группы и определяет повышенный риск развития хронического калькулезного холецистита (рf=0,002; ррerm=0,01; OR=2,4; 95% CI 1,36-4,25).
Также зарегистрированы различия в частотах сочетания двух генетических маркеров -511C IL-1B и -703С IL-5 между женщинами больными ХКХ (71,15%) и контролем (84,21%). Данная комбинация полиморфных вариантов генов интерлейкинов является протективным фактором формирования данной патологии (рf=0,006; ррerm=0,05; OR=0,46; 95% CI 0,26-0,83).
Установлено, что сочетание аллелей -511Т IL-1B, -703Т IL-5 и -584C IL-4 является фактором риска развития хронического калькулезного холецистита у женщин. Данная комбинация генетических маркеров отмечается у 38,16% больных ХКХ, что 1,6 раз чаще, чем в контрольной группе (23,66%), (рf=0,006; ррerm=0,05; OR=1,99; 95% CI 1,18-3,34).
Таким образом, резюмируя полученные данные, можно сделать вывод о значимом вкладе полиморфных вариантов генов интерлейкинов IL-1А -889Т>С, IL-1 В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т, IL-8 -251А>Т, IL-9 Т113М, IL-10 -592С>А и их сочетаний в развитие ХКХ у женщин. Причем наличие у женщин генетического варианта -511Т IL-1 В, либо сочетания аллелей и генотипов -889ТT IL-1А, -511Т IL-1 В и -113Т IL-9, либо сочетания аллелей и генотипов -511Т IL-1 В и -113ТТ IL-9; либо сочетания аллелей -511Т IL-1B, -113Т IL-9, -592C IL-10 и -251Т IL-8, либо сочетания аллелей -511Т IL-1B, -703Т IL-5 и -584C IL-4 обуславливает повышенный риск развития ХКХ, а наличие сочетания аллелей -889С IL-1А, -511С IL-1B и -703С IL-5 либо сочетания аллелей -511C IL-1B и -703С IL-5 обладает протективным действием при формировании данного заболевания.
Примеры, подтверждающие осуществимость предложенного изобретения.
1. Генетический вариант -511Т IL-1 В был выявлен у пациентки В. При дальнейшем обследовании данной пациентке был поставлен диагноз хронический калькулезный холецистит.
2. Сочетание генотипа -889ТT IL-1А с аллелями -511Т IL-1 В и -113Т IL-9 было обнаружено у пациентки С. При дальнейшем детальном обследовании у данной пациентки был обнаружен хронический калькулезный холецистит.
3. Комбинация аллеля -511Т IL-1 В и генотипа -113ТТ IL-9 была выявлена у пациентки М. При дальнейшем обследовании данной пациентке был поставлен диагноз хронический калькулезный холецистит.
4. Сочетание аллелей -889С IL-1А, -511С IL-1B и -703С IL-5 было обнаружено у пациентки З. При дальнейшем детальном обследовании у этой пациентки не было обнаружено хронического калькулезного холецистита.
5. Комбинация аллелей -511Т IL-1B, -113Т IL-9, -592C IL-10 и -251Т IL-8 была выявлена у пациентки К. При дальнейшем обследовании данной пациентке был поставлен диагноз хронический калькулезный холецистит.
6. Сочетание генетических маркеров -511C IL-1B и -703С IL-5 было обнаружено у пациентки Б. При дальнейшем детальном обследовании у этой пациентки не было обнаружено хронического калькулезного холецистита.
7. Комбинация аллелей -511Т IL-1B, -703Т IL-5 и -584C IL-4 была выявлена у пациентки Т. При дальнейшем обследовании данной пациентке был поставлен диагноз хронический калькулезный холецистит.
Использование данного способа позволяет прогнозировать риск развития ХКХ у индивидуумов женского пола русской национальности, являющихся уроженками Центрального Черноземья России, что будет способствовать более эффективной реализации лечебно-профилактических мероприятий по предупреждению формирования данного заболевания.
Способ прогнозирования риска развития хронического калькулезного холецистита у женщин русской национальности, являющихся уроженками Центрального Черноземья России, включающий забор крови, отличающийся тем, что после выделения ДНК из периферической венозной крови проводят анализ полиморфизмов генов IL-1А -889Т>С, IL-1В -511С>Т, IL-4 -584С>Т, IL-5 -703С>Т, IL-8 -251А>Т, IL-9 Т113М, IL-10 -592С>А и прогнозируют повышенный риск развития ХКХ в случае выявления генетического варианта -511Т IL-1В, либо сочетания аллелей и генотипов -889ТT IL-1А, -511Т IL-1В и -113Т IL-9, либо сочетания аллелей и генотипов -511Т IL-1В и -113ТТ IL-9, либо сочетания аллелей -511Т IL-1B, -113Т IL-9, -592C IL-10 и -251Т IL-8, либо сочетания аллелей -511Т IL-1B, -703Т IL-5 и -584C IL-4, прогнозируют низкий риск развития данного заболевания в случае выявления сочетаний аллелей -889С IL-1А, -511С IL-1B и -703С IL-5, либо сочетания аллелей -511C IL-1B и -703С IL-5.