Дикетоны и гидроксикетоны в качестве активатора сигнального пути катенина
Иллюстрации
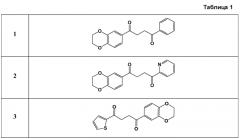
Показать всеДанное изобретение относится к соединениям или их фармацевтически приемлемым солям общей формулы I, где R1 представляет собой ;R2 выбирают из группы, состоящей из замещенного или незамещенного фенила и , и ; и
R3, R4, R5 и R6 все представляют собой Н, также к соединениям II и III. Изобретение также относится к фармацевтическим композициям на основе этих соединений, способу активации передачи сигнала Wnt, способам лечения заболеваний, связанных с сигнальной трансдукцией, и применению их для лечения таких заболеваний, как остеопороз и остеоартропатия; несовершенный остеогенез, дефекты костей, переломы костей, пародонтоз, отосклероз, заживление раны, черепно-лицевые дефекты, онколитическое заболевание костей, травматические повреждения мозга, относящиеся к дифференцировке и развитию центральной нервной системы, включающие болезнь Паркинсона, удар, ишемическое церебральное заболевание, эпилепсию, болезнь Альцгеймера, депрессивное состояние, биполярное расстройство, шизофрению; глазные заболевания, такие как возрастная макулярная дегенерация, диабетический макулярный отек или пигментный ретинит, и заболевания, относящиеся к дифференцировке и росту стволовых клеток, включающие выпадение волос, заболевания, относящиеся к гемопоэзу, и заболевания, относящиеся к регенерации тканей. 8 н. и 31 з.п. ф-лы, 2 табл., 5 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Заявка испрашивает приоритет предварительной заявки на Патент США №61/374687, зарегистрированной 18 августа 2010 года, и предварительной заявки на Патент США No. 61/427974, зарегистрированной 29 декабря 2010 года, содержание которых приводится в описании настоящего изобретения путем ссылки на них.
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее изобретение относится к активаторам одного или более белков в сигнальном пути Wnt, включая активаторы одного или более Wnt белков, и к композициям, включающим эти активаторы. Более конкретно, изобретение относится к применению β-дикетона, γ-дикетона или γ-гидроксикетона или их солей или аналогов при лечении остеопороза и остеоартропатии; несовершенного остеогенеза, дефектов костей, переломов костей, пародонтоза, отосклероза, заживления раны, черепно-лицевых дефектов, онколитического заболевания костей, травматических повреждений мозга, связанных с дифференцировкой и развитием центральной нервной системы, включающих болезнь Паркинсона, удары, ишемическое церебральное заболевание, эпилепсию, болезнь Альцгеймера, депрессивное состояние, биполярное расстройство, шизофрению; глазных заболеваний, таких как возрастная макулярная дегенерация, диабетический макулярный отек или пигментный ретинит, и заболеваний, связанных с дифференцировкой и ростом стволовых клеток, включающих выпадение волос, заболеваний, связанных с гемопоэзом, и заболеваний, связанных с регенерацией тканей.
Описание известного уровня техники
Сигнальный путь Wnt/β-катенина играет важную роль во многих биологических процессах. Он регулирует направление развития пока еще неразвитых клеток в эмбриональной форме. Сигнальный путь Wnt/β-катенина имеет важное значение для самообновления и пролиферации стволовых клеток, а также развития стволовых клеток во взрослых организмах (например, клеток кожи, костных клеток, клеток печени, и других клеток) [Science (2002), 296(5573), 1644-1646]. Сигнальный путь Wnt/β-катенина регулирует развитие, морфологию, пролиферацию, подвижность и предопределение клеток [Annual Review of Cell and Developmental Biology (2004), 20, 781-810]. Сигнальный путь Wnt/β-катенина играет центральную роль при онкогенезе, и неадекватная активация этой системы наблюдается при различных видах рака у человека ["Wnt Signaling in Human Cancer", in Signal Transduction in Cancer (pp. 169-187). (2006) Springer]. Wnt/β-катенин был первым описанным у человека белком, который взаимодействует с цитоплазматическим доменом E-кадгерина, при этом Wnt/β-катенин связывает комплекс кадгерина с актином цитоскелета [Science (1991), 254(5036), 1359-1361]. Кроме того, была обнаружена дополнительная функция Wnt/β-катенина у млекопитающих, а именно, в качестве ключевого медиатора передачи сигнала Wnt/β-катенин.
В случае присутствия Wnt лиганда, если он не ингибирован выделяемыми антагонистами, Wnt лиганд связывает комплекс Frizzled (Fzd)/рецептор белка липопротеина низкой плотности (LRP), активирующий цитоплазматический белок Dishevelled (Dsh у дрозофилы, и Dvl у позвоночных). Как активируется Dsh/Dvl полностью не ясно, но было сделано предположение, что активация может быть частично связана с фосфорилированием с помощью казеинкиназы 1 (CK1) и казеинкиназы 2 (CK2) [Proceedings of the National Academy of Sciences of the USA (1999), 96(22), 12548-12552]. Dsh/Dvl затем ингибирует активность мультибелкового комплекса (β-катенин- аксин - ген аденоматозного полипоза толстой кишки (APC) - гликоген синтаза киназа (GSK)-3β), который целенаправленно воздействует на β-катенин путем фосфорилирования для деградации с помощью протеасомы. Предполагается, что Dsh/Dvl связывает CK1 и, в результате этого, ингибирует примирование β-катенина и косвенно предотвращает GSK-3β фосфорилирование β-катенина [Genes & Development (2002), 16(9), 1066-1076]. Было также показано, что после Wnt стимуляции, Dvl способствует вхождению GSK-3 связывающего белка (GBP) в мультибелковый комплекс. GBP может оттитровывать GSK-3β от аксина и таким способом ингибировать фосфорилирование β-катенина. И наконец, было описано секвестрация аксина в клеточной мембране с помощью LRP [Molecular cell (2001), 7(4), 801-809]. Суммарным результатом является накопление цитозольного β-катенина. Стабилизированный β-катенин затем перемещается в ядро и связывается с членами семейства ДНК связывающих белков, фактором Т-клетки (Tcf)/лимфоидным усиливающим фактором (Lef), что приводит к транскрипции Wnt целевых генов.
В отсутствии Wnt лиганда, аксин способствует вхождению CK1 в мультибелковый комплекс, вызывая примирование β-катенина и инициирование каскада фосфорилирования β-катенина, осуществляемого с помощью GSK-3β. Фосфорилированный β-катенин затем распознается как белок, содержащий повторяющийся β-трансдуцин (β-TrCP), и разлагается протеасомой, что приводит к снижению уровня цитозольного β-катенина.
Аберрантная активация пути Wnt/β-катенин приводит к различным фенотипам, включающим развитие ряда онкологических заболеваний у людей, и заболеваний, приводящих к аномальному развитию и функционированию стволовых клеток [Oncogene (2009), 28(27), 2163-2172; Cancer Cell (2008), 14(6), 471-484; American Journal of Pathology (2003), 162(5), 1495-1502]. Хроническая активация сигнального пути Wnt/β-катенина связана с развитием целого ряда злокачественных новообразований у человека, включающих синдром увеличенной костной массы, рубцевание ткани, колоректальные злокачественные опухоли, злокачественные гепатомы (HCC), карциномы яичника, матки, поджелудочной железы, и меланомы [BioEssays (1999) 21(72), 1021-1030; Cell (2000), 103(2), 311-320; Genes Dev. (2000), 14(15), 1837-1851]. Так как путь Wnt/β-катенин участвует в громадном количестве процессов роста и развития, мутация белков, вовлеченных в систему сигнальной трансдукции Wnt/β-катенин, тесно связана с различными заболеваниями человека, такими как аномалии развития, морфогенез волосяного фолликула, дифференцировка стволовых клеток, костеобразование и пролиферация клеток.
Выпадение волос
Волосы образуют под кожей похожую на мешочек структуру, называемую волосяным фолликулом. Видимая часть волос, например, которую мы видим на коже головы, фактически является волосяными стержнями, которые представляют собой ороговевшую отвержденную ткань, которая растет из волосяных фолликулов. В частности, волосяной стержень состоит в основном из кератина, который продуцируется кератиноцитами.
Нормальные волосяные фолликулы совершают цикл развития, включающий стадию роста (стадию анагена), стадию регрессии (стадию катагена) и стадию покоя (стадию телогена). Волосы кожи головы имеют относительно продолжительный цикл жизни: стадия анагена длится от 2 до 6 лет, стадия катагена имеет продолжительность от нескольких дней до нескольких недель, и стадия телогена составляет приблизительно три месяца. Более короткие волосы, находящиеся в других местах на теле человека, имеют соответственно более короткие продолжительности анагена. Морфология волос и волосяного фолликула значительно изменяется в течение жизненного цикла волос [Dermatology in General Medicine (Vol. I), McGraw-Hill, Inc., 1993, pp. 290-91; Sperling, L.C; J. Amer. Acad. Dermatology (1991), 25(1, Part 1), 1-17].
В период анагена, волосяной фолликул метаболически очень активен. Фолликул включает в своем основании дермальную папиллу, а эпидермальные матричные клетки, окружающие дермальную папиллу, образуют основание волосяного стержня, который распространяется вверх из папиллы через волосяной канал. Матричные клетки представляют собой активно растущую часть волос.
На стадии катагена, матричные клетки покидают папиллу, и происходят другие дегенеративные изменения. Например, сосуды и капилляры, снабжающие кровью и питательными веществами волосяной фолликул, ссыхаются и перестают функционировать. Столбик эпителиальных клеток выталкивает вверх ороговевший прилегающий стержень волоса, и внутри фолликула происходит гибель клеток. Волосяной стержень затем выпадает из кожи головы или другой части тела, и волосяной фолликул входит в стадию телогена, стадию покоя цикла роста волос.
Несмотря на то, что регуляция и рост волосяного фолликула хорошо не изучены, тем не менее, очевидно, что они представляют динамические процессы пролиферации, дифференцировки и клеточных взаимодействий во время морфогенеза тканей. Предполагают, что волосяные фолликулы образуются только на ранних стадиях развития, и они не замещаются. Поэтому, увеличение поврежденных или нефункционирующих волосяных фолликулов обычно связывают с выпадением волос.
При мужском или женском облысении обязательно присутствуют мужские или женские гормоны, например, андрогены, но причина этого неизвестна. Степень выпадения волос у любого мужчины сильно зависит от генов, которые он унаследовал от своего отца, матери, или их обоих. Выпадение волос начинается на висках или на макушке. Если выпадение волос у мужчин начинается в подростковом возрасте, последующее выпадение волос обычно становится довольно обширным. Облысение у мужчин происходит волнообразно. Выпадение волос может начинаться в возрасте около 20 лет, затем приостанавливаться, и опять возобновляться через несколько лет. В возрасте от 20 до 30 лет, 30% мужчин имеют проплешины. Выпадение волос продолжает увеличиваться вплоть до возраста 50-60 лет, в котором 50% мужчин являются абсолютно лысыми.
На скорость выпадения волос влияет возраст, тенденция к раннему облысению, обусловленная унаследованными генами, и излишнее количество мужского гормона дигидротестостерона (DHT) в волосяном фолликуле. DHT воздействует на рецептор гормона в волосяном фолликуле, в силу чего замедляется образование волос и растут слабые короткие волосы. Иногда продуцирование DHT даже полностью останавливает рост волос. Лысеющие мужчины имеют содержание DHT в волосяных фолликулах выше среднего значения, но содержания у них тестостерона обычно не превышает средних уровней.
Женское облысение отличается от мужского облысения, и частота его случаев увеличивается. Выпадение волос происходит в основном на макушке, но полное облысение встречается у женщин редко.
Токсическое облысение представляет собой временное явление, но оно обычно длится от трех до четырех месяцев и часто вызывается инфекционными заболеваниями. Например, токсическое облысение может возникать в результате гипотиреоза, диабета, гормональных проблем, авитаминозов, гипофункции гипофиза, паразитирующих организмов, плохого пищеварения, ранней стадии сифилиса, передозировки витамина A или ретиноида, или других цитотоксических лекарственных средств.
Гнездная алопеция представляет собой внезапное выпадение волос в четко очерченных областях. Она может поражать любую покрытую волосами область, но чаще всего она поражает волосы на голове и бороду. Выпадение волос на нескольких участках часто прекращается, и волосы восстанавливаются через несколько месяцев даже без лечения, но возможны и рецидивы. Гнездная алопеция обычно возникает у людей, у которых не наблюдается явное заболевание кожи или системное заболевание, но в редких случаях при лабораторных исследованиях могут обнаруживаться антимикросомные антитела к тиреоглобулину, желудочные париетальные клетки и адренальные клетки.
Рубцовая алопеция является результатом воспаления и распада ткани. Она может быть обусловлена повреждениями, такими как ожоги, физическая травма или распад после радиоактивного облучения. В этих случаях, можно ожидать небольшого возобновления роста волос. Другие случаи представляют собой кожные проявления красной волчанки, красный плоский лишай, хронические подкожные бактериальные или грибковые инфекции, подкожные язвы, саркоидоз, сифилис или туберкулез. Медленно растущие опухоли кожи головы являются редкой причиной выпадения волос.
Ни одно из этих состояний хорошо не изучено, но каждое состояние вызывает чувство обеспокоенности и дискомфорта, так как волосы часто считают важным фактором при социальных контактах и взаимодействиях людей.
Было предложено множество подходов при лечении выпадения волос. Двумя наиболее часто применяемыми и признанными соединениями для предотвращения выпадения волос являются миноксидил, активный ингредиент в препарате Rogaine®, и ингибитор 5α-редуктазы, финастерид, активный ингредиент в препарате Propecia®. Однако, косметическое лечение возрастного выпадения волос у пациентов с помощью раствора миноксидила или финастерида для местного применения приводило только к умеренному возобновлению роста волос у менее чем 40% таких пациентов. И на самом деле, менее чем десять процентов мужчин, которые применяют Rogaine®, достигают удовлетворительных результатов. Поэтому, существует необходимость в более эффективных способах и в более эффективных композициях для лечения выпадения волос. Предпочтительно, чтобы новые способы и композиции требовали бы меньшего количества наносимых активных ингредиентов, обеспечивали бы более быстрое возобновление роста волос в большем количестве и с большой густотой, чем в настоящее время в наблюдаемых случаях при лечении миноксидилом или финастеридом.
Было обнаружено, что развитие и регенерация волосяного фолликула регулируется с помощью канонического сигнального пути Wnt/β-катенина [Investigative Dermatology (2008), 128(5), 1081-1087]. В эпидермисе, развитие волосяного фолликула инициируется при заполнении кожи мезенхимальными клетками. Во время этого процесса, сигналы, исходящие из дермы, индуцируют уплотнение эпителия, удлинение эпителиальных клеток и образование плакодов, содержащих Wnt-восприимчивые клетки. В результате, плакоды передают сигнал клеткам кожи к уплотнению, в силу чего формируется компонент дермальной папиллы волосяного фолликула, который также восприимчив к передаче сигналов Wnt. Из волосяного эпителия выделяется Wnt3a и оказывает аутокринное и паракринное действие, и было показано, что Wnt-3α поддерживает на стадии анагена экспрессию гена в клетках дермальной папиллы и опосредует побуждающую к росту волос активность в культуре органа. Этот Wnt-3α -опосредованный рост волос может зависеть от канонического сигнального пути Wnt/β-катенина, так как делеция гена β-катенина или Lef1 приводила к выпадению волос у мышей. Поэтому, активация β-катенина с помощью Wnt способствует ингибированию дифференцировки кератиноцитов, индуцированию образования волосяного фолликула, и поддержанию пролиферации предшественников нервных клеток.
Нейродегенеративные заболевания
Нейродегенеративные заболевания являются следствием нарушения функции нейронов или их миелиновой оболочки, которые с течением времени могут привести к дисфункции и, в результате этого, к нарушениям функций. Мозг взрослого млекопитающего имеет ограниченную способность к регенерации. Это делает опасным восстановление любых повреждений, и, следовательно, травмы ЦНС являются очень тяжелыми.
Новые нейроны образуются из нейронных стволовых клеток в двух областях центральной нервной системы взрослого млекопитающего: в субвентрикулярной зоне бокового желудочка, и в субгранулярной зоне гиппокампальной зубчатой извилины [Current Opinion in Cell Biology (2001), 13, 666-672]. Сигналы, подаваемые микросредой, способствуют регуляции поддержания, пролиферации и предопределенного нейронного коммитирования локальных стволовых клеток. Многие из этих сигналов и сигнальных путем являются неизученными.
Болезнь Альцгеймера (AD) является самой распространенной причиной деменции, которая постепенно разрушает нейроны, и которой страдают более чем 24 миллиона человек в мире. Она возникает главным образом у пожилых людей, и пациенты, страдающие AD, теряют способность к обучению, запоминанию, принятию решений, общению и выполнению повседневных функций. Этиология и развитие AD изучено плохо, но эту болезнь связывают с бета-амилоидными (Αβ) бляшками и нейрофибриллярными клубками в мозге.
Болезнь Паркинсона (PD) представляет собой дегенеративное расстройство центральной нервной системы, которым поражено более чем 6 миллионов человек в мире и которое часто нарушает двигательные навыки и речь пациентов. Симптомы болезни Паркинсона являются результатом потери секретирующих допамин клеток в области черной субстанции (дословно "черного вещества"). Эти нейроны имеют проекцию в стриатум, и их потеря приводит к нарушениям активности нейронных цепей в подкорковых узлах, которые регулируют движение.
Боковой амиотрофический склероз (ALS) является нейродегенеративным заболеванием со смертельным исходом, которое возникает вследствие гибели двигательных нейронов. Контролирование прогрессирующей потери мышц отрицательно влияет на способность пациента к независимому функционированию. ALS поражает клетки в головном мозге и спинном мозге (двигательные нейроны), которые посылают сигналы для движения мышц. В некоторых случаях, мутация в гене SOD1 дает в результате белок в дисфункциональном состоянии, белок супероксиддисмутазы (называемый SOD1), который обычно проводит "очистку" внутри клетки от токсичных частиц. При мутации SOD1, токсичные частицы накапливаются внутри двигательных нейронов, вызывая нарушение их функционирования. Но эта мутация объясняет только небольшой процент случаев ALS. Основная причина ALS, которым страдают около 350000 взрослых людей в мире, неизвестна.
Удар и травматическое повреждение мозга могут также вызывать потерю нейронов и приводить к снижению когнитивной способности. Удар может быть подразделен на два основных типа: ишемический и геморрагический. Ишемия обусловлена прекращением кровоснабжения, в то время как геморрагия обусловлена разрывом кровеносного сосуда или патологической васкулярной структурой. Удар может вызывать продолжительное неврологическое повреждение, осложнения и смерть, если его быстро не диагностируют и не начинают его лечение. Он является третьей по распространенности причиной смерти и причиной нетрудоспособности взрослого населения в США и Европе.
Лобно-височная деменция (FTD) составляет 18% деменций у людей моложе 65 лет. Сама по себе она часто проявляется в виде нарушения поведения и может прогрессировать с причинением ущерба способности пациента к самостоятельному мышлению и функционированию. В последних исследованиях были вскрыты генетические факторы, которые способствуют возникновению этой деменции, однако еще не существует лечения, которое бы блокировало нарушение функционирования мозга, вызываемое этой деменцией.
Система сигнальной трансдукции Wnt/β-катенин играет исключительно важную роль в дифференцировке и развитии нервных клеток для центральной нервной системы, что предполагает взаимосвязь между Wnt/β-катенин белками и числом случаев различных заболеваний центральной нервной системы, включающих нейродегенеративные заболевания [Nature (2005), 437(7063), 1370-1375]. В частности, было также обнаружено, что передача сигнала Wnt/β-катенин связана с заболеваниями, возникающими в результате аномалии нервных клеток, такими как повреждение мозга, болезнь Паркинсона, боковой амиотрофический склероз (болезнь Лу Герига), удар, эпилепсия, болезнь Альцгеймера (AD), депрессивное состояние, биполярное расстройство и шизофрения.
Болезнь Альцгеймера является самым распространенным возрастным нейродегенеративным расстройством. В действительности, была обнаружена взаимосвязь между нейротоксичностью, индуцируемой амилоид-β-пептидом (Αβ), и снижением цитоплазматических уровней β-катенина. По-видимому, Αβ связывает внеклеточный богатый цистеином домен рецептора Frizzled (Fz), тем самым ингибируя передачу сигнала Wnt/β-катенин. Перекрестная связь с другими сигнальными каскадами, которые регулируют передачу сигнала Wnt/β-катенин, включающими активацию M1 мускаринового рецептора и PKC, использование бифункциональных соединений ибупрофен-ChE, PPAR α, γ агонистов, никотина и некоторых антиоксидантов, обеспечивает в результате нейропротективное действие в отношении Αβ. Эти исследования указывают, что устойчивая потеря Wnt сигнальной функции может приводить к Αβ-зависимой нейродегенерации, наблюдаемой в мозге пациентов, страдающих болезнью Альцгеймера. Следовательно, в качестве терапевтической цели при лечении AD могла бы быть предложена активация сигнального пути Wnt/β-катенина.
Глазные заболевания
Возрастная макулярная дегенерация (AMD) представляет собой болезненное состояние, которое обычно поражает пожилых людей и приводит к потере зрения в центре поля зрения (макулы) в результате повреждения сетчатки глаза. Она может протекать в "сухой" и "влажной" формах. AMD является основной причиной нарушения зрения у пожилых людей (старше 50 лет). Внутренний слой глаза представляет собой сетчатку, которая содержит нервы, обеспечивающие поле зрения, а за сетчаткой находится сосудистая оболочка глаза, которая содержит кровеносную сеть для снабжения кровью макулы (центральной части сетчатки). При сухой (неэкссудативной) форме, продукты распада клеток, называемые друзами, накапливаются между сетчаткой и сосудистой оболочкой, и сетчатка может начать отслаиваться. При влажной (экссудативной) форме, которая является более тяжелой, кровеносные сосуды разрастаются из сосудистой оболочки позади сетчатки, и сетчатка также может начать отслаиваться. AMD может быть подвергнута лечению с помощью лазерной коагуляции и с помощью лекарственных средств, которое приостанавливает рост кровеносных сосудов, а иногда направляет развитие процесса в обратном направлении.
Диабетическая ретинопатия представляет собой ретинопатию (повреждение сетчатки), вызываемую осложнениями при диабете, которая может, в конечном счете, приводить к слепоте. Она представляет собой офтальмологическое проявление системного заболевания, которое поражает до 80% всех пациентов, которые страдают диабетом в течение 10 лет или более. Так как в ходе пролиферативной диабетической ретинопатии (PDR) образуются новые кровеносные сосуды позади глаза, они могут кровоточить (геморрагия) и в результате приводить к получению размытого изображения. У некоторых людей развивается состояние, называемое макулярным отеком. Оно возникает, когда из поврежденных кровеносных сосудов просачивается жидкость и липиды и попадают на макулу, часть сетчатки, которая позволяет нам видеть мелкие детали. По мере развития заболевания, тяжелая непролиферативная диабетическая ретинопатия вступает в позднюю, или пролиферативную, стадию. Недостаток кислорода в сетчатке вызывает рост новых хрупких кровеносных сосудов около сетчатки и в прозрачном гелеобразном стекловидном теле глаза, которое заполняет внутреннюю часть глаза. Без своевременного лечения, эти новые кровеносные сосуды могут кровоточить, приводить к затуманенному зрению и разрушить сетчатку.
Пигментный ретинит (RP) представляет собой группу генетических глазных заболеваний. В процессе развития симптомов RP, ночная слепота обычно предшествует туннельному зрению в течение нескольких лет или даже десятилетий. Многие люди, страдающие RP, не становятся официально слепыми до 40 или 50 лет и сохраняют некоторое зрение в течение всей жизни [American Journal of Ophthalmology (2003), 136(4), 678-68]. Другие становятся полностью слепыми в результате RP, в некоторых случаях уже в детстве. Развитие RP в каждом случае происходит различно. RP представляет собой тип прогрессирующей ретинальной дистрофии, группы наследственных расстройств, при которых аномалии зрительных рецепторов (палочек и колбочек) или ретинального пигментного эпителия (RPE) сетчатки приводят к прогрессирующей потере зрения. Страдающие этим заболеванием пациенты сначала испытывают нарушенную адаптацию к темноте или никталопию (ночную слепоту), затем уменьшение периферического поля зрения (известное как туннельное зрение) и, иногда, потерю центрального зрения на последней стадии заболевания.
Глия Мюллера, или клетки Мюллера, являются глиальными клетками, обнаруживаемыми в сетчатке позвоночных, которые обычно выполняют функции любых нормальных глиальных клеток. Однако было обнаружено, после повреждения сетчатки глия Мюллера подвергается дедифференцировки в мультипотентные клетки-предшественники. На этой стадии, клетка-предшественник может делиться и дифференцироваться в ряд клеток ретинального типа, включая зрительные рецепторы, которые могли быть повреждены в результате травмы. Кроме того, в недавно опубликованном исследовании было показано, что клетки Мюллера действуют в глазу млекопитающего как собиратели света, аналогично волоконнооптической пластинке, направляющие свет на клетки палочек и колбочек.
Мультипотентные ретинальные клетки-предшественники должны решать две фундаментальных проблемы. Во-первых, они должны сначала увеличить свое число, но затем ограничить свою пролиферацию, так чтобы продуцировалось надлежащее число дифференцированных клеток при приемлемом времени развития. Во-вторых, различающиеся процессы деления и дифференцировки должны быть скоординированы, так чтобы дифференцировка могла начинаться только тогда, когда клетки закончили деление [Current Opinion in Genetics & Development (1997), 7(5), 651-658; Nature Reviews Neuroscience (2001), (2), 109-118]. Wnt промотирует пролиферацию клеток во многих тканях [Cell and Tissue Research (2008), 331(1), 193-210], в частности, в развивающейся сетчатке [Stem Cells (2008), 26(5), 2063-2074; Development (2003), 130(3), 587-598; Development (2005), 132(12), 2759-2770; Development (2005), 132(13), 3027-3043]. Семейство SoxB1 генов (Sox1-3) может быть ключевыми эффекторами передачи сигналов Wnt/β-катенин в развивающейся нервной системе [Development (2006), 133(22), 4451-4461; Neuron (2005), 46(1), 23-36]. В процессе нейрогенеза, Sox2 противодействует генам предшественников нейронов и может поддерживать клетки-предшественники [Nature Neuroscience (2003), (6), 1162 - 1168; Neuron (2003), 39(5), 749-765]. В сетчатке глаза лягушки, передача сигнала Wnt/β-катенин через Fz5 является необходимой для экспрессии Sox2, который требуется для экспрессии гена предшественника нейрона и для перехода от клеток-предшественников в нейроны [Neuron (2005), 46(1), 23-36]. Было обнаружено, что эти факторы являются базовыми компонентами консервативного иерархического каскада, и предполагается, что они образуют мощную направленную сеть, которая способствует переходу клеток из пролиферативного, недифференцированного состояния в непролиферативное, дифференцированное нейронное или глиальное состояние [Development (2009), 136(19), 3289-3299].
Регенерация ЦНС млекопитающего весьма ограничена. В отличие от модели на цыплятах, современные модели подтверждают, что ретинальные нейроны никогда не регенерируются. Было показано, что в сетчатке взрослого млекопитающего после острого нейротоксичного повреждения in vivo глия Мюллера дедифференцирует и продуцирует ретинальные клетки, включая зрительные рецепторы. Однако число вновь генерированных ретинальных нейронов является очень ограниченным. Было показано, что передача сигнала Wnt/β-катенин промотирует пролиферацию образующихся из глиа Мюллера ретинальных клеток-предшественников и нейронную регенерацию после повреждения или во время дегенерации. Лечение с помощью Wnt3a увеличивает пролиферацию дедифференцированных глия Мюллера более чем в 20 раз в сетчатке с поврежденным зрительным рецептором. Было также показано, что при дегенерации сетчатки, Wnt3a повышал пролиферацию клеток, и лечение с помощью RA или VPA промотировало дифференцировку этих клеток в клетки родопсин-положительного зрительного рецептора [Journal of Neuroscience (2007), 27(15), 4210-4219].
Поэтому, предполагается, что модулирование пути Wnt/β-катенин является одной возможной терапевтической стратегией для интенсификации замены потерянных нейронов путем генерирования клеток, образующихся из эндогенных нейронных клеток-предшественников.
Костеобразование
Было показано, что каноническая передача сигнала Wnt/β-катенин повышает костеобразование, и компоненты сигнального пути Wnt рассматриваются в качестве мишеней для воздействия лекарственных средств при остеопорозе и других метаболических заболеваний костей [Bone (2009), 44(6), 1063-1068]. В настоящее время, случаи заболевания костей увеличиваются вследствие социально-экологических и генетических факторов, в частности, вследствие увеличения численности пожилых людей. Обычно, заболевания костей возникает и развивается без специальных симптомов, но с возрастом состояние быстро ухудшается. Не смотря на то, что к настоящему времени разработано много лекарственных средств для лечения заболеваний костей, большинство из них нацелено главным образом на облегчение боли или на замедление снижения плотности костей. Они не эффективны в качестве исцеляющих лекарственных препаратов, целью которых является повышение плотности костей пациентов, которые страдают от остеопороза. Некоторые другие лекарственные средства обычно используют в форме инъекций и, как сообщают, они проявляют побочные эффекты при их длительном введении.
Передача сигнала через путь Wnt/β-катенин может увеличивать массу костей в результате действия ряда механизмов, включающих обновление стволовых клеток, стимулирование репликации преостеобластов, индуцирование остеобластогенеза, и ингибирование апоптоза остеобластов и остеоцитов. Один молекулярный механизм представляет собой стимуляцию сигнального пути Wnt путем Wnt-3α взаимодействия его рецепторов LRP5 и Fzd [Journal of Medicinal Chemistry (2009), 52(22), 6962-6965]. Костеобразующие остеобласты экспрессируют на поверхности мембраны белки LRP5 и Fzd, которые служат в качестве корецепторов для растворимого пептидного агониста Wnt-3α. После стимуляции с помощью Wnt-3α, внутренние концентрации свободного β-катенина возрастают, и он проникает в ядро и стимулирует фактор Т-клетки (TCF). Далее следуют транскрипционные события, что приводит в результате к продуцированию дополнительных анаболических генных продуктов. Дополнительный растворимый внеклеточный белок, Dkk-1, противодействует этому процессу путем одновременного связывания рецепторов клеточной поверхности Kr2 и LRP5, эффективно ингибируя связывание Wnt-3α с LRP5. Кроме того, происходит эндоцитоз комплекса Kr2/LRP5/Dkk-1 с удалением LRP5 клеточной мембраны, тем самым сводя к нулю его функцию. Мутация с потерей функции выделяемых Wnt антагонистов, таких как Dkk-1, SOST/склеростин и выделяемый белок (sFRP)-1, относящийся к белку Frizzled, приводит к повышенному костеобразованию, обусловленному изменениями ряда параметров остеобластов, таких как пролиферация, дифференцировка, рекрутинг/срок жизни и функционирование [Journal of Bone and Mineral Research (2009), 21(6), 934-945], в то время как делеция активируемого β-катенином транскрипционного фактора TCF-1 вызывает остеопению, которая возникает в результате снижения экспрессии остеопротегерина под воздействием остеобластов [Developmental Cell (2005), 8(5), 751-764].
Желудочно-кишечные заболевания
Эпителиальная ткань кишечника взрослого человека характеризуется непрерывной заменой эпителиальных клеток в результате стандартного цикла деления клетки, дифференцировки, миграции и эксфолиации, происходящего в течение 5-7 дней транзитного времени для крипта/ворсинка. Предполагаемые факторы роста, регулирующие внутри ниши пролиферацию кишечных стволовых клеток взрослого человека, еще не выявлены, хотя при исследованиях изучалась внутриклеточная активность передачи сигнала β-катенин/Lef/Tcf внутри пролиферативного компатмента крипты.
Ряд патологических состояний характеризуются поражением клеток кишечника. Воспалительное заболевание кишечника (IBD) может возникать в любом одном из двух или в обоих тонком и толстом кишечнике. Болезнь Крона и язвенный колит являются наиболее изученными формами IBD, и эти оба заболевания относятся к категории "идиопатического" воспалительного заболевания кишечника, так как этиология их неизвестна. "Активное" IBD характеризуется острым воспалением. "Хроническое" IBD характеризуется архитектурными изменениями в результате деформации и рубцевания крипты. Криптогенные абсцессы могут возникать при многих формах IBD.
Язвенный колит (UC) поражает толстую кишку в форме диффузной вирусной диареи с дистальным преобладанием. Фактически, всегда поражается прямая кишка, и могут быть вовлечены в процесс дополнительные части толстой кишки, непрерывно распространяясь поблизости от прямой кишки. Этиология возникновения UC неизвестна. Пациенты, длительно страдающие UC, относятся к группе повышенного риска развития рака толстой кишки.
Пациенты, страдающие UC, относятся также к группе риска развития заболеваний печени, включая склерозирующий холангит и злокачественную опухоль желчного протока.
Болезнь Крона может поражать любую часть желудочно-кишечного тракта, но наиболее часто она поражает дистальную тонкую кишку и толстую кишку. Воспаление обычно является трансмуральным и может вызывать все что угодно, от небольшой язвы и лимфоидного фолликула (афтоидной язвы) до глубоких язвенных трещин, трансмуральных рубцов и хронического воспаления. В одной трети случаев присутствует гранулема, и в паракишечных местах, таких как лимфатические узлы, печень и суставы, может также присутствовать гранулема. Трансмуральное воспаление приводит к развитию свищей между петлями кишечника и другими структурами. Обычно воспаление является сегментарным, включающим разделяющие области в пораженном кишечнике. Этиология неизвестна, хотя и были предложены инфекционный и иммунологический механизмы.
Глютен, обычный пищевой белок, присутствующий в пшенице, ячмене и ржи, вызывает у восприимчивых к нему людей заболевание, называемое глютеновой болезнью. Прием внутрь таких белков восприимчивыми к ним людьми вызывает уплощение эпителиальной выстилки тонкого кишечника, в нормальном состоянии похожей на пышный ковер.
Другие клинические симптомы глютеновой болезни включают утомляемость, хроническую диарею, нарушение всасывания питательных веществ, потерю в весе, вздутие живота, анемию, а также существенно повышенный риск развития остеопороза и злокачественных опухолей кишечника, таких как лимфома и карцинома. Глютеновую болезнь обычно считают аутоиммунным заболеванием, и антитела, обнаруживаемые в сыворотке крови пациентов, поддерживают теорию, согласно которой это заболевание является иммунологическим.
Трансгенные мыши с нокаутом Tcf локуса проявляют потерю стволовых клеток пролиферативных компартментов в тонком кишечнике на последней стадии эмбриогенеза [Oncogene (2006) 25(57), 7512-7521]. Однако нокаут вызывает летальный исход, и поэтому исследование не проводилось на взрослых мышах. У химерных трансгенных мышей, в случае которых можно проводить исследование на взрослых особях, экспрессия конститутивно активного NH2-усеченного β-катенина стимулировала пролиферацию в криптах тонкого кишечника, хотя слияния либо NH2-усеченного β-катенина, либо Lef-1/-катенин, также индуцировали повышенный апоптоз крипты [The Journal of Cell Biology (1998), 141(3), 765-777; The Journal of Biological Chemistry (2002), 277(18), 15843-15850]. Так как разнообразные факторы регулируют β-катенин/Lef/Tcf-зависимую транскрипцию, включая non-Frizzled GPCR и PTEN/PI-3-киназу, причина дефекта кишечных стволовых клеток остается неизученной. Гены, экспрессируемые в желудочно-кишечном тракте, которые контролируются с помощью Wnt/β-катенина, включают CD44 и EphB2.
Регенеративная медицина
Вследствие значительных успехов, которые были достигнуты в области медицины за последние годы, в результате применения методов трансплантации тканей и органов от живых доноров постоянно увеличиваются возможности для спасения жизней. Однако, имеются ограничения на лечение с помощью трансплантатов от живых доноров, обусловленные такими факторами, как нехватка доноров трансплантатов и возможность отторжения. Если бы была возможна регенерация ткани или органа, которые были потеряны вследствие хирургического лечения или непредвиденного несчастного случая, то было бы возможно значительно повысить качество жизни пациентов. Кроме того, регенеративная медицина также позволяет решать проблемы, с которыми сталкиваются живые доноры трансплантатов. С этой точки зрения, на регенеративную медицину возлагаются большие надежды.
Технологии, в которых регенеративная медицина уже достигла успеха, в основном относятся к относительно простой, с точки зрения морфологии или функции, ткани наподобие искусственной кожи, искусственной кости и искусственных зубов. Реконструируемую искусственную кожу и искусственную кость встраивают в клетки, способные обеспечить подачу сигналов, требуемых для создания ткани. Однако существуют ограничения, накладываемые методами регенеративной медицины, на репертуар дифференцировки искусственной кожи и искусственной кости. Например, несмотря на то, что аллогенные кератиноциты или фибробласты кожи и другие п