Способ лечения артериальной гипертензии путем ингаляционного введения аэрозоля гипотензивного препарата
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к способу лечения артериальной гипертензии у млекопитающих, включая людей, и может быть использовано для экстренного лечения острых гипертонических состояний, например гипертонического криза. Согласно предлагаемому способу осуществляют ингаляционное введение аэрозольного гипотензивного препарата в терапевтически эффективном количестве из группы антагонистов кальция в наноаэрозольной форме с размером частиц в пределах 5-200 нм и их концентрацией в диапазоне 103-108 см-3. В качестве гипотензивного препарата используют нифедипин или нисолдипин. Техническим результатом настоящего изобретения является быстрое снижение (на 25%) артериального давления за счет ингаляционной доставки лекарственного средства в форме наноразмерного аэрозоля, повышение эффективности лечения артериальной гипертонии за счет высокой биодоступности применяемых препаратов в наноаэрозольной форме и снижения их терапевтической дозы, 7 ил., 4 табл.
Реферат
Изобретение относится к медицине, в частности к способам лечения артериальной гипертензии у млекопитающих, включая людей путем ингаляционного введения аэрозольных лекарственных препаратов, и может быть использовано для купирования острых гипертонических состояний, например гипертонического криза.
Артериальная гипертензия является одной из самых актуальных проблем терапии. В настоящее время в мире 30% населения имеют повышенное артериальное давление (АД), т.е. систолическое кровяное давление более 140 мм ртутного столба (мм рт. ст.) или диастолическое кровяное давление более 90 мм рт. ст. Кроме того, пациенты с кровяным давлением 120/80 мм рт. ст. или выше составляют группу повышенного риска развития гипертензии и рассматриваются как пациенты с состоянием предгипертензии. Известные способы лечения артериальной гипертензии имеют целью снизить повышенное артериальное давление АД для больных молодого и среднего возраста до 130/85 мм рт. ст., для лиц пожилого возраста до 140/90 мм рт. ст.
Наиболее часто для лечения гипертонии применяются пероральные формы введения лекарственных средств для лечения гипертонии. Используются препараты основных классов (диуретики, бета-блокаторы. антагонисты кальция, ингибиторы ангиотензинпревращающего фермента, антагонисты ангиотензиновых рецепторов, альфа-блокаторы [1-3]. Достоинством орального способа является удобство, так как он не требует специальных приспособлений и квалифицированного труда медицинского персонала. К недостаткам этого способа относят сравнительно медленное развитие фармакологического эффекта (30-60 мин), низкая биодоступность лекарственных препаратов (40-60%), что делает его непригодным для терапии неотложных состояний, и низкую биодоступность лекарственных препаратов (40-60%). Увеличение дозы препаратов при пероральном введении может сопровождаться развитием побочных эффектов со стороны желудочно-кишечного тракта.
В лечебной практике получили также распространение инъекционные способы введения лекарственных препаратов. Зачастую они являются незаменимыми, особенно при неотложных состояниях, если требуется достижение быстрого лечебного эффекта в условиях, когда состояние больного не позволяет осуществить их введение с помощью других способов. Для инъекционных путей введения характерна высокая биодоступность препаратов (до 100%), быстрое развитие терапевтического эффекта, возможность точного дозирования. В частности, применяется инъекционное введение лекарственных препаратов при лечении артериальной гипертензии [4, 5]. Недостатками инъекционных путей введения являются частое развитие флебитов и тромбозов, инфекционных осложнений в виде абсцессов, возможное развитие воздушной эмболии, негативное психоэмоциональное восприятие, связанное с болезненностью инъекций. Применение инъекционного способа требует наличия специальных инструментов и оборудования, медицинских навыков и нередко может проводиться только в условиях стационара. Кроме того, инъекционное введение практически неприменимо для водонерастворимых субстанций ввиду невозможности приготовления водного раствора, а использование эмульгаторов зачастую приводит к такому негативному побочному действию, как тромбоэмболии.
В течение последних трех десятков лет появились новые наноаэрозольные формы доставки лекарственных средств. В частности, быстро расширяется спектр системных лекарств наноразмерного диапазона, которые могут быть доставлены ингаляционным путем. При доставке системных лекарств аэрозольная ингаляция имеет ряд преимуществ по сравнению с оральным способом введения. В частности, респираторное введение позволяет избежать потерь в желудочно-кишечном тракте и метаболизма в печени. В отличие от инъекций ингаляционная терапия является неинвазивной, и, потому, более удобна и безопасна. С другой стороны, аэрозольная доставка не имеет ограничений, связанных с использованием водонерастворимых лекарственных средств в отличие от инъекционной терапии [6-9]. Оптимальным местом доставки лекарств через дыхательную систему является альвеолярный отдел легких, благодаря высокой площади поверхности, обильному кровоснабжению и высокой проницаемости стенок альвеол, что способствует прямому попаданию лекарств в малый, а затем и в большой круг кровообращения. Одним из критических параметров, влияющих на эффективность осаждения аэрозольных частиц в респираторной части легких, является их размер. Известно, что частицы диаметром 10-20 нм осаждаются в альвеолярной части легких человека в несколько раз эффективнее, чем частицы микронного диапазона [10-17]. Кроме того, важным фактором является время растворения частиц лекарственного средства в альвеолярной области. После растворения субстанция проникает в кровоток чрезвычайно быстро, в течение минуты для липофильных молекул и порядка десятка минут для водорастворимых субстанций [9, 18]. Время растворения для наноразмерных частиц гораздо более короткое, чем для частиц субмикронного и микронного диапазонов. Поэтому время достижения лекарственного действия существенно короче и точность дозировки выше для наночастиц по сравнению с микронными.
Известен способ ингаляционного введения лекарственного препарата (фармацевтической композиции) по патенту [19], действующего на сердечно-сосудистую систему, который предусматривает введение препаратов в виде сухого или жидкого аэрозоля с масс-медианным аэродинамическим диаметром частиц от 0,8 до 2,0 мкм, обеспечивающий гипотензивный эффект при ингаляционном введении композиции, включающей нифедипин.
Недостатком данного способа является крупный размер частиц аэрозоля, что приводит к тому, что не более 20% частиц осаждаются в альвеолах, не индивидуальная субстанция нифедипина, а композиция. Кроме того, такие крупные частицы обладают относительно большим временем растворения в альвеолах по сравнению с наночастицами. В результате, использование крупного размера частиц для ингаляционной доставки лекарственного средства приводит к большой неопределенности в дозировке.
Наиболее близким к заявленному изобретению, является способ лечения гипертонических кризов, описанный в авторском свидетельстве [20] и принятый за прототип, в котором описан ингаляционный способ лечения гипертонических кризов путем аэрозольного введения гипотензивного препарата ганглиоблокатора гигрония с размером частиц 0,5-5 мкм. Лекарственные аэрозоли вводят посредством ультразвуковых серийных генераторов.
К недостаткам прототипа следует отнести крупный размер частиц аэрозоля, приводящий к большой неопределенности в дозировке.
Задачей предлагаемого изобретения является повышение эффективности лечения артериальной гипертонии введением наноаэрозольной формы лекарственных препаратов, за счет повышения биодоступности препаратов, а также снижения их терапевтически эффективного количества при ингаляционном введении, точности контроля количества поступившего лекарственного средства.
Предлагаемый способ включает введение аэрозольного гипотензивного препарата в терапевтически эффективном количестве, новым является то, что вводят препарат, из группы антагонистов кальция, в наноаэрозольной форме с размером частиц в пределах 5-200 нм и их концентрацией в диапазоне 103-108 см-3.
Положительный эффект достигается в быстром снижении (на 25%) артериального давления за счет ингаляционной доставки лекарственного средства в наноаэрозольной форме.
В заявляемом способе используют препараты в наноаэрозольной форме, полученные методом нуклеации пересыщенного пара, позволяющим получать наночастицы с высокой концентрацией и стабильностью, посредством разработанного генератора.
Установлено, что в случае аэрозольной доставки понижение давления наблюдается уже при 0,1 мг на кг живого веса. Наблюдается одинаковое снижение давления при аэрозольном и внутривенном введении при одинаковых дозах. Это указывает на то, что ингаляционная доза соответствует системно доставленной дозе. Было обнаружено, что при аэрозольной ингаляции наблюдается такой же гипотензивный эффект, что и при оральном введении но при дозе на два порядка меньшей оральной.
Предлагаемое изобретение иллюстрируется чертежами, на которых изображены:
на фиг. 1 - схема образования наноаэрозоля в аэрозольном генераторе;
на фиг. 2 -схема ингаляционной установки;
на фиг. 3 - хроматограммы исходной субстанции нисолдипина и аэрозольных частиц, полученных возгонкой исходной субстанции;
на фиг. 4 - изображение лабораторных крыс в камерах «NoseOnly» при проведении ингаляционных экспериментов;
на фиг. 5 - относительное понижение артериального давления (Р0-Р)/Р0 для крыс ВИСТАР и НИСАГ (Р0) и Ρ - давление до и после воздействия нисолддипина или нифедипина. соответственно) в зависимости от дозы лекарственного средства; использовались камеры типа "Whole Body";
на фиг. 6 - легкие лабораторных крыс контрольной группы (которым не вводилось лекарственное средство);
на фиг. 7 - легкие лабораторных крыс после ингаляции наночастиц нисолдипина средним диаметром 120 нм.
Способ реализуется следующим образом.
Лекарственные гипотензивные наноаэрозоли, такие как (нифедипин или нисолдипин), получают методом гомогенной нуклеации посредством разработанного генератора с дозирующим устройством, генерирующего наноаэрозоль с размером частиц в пределах 5-200 нм и их концентрацией 103-108 см-3. Полученный аэрозоль вводят в организм в терапевтически эффективном количестве путем ингаляции.
Возможность достижения положительного эффекта от использования изобретения подтверждается проведенными экспериментами in vivo.
Осуществление настоящего изобретения основано на полученном антигипертензивном эффекте при использовании гипотензивных препаратов в наноаэрозольной форме с размером частиц в пределах 5-200 нм при проведении ингаляционных экспериментов на лабораторных животных. Данный способ позволяет быстро, легко и безопасно доставить препарат в легкие, как млекопитающего, так и человека.
Принцип генерации наноаэрозоля гипотензивных средств показан на фиг. 1. Генератор аэрозоля представляет собой цилиндрический канал с внешним нагревом 1, внутри которого находится исходная субстанция гипотензивного препарата 2. Фильтрованный воздух подают на вход генератора. Внутри генератора на выходе из зоны нагрева образуется пересыщенный пар 3. В области пересыщения образуется наноаэрозоль в результате наступления стадии нуклеации 4 из пересыщенного пара 3. В случае если субстанция подвержена термическому разложению при нагреве до высоких температур, используется принцип затопленной струи (т.е. пар лекарственного средства, выходящий через сопло из зоны нагрева, смешивается со встречным потоком холодного воздуха) для достижения условий аэрозолеобразования при относительно низких температурах нагрева исходной субстанции 2.
Схема ингаляции включает аэрозольный генератор 5, ингаляционные камеры 6 для крыс, и аэрозольный спектрометр 7 для измерения аэрозольной концентрации и распределения частиц по размерам (фиг. 2). Поток аэрозоля из генератора 5 подается в ингаляционную камеру 6. Счетная концентрация частиц и их средний диаметр варьировались в диапазонах 5-200 нм и 105-107 см-3, соответственно, изменением температуры генератора 5. Спектры частиц хорошо описывались логнормальным распределением со стандартным геометрическим отклонением σg=1.4. Хроматографические измерения показали химическую идентичность наночастиц и исходной субстанции. Пример хроматографических спектров приведен на фиг. 3.
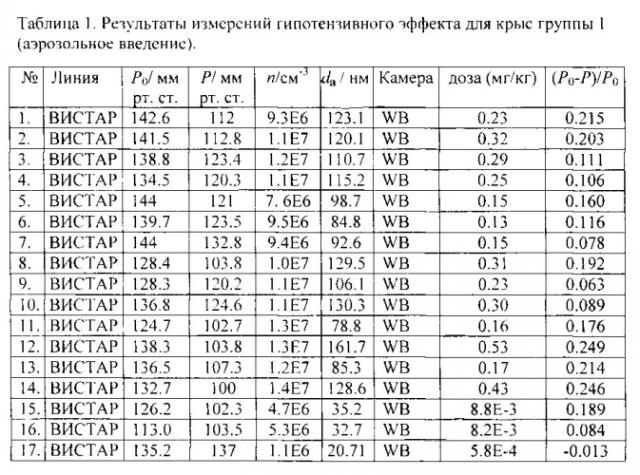
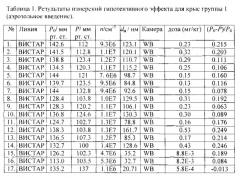
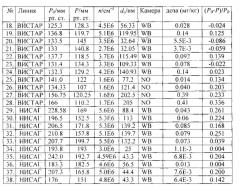
Ингаляционные эксперименты проводились на крысах линий ВИСТАР и НИСАГ с массой тела 190-210 и 330-370 г, соответственно (крысы Вистар (Wistar) - гибридная альбиносная линия, выведенная в Вистаровском институте в 1906 г.; крысы НИСАГ (ISIAH) - крысы с наследственно-индуцированной стрессом артериальной гипертензией), полученных из вивария Института цитологии и генетики СО РАН.
Для ингаляции использовалась камера "Whole Body" (WB) объемом 2000 см3 (в которую помещалась лабораторная крыса целиком), выполненная из кварца и нержавеющей стали и "Nose Only" (NO). В камере WB находилось по одному лабораторному животному не ограниченному в перемещении по камере. В камере NO тело крысы было изолировано от аэрозоля, и в аэрозольном потоке находился только нос животного (фиг. 4).
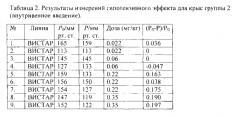
Далее, в качестве примера описаны эксперименты по измерению понижения артериального давления в результате ингаляционной доставки нисолдипина или нифедипина. Животных делили на четыре группы. Первую группу подвергали воздействию аэрозоля в камерах WB или NO в течение 40 мин. Второй группе вводили внутривенно субстанцию нисолдипина или нифедипина, при этом доза варьировалась от 5×10-3 до 3.5×10-1 мг на кг живого веса. Животным третьей группы нисолдипин или нифедипин вводился орально от 3.5×10-3 до 35 мг на кг живого веса (мг/кг).
Четвертая группа подвергалась воздействию чистого воздуха в течение 40 мин в камере (контроль). Поток аэрозоля или чистого воздуха через камеры составлял 45 см3/с. Время экспозиции составляло 40 мин. Крысы первой и четвертой групп экспонировались в одних и тех же условиях (четвертая группа - чистым воздухом, первая - аэрозолем). Перед экспозицией и непосредственно после экспозиции проводилось неинвазивное автоматическое измерение артериального давления с помощью хвостовой манжеты на приборе LE 5007 (Panlab, Испания).
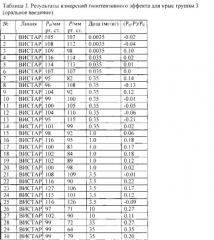
Относительное понижение давления определялось как разность между исходным давлением и давлением после экспозиции, отнесенная к исходному давлению. Результаты измерений приведены в таблицах 1-4, где Р0 и Р - давление до и после воздействия лекарственного средства, соответственно; n - счетная концентрация аэрозоля, da - средний арифметический диаметр.
На фиг. 5 для крыс ВИСТАР и НИСАГ проведено сравнение относительного понижения давления для различных способов доставки лекарственного средства в зависимости от дозы нисолдипина или нифедипина. Можно увидеть, что в случае аэрозольной доставки понижение давления наблюдается уже при дозах 0.1 мг на кг. Важно отметить хорошее совпадение дозозависимых эффектов для аэрозольного и внутривенного способов доставки. Это совпадение говорит о том, что ингаляционная доза примерно равна системно доставленной дозе. Важно также отметить, что при аэрозольной ингаляции наблюдается такой же гипотензивный эффект, что и при оральной доставке, но при ингаляционной дозе на два порядка меньшей, чем оральная доза.
Для того, чтобы выявить возможные морфологические изменения в легких после ингаляционной доставки, был проведен гистологический анализ. Животные подверглись ингаляции аэрозоля со средним диаметром частиц 80. 120 и 200 нм, что соответствовало ингаляционной дозе 0,04, 0,12 и 1,2 мг/кг, соответственно (фиг. 6 и 7). Гистоморфологический анализ образцов тканей легких животных не выявил патологических отклонений от нормы.
Все манипуляции с животными проводились согласно Женевской конвенции (Страсбург, 1986 года).
Таким образом, предлагаемым изобретением показано повышение эффективности лечения артериальной гипертонии при ингаляционном введении наноаэрозоля гипотензивного препарата за счет высокой биодоступности применяемых препаратов и снижения (на два порядка) их терапевтической дозы.
Источники информации:
1. Патент США №5071642, МПК А61К 31/44, А61К 31/455, А61К 47/00, опубл. 10.12.1991.
2. Патент США №2009214664, МПК А61К 31/4422, А61К 9/16, опубл. 27.08.2009.
3. Патент Китая №101516352, ΜПК Α61К 31/4422, А61К 9/16, А61К 9/24, опубл. 26.08.2008.
4. Патент №2391980, МПК А61К 31/4422, А61Р 9/02, опубл. 22.10.2008.
5. Патент США №4481191, МПК А61К 38/00, А61Р 9/06, А61Р 9/12, опубл. 06.11.1984.
6. Agu. R.U., Ugwoke. M.I., Armand, M., Kinget, R., & Verbeke, N. (2001). The lung as a route for systemic delivery of therapeutic proteins and peptides. Respir. Res., 2, 198-209.
7. Labiris, N.R., & Dolovich. M.B. (2003). Pulmonary drug delivery. Part I: Physiological factors affecting therapeutic effectiveness of aerosolized medications. J. Clin. Pharmacol. 56, 588-599.
8. Laube, B.L. (2005). The Expanding Role of Aerosols in Systemic Drug Delivery. Gene Therapy, and Vaccination. Respiratory Care 50, 1161-1176.
9. Patton, J.S., Fishburn, С.S., & Weers, J.G. (2004). The Lungs as a Portal of Entry for Systemic Drug Delivery. Proc. Am. Thoruc. Soc. 1, 338-344.
10. Edwards, D.A.. Valente. A.X., Man. J., & Tsapis, N. (2003). Recent Advances Related to the Systemic Delivery of Therapeutic Molecules by Inhalation, in: Hickey, A.J. (Ed.) Pharmaceutical Inhalation Aerosol Technology. CRC Press, pp. 541-550.
11. Hinds, W.C., (1999). Aerosol Technology. Properties, Behavior, and Measurement of Airborn Particles. Second Edition, second ed. John Wiley & Sons. Inc., New York.
12. Heyder. J., (2004). Deposition of Inhaled Particles in the Human Respiratory Tract and Consequences for Regional Targeting in Respiratory Drug Delivery. Proc. Am, Thorac, Soc, 1, 315-320.
13. Hussain, M., Madl, P., & Khan, A. (2011). Lung deposition predictions of airborne particles and the emergence of contemporary diseases Part-1. the Health 2, 51-59.
14. Jaques, P., Α., & Kim, C.S. (2000). Measurement of total lung deposition of inhaled ultrafine particles in healthy men and women, Inhalation Toxicology. 12, 715-731.
15. Labiris. N.R., & Dolovich. M.B. (2003). Pulmonary drug delivery. Part I: Physiological factors affecting therapeutic effectiveness of aerosolized medications. J. Clin. Pharmacol. 56. 588-599.
16. OberdÖrster. G., OberdÖrster, E., & OberdÖrster, J. (2005). Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles. Environmental Health Perspectives. 113: 823-839.
17. Wong, B.A. (2007). Inhalation Exposure Systems: Design, Methods and Operation. Toxicologic Pathology 35, 3-14.
18. Rabinowitz, J.D., Wensley. M., Lloyd. P., Myers. D., Shen, W., Lu. Α., Hodges, С., Hale, R., Mufson. D., & Zaffaroni. A. (2004). Fast onset medications through thermally generated aerosols. J. Pharmacol. Exp. Ther. 309, 769-775.
19. Патент №2445119, МПК A61K 47/40, A61K 47/30, A61K 9/12, A61K 9/72, A61K 9/14, A61K 31/00, опубл. 20.03.2012.
20. Авторское свидетельство №1165410, МПК А61М 11/00, опубл. 07.07.1985 - прототип.
Способ лечения артериальной гипертензии путем ингаляционного введения аэрозоля гипотензивного препарата в терапевтически эффективном количестве, отличающийся тем, что вводят препарат, выбранный из группы антагонистов кальция, нифедипин или нисолдипин в наноаэрозольной форме с размером частиц в пределах 5-200 нм и их концентрацией 103-108 см-3.