Способы очистки полипептидов
Иллюстрации
Показать всеИзобретение относится к способам очистки антитела или иммуноадгезина из композиции, содержащей антитело или иммуноадгезин и по меньшей мере одно загрязняющее вещество. Способы очистки включают очистку на катионообменном материале, представляющем собой частицы смолы, и материале смешанного типа, где плотность загрузки на катионообменном материале составляет более 150 г/л. Способ позволяет осуществлять очистку антитела или иммуноадгезина с высоким выходом. 28 з.п. ф-лы, 34 ил., 17 табл., 5 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/348143, зарегистрированной 25 мая 2010, содержание которой включено в описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам очистки полипептида из композиции, содержащей полипептид и по меньшей мере одно загрязняющее вещество, и к препаратам, содержащим полипептид, очищенный указанными способами.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Крупномасштабное, экономичное очищение полипептидов становится все более важной проблемой в биотехнологии. Обычно полипептиды получают с помощью клеточной культуры с использованием клеточных линий млекопитающих или бактерий, сконструированных для получения интересующего полипептида путем введения рекомбинантной плазмиды, содержащей ген указанного полипептида. Поскольку используемые клеточные линии являются живыми организмами, они должны обеспечиваться комплексной питательной средой, содержащей сахара, аминокислоты и факторы роста, обычно получаемые из препаратов сыворотки животных. Желательно отделить интересующий полипептид от смеси соединений, продуцируемых клеткам, и от побочных продуктов самих клеток.
Отделение интересующего полипептида от других продуктов, продуцируемых клеткой обычно пытаются проводить путем комбинирования различных хроматографических методов. В указанных методах смеси полипептидов разделяют на основе их заряда, степени гидрофобности, размера или специфического взаимодействия интересующего полипептида и иммобилизованного захватывающего средства. Для каждого из указанных методов имеется несколько различных хроматографических смол, предусматривающих тщательную подгонку схемы очистки к определенному рассматриваемому полипептиду. Сущность каждого из указанных методов разделения заключается в том, что полипептиды можно заставить двигаться с разными скоростями вниз по длинной колонке, достигая физического разделения, которое увеличивается по мере того, как они проходят дальше вниз по колонке, или они селективно присоединяются к среде разделения, и затем дифференциально элюируются различными растворителями. В некоторых случаях интересующий полипептид отделяют от примесей, в то время как примеси специфически присоединяются к колонке, и интересующий полипептид не присоединяется, то есть интересующий полипептид представлен в элюате.
Крупномасштабное, рентабельное выделение полипептида с достаточной чистотой для применения в качестве лекарственного средства для человека остается сложной задачей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В описании раскрыты способы очистки полипептида из композиции, содержащей полипептид и по меньшей мере одно загрязняющее вещество, где способ включает либо (i), либо (ii): (i) последовательные стадии (a) загрузки катионообменного материала композицией с плотностью загрузки более чем 150 г/л катионообменного материала; и (b) загрузки материала смешанного типа композицией, выделенной с катионообменного материала; или (ii) последовательные стадии (a) загрузки композиции на материал смешанного типа; и (b) загрузки катионообменного материала композицией, извлеченной из смешанного материала, с плотностью загрузки более чем 150 г/л катионообменного материала.
В некоторых вариантах осуществления любого из способов полипептид характеризуется значением pI приблизительно от 6 до 10. В некоторых вариантах осуществления полипептид характеризуется значением pI приблизительно 7-9.
В некоторых вариантах осуществления любого из способов полипептид представляет собой антитело или иммуноадгезин. В некоторых вариантах осуществления полипептид представляет собой иммуноадгезин. В некоторых вариантах осуществления полипептид представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления моноклональное антитело представляет собой химерное антитело, гуманизированное антитело или антитело человека. В некоторых вариантах осуществления, моноклональное антитело представляет собой моноклональное антитело IgG. В некоторых вариантах осуществления антитело представляет собой антигенсвязывающий фрагмент. В некоторых вариантах осуществления антигенсвязывающий фрагмент выбирают из группы, состоящей из Fab-фрагмента, Fab'-фрагмента, F(ab')2 фрагмента, scFv, Fv и диатела.
В некоторых вариантах осуществления любого из способов по меньшей мере одно загрязняющее вещество представляет собой одно или более из перечисленного: белок яичника китайского хомячка (CHOP), смытый белок A, ДНК, агрегированный белок, компонент среды клеточной культуры, гентамицин и вирусный контаминант.
В некоторых вариантах осуществления любого из способов последовательные стадии в (i) и/или (ii) являются непрерывными. В некоторых вариантах осуществления любого из способов последовательные стадии в (i) и/или (ii) являются дискретными. В некоторых вариантах осуществления любого из способов способ представляет собой (i). В некоторых вариантах осуществления любого из способов способ представляет собой (ii).
В некоторых вариантах осуществления любого из способов плотность загрузки составляет приблизительно от 150 г/л до 2000 г/л. В некоторых вариантах осуществления плотность составляет приблизительно от 150 г/л до 1000 г/л. В некоторых вариантах осуществления плотность составляет приблизительно от 500 г/л до 700 г/л.
В некоторых вариантах осуществления любого из способов катионообменный материал содержит функциональную группу карбоновых кислот или функциональную группу сульфоновых кислот. В некоторых вариантах осуществления функциональная группа представляет собой сульфопропил, сульфоэтил, сульфоизобутил или карбоксил. В некоторых вариантах осуществления катионообменный материал представляет собой мембрану, монолит или частицы смолы. В некоторых вариантах осуществления катионообменный материал представляет собой смолу. В некоторых вариантах осуществления катионообменный материал представляет собой Mustang S, Sartobind S, SO3 Monolith, S Ceramic HyperD, Poros HS50, Poros HS20, sulfopropyl-Sepharose Fast Flow (SPSFF), SP-Sepharose XL (SPXL), CM Sepharose Fast Flow, Capto S, Fractogel Se HiCap, Fractogel SO3 или Fractogel COO. В некоторых вариантах осуществления катионообменный материал представляет собой Poros HS50.
В некоторых вариантах осуществления любого из способов материал смешанного типа содержит функциональные группы, способные к анионному обмену и гидрофобным взаимодействиям. В некоторых вариантах осуществления материал смешанного типа представляет собой смолу Capto-Adhere, смолу MEP HyperCel, смолу HEA HyperCel, смолу PPA HyperCel или мембрану ChromaSorb. В некоторых вариантах осуществления материал смешанного типа представляет собой смолу Capto-Adhere.
В некоторых вариантах осуществления любого из способов способ включает применение равновесного буфера, отмывочного буфера, и/или загрузочного буфера с катионообменным материалом и/или анионообменным материалом, и проводимость равновесного буфера, промывочного буфера, и/или загрузочного буфера составляет приблизительно от 2 мСм/см до 25 мСм/см. В некоторых вариантах осуществления проводимость равновесного буфера, промывочного буфера, и/или загрузочного буфера составляет приблизительно от 3 мСм/см до 8 мСм/см.
В некоторых вариантах осуществления любого из способов способ включает применение равновесного буфера, промывочного буфера и/или загрузочного буфера с катионообменным материалом, и/или анионообменным материалом, и значение pH равновесного буфера, промывочного буфера и/или загрузочного буфера составляет приблизительно 4,5-6,5.
В некоторых вариантах осуществления любого из способов равновесный буфер, промывочный буфер и/или загрузочный буфер с катионообменным материалом, и/или анионообменным материалом являются одинаковыми. В некоторых вариантах осуществления любого из способов равновесный буфер, промывочный буфер, и/или загрузочный буфер с катионообменным материалом и/или с анионообменным материалом являются разными.
В некоторых вариантах осуществления любого из способов, способ также включает воздействие на композицию, содержащую полипептид, одной или более дополнительных стадий очистки до или после стадий (a) и (b). В некоторых вариантах осуществления любого из способов способ также включает извлечение очищенного полипептида. В некоторых вариантах осуществления любого из способов способ также включает объединение очищенного полипептида с фармацевтически приемлемым носителем.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
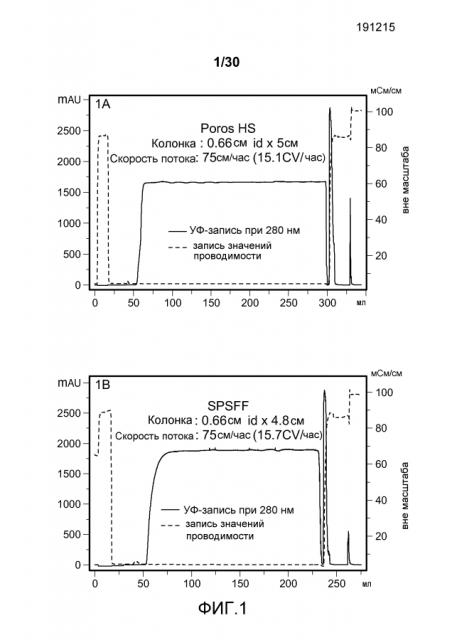
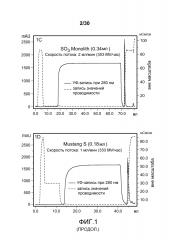
На фиг. 1A-D представлены хроматограммы, полученные с использованием Poros HS50, SPSFF, SO3 Monolith, и Mustang S при очистке антитела против CD11a.
На фиг. 2 представлены C/C0 (концентрация Mab ("мономерное антитело")) и C/C0 (концентрация белка яичников китайского хомячка ("CHOP")) при изменяющемся количестве продукта, содержащего антитело против CD11a, полученное (г/л CV или MV) с применением SPSFF, Poros HS50, Mustang S, и SO3 monolith. C представляет собой концентрацию Mab или CHOP в собранной фракции, и C0 представляет собой концентрацию Mab или CHOP в загрузке.
На фиг. 3 показаны C/C0 (концентрация Mab) и C/C0 (концентрация высокомолекулярных соединений ("HMW")) при изменяющимся количестве продукта, содержащего антитело против CD11a, полученное (г/л CV или MV) с применением SO3 monolith, Mustang S, SPSFF, и Poros HS50. C представляет собой процентное содержание Mab или HMW в собранной фракции и C0 представляет собой процентное содержание Mab или HMW в загрузке.
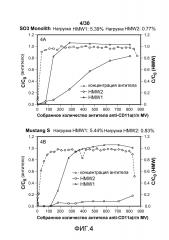
На фиг. 4A-D показаны C/C0 (концентрация Mab), C/C0 (концентрация HMW1) и C/C0 (концентрация HMW2) при изменяющемся количестве продукта, содержащего антитело против CD11a, собранного (г/л CV или MV) с применением SO3 monolith, Mustang S, SPSFF и Poros HS50.
На фиг. 5A представлена хроматограмма HMW и Mab в продукте, содержащем антитело против CD11a, нагруженном на Poros HS50; на фиг. 5B представлена хроматограмма HMW и Mab в пуле элюирования с применением Poros HS50 (на расположенной внутри фигуре показан увеличенный участок пиков); на фиг. 5C показано суммарное значение HMW % в пуле непрерывного потока ("FT") и HMW % во фракциях FT при изменяющемся количестве продукта, содержащего антитело против CD11a, полученном (г/л CV) с использованием Poros HS50.
На фиг. 6A показаны хроматограммы пула FT при изменяющемся количестве продукта, содержащего антитело против CD11a, полученного с помощью колонки SPSFF; на фиг. 6B показано суммарное значение HMW% в пуле FT и HMW% во фракциях FT при изменяющемся количестве продукта, содержащего антитело против CD11a, полученного (мг/мл CV) с применением SPSFF; на фиг. 6C показаны HMW% при изменяющемся количестве продукта, содержащего антитело против CD11a, полученного (мг/мл) с применением SPSFF.
На фиг. 7A-D показаны хроматограммы, полученные при использовании Poros HS50, SPSFF, SO3 Monolith, и Mustang S для очистки антитела против VEGF.
На фиг. 8 показано C/C0 (концентрация Mab) антитела против VEGF при изменяющемся количестве нагружаемого продукта (г/л CV или MV) с применением Poros HS50, Mustang S, SO3 monolith и SPSFF.
На фиг. 9 показаны C/C0 (концентрация CHOP) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV или MV) с применением SPSFF, Sartobind S, Poros HS50, Mustang S и SO3 monolith.
На фиг. 10 показано количество ДНК (пг/мг) при изменяющемся количестве продукта, содержащего антитело против VEGF, собранного (г/л CV или MV) при использовании SPSFF, Poros HS50, Mustang S, и SO3 monolith.
На фиг. 11 показаны C/C0 (концентрация HMW) при изменяющемся количестве продукта, содержащего антитело против VEGF, собранное (г/л CV or MV) с применением SPSFF, Sartobind S, Poros HS50 с разведенным Mab, Poros HS50, Mustang S и SO3 monolith.
На фиг. 12A-B показаны C/C0 (концентрация HMW1) и C/C0 (концентрация HMW 2) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV или MV) с применением SPSFF, Poros HS50 с разведенным Mab, Poros HS50, Mustang S и SO3 monolith.
На фиг. 13A-E показано значение % HMW, связанного со смолой (Poros HS50, SE HiCap, SPSFF, SPXL, и Capto S), с применением продукта, содержащего антитело против CD20, при различных значениях pH и концентрациях солей.
На фиг. 14A-E показано значение % CHOP, связанного со смолой (Poros HS50, SE HiCap, SPSFF, SPXL, и Capto S), с применением продукта, содержащего антитело против CD20, при различных значениях pH и концентрациях солей.
На фиг. 15 показано C/C0 (концентрация HMW%) при изменяющемся количестве продукта, содержащего антитело против CD20, полученного (г/л CV) с применением Poros HS50 и Capto S.
На фиг. 16 показано суммарное значение HMW(%) при изменяющемся количестве продукта, содержащего антитело против CD20, полученного (г/л CV) с применением Poros HS50 и Capto S.
На фиг. 17 показано C/C0 (концентрация CHOP) при изменяющемся количестве продукта, содержащего антитело против CD20, полученное (г/л CV) с применением Poros HS50 и Capto S.
На фиг. 18 показано суммарное значение CHOP (ppm) при изменяющемся количестве продукта, содержащего антитело против CD20, полученное (г/л CV) с применением Poros HS50 и Capto S.
На фиг. 19A-B представлены хроматограммы с UV-кривой, полученной при 280 нм, нанесенной на график в течение времени цикла (фиг. 19A) и в пределах объема загрузки продуктом (фиг. 19B) с применением SPSFF при различных скоростях потока для очистки антитела против VEGF.
На фиг. 20 показано C/C0 (концентрация Mab) и C/C0 (концентрация CHOP) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением SPSFF при различных скоростях потока.
На фиг. 21 показано количество ДНК (пг/мг) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением SPSFF при различных скоростях потока.
На фиг. 22 показано C/C0 (концентрация HMW) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV) с применением SPSFF при различных скоростях потока.
На фиг. 23 показано C/C0 (концентрация HMW (%)), C/C0 (Концентрация CHOP (ppm)), и количество ДНК (пг/мг) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV) с применением Poros HS50 при различных скоростях потока.
На фиг. 24 представлены хроматограммы, полученные с применением Poros HS50 при различных значениях проводимости в загрузке для очистки антитела против VEGF.
На фиг. 25A-B представлены хроматограммы элюата, полученного в результате элюции (пик P1), и элюата, полученного в результате очистки (пик P2) с применением колонки Poros HS50, нагруженной продуктом, содержащим антитело против VEGF, при различных значениях проводимости загрузки.
На фиг. 26 показано количество CHOP во фракции (ppm) при изменении количества нагружаемого CHOP (мг/мл CV) с применением Poros HS50 при различных значениях проводимости загрузки для очистки антитела против VEGF.
На фиг. 27 показано C/C0 (концентрация HMW) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением Poros HS50 при различных значениях проводимости загрузки.
На фиг. 28A-B показано количество ДНК (пг/мл) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV) при различных значениях проводимости в загрузке и различных скоростях потока (различное количество ДНК в загрузке (пг/мг) для различных значений проводимости в загрузке).
На фиг. 29 показано количество ДНК (пг/мл) и концентрация антитела при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением Poros HS50, элюированного с элюцией линейного градиента соли.
На фиг. 30 показано C/C0 (концентрация HMW (%)), C/C0 (концентрация CHOP (ppm)), и количество ДНК (пг/мг) при изменяющемся количестве нагружаемого продукта, содержащего антитело против VEGF, (г/л CV) с применением Poros HS50 с высотой слоя 4,6 см или 14,2 см.
На фиг. 31A-F представлены значения % извлечения Mab для антитела против VEGF (во фракции FT), антитела против CD11a, и антитела против CD20, с применением смолы Capto Adhere при различных значениях pH и проводимости (с NaAC или глицин HCl в качестве буферной соли).
На фиг. 32A-F представлены значения связанного HMW % с применением смолы Capto Adhere resin при различных значениях pH и приводимости (с NaAC или глицин HC1 в качестве буферной соли) для антитела против VEGF, антитела против CD11a и антитела против CD20.
На фиг. 33A-F представлены значения связанного CHOP % с применением смолы Capto Adhere при различных значениях pH и приводимости (с NaAC или глицин HCl в качестве буферной соли) для антитела против VEGF, антитела против CD11a и антитела против CD20.
На фиг. 34 представлены хроматограммы, полученные при использовании колонки Capto Adhere, соединенной с колонкой Poros HS50 для очистки антитела против CD11a.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин "полипептид" или "белок" означает последовательность аминокислот с длиной цепи достаточной, чтобы создать более высокие уровни третичной и/или четвертичной структуры. Таким образом, белки отличаются от "пептидов", которые также являются молекулами на основе аминокислот, тем, что пептиды не обладают такой структурой. Обычно белок для применения будет характеризоваться молекулярным весом по меньшей мере приблизительно 5-20 кДа, альтернативно по меньшей мере приблизительно 15-20 кДа, предпочтительно, по меньшей мере приблизительно 20 кДа. "Пептид" обозначает последовательность аминокислот, которая обычно не проявляет более высокого уровня третичной и/или четвертичной структуры. Пептиды обычно имеют молекулярный вес меньше чем приблизительно 5 кДа.
Примеры полипептидов, охватываемые определением в настоящем описании, включают белки млекопитающих, такие как, например, ренин; гормон роста, включая гормон роста человека и гормон роста крупного рогатого скота; фактор, стимулирующий выделение гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор, и фактор Виллебранда; противосвертывающие факторы, такие как протеин C; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа или мочевина человека, или тканевой активатор плазминогена (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли альфа и бета; энкефалиназа; RANTES (регулирующий активацию нормальной Т-клеточной экспрессии и секреции); макрофагальный белок воспаления человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллеров ингибирующий фактор; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген, связанный с цитотоксическими Т-лимфоцитами (CTLA), такой как CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы гормонов или факторов роста; протеин A или D; ревматоидные факторы; нейротрофический фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротрофин-3, -4, -5, или -6 (NT-3, NT-4, NT-5 или NT-6), или ростовой фактор нервов, такой как NGF-b; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF) такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (brain IGF-I), белки, связывающие инсулиноподобный фактор роста (IGFBP); CD-белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета, и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF, и G-CSF; интерлейкины (IL), например, IL-1 - IL-10; супероксид-дисмутаза; T-клеточные рецепторы; белки мембранной поверхности; стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; хоминг-рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолеассоциированный антиген, такой как CA125 (антиген рака яичников) или рецептор HER2, HER3 или HER4; иммуноадгезины; и фрагменты и/или варианты любого из вышеперечисленных белков, а также антитела, включая фрагменты антител, связывающие белок, включая, например, любой из вышеперечисленных белков.
"Очищенный" полипептид (например, антитело) означает, что чистота полипептида увеличена, так что он представлен в форме боле чистой, чем форма, в которой он представлен в своем природном окружении и/или когда он исходно синтезирован и/или амплифицирован в лабораторных условиях. Термин “чистота” имеет относительное значение и не обязательно означает абсолютную чистоту.
Термин "меченный по эпитопу", когда используется в описании, обозначает химерный полипептид, включая полипептид, соединенный с "tag-полипептидом". Tag-полипептид содержит число остатков, достаточное, чтобы предоставить эпитоп, против которого может быть создано антитело, но в то же время является достаточно коротким, чтобы не влиять на активность полипептида с котором он соединен. Tag-полипептид, предпочтительно, также является достаточно уникальным так, чтобы антитело по существу не реагировало перекрестно с другими эпитопами. Подходящие tag полипептиды, как правило, имеют в своем составе по меньшей мере шесть аминокислотных остатков и обычно состоит приблизительно из 8-50 аминокислотных остатков (предпочтительно, приблизительно из 10-20 аминокислотных остатков).
"Активный" или "активность" в контексте настоящего документа относится к форме (формам) полипептида, которые сохраняют биологическую и/или иммунологическую активность нативного или природного полипептида, где "биологическая" активность обозначает биологическую функцию (ингибирующую или стимулирующую) обусловленную нативным или природным полипептидом, другую, чем способность вызывать продукцию антитела против антигенного эпитопа, принадлежащего нативному или природному полипептиду, и "иммунологическая" активность обозначает способность вызывать продукцию антитела против антигенного эпитопа, принадлежащего нативному или природному полипептиду.
Термин "антагонист" используется в самом широком смысле, и включает любую молекулу, которая частично или полностью блокирует, ингибирует, или нейтрализует биологическую активность нативного полипептида. Аналогичным образом термин "агонист" используется в самом широком смысле и включает любую молекулу, которая воспроизводит биологическую активность нативного полипептида. Подходящие молекулы агониста или антагониста, в частности, включают агонистические или антагонистические антитела или фрагменты антител, фрагменты или варианты аминокислотных последовательностей природных полипептидов и т.д. Способы определения агонистов или антагонистов полипептида могут включать взаимодействие полипептида с молекулой-кандидатом агониста или антагониста, и измерение обнаруживаемого изменения одной или более биологических активностей, обычно связанных с полипептидом.
"Комплементзависимая цитотоксичность" или "CDC" обозначает способность молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, полипептидом (например, антителом)), образующей комплекс с узнаваемым антигеном. Для оценки активации комплемента может быть проведен тест CDC, например, как описано в публикации Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Полипептид, "который связывает" интересующий антиген, например, опухоль-ассоциированный полипептидный антиген-мишень, представляет собой полипептид, который связывает антиген с достаточной аффинностью, так что полипептид полезен в качестве диагностического и/или терапевтического средства в определении клетки или ткани, экспрессирующей антиген, и что особенно важно, не реагирует перекрестно с другими полипептидами. В таких вариантах осуществления степень связывания полипептида с "нецелевым" полипептидом будет составлять меньше, чем приблизительно 10% от связывания полипептида с его специфическим полипептидом-мишенью, которую определяют с помощью анализа методом флуоресцентной сортировки клеток (FACS) или радиоиммунопреципитация (RIA).
Что касается связывания полипептида с молекулой-мишенью, термин "специфическое связывание" или "специфически связывается с" или является "специфичным для" определенного полипептида или эпитопа на определенном полипептиде-мишени означает связывание, которое в известной мере отличается от неспецифического взаимодействия. Специфическое связывание можно измерить, например, путем определения связывания молекулы по сравнению со связыванием контрольной молекулы, которая, обычно представляет собой молекулу сходной структуры, которая не обладает связывающей активностью. Например, специфическое связывание можно определить с помощью конкуренции с контрольной молекулой, которая похожа на мишень, например, избыток немеченной мишени. В этом случае специфическое связывание определяется, если связывание меченной мишени с зондом конкурентно ингибируется избытком немеченной мишени.
Полипептид, который "ингибирует рост опухолевых клеток" или "ингибирующий рост" полипептид представляет собой полипептид, который вызывает измеряемое ингибирование роста раковых клеток. В одном из вариантов осуществления ингибирование роста можно измерить при концентрации полипептида приблизительно 0,1-30 мкг/мл или приблизительно 0,5 нМ-200 нМ в клеточной культуре, где ингибирование роста определяют через 1-10 дней после воздействия полипептида на опухолевые клетки. Полипептид является ингибирующим рост in vivo, если введение полипептида в количестве приблизительно 1 мкг/кг-100 мг/кг веса тела приводит к уменьшению размера опухоли или пролиферации опухолевых клеток в течение приблизительно от 5 дней до 3 месяцев после первого введения полипептида, предпочтительно, в течение приблизительно 5-30 дней.
Полипептид, который "вызывает апоптоз" представляет собой полипептид, который вызывает программированную клеточную гибель, которую определяют по связыванию аннексина V, фрагментации ДНК, сморщиванию клетки, разрежение эндоплазматического ретикулума, фрагментации клетки, и/или образование мембранных везикул (называемых апоптотическими тельцами). Предпочтительно, клетка является опухолевой клеткой, например, клеткой предстательной железы, молочной железы, яичника, желудка, эндометрия, легкого, почки, толстой кишки, мочевого пузыря. Существуют различные методы оценки клеточных событий, ассоциированных с апоптозом. Например, транслокацию фосфатидилсерина (PS) можно измерить с помощью связывания аннексина; фрагментацию ДНК можно оценить по электрофоретическому расщеплению ДНК; и конденсацию ядра/хроматина наряду с фрагментацией ДНК можно оценить по увеличению гиподиплоидных клеток. Предпочтительно, полипептид, который вызывает апоптоз, представляет собой полипептид, который вызывает индукцию связывания аннексина приблизительно в 2-50 раз, предпочтительно, приблизительно в 5-50 раз и, наиболее предпочтительно, приблизительно 10-50 раз, выше по сравнению с необработанной клеткой в тесте связывания аннексина.
Полипептид, который "вызывает клеточную гибель" представляет собой полипептид, который является причиной того, что жизнеспособная клетка становится нежизнеспособной. Предпочтительно, клетка является раковой клеткой, например, клеткой молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. Гибель клеток in vitro можно определить в отсутствие комплемента и иммунных эффекторных клеток, чтобы различать клеточную гибель, вызванную антителозависимой клеточноопосредованной цитотоксичностью (ADCC) или комплементзависимой цитотоксичностью (CDC). Таким образом, анализ определения клеточной гибели можно осуществить с применением сыворотки, инактивированной нагреванием, (т.е., в отсутствие комплемента) и в отсутствие иммунных эффекторных клеток. Чтобы определить, способен ли полипептид вызвать клеточную гибель, можно оценить, в сравнении с необработанными клетками, потерю целостности мембраны клеток, которую определяют по захвату клетками пропидиум иодида (PI), трипанового синего (см. Moore et al. Cytotechnology 17: 1-11 (1995)) или 7AAD.
Термин "антитело" в описании используется в самом широком смысле и, в частности, предусматривает моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител, при условии что они проявляют желаемую биологическую активность. Термин "иммуноглобулин" (Ig) используется в описании взаимозаменяемо с термином “антитело”.
Антитела представляют собой природные молекулы иммуноглобулинов, которые характеризуются различными структурами на основе характерной для иммуноглобулинов укладки цепи. Например, антитела IgG имеют две "тяжелых" цепи и две "легких" цепи, которые соединяются дисульфидными связями с образованием функционального антитела. Каждая тяжелая и легкая цепь содержит "константную" (C) и "вариабельную" (V) область. V-области определяют антигенсвязывающую специфичность антитела, в то время как C-области обеспечивают структурную поддержку и функционирование в антиген-неспецифичных взаимодействиях с иммунными эффекторами. Антигенсвязывающая специфичность антитела или антигенсвязывающий фрагмент антитела заключается в способности антитела специфически связываться с определенным антигеном.
Антиген-связывающая специфичность антитела определяется структурными характеристиками V-области. Вариабельность распределена неравномерно в 110-аминокислотном промежутке вариабельных доменов. На самом деле, V-области состоят из относительно инвариантных участков, называемых каркасными областями (FR) длиной 15-30 аминокислот, разделенных короткими участками повышенной вариабельности, называемых "гипервариабельные участки", каждый из которых имеет длину 9-12 аминокислот. Вариабельные домены нативных тяжелой и легкой цепей, каждый, включают четыре FR, преимущественно принимающих конфигурацию β-листа, соединенных тремя гипервариабельными участками, которые образуют петли соединяющие, и в некоторых случаях формирующие часть структуры β-листа. Гипервариабельные участки в каждой цепи удерживаются вместе в непосредственной близости с помощью FR, и вместе с гипервариабельными участками из другой цепи участвуют в формировании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Каждая V-область обычно содержит три гипервариабельных участка ("CDR", каждый из которых содержит "гипервариабельную петлю"), и четыре каркасные области. Сайт связывания антитела, минимальная структурная единица, необходимая для связывания со значительной аффинностью с конкретным заданным антигеном, соответственно, будет содержать обычно три CDR, и по меньшей мере три, предпочтительно, четыре, каркасные области, расположенные между ними для удержания и представления CDR в соответствующей конформации. Классические четырехцепочечные антитела имеют антигенсвязывающие сайты, которые определяются доменами VH и VL при их кооперировании. Определенные антитела, такие как антитела верблюда и акулы, не имеют легких цепей и основаны на сайтах связывания, образованных только тяжелыми цепями. Можно создать однодоменные сконструированные иммуноглобулины, в которых сайты связывания образованы только тяжелыми цепями или легкими цепями, при отсутствии взаимодействия между VH и VL.
Термин "вариабельный" обозначает тот факт, что определенные части вариабельных доменов различаются в широких масштабах среди антител и используются при связывании и специфичности каждого конкретного антитела с его определенным антигеном. Однако вариабельность обычно неравномерно распределена на всем протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными областями, в вариабельных доменах легкой цепи и тяжелой цепи. Более высококонсервативные части вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей включают 4 области FR, главным образом принимающие конфигурацию β-листа, соединенного тремя CDR, которые образуют петли, соединяющие и в некоторых случаях формирующие часть структуры β-листа. Гипервариабельные области в каждой цепи удерживаются вместе в тесной близости областями FR и с CDR из другой цепи, участвуют в формировании антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Термин "гипервариабельная область", когда используется в описании, относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельная область может содержать аминокислотные остатки из "определяющей комплементарность области" или "CDR" (например, примерно вблизи остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL, и примерно вблизи остатков 31-35B (H1), 50-65 (H2) и 95-102 (H3) в VH (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) и/или указанные остатки из "гипервариабельной петли " (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в VL, и 26-32 (H1), 52A-55 (H2) и 96-101 (H3) в VH (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)).
"Каркасные" или "FR" остатки представляют собой остатки вариабельного домена, за исключением остатков гипервариабельной области, которые определены в описании.
"Фрагменты антитела" содержат часть интактного антитела, предпочтительно, содержащую антигенсвязывающий участок. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2, и Fv; диатела; линейные антитела; одноцепочечные молекулы антител; и полиспецифические антитела, образованные из фрагментов антител.
Расщепление антител папаином приводит к образованию двух идентичных антиген-связывающих фрагментов, названных "Fab"-фрагментами, каждый с единственным антиген-связывающим сайтом, и остаточным "Fc"-фрагментом, наименование которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который обладает двумя антиген-связывающими сайтами и все еще способен перекрестно взаимодействовать с антигеном.
"Fv" является наименьшим фрагментом антитела, который содержит антиген-распознающий и -связывающий сайт. Данная область состоит из димера одной тяжелой и одной легкой цепи вариабельного домена, находящихся в тесной нековалентной связи. В данной конфигурации три гипервариабельных области каждого вариабельного домена взаимодействуют с определенным антиген-связывающим сайтом на поверхности VH-VL-димера. Совместно эти шесть гипевариабельных областей придают данному антителу антиген-связывающую специфичность. Однако даже одиночный вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью по сравнению с полным связывающим сайтом.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов из-за добавления нескольких остатков по карбоксиконцу тяжелой цепи CH1-домена, в том числе одного или более цистеинов шарнирной области антитела. Fab'-SH обозначает в настоящем описании Fab', в котором цистеиновый остаток(и) константных доменов несут по меньшей мере одну свободную тиольную группу. F(ab')2-фрагменты антитела исходно получают в виде пары Fab'-фрагментов, которые содержат между собой шарнирные цистеины. Известны также и другие химические соединения фрагментов антител.
"Легкие цепи" антител (иммуноглобулинов) любого вида позвоночных можно отнести к одному из двух отчетливо различимых типов, называе