Лекарственное средство с противовирусной активностью (варианты)
Иллюстрации
Показать всеИзобретение относится к лекарственному средству с противовирусной активностью в отношении ВИЧ инфекции и вируса гепатита В, представляющему собой производное 2-хлор-5-фенил-5Н-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4-ола общей формулы (I)
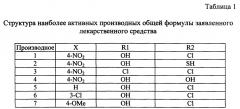
где X выбран из группы Н, NO2, Hal, ОМе; R1 выбран из группы: Cl, ОН; R2 выбран из группы: Cl, SH, ОН. Лекарственное средство может содержать в эффективных количествах совместно с соединением формулы (I) ингибитор обратной транскриптазы, выбранный из Ретровира, или ингибитор протеазы, выбранный из Лопинавира. Лекарственное средство может быть приготовлено в форме таблеток или капсул для энтерального приема или в форме лиофильно высушенной субстанции; или в форме ректальных свечей. 2. н.п. ф-лы, 9 табл., 6 пр.
Реферат
Изобретение относится к области органической химии и медицины, конкретно - к синтетическим веществам пиримидинового ряда - производным 2-хлор-5-фенил-5H-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4-ола, обладающим противовирусной активностью.
Изобретение может быть использовано для лечения заболеваний, вызванных вирусами иммунодефицита и другими ретровирусами, вирусами гепатита В, а также для аналогичных целей в ветеринарии. Заявленное средство может применяться как в индивидуальном виде, так и в комбинации с другими препаратами и фармацевтическими добавками.
Как известно, многие производные пиримидина обладают выраженной биологической активностью и участвуют в процессах жизнедеятельности организмов. Производные пиримидина являются нуклеиновыми основаниями (урацил, тимин, цитозин), витаминами (тиамин, фосфотиамин), коферментами (кокарбоксилаза), регуляторами роста (оротовая кислота) и т.д. [Data for Biochemical Research (3rd ed.), R.M.C. Dawson, D.C. Elliott, W.H. Elliott, K.М. Jones. (Clarendon Press, 1986].
Особый интерес представляют системы, в которых пиримидиновый цикл аннелирован другими гетероциклами. К ним относятся пурины, входящие в состав нуклеиновых кислот (аденин, гуанин), фолиевая кислота, АТФ, птерины, флавины, многие другие природные вещества и их синтетические аналоги.
Из синтетических производных пиримидина широкое использование в медицине приобрели замещенные барбитуровые и 2-тиобарбитуровые кислоты. Данные о биологической активности разнообразных производных 5-илиденбарбитуровых кислот суммированы в обзоре [2 - Sans R.G., Chosas M.G. // Pharmazie, 1988, Bd 43, N 12, S. 827-829], где отмечены антиконвульсантное, антимикробное, спазмолитическое, жаропонижающее, противоопухолевое действие этих веществ.
Высокая биологическая активность обнаружена также у аннелированных производных пиримидина, например у пиразоло[3,4-d]пиримидинов, полученных конденсацией 6-гидразиноурацилов с изо(тио)цианатами [3 - Naka Т., Nagaoka A., Furukawa Y., заявка ЕПВ No. 237289 (1987)], 5-деазафлавинов [4 - Yoneda F., Sasaki Т., Патент Японии, М кл. C07D 471/04, No 03 81276, заявлена 24.08.1989 (89/218146), опуб. 05.04.1991], производных пирроло[2,3-d]пиримидинов [5 - Quijano M.L., Nogueras М., Melguizo М., Alvarez de Cienfuegos G., Melgarejo М., Sanches A. // Nucleosides & Nucleotides, 1989, Vol. 8, N8, P. 1519-1528], пирано[2,3-d]пиримидинов [6 - Ahluwalia V.K., Batla R., Khurana A., Kumar R. // Indian J. Chem., 1990, Vol. 29B, N 12, P. 1141] и пиримидо[4,5-с]пиридазинов [7 - Billings B.K., Wagner J.A., Cook F.D., Castle R.N. // J. Heterocycl. Chem., 1975, Vol. 12, N 6, P. 1221-1224]. Перечисленные соединения обладают пестицидным, противоопухолевым, антимикробным, иммуносупрессивным, ноотропным, антигипертензионным и антиаллергическим действием.
Приведенные выше материалы свидетельствуют о перспективности поиска новых фармацевтических препаратов среди производных пиримидина.
В то же время известны лишь несколько примеров образования пирано[2,3-d:6,5-d′]дипиримидиновой системы, в частности, при взаимодействии барбитуровых кислот с 3-ацилхромонами [8 - Eiden F., Schikorr W. // Arch. Pharm., 1972, Bd 305, N 3, S. 187-193] [9 - Stone K.M., Wittington W.L., Treatment of genital gerpes. Rev. of Infect. Dis., 1990, 12, Supl. 6, P. 610-619]. Об их биологической активности сведений нет. Как было отмечено выше, соединения, содержащие фрагмент пиримидиндиона, обладают разнообразной биологической активностью. Однако эффективность многих из изученных веществ недостаточно высока, многие из них токсичны и обладают побочными эффектами. Кроме того, у бактерий, вирусов и опухолевых клеток очень быстро вырабатывается устойчивость к существующим препаратам [10 - Stone К.М., Wittington W.L., Treatment of genital gerpes, Rev. of Infect. Dis., 1990, 12, Supl. 6, P. 610-619].
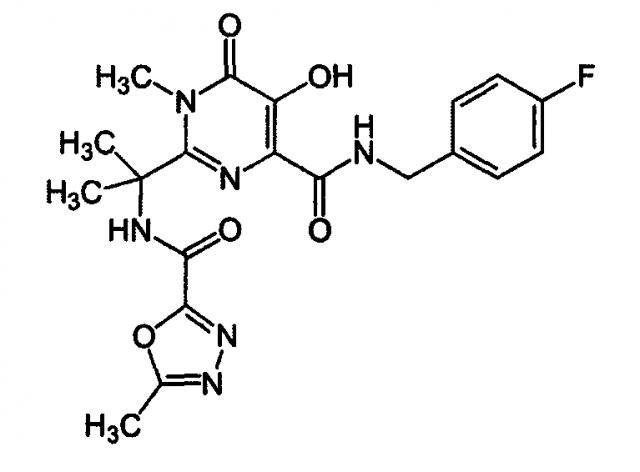
Прототипом изобретения выбран препарат Ралтегравир (Raltegravir) ингибитор интегразы, N-(2-(4-(4-флюоробензилкарбамоил)-5-гидрокси-1-метил-6-оксо-1,6-дигидропиримидин-2-ил)пропан-2-ил), общей формулы
(http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/022145s0181bl.pdf).
Препарат ингибирует каталитическую активность ВИЧ интегразы - фермента, участвующего в репликации вируса. Ингибирование интегразы предотвращает ковалентное введение генома ВИЧ в геном клетки хозяина на ранних стадиях развития инфекции. Недостатки прототипа связаны с быстро возникающей резистентностью вирусов к данному препарату, что обусловливает его невысокую эффективность.
Задачей изобретения является создание эффективного лекарственного средства с противовирусной активностью.
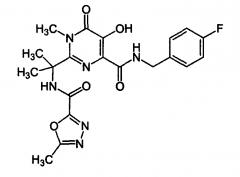
Согласно изобретению поставленная задача решается путем синтеза лекарственного средства 2-хлор-5-фенил-5Н-пиримидо[5',4':5,6]пирано[2,3-d]пиримидин-4-ола общей формулы
,
где Х выбран из группы: Н, NO2, Hal, OMe;
R1 выбран из группы: Cl, ОН;
R2 выбран из группы: Cl, SH, ОН;
лекарственное средство может быть приготовлено в форме таблеток или капсул для энтерального приема, или в форме лиофильно высушенной субстанции, или в форме ректальных свечей; лекарственное может быть выполнено совместно с ингибиторами обратной транскрипции, или совместно с ингибиторами интеграции, или совместно с ингибиторами протеаз.
Изобретение распространяется на все пространственные изомеры заявляемых веществ, все их таутомерные формы, а также соли.
Заявителю не известны какие-либо источники информации, в которых бы содержались сведения об идентичных технических решениях, что позволяет сделать вывод о соответствии изобретения условию патентоспособности «Новизна».
Заявителем не выявлены какие-либо источники информации, содержащие сведения о влиянии признаков изобретения на достигаемый вследствие их реализации технический результат. Это, по мнению заявителя, свидетельствует о соответствии данного технического решения условию патентоспособности «Изобретательский уровень».
Для решения поставленной задачи наиболее предпочтительны производные заявленного вещества, указанные в таблице 1.
Синтез заявленного лекарственного средства
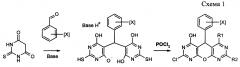
Производные 1-7 заявленного вещества синтезируют в 2 этапа в соответствии со схемой 1.
Для получения заявляемых веществ вначале синтезируют промежуточные вещества - соли производных бис-[5-(2-сульфгидрил-4,6-дигидроксигексагидропиримидо)]фенилметана из соответствующих ароматических альдегидов и 2-тиобарбитуровой кислоты в присутствии основания (Base) - триэтиламина или пиридина. Затем обработкой промежуточных соединений хлорокисью фосфора синтезируют заявленные вещества.
Заявленное вещество получают следующим образом.
Для получения производного 1 в колбу вместимостью 500 мл помещают 14.4 г (0.1 моль) 2-тиобарбитуровой кислоты, приливают 150 мл воды и нагревают смесь до 90-95°С. Затем к горячему раствору при перемешивании приливают 5.01 (0.05 моль) триэтиламина в 7 мл спирта и нагревают еще 1 мин до полного растворения. Затем раствор снимают с нагрева и быстро при перемешивании приливают раствор 7.55 г (0.05 моль) 4-нитробензальдегида в 25-30 мл горячего спирта. Реакционную смесь перемешивают без нагревания 5 мин и оставляют при 15-20°С на 3-4 ч. Выпавший кристаллический осадок отфильтровывают, промывают небольшим количеством воды и сушат на воздухе до постоянного веса. Получают 24 г промежуточного вещества - триэтиламмониевой соли бис-[5-(2-сульфгидрил-4,6-дигидроксигексагидропиримидо)]4-нитрофенилметана в виде кристаллического порошка кремового цвета, Т разл. 240°С.
Затем в колбу вместимостью 200 мл помещают 100 мл хлорокиси фосфора, нагревают до кипения и к кипящей жидкости при перемешивании добавляют 10 г полученного выше промежуточного вещества (триэтиламмониевой соли бис-[5-(2-сульфгидрил-4,6-дигидроксигексагидропиримидо)]-(4-нитрофенил)метана), и продолжают перемешивать при интенсивном кипячении с обратным холодильником 30-50 мин до полного растворения осадка, после чего кипятят еще 1 ч. После этого реакционную смесь охлаждают до комнатной температуры и при активном перемешивании порциями вливают в 350 г толченого льда. Скорость прибавления смеси регулируют так, чтобы температура массы была не выше 15°С. После прибавления всей смеси продолжают перемешивать массу, постепенно доводя ее до температуры 20°С, а при достижении заданной температуры добавляют к смеси еще 50 г льда, удерживая температуру в пределах 20-35°С. После завершения экзотермической реакции разбавляют смесь водой до конечного объема 1 л, выделившийся белый осадок фильтруют и промывают водой до слабокислой реакции смывов (рН 4-5). Далее сырой осадок переносят в колбу, добавляют 200 мл воды, 5 г трис-оксиметиламинометана (ТРИС) и перемешивают без нагревания до полного растворения осадка. Полученный раствор фильтруют от инородных частиц. К фильтрату добавляют 100 мл водного раствора уксусной кислоты 1% до рН 7 и выдерживают 30 мин, а выделившийся осадок отделяют и отбрасывают. К полученному фильтрату добавляют 100 мл раствора уксусной кислоты 1% до рН 5 и выдерживают 1 ч, сформировавшийся осадок фильтруют, промывают водным раствором уксусной кислоты 0.1%, затем чистой водой и сушат в вауум-эксикаторе над КОН при температуре до 30°С. Получают 3.5 г производного 1 заявляемого вещества в виде стеклообразного продукта коричневого цвета. Выход 40% от теории.
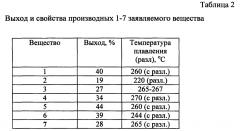
Примечание. По аналогичной методике при использовании соответствующих альдегидов (бензальдегида, 3-хлорбензальдегида и 4-метоксибензальдегида) получают производные 5, 6 и 7. Выход продуктов указан в таблице 2, характеристики и данные элементного анализа - в таблицах 3 и 4.
Для получения смеси производных 1, 2 и 3 в колбу вместимостью 200 мл помещают 100 мл хлорокиси фосфора и нагревают до кипения. Затем в кипящую жидкость при перемешивании добавляют 10 г полученного выше промежуточного вещества (соли бис-[5-(2-сульфгидрил-4,6-дигидроксигексагидропиримидо)]-(4-нитрофенил)метана) и продолжают перемешивать при интенсивном кипячении с обратным холодильником 30-50 мин до полного растворения осадка, после чего кипятят еще 1 ч. После этого реакционную смесь охлаждают до комнатной температуры и при активном перемешивании порциями вливают в 350 г толченого льда. Скорость прибавления смеси регулируют так, чтобы температура массы была не выше 15°С. После прибавления всей смеси продолжают перемешивать массу, постепенно доводя ее до температуры 20°С, а при достижении заданной температуры добавляют к смеси еще 50 г льда, удерживая температуру в пределах 20-35°С. После завершения экзотермической реакции разбавляют смесь водой до конечного объема 1 л. Выделившийся белый осадок фильтруют через бумажный фильтр и тщательно промывают водой до слабокислой реакции смывов (рН 4-5). Далее сырой осадок переносят в колбу, добавляют 200 мл воды, 5 г трис-оксиметиламинометана (ТРИС) и перемешивают без нагревания до полного растворения осадка и получения раствора с рН 8-9. Полученный раствор разбавляют водой до конечного объема 400 мл и фильтруют от инородных частиц. Затем к полученному фильтрату медленно, при перемешивании, добавляют 50 мл водного раствора, содержащего 5 мл уксусной кислоты до рН 3. Выпавший густой осадок выдерживают 30 мин и фильтруют, тщательно промывают осадок на фильтре водным раствором уксусной кислоты 0.1%, затем чистой водой и сушат на воздухе при температуре не выше 40°С. После сушки получают 6 г стеклообразного продукта коричневого цвета, представляющего собой смесь производных 1, 2 и 3 заявляемого вещества в соотношении (%) 40:30:20 соответственно. Суммарный выход около 80% от теории.
Для получения целевого продукта, а именно 2-хлор-8-сульфгидрил-5-(4-нитрофенил)-5Н-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4,6-диола (производное 2), в колбу вместимостью 200 мл помещают 100 мл хлорокиси фосфора и нагревают до кипения. Затем в кипящую жидкость при перемешивании добавляют 10 г полученного выше промежуточного вещества (соли бис-[5-(2-сульфгидрил-4,6-дигидрокси-гексагидропиримидо)]-(4-нитрофенил)метана) и продолжают перемешивать при интенсивном кипении до полного растворения осадка (30-50 мин). После этого реакционную смесь охлаждают до комнатной температуры и при активном перемешивании порциями вливают в 250 г толченого льда, регулируя скорость прибавления смеси так, чтобы конечная температура массы составляла 50-60°С. После завершения экзотермической реакции осадок фильтруют через бумажный фильтр и тщательно промывают водой. Далее сырой осадок переносят в колбу и растворяют в 200 мл воды с добавкой 5-6 мл аммиака 25%. Полученный раствор фильтруют от инородных частиц и фильтрат подкисляют водным раствором уксусной кислоты 5% до рН 5. Выпавший осадок отделяют и отбрасывают, а фильтрат подкисляют HCl до рН 1 и выдерживают 1 ч при 20°С. Выделившийся осадок фильтруют, промывают водой и сушат в вауум-эксикаторе над КОН при температуре до 30°С. После сушки получают 1.35 г производное 2 в виде светло-желтого кристаллического порошка. Выход 19% от теории.
Для получения заявляемого производного, а именно 2,6,8-трихлор-5-(4-нитрофенил)-5H-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4-ола (производное 3), в колбу вместимостью 200 мл помещают 100 мл хлорокиси фосфора и нагревают до кипения. Затем в кипящую жидкость при перемешивании добавляют 3 г полученного выше промежуточного вещества (соли бис-[5-(2-сульфгидрил-4,6-дигидрокси-гексагидропиримидо)]-(4-нитрофенил)метана) и продолжают перемешивать при интенсивном кипении 2 ч. После этого из смеси отгоняют в вакууме не менее 70 мл хлорокиси фосфора при температуре бани до 90°С и остаток охлаждают до комнатной температуры. Затем реакционную смесь при активном перемешивании порциями вливают в 150 г толченого льда, регулируя скорость прибавления смеси так, чтобы температура массы не превышала 15°С. После завершения экзотермической реакции осадок фильтруют через бумажный фильтр и тщательно промывают водой. Далее сырой осадок переносят в колбу, добавляют 100 мл воды, 2 г трис-оксиметиламинометана (ТРИС) и перемешивают без нагревания до полного растворения осадка и получения раствора с рН 8-9. Полученный раствор фильтруют от инородных частиц и фильтрат подкисляют водным раствором уксусной кислоты 1% до рН 7. Выпавший осадок фильтруют, тщательно промывают водой и сушат в вауум-эксикаторе над КОН при температуре до 30°С. После сушки получают 0.56 г производного 3 заявляемого вещества в виде стеклообразного продукта светло-коричневого цвета. Выход 27% от теории.
Для получения целевого продукта, а именно 2-хлор-5-(4-нитрофенил)-5H-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4,6,8-триола (производное 4), в колбу вместимостью 200 мл помещают 100 мл хлорокиси фосфора и нагревают до кипения. Затем в кипящую жидкость при перемешивании добавляют 10 г полученного выше промежуточного вещества (соли бис-[5-(2-сульфгидрил-4,6-дигидрокси-гексагидропиримидо)]-(4-нитрофенил)метана) и продолжают перемешивать при интенсивном кипении до полного растворения осадка (30-50 мин). После этого реакционную смесь охлаждают до комнатной температуры и при активном перемешивании порциями вливают в 250 г толченого льда, регулируя скорость прибавления смеси так, чтобы конечная температура массы составляла 50-60°С. После завершения экзотермической реакции смесь перемешивают при 50°С в течение 8 ч. Затем охлаждают смесь до комнатной температуры, осадок фильтруют через бумажный фильтр и тщательно промывают водой. Далее сырой осадок переносят в колбу и растворяют в 200 мл воды с добавкой 5-6 мл аммиака 25%. Полученный раствор фильтруют от инородных частиц и фильтрат подкисляют водным раствором уксусной кислоты 5% до рН 5. Выпавший осадок отделяют и отбрасывают, а фильтрат подкисляют HCl до рН 1 и выдерживают 1 ч при 20°С. Выделившийся осадок фильтруют, промывают водой, затем спиртом, эфиром и сушат на воздухе при комнатной температуре. Получают 2.4 г производного 4 заявляемого вещества в виде бесцветного кристаллического порошка. Выход 34% от теории.
Исследование биологической активности заявленного лекарственного средства.
Пример 1. Определение анти-ВИЧ активности производных 1-7 заявленного лекарственного средства.
Материалы и методы:
Клетки. Использовали перевиваемые лимфобластоидные клетки человека МТ-4. Клетки культивировали в среде RPMI 1640 с 10% сыворотки эмбрионов коров, 100 мкг/мл гентамицина.
Вирусы. В качестве источника вируса использовали штамм ВИЧ-1899А.
Препарат. Исследовали образцы препаратов, растворенные в диметилсульфоксиде.
Структура исследования:
Исследование цитотоксического действия препарата.
К клеткам добавляли исследуемый препарат в различных концентрациях. Инкубировали клетки при 37С° в атмосфере с 5% CO2 и 98% влажности 5 дней. Учет результатов: определение жизнеспособности и количества клеток при помощи красителя.
Исследование противовирусного действия препарата.
К клеткам добавляли исследуемые препараты в различных дозах при одновременном инфицировании вирусом в дозе 0,01 ТЦИД50/клетка. Инкубировали культуры клеток при 37С° в атмосфере с 5% CO2 и 98% влажности 5 дней. Учет результатов проводили окрашиванием клеток с помощью тетразолиевого красителя (метод МТТ) со спектрофотометрией и световой микроскопией: исследование цитопатического эффекта вируса (ЦПД) и вирусиндуцируемого образования синцития (синцитий - конгломерат нескольких клеток с общей клеточной оболочкой, образовавшейся в результате слияния их мембран).
Степень защиты клеток от цитодеструктивного действия вируса определяли по формуле
А - число жизнеспособных клеток в опытной группе;
В - то же в инфицированной культуре (контроль вируса);
К - то же в неинфицированной культуре (контроль клеток).
Результаты исследования приведены в таблице 6.
Пример 2. Определение 50%-ной летальной дозы смеси производных 1+2+4 заявленного вещества (ЛД50) при парентеральном (инъекционном) способе введения.
Определение показателей острой токсичности при парентеральном способе введения включало эксперименты на мышах массой 18-20 г, возраст 8-9 недель.
В опытах на грызунах для исследования каждой дозы использовались группы по 5 животных одного пола. Препараты растворяли в стерильной Н2О и вводили в хвостовую вену (в/в).
Результаты: ЛД50 смеси производных 1+2+4 составило 2000-2500 мг/кг.
Пример 3. Определение ЛД50 смеси производных 1+2+5 при энтеральном способе введения.
Определение ЛД50 заявленного вещества при энтеральном способе введения.
Определение показателей острой токсичности при энтеральном способе введения включало эксперименты на мышах массой 18-20 г, возраст 8-9 недель.
В опытах на грызунах для исследования каждой дозы препаратов использовались группы по 5 животных одного пола. Препараты вводили внутрижелудочно (в/ж) в возрастающих дозах по Литчфилду-Уилкоксону.
Для этого их разводили в 1% крахмальной слизи и полученную взвесь вводили животным.
Результаты: ЛД50 смеси производных 1+2+5 составило 12000-16000 мг/кг.
Пример 4. Определение ЛД50 при внутривагинальном способе введения
Определение показателей острой токсичности при внутривагинальном способе введения включало эксперименты на крысах массой 150-170 г, возраст 3-3,5 месяца. Суппозитории, содержащие 1000 мкг/суппозиторий №14, нарезались бритвой на полоски меньшего размера, удобные для вагинального введения. Введения препарата осуществляли на протяжении 12 ч с интервалами в 2 ч. Общая дозировка, получаемая животным при введении, составила 2200 мкг/кг. Ни у одного из животных не отмечалось гибели и каких-либо признаков негативного воздействия препарата. Динамика массы тела во всех группах оставалась нормальной.
Пример 5. Совместное действие заявленного лекарственного средства и препаратов, используемых для лечения заболеваний, вызванных вирусами иммунодефицита человека.
Материалы и методы:
Использовали перевиваемые лимфобластоидные клетки человека МТ-4. Клетки культивировали в среде RPMI 1640 с 10% сыворотки эмбрионов коров, 100 мкг/мл гентамицина.
В качестве источника вируса использовали штамм ВИЧ-1899А.
Препарат. Исследовали образцы препаратов, растворенных в диметилсульфоксиде. В качестве антиретровирусного референс-препарата использовали препарат Ралтегравир (прототип).
Исследование противовирусного действия препарата (защита клеток).
К клеткам добавляли исследуемые препараты в различных дозах при одновременном инфицировании вирусом в дозе 0,01 ТЦИД50/клетка. Инкубировали культуры клеток при 37С° в атмосфере с 5% СО2 и 98% влажности 5 дней. Учет результатов проводили окрашиванием клеток с помощью тетразолиевого красителя (метод МТТ) со спектрофотометрией и световой микроскопией: исследование цитопатического эффекта вируса (ЦПД) и вирусиндуцируемого образования синцития (синцитий - конгломерат нескольких клеток с общей клеточной оболочкой, образовавшейся в результате слияния их мембран).
Результаты приведены в таблице 8.
Таким образом, можно сделать вывод о синергическом действии заявленного лекарственного средства при совместном использовании с препаратами, используемыми для лечения заболеваний, вызываемых вирусами иммунодефицита человека.
Пример 6. Влияние заявляемых соединений на репродукцию вируса гепатита В (HBV).
Материалы и методы.
Клетки линии HepG2.2.15, инфицированные вирусом гепатита В, выращивали на среде DMEM с добавлением 10% бычьей сыворотки при 5% CO2, 37°С.
Анализ количества внеклеточной HBV ДНК.
Через 5 дней инкубации HepG2.2.15 отбирали культуральную среду, центрифугированием отделяли клетки и выделяли ДНК по методу Klintschar и Neuhuber (Klintschar and Neuhuber, 2000). Количественное определение HBV проводили с использованием RT-PCR.
Результаты приведены в таблице 9.
Полученные данные указывают, что заявленное лекарственное средство активно против вируса гепатита В.
1. Лекарственное средство с противовирусной активностью в отношении ВИЧ инфекции и вируса гепатита В, представляющее собой производные 2-хлор-5-фенил-5Н-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4-ола общей формулы: где: X выбран из группы: Н, NO2, Hal, ОМе;R1 выбран из группы: Cl, ОН;R2 выбран из группы: Cl, SH, ОН.
2. Лекарственное средство с противовирусной активностью в отношении ВИЧ инфекции, содержащее производное 2-хлор-5-фенил-5Н-пиримидо[5′,4′:5,6]пирано[2,3-d]пиримидин-4-ола общей формулы: где: X выбран из группы: Н, NO2, Hal, ОМе;R1 выбран из группы: Cl, ОН;R2 выбран из группы: Cl, SH, ОНсовместно с ингибитором обратной транскриптазы, выбранным из Ретровира, или с ингибитором протеазы, выбранным из Лопинавира, взятых в эффективном количестве.