Полимеросодержащее лекарственное средство на основе противоопухолевого препарата этопозида
Иллюстрации
Показать всеИзобретение относится к области фармакологии и медицины, а именно к новому поколению противоопухолевых препаратов на основе этопозида, и описывает полимерсодержащее лекарственное средство на основе противоопухолевого препарата этопозида, который включает биодеградируемый полимер в виде сополимера молочной и гликолевой кислот с характеристической вязкостью 0,41 дл/г и молярным соотношением мономерных звеньев 50 на 50%, поверхностно-активное вещество в виде поливинилового спирта, криопротектор в виде D-маннитола, представляющее собой частицы субмикронного размера, следующего состава, мас.%: этопозид - 5.0÷8,0; сополимер молочной и гликолевой кислот - 55.0÷61.0; поливиниловый спирт - 16.0÷18.0; D-маннитол - 17.0÷20.0. Изобретение характеризуется высокой противоопухолевой активностью при подкожном, внутрибрюшинном и внутривенном путях введения, а также пониженным уровнем токсического действия и может быть использовано для лечения злокачественных новообразований. 1 з.п. ф-лы, 6 ил., 2 табл., 4 пр.
Реферат
Область техники
Изобретение относится к области фармакологии и медицины, а именно к новому поколению противоопухолевых препаратов на основе этопозида.
Уровень техники
Повышение эффективности лечения злокачественных новообразований является актуальной медицинской и социально-экономической проблемой. Известно, что химиотерапевтические методы лечения злокачественных опухолей затруднены низкой специфичностью многих препаратов, действующих также на здоровые ткани. Полимерные системы доставки противоопухолевых средств можно рассматривать в качестве перспективного технологического подхода повышения эффективности и безопасности противоопухолевых препаратов. Известно, что опухолевые ткани обладают способностью аккумулировать полимерные частицы. Для некоторых противоопухолевых лекарственных средств, таких как паклитаксел, доцетаксел, цисплатин, показано значительное увеличение эффективности полимерных систем доставки по сравнению со свободными веществами.
В соответствии с современными представлениями идеальный полимерный носитель должен обладать рядом свойств, такими как: биосовместимость и биодеградируемость; способность защищать лекарственное вещество от быстрой деградации и обеспечивать селективность транспорта лекарственного средства в органы/клетки-мишени; способность обеспечивать пролонгированное действие лекарственного вещества; пригодность для различных способов введения; стабильность; апирогенность; возможность стерилизации. Всем вышеперечисленным требованиям в полной мере удовлетворяет биодеградируемый фармацевтический полимер полилактидгликолид (сополимер молочной и гликолевой кислот - PLGA), в связи с чем весьма актуальным представляется создание полимерных форм противоопухолевых препаратов на его основе.
Одним из самых активных и полезных противоопухолевых агентов является этопозид, который используется обычно при лечении герминогенных опухолей (опухоли яичка, хориокарцинома), рака яичников, мелкоклеточного и немелкоклеточного рака легкого, лимфогранулематоза, неходжкинских лимфом, рака желудка (монотерапия и в составе комбинированной терапии), саркомы Юинга, саркомы Калоши, нейробластом, рака молочной железы (с метастазами в печень, в плевру), острых нелимфобластный лейкозов, мезотелиомы [1, 2].
Этопозид относится к полусинтетическим эпиподофиллотоксинам, производным 4′-диметилэпиподофиллотоксина, содержащегося в экстракте мандрагоры [3]. Этопозид в форме раствора для инъекций включен в Перечень жизненно необходимых и важнейших лекарственных препаратов. Фармакологически активным является транс-изомер этопозида. Этопозид является ингибитором ДНК-топоизомеразы II - фермента, создающего временные разрывы в обеих цепях ДНК и тем самым предотвращающего ее суперспирализацию [4]. Этопозид стабилизирует комплекс ДНК с ДНК-топоизомеразой II, мешая ферменту зашить разрывы в цепях ДНК.
Препарат принимается внутривенно или перорально. Режим дозирования устанавливают индивидуально, в зависимости от используемой схемы химиотерапии. Для приема внутрь суточная доза составляет около 50 мг/м2 в течение 21 дня ежедневно, затем в той же дозе - на 28-й день. При необходимости курс лечения можно повторять 4-6 раз. Интервалы между курсами лечения устанавливают также индивидуально, в зависимости от восстановления гемопоэза. Доза может быть изменена с учетом эффективности препарата и его переносимости. Для внутривенных инфузий применяют растворы с концентрацией этопозида 200 мкг/мл, реже - до 400 мкг/мл.
При приеме внутрь этопозид всасывается из желудочно-кишечного тракта. Биодоступность не превышает 50%. Имеются доказательства, что биодоступность этопозида уменьшается с увеличением дозы, по-видимому, из-за снижения растворимости этопозида в желудке и тонкой кишке при повышении концентрации препарата [5]. Метаболизируется этопозид в печени. Конечный период полувыведения в среднем составляет 7 ч. Выводится в основном почками (44-60%).
Применение препарата приводит к существенным нарушениям со стороны системы кроветворения, со стороны пищеварительной системы, со стороны ЦНС и периферической нервной системы, со стороны обмена веществ, со стороны сердечнососудистой системы, со стороны репродуктивной системы. Препарат вызывает аллергические реакции: озноб, лихорадка, бронхоспазм и дерматологические реакции: алопеция.
После внутривенного введения препарат обнаруживается в плевральной жидкости, в слюне, ткани печени, селезенке, почках, миометрии, в тканях мозга (в том числе в опухолях). Препарат проникает через плацентарный и гематоэнцефалический барьеры. Немногочисленные данные позволяют предположить, что этопозид поступает в ткань опухоли мозга быстрее, чем в здоровую ткань мозга. Было показано, что концентрации этопозида в здоровой ткани легких выше, чем в легочных метастазах, а уровни, достигаемые в первичных опухолях миометрия сходны с таковыми в здоровой ткани миометрия.
Для повышения биодоступности этопозида получают водорастворимые производные этопозида (например, фосфат этопозида) [6], примененяют микроэмульсии этопозида с фосфолипидами или холестеролом [7], получают липосомальные формы этопозида [8], а также полимерные частицы, содержащих этопозид [9-11].
Из уровня техники известна международная публикация заявки на изобретение WO №2007069272 [16], опубл. 21.06.2007, в которой раскрывается состав композиций на основе биодеградируемого полимера и противоопухолевого препарата. Биодеградируемый полимер выбирается из круга белков, пептидов, поли (ε-капролактона), поли (β-гидроксибутирата), поли (гидроксивалерата) и (β-оксибутират-гидроксивалерата), поли(молочной кислоты), поли (гликолевой кислоты), поли (D, L-молочной-со-гликолевой кислоты), амфифильных блок-сополимеров полимолочной кислоты оксида-полиэтилена, полиалкиленгликоля, полиэтиленоксида, блок-сополимеров полиэтилен оксид-оксида полипропилена, полиангидридов, полиортоэфиров, поли (N-винилпирролидона), поливинилового спирта, поливинилацетата, сложных полиэфиров, полиаминокислот, поливинилпирролидона. В состав композиции дополнительно входит вторичный полимер, обеспечивающий рН-чувствительность и температурную чувствительность, выбираемый из круга поли (N-ацетилфкриламида), поли (N-изопропилакриламида), поли (N-изопропилакриламид-СО-акриламида), поливинилового спирта, полиэтиленгликолья, полиакриламида, поли (метакриламида). Лекурственное вещество выбирается из широкого круга противоопухолевых препаратов - паклитаксел, доцетаксел, таксотер, винбластин, винкристин, виндезин, винорелбин, иринотекан, топотекан, амсакрин, этопозид. тенипозид, флюоксиместерон, тестолактон, бикалутамид, ципротерона, флутамид, нилутамид, аминоглютетимид, анастрозол, эксеместан, форместан, летрозол, дексаметазон, преднизолон, диэтилстилбестрол, фулвестрант, ралоксифен, тамоксифен, toremifine, бузерелин, госерелин, леупролид, трипторелин и др. Итоговой композицией является композиция, которая содержит в качестве лекарственного вещества - паклитаксел в количестве от примерно 0,5% до примерно 99,5%; в качестве полимера - поли(D, L-молочную-со-гликолевую кислоты) или альбумин в количестве от примерно 2,0% до примерно 99,0%; необязательно, в качестве вторичного полимера - поли (N-изопропилакриламид) в количестве от примерно 2,0% до примерно 90,0%, и один или несколько фармацевтически приемлемых наполнителей, носителей или их комбинацией от около 0,01% до около 99,9% от веса. Размер частиц менее 80 nm (10% частиц), менее 200 nm (50% частиц), менее 450 nm (90% частиц).
В данной международной публикации заявки не содержится сведений о биологической активности полимерной композиции с этопозидом, поэтому трудно судить о перспективности его дальнейшего использования в медицине.
В Европейском патенте на изобретение ЕР 2105150 [17], опубл. 10.01.2007, описан состав рентгеноконтрастных биоразлагаемых микросфер для сосудистой эмболии, включающих три компонента: биоразлагаемый полимерную матрицу, терапевтический агент(ы) и рентгеноконтрастный материал. В качестве полимерной матрицы могут быть использованы полимеры из группы: полилактид, поли (лактид-ко-гликолид), поли (лактид-эфир), поликапролактон, поли (капролактон-эфир)блок-сополимер, коллаген, хитин, хитозан, желатин, альгинат. Терапевтический агент выбирается из группы противоопухолевых препаратов: карбоплатин, цисплатин, паклитаксел, доцетаксел, оксалиплатин, циклофосфамид, ифосфамид, доксорубицин, пегилированной липосомальной доксорубицин, эпирубицин, топотекан, иринотекан, этопозид, фторурацил, блеомицин, винкристин, гемцитабин, актиномицин, и их комбинации.
Частицы с цитостатиками имеют достаточно крупные размеры - от 10 до 1500 µm, по этому не могут проникать в опухолевые клетки путем эндоцитоза и преодолевать барьеры резистентности, вызванные действием А, В, С - транспортеров в отличие от частиц нано- и субмикронного размеров.
В патенте на изобретение РФ №2290950 [18], опубл. 10.01.2007, описана биоразлагаемая противоопухолевая композиция с пролонгированным высвобождением противоопухолевого агента, предназначенная для введения в ткани. Композиция состоит из одного противоопухолевого агента и полимерного носителя, состоящего из биоразлагаемого олигомерного сложного эфира, со среднечисленной относительной молекулярной массой Mn=650-7500, средневесовой относительной молекулярной массой Mw=800-10000. Биоразлагаемый носитель представляет собой низкомолекулярный олигомерный сложный эфир с сильно разветвленной цепью, который синтезируют по реакции поликонденсации. Полифункциональный разветвляющий компонент представляет собой многоатомный спирт или сахар с тремя или более гидроксильными группами, такой как глицерин, пентаэритрит, инозит, ксилит, манит, сорбит, эритроза, треоза, арабиноза, рибоза, гюлоза, идоза, альтроза, алоза, талоза, сорбоза, манноза, глюкоза, фруктоза, галактоза, сахароза, лактоза. Цепи альфа-гидроксикислот, например таких как DL-молочная кислота, гликолевая кислота, альфа-гидроксимаслянная кислота, альфа-гидроксивалериановая кислота, альфа-гидроксикапроновая кислота, соединены посредством сложноэфирных связей с молекулами многоатомного спирта. В связи с этим олигомерный сложный эфир имеет звездообразную структуру с центральной молекулой из многоатомного спирта, которая играет роль разветвляющего компонента в ходе реакции поликонденсации. Способ получения противоопухолевой композиции заключается в том, что противоопухолевый агент, носитель, а также биологически совместимый пластификатор, агент, влияющий на кинетику высвобождения противоопухолевого агента, стабилизатор противоопухолевого агента или стабилизатор носителя, нагревают до температуры 35-75°С и смешивают. Среди соединений с противоопухолевой активностью, подходящих для использования в составе композиции, можно отметить фармацевтические средства из группы производных фолиевой кислоты, такие как метотрексат и т.п., аналоги пиримидина, такие как 5-фтороурацил и т.п., группу алкилирующих агентов, такую как цисплатин и его производные, комплексы платины в состоянии окисления IV, группу производных мочевины, таких как кармустин, ломустин и т.п., группу антибиотиков, действующих по механизму включения, таких как антибиотики группы антрациклина, например доксорубицин, идарубицин и т.п., производные антрацена и антрапиразолов, такие как митоксантрон, орацин и т.п., группу ингибиторов митоза, такие как винкаалкалоиды, а также таксаны, такие как паклитаксел, доцетаксел, группу ингибиторов топоизомеразы, таких как топотекан, каптотецин и т.п., этопозид, тенипозид и т.п., при этом с успехом также могут применяться соединения из группы гормонов, такие как аналоги гонадолиберина, госерелин, леупролин и т.п., группу ингибиторов CDK (циклинзависимая киназа), предпочтительно три- и тетразамещенных. Данная композиция предназначена для введения в ткани и характеризуется пролонгированным высвобождением противоопухолевого агента. Эрозия олигомерных сложноэфирных частиц происходит по механизму диффузии и элюирования низкомолекулярных и водно-растворимых продуктов деградации в биологическое гидрофильное окружение. Подложка, состоящая из носителей такого типа, находится в водной среде или внутри организма и постепенно уменьшается до полного исчезновения без остатка. Низкая степень набухания и гетерогенная природа деградации разветвленного полимерного носителя создает условия для непрерывного длительного высвобождения биологически активных соединений в окружающую ткань. Противоопухолевый агент включен в состав олигомерного сложного эфира звездообразной структуры с центральной молекулой из многоатомного спирта, которая играет роль разветвляющего компонента, в отличие от, предлагаемого нами, линейного полилактидгликолида. Кроме того, в данном патенте не содержится сведений о биологической активности полимерной композиции с этопозидом.
В патенте на изобретение РФ №2480201 [19], опубл. 27.04.2013, описана композиция, содержащая наночастицы, предназначенная для переноса терапевтически активных веществ в раковые клетки. Наночастицы состоят из трех компонентов - полимерной матрицы, положительно заряженной оболочки и магнитного материала. Полимерная матрица состоит из биологически стабильных биодеградируемых полимеров (предпочтительно поливалеролактоны, полилактоновая кислота, полигликолевая кислота, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, полигидроксибутират, полицианоакрилаты, поликапролактон диметилакрилат, мультиблочные полимеры, например, из олигокапролактондиолов и олигодиоксанондиолов, полиэфир сложноэфирные мультиблочные полимеры, такие как ПЭГ и поли(бутилентерефталат), триметилкарбонаты полигликолевой кислоты, поликапролактон гликолиды, полиортоэфиры, поли(N-винил)-пирролидон, поливиниловые спирты, полиэфирные амиды, полиангидриды, полиэтиленоксидпропиленоксид, полиэфирные сложные эфиры, такие как полиэтиленоксид, полиалкиленоксалаты, полиортоэфиры, а также их сополимеры, полимеры на основе белков, полиаминокислоты, альбумин, гиалуроновая кислота, хитозан и его производные, гепарансульфаты, декстран, - циклодекстрины, альгинаты, сополимеры с ПЭГ и полипропиленгликолем и ряд др.). Отличительным свойством наночастиц является наличие положительного поверхностного заряда, которое можно получить покрытием наночастиц веществами, которые могут положительно поляризоваться и/или положительно ионизироваться за счет содержания аминогрупп или протонируемых атомов азота, которые могут находиться в протонированной форме при соответствующем рН (предпочтительно мономерные аминосиланы, таких как 3-аминопропилтриэтоксисилан, 2-аминометил-3-аминопропилтриметоксисилан, триметоксисилил-пропил-диэтилентриамин или N-(6-аминогексил)-3-аминопропил-триметоксисилан. Сами же наночастицы состоят из магнитного материала, предпочтительно ферромагнитного, антиферромагнитного, ферромагнитного, антиферромагнитного или суперпарамагнитного материала, более предпочтительно из оксидов железа, в частности из суперпарамагнитных оксидов железа или из чистого железа с оксидным слоем (предпочтительно из оксидов железа, в частности из магнетита (Fe3O4). Наночастицы предпочтительно имеют диаметр менее 500 нм. Данные наночастицы подходят для переноса терапевтических веществ, предпочтительно противоопухолевых лекарств, цитостатиков, цитотоксические агентов, антипролиферативных агентов (в том числе, алкилирующих средств, антибиотиков с цитостатическими свойствами, антиметаболитов, ингибиторов микротрубочек и ингибиторов топоизомеразы, платины, алкалоидов, таксанов, гормонов, иммуномодуляторов, сигнальных трансдукторов и цитокинов). Примеры алкилирующих средств включают, помимо прочих, хлорэтамин, циклофосфамид, трофосфамид, ифосфамид, мелфалан, хлорамбуцил, бусульфан, тиотепа, кармустин, ломустин, дакарбазин, прокарбазин, темозолумид, треосульфан, эстрамустин и нимустин. Примеры антибиотиков с цитостатическими свойствами включают даунорубицин и липосомальный даунорубицин, доксорубицин (адриамицин), дактиномицин, митомицин С, блеомицин, эпирубицин (4-эпиадриамицин), идарубицин, дактиномицин, митоксантрон, амсакрин и актиномицин D. Метотрексат, 5-фторурацил, 6-тиогуанин, 6-меркаптопурин, флударубин, кладрибин, пентостатин, гемцитабин, цитарабин, азатиоприн, ралтитрексед, капецитабин, цитозин арабинозид, тиогуанин и меркаптопурин можно привести в качестве примеров антиметаболитов (антиметаболических агентов). К ингибиторам микротрубочек относятся, например, такие алкалоиды, как алкалоиды барвинка (винкристин, винбластин, виндезин, винорелбин) и паклитаксел (Taxol®), а также производные паклитаксела. Примеры ингибиторов топоизомеразы включают этопозид, тенипозид, камптотецин, топотекан и иринотекан. Наночастицы способны переносить терапевтические вещества и повышать уровень накопления терапевтических веществ в опухолевой ткани. Применение композиции приводит к снижению побочных эффектов по сравнению с использованием терапевтических веществ без наночастиц. Данное изобретение предназначено для комбинированной терапии опухолей - гипертермии, термотерапии, радиотерапии и химиотерапии. Лекарственные средства, описанные в данном патенте, содержат кроме полимерной матрицы также положительно заряженную оболочку и магнитный материал.
Недостатком данного изобретения является сложная структура и технология получения данных препаратов и связанная с этим их высокая стоимость. Кроме того, в данном патенте не содержится сведений о противоопухолевой активности и токсичности полимерной композиции с этопозидом.
В заявке Китая CN 102247320 [20], опубл. 13.03.2013, раскрыто изобретение, относящееся к области лекарственных средств, и длительно циркулирующей эмульсии для инъекций на основе этопозида, и способу ее приготовления. Длительно циркулирующая эмульсия на основе этопозида содержит этопозид, жидкое масло, эмульгаторы, полиэтиленгликоль (ПЭГ)-модифицированные эфиры и т.п., и имеет характеристики высокой степени включения, хорошей стабильности и низкой токсичности. Длительно циркулирующая эмульсия на основе этопозида улучшает растворимость и стабильность этопозида, уменьшает токсические эффекты этопозида на кровеносные сосуды, увеличивает время циркуляции этопозида в крови, и улучшает биораспределение этопозида in vivo, таким образом, улучшая его лечебные эффекты. Получение длительно циркулирующей эмульсии на основе этопозида решает проблему лекарственных средств с плохой растворимостью в воде и жировой растворимостью, достигая стабильности хранения. Данный препарат представляет собой мелкодисперсную форму этопозида, стабилизированную от агрегации эмульгатором (жидкое мыло, ПЭГ и т.д.) и не содержит полимерную матрицу, в которую встраивается цитостатик.
Для таких лекарственных форм не характерны: пролонгированность действия; способность защиты активных веществ, находящиеся внутри частиц, от воздействия различных факторов в организме человека, в том числе и многих ферментов; эффект пассивного направленного транспорта.
В патенте Китая CN 1961864 [21], опубл. 16.05.2007, приведено изобретение, в котором раскрывается противоопухолевая инъекционная композиция, которая включает микросферы, обеспечивающие замедленное высвобождение лекарственных веществ и состоящая из вспомогательных веществ, производных эпотилона, глиоксалин пиперазидина, комбинации ингибиторов фермента топоизомеразы, выбранных их SN-38, СРТ-11, НСРТ, топотекана, иринотекана, этопозида, тенипозида, амрубицина, валтаксина, ХК469, AD312, ICRF-187 или ICRF-193, растворителя, состоящего из адъюванта суспендируемости, вспомагательных веществ, обеспечивающих замедленное высвобождение, выбираемые из полимолочной кислоты и ее сополимера, полиэтилен/полимолочной кислоты, сополимера гликолевой кислоты, алифатических кислот, при этом вязкость адъюванта суспендируемости составляет 80-3000 сР (на 20-30 град С), и его выбирают из карбоксиметилцеллюлозы. Микросферы, обеспечивающие замедленное высвобождение, могут быть также получены из имплантируемого агента для медленного высвобождения, предназначенного для инъекций или размещения в или вокруг опухоли с периодом высвобождения около 40 дней. Инъекционная композиция для замедленного высвобождения или имплантируемый агент для замедленного высвобождения, могут быть использованы независимо для эффективного подавления опухолевого роста или использованы в сочетании с нехирургическими методами, такими как химиотерапия и/или радиотерапия с целью повышения эффективности лечения.
Частицы с цитостатиками, имеющие микронные размеры, непосредственно не могут проникать в опухолевые клетки путем эндоцитоза и преодолевать барьеры резистентности, вызванные действием А, В, С - транспортеров в отличие от частиц нано- и субмикронного размеров, и не могут быть использованы для лечения опухолей, резистентных к используемым лекарствам.
Раскрытие изобретения
Техническим результатом заявленного изобретения является:
- достижение высокой цитотоксической активности в отношении широкого спектра опухолевых клеток разных типов, включая резистентные к химиотерапевтическим препаратам;
- пониженная токсичность;
- сниженный уровень побочных эффектов;
- пригодность для различных способов введения.
Технический результат достигается тем, что полимерсодержащее лекарственное средство на основе противоопухолевого препарата этопозида включает биодеградируемый полимер в виде сополимера молочной и гликолевой кислот с характеристической вязкостью 0,41 дл/г и молярным соотношением мономерных звеньев 50 на 50%, поверхностно-активное вещество в виде поливинилового спирта, криопротектор в виде D-маннитола, представляющее собой частицы субмикронного размера, следующего состава, % масс:
| этопозид | 5.0÷8.0 |
| сополимер молочной и гликолевой кислот | 55.0÷61.0 |
| поливиниловый спирт | 16.0÷18.0 |
| D-маннитол | 17.0÷20.0 |
Полимерсодержащее лекарственное средство может быть выполнено, например, в виде капсул, гранул, порошка или другой пероральной формы, а также суспензии для инъекций.
Краткое описание чертежей
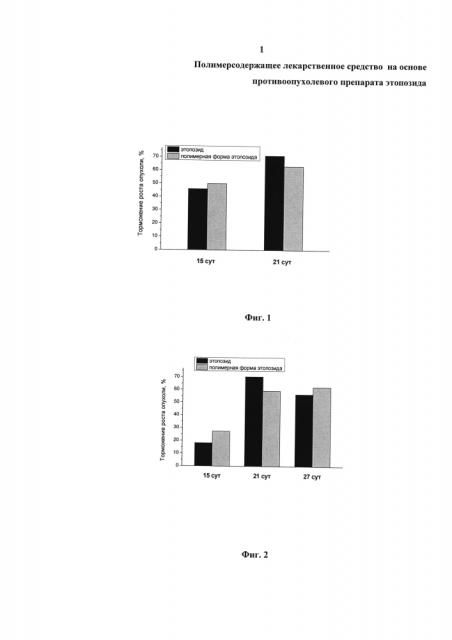
На фиг. 1 представлены данные по торможению роста асцита у экспериментальных животных при подкожном введении препаратов в дозе 15 мг/кг (по этопозиду). Несмотря на окончание лечения экспериментальных животных на 9-е сутки, противоопухолевый эффект полимерной формы этопозида сохранялся на 15-е сутки и 21-е сутки.
На фиг. 2 представлены данные по торможению роста асцита у экспериментальных животных при внутрибрюшинном введении полимерной формы этопозида в дозе 15 мг/кг. Противоопухолевый эффект, оцениваемый по торможению роста асцитной опухоли, был сходен с противоопухолевым эффектом при подкожном введении препарата. Торможение роста опухоли на 25 сутки эксперимента (16-е сутки после окончания лечения) достигало 59,3% (60% в случае подкожного введения). Противоопухолевый эффект полимерной формы этопозида сохранялся и далее, препарат эффективно блокировал рост асцитных опухолей.
Торможение роста асцитной опухоли сопровождалось увеличением продолжительности жизни леченых животных (см. фиг. 3). При внутрибрюшинном введении полимерной формы этопозида увеличение продолжительности жизни животных составило 110% на 70-е сутки эксперимента.
При анализе результатов исследования противоопухолевой активности полимерной формы этопозида на экспериментальной солидной модели лимфолейкоза мышей Р388 обнаружена высокая эффективность терапии данным препаратом при всех схемах лечения.
На фигурах 4 и 5 приведена динамика роста опухоли у экспериментальных животных при трехкратном введении в разовой дозе 25 мг/кг (см. фиг. 4) и пятикратном введении в разовой дозе 15 мг/кг (см. фиг. 5) внутрибрюшинном введении полимерной формы этопозида (суммарная курсовая доза 75 мг/кг).
Как следует из графиков, полимерная форма этопозида в значительной степени подавляла рост солидной опухоли Р388. Трехкратное внутривенное введение полимерной формы этопозида в дозе 20 мг/кг через день (1, 3, 5 сутки после прививки опухолевых клеток) так же, как и внутрибрюшинное введение, индуцировало выраженное торможение роста опухоли (см. фиг. 6).
Таким образом, показана высокая эффективность противоопухолевого действия полимерной формы этопозида при терапии солидной модели лимфолейкоза мышей Р388 как при внутрибрюшинном, так и внутривенном введении.
Осуществление и примеры реализации изобретения
Полимерсодержащее лекарственное средство на основе этопозида в виде субмикронных частиц (полимерная форма этопозида) получали известным методом простого эмульгирования (вода/масло). Подробное описание методики представлено в примере 1.
При проведении исследования противоопухолевой активности разработанного лекарственного средства использовали методику учета выживаемости на клеточных линиях. Для исследования цитотоксической активности (ЦТА) полимерной формы этопозида in vitro использовались следующие линии опухолевых клеток - лимфолейкоза мыши линии Р388, чувствительной и резистентной сублиний клеток линии аденокарциномы молочной железы MCF-7 и MCF-7ADR и чувствительной и резистентной сублиний клеток миелолейкоза человека линии К562 и K562ADR, аденокарциномы ободочной кишки линии Сасо-2, аденокарциномы прямой кишки линии SW837. В виду актуальности проблемы преодоления множественной лекарственной устойчивости опухолевых клеток при проведении исследования противоопухолевой активности в число тестерных клеточных линий были включены линии опухолевых клеток, характеризующихся множественной лекарственной устойчивостью: резистентная сублиния клеток линии аденокарциномы молочной железы MCF-7ADR и резистентная сублиния клеток миелолейкоза человека K562ADR, резистентность которых определяется высоким уровнем экспрессии белка MDR1. Оценку выживаемости клеток в культуре проводили с помощью биохимического МТТ-теста. Для этого в лунки с клетками добавляли раствор МТТ, инкубировали 2-4 часа при 37°C, после чего удаляли раствор МТТ, вносили ДМСО и измеряли оптическую плотность по поглощению при 540 нм с помощью многоканального спектрофотометра. В качестве вещества сравнения использовали субстанцию этопозида. Подробное описание материалов, методов и схемы эксперимента представлено в примере 2. Полученные результаты представлены в таблице 1.
Полученные результаты позволяют заключить, что полимерная форма этопозида обладает более высокой специфической активностью, чем субстанция этопозида в отношении высоко резистентных сублиний опухолевых клеток аденокарциномы молочной железы MCF-7ADR и миелолейкоза человека K562ADR. Значения IC50 в обоих вариантах резистентных клеток значительно ниже при использовании полимерной формы этопозида. Таким образом, обнаружено, что полимерная форма этопозида обладает высокой цитотоксической активностью в отношении широкого спектра опухолевых клеток разных типов, включая резистентные к химиотерапевтическим препаратам опухолевые клетки. ЦТА полимерной формы этопозида, оцениваемая по показателю IC50, была, в зависимости от типа клеток либо близка к субстанции этопозида, либо превышала ЦТА субстанции этопозида.
Исследование противоопухолевой активности активности разработанного лекарственного средства in vivo проводили на экспериментальной модели перевиваемого лимфолейкоза мышей Р388. Лимфолейкоз Р388 прививали мышам линии DBA/2 внутрибрюшинно (экспериментальная асцитная модель) или подкожно (экспериментальная солидная модель) суспензией клеток, полученных из асцита, в прививочной дозе 106 клеток на особь. При исследования противоопухолевой активности полимерной формы этопозида использовали три способа введения препарата - внутрибрюшинный, внутривенный и подкожный. При исследовании противоопухолевой активности полимерной формы этопозида на экспериментальной асцитной модели препараты вводили, используя два способа введения - подкожный и внутрибрюшинный. При исследовании противоопухолевой активности полимерной формы этопозида на экспериментальной солидной модели препараты вводили, используя два способа введения - внутрибрюшинный и внутривенный. Для определения противоопухолевой активности препаратов проводили оценку степени торможения роста опухоли по размеру (объему) опухолей и оценку увеличения продолжительности жизни животных в сутках по сравнению с соответствующими контрольными группами. В качестве препарата сравнения использовался препарат Этопозид, производства «Эбеве Фарма Гес.м.б.Х. Нфг. КГ» (Австрия). Подробное описание схемы исследования приведено в примере 3.
При анализе результатов исследования противоопухолевой активности полимерной формы этопозида на экспериментальной асцитной модели лимфолейкоза мышей Р388 обнаружено, что полимерная форма этопозида в дозе 15 мг/кг проявляла значительную противоопухолевую активность, сравнимую с активностью препарата сравнения этопозидом.
Для исследования токсических свойств полимерной формы этопозида избраны внутривенный и внутрибрюшинный пути введения экспериментальным животным. Были определены летальные дозы полимерной формы этопозида в сравнении с препаратом сравнения этопозидом, производства «Эбеве Фарма Гес.м.б.Х. Нфг.КГ» (Австрия). При выборе доз для испытания острого токсического действия при однократном введении полимерной формы этопозида руководствовались литературными данными о токсичности субстанции этопозида [22, 23], а также сведениями базы данных (RTECS - «Реестр токсических воздействий химических веществ», RTECS No: KC0190000, http://www.ccohs.ca/products/rtecs/).
Исследование острого токсического действия проводили на мышах линии BALB/c обоего пола при двух способах введения (в/в и в/б) в 4-х дозах. Для испытания сравниваемых препаратов было сформировано по 8 опытных групп мышей для каждого способа введения (в/в и в/б) из расчета по две однополые группы (6 самок/6 самцов) на каждую дозу и по 2 группы контроля - контроль 1 с введением стерильной воды для инъекций и контроль 2 интактный (6 самок/6 самцов). Всего 20 групп животных для каждого способа введения. Определение диапазона летальных доз полимерной формы этопозида проводили путем токсикометрического анализа выживаемости животных после однократного внутривенного/внутрибрюшинного введения с последующим 30-дневным наблюдением. Проводили подсчет летальности, время гибели животных, наблюдение общего состояния, поведения и картины интоксикации, оценку изменения массы тела животных (перед испытаниями - день 0 и на 2, 7, 14, 21, 30 дни от момента введения препаратов), патоморфологические исследования (некропсия). Изучение отсроченной токсичности проводилось в течение 30 дней (после однократного введения полимерных форм этопозида) с характеристикой смертности, наблюдениями за общим состоянием и оценкой изменения массы тела животных. Данные испытания острого токсического действия полимерной формы этопозида на мышах линии BALB/c при в/в и в/б введении позволили рассчитать значения среднесмертельных доз. Для полимерной формы этопозида значение среднесмертельной дозы на мышах линии BALB/c при в/в введении составило - ЛД50=129.6 мг/кг (не зависимо от пола животных), а для препарата сравнения этопозида значение среднесмертельной дозы на мышах линии BALB/c составило - ЛД50=70.0 мг/кг (не зависимо от пола животных). Для полимерной формы этопозида значение среднесмертельной дозы на мышах линии BALB/c при в/б введении составило - ЛД50=172.7 мг/кг (не зависимо от пола животных), а для препарата сравнения этопозида значение среднесмертельной дозы на мышах линии BALB/c составило - ЛД50=79.6 мг/кг (не зависимо от пола животных). Сравнение значения LD50 полимерной формы этопозида и препарата сравнения указывает на существенно меньшее острое токсическое действие разработанного препарата, чем токсическое действие препарата сравнения при внутривенном и внутрибрюшинном введении. Подробное описание схемы эксперимента представлено в примере 4.
Изучение токсического действия полимерной формы этопозида при курсовом введении при в/в способе введения проводили на мышах линии BALB/c в разовой дозе 20 мг/кг в пересчете на действующее вещество этопозид (группы №1 и 2); в такой же дозе испытывался препарат сравнения этопозид (группы №3 и 4). Курс введения составил 5 дней. Суммарная доза составила 100 мг/кг. Препараты вводили внутривенно в боковую хвостовую вену мыши, максимальный объем однократного введения не превышал 0,5 мл. Изучение токсического действия полимерной формы этопозида при курсовом введении при внутрибрюшинном способе введения проводили в разовой дозе 25 мг/кг в пересчете на действующее вещество этопозид (группы №1 и 2); в такой же дозе испытывался препарат сравнения этопозид (группы №3 и 4). Курс введения составил 5 дней. Суммарная доза составила 125 мг/кг. Препараты вводили внутрибрюшинно в предпаховую область мыши, максимальный объем однократного введения 1,0 мл. Определяли летальность и время гибели животных, проводили ежедневное наблюдение общего состояния, поведения и картины интоксикации у животных в процессе и после окончания курса введения (общий срок наблюдений от начала введения препаратов составил 30 дней), проводили оценку изменения массы тела животных (перед испытаниями - день 0 и на 2, 5, 14, 21, 30 дни от начала введения препаратов), проводили гематологические исследования (определение уровня лейкоцитов перед испытаниями - день 0 и на 3, 5, 30 дни от начала введения препаратов). При изучении токсического действия полимерной формы этопозида при 5-дневном курсовом в/в и в/б введении летальных исходов не отмечено на протяжении всего курса введений, а также на протяжении последующих 30-ти дней наблюдения. Животные перенесли курсовое введение полимерной формы этопозида по оценке общего состояния и поведения животных удовлетворительно. Согласно данным клинического использования этопозида наиболее серьезным побочным токсическим эффектом, ограничивающим дозу применения препарата, является лейкопения [24, 25], в связи с чем проведен сравнительный анализ влияния курсового в/в и в/б ведения полимерной формы этопозида и препарата сравнения на уровень лейкоцитов в крови животных. Анализ изменения уровня лейкоцитов показывает обратимое снижение показателя на начальном периоде курса введения (3-5 дни), особенно выраженное в группе препарата сравнения. Токсические эффекты, имевшие место в период курсового введения препаратов (угнетение поведенческой активности, снижения динамики роста массы тела, лейкопения), носили обратимый характер и исчезали вскоре после отмены инъекций. В целом, побочные токсические проявления (угнетение поведенческой активности, снижения динамики роста массы тела, лейкопения), сопровождавшие курсовое введение полимерной формы этопозида были существенно менее выражены, чем при действии препарата сравнения этопозида.
Таким образом, результаты сравнительного анализа показателей острой токсичности при однократном введении и показателей переносимости при курсовом введении, свидетельствуют о том, что полимерная форма этопозида менее токсична и лучше переносится по сравнению с препаратом сравнения этопозидом.
Заявленное изобретение иллюстрируется нижеследующими примерами.
Пример 1. Получение полимерных частиц с включенным в них этопозидом методом простых эмульсий
Получение композиции на основе полимера PLGA 50/50 (№-4).
В стеклянном флаконе взвешивали субстанцию этопозида в количестве 29.5÷47.3 мг. (5.0÷8.0%, мас. от загруженных сухих веществ). Добавляли 324.9÷360.4 мг (55.0÷61.0%, мас.) полимера PLGA 50/50. Пипеточным дозатором загружали 5.0 мл (6.7 г) метилена хлористого (дихлорметана), закрывали флакон крышкой и перемешивали на магнитной мешалке при 500 об/мин в течение 10 мин. Флакон помещали в подогретую до 40÷45°C баню с водой и продолжали перемешивание суспензии еще 10÷15 мин, после чего раствор охлаждали до комнатной температуры. В сосуде взвешивали 18.9÷21.3 г (16.0÷18.0%, мас.) 0.5% раствора ПВС в деионизированной воде. Опускали в сосуд магнит для перемешивания и пос