Фармацевтические композиции спиро-оксиндольного соединения для местного введения и их применение в качестве терапевтических агентов
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтике. Описана фармацевтическая композиция для местного введения, содержащая терапевтически эффективное количество спиро-оксиндольного соединения, имеющего следующую формулу:
В композиции спиро-оксиндольное соединение присутствует в концентрации от 1% вес./вес. до 8% вес./вес. Композиция содержит растворитель (PEG 400 или PEG 3350), агент, улучшающий проникновение (Transcutol® Р, или олеиновый спирт, или изопропилмиристат), загуститель (стеариловый спирт), мазевую основу (PEG 400 или PEG 3350) и антиоксидант (бутилированный гидрокситолуол). Описан способ лечения, предотвращения или улучшения заболевания или состояния, опосредованного натриевыми каналами, включающий введение указанной выше композиции. Также описан способ лечения боли за счет ингибирования ионного тока через потенциалзависимые натриевые каналы. Группа изобретений обеспечивает расширение ассортимента композиций для местного введения. 3 н. и 9 з.п. ф-лы, 5 ил., 4 пр., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической композиции для местного введения млекопитающему, предпочтительно человеку, содержащей один или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, которое является блокатором натриевых каналов, предпочтительно антагонистом нейрональных потенциалзависимых натриевых каналов. В частности, настоящее изобретение относится к фармацевтическим композициям для лечения заболеваний или состояний, таких как боль, предпочтительно постгерпетическая невралгия (PHN), остеоартрит и постоянная постоперационная боль, которая облегчается ингибированием натриевых каналов, предпочтительно нейрональных потенциалзависимых натриевых каналов. Однако другие неврологические заболевания, не связанные с болью, можно лечить аналогичным образом как часть настоящего изобретения, например, облегчение симптомов миотонии и множественного склероза.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Заболевания и состояния, которые облегчаются ингибированием (или "блокированием") натриевых каналов, в частности нейрональных потенциалзависимых натриевых каналов, включают острую и хроническую боль, в частности невропатическую и воспалительную боль. Постоянная (хроническая) невропатическая боль наблюдается при широком диапазоне клинических состояний, включая постгерпетическую невралгию (PHN), невралгию тройничного нерва, болезненную диабетическую невропатию (PDN), боль в нижнем отделе спины, постоперационную боль, боль, связанную с химиотерапией и ВИЧ инфекцией. Оценка распространенности хронической невропатической боли сильно различается в зависимости от географического региона в диапазоне от приблизительно 11% популяции США до оценки, что 20% всех взрослых европейцев страдают от умеренной - сильной хронической боли (смотри, например, Hall, G.C. et al., "Primary Care Incidence and Treatment of Four Neuropathic Pain Conditions: A Descriptive Study, 2002-2005," BMC Fam. Pract. (2008); Vol. 9, No. 26; и Hardt, J. et al., "Prevalence of Chronic Pain in a Representative Sample in the United States," Pain Medicine (2008), Vol. 9, No. 7, pp. 803-812). В США считают, что наиболее распространенным заболеваниям с хронической невропатической болью, PHN и PDN, подвергаются 1 миллион и 3 миллиона человек, соответственно (смотри, например, Dworkin, R.H. et al., "Advances in Neuropathic Pain Diagnosis, Mechanism, and Treatment Recommendations," Arch. Neurol. (2003), Vol. 60, pp. 1524- 534).
Большое количество фармакологических агентов доступно для лечения невропатической боли, включая трициклические антидепрессанты, ингибиторы обратного захвата норадреналина и серотонина, антиконвульсанты (например, габапентин и прегабалин), анестезирующие средства местного действия и опиоиды (например, морфин). Однако данные способы лечения обеспечивают недостаточной эффективностью и/или обладают неприемлемыми побочными эффектами при постоянном применении, с достаточным облегчением невропатической боли, сообщенным только для приблизительно 50% пациентов (смотри, например, Moulin, D.E., "The Clinical Management of Neuropathic Pain," Pain Res. Manag. (2006), Vol. 11 (Supplement A), pp. 30A-36A). Часто, мультилекарственная терапия с применением трициклических антидепрессантов, антиконвульсантов и анестезирующих средств местного действия является необходимой для облегчения невропатической боли.
Lidoderm® пластырь (5% лидокаин) относится к классу локальных и местных анестезирующих лекарственных препаратов и одобрен для лечения PHN. Однако, тогда как лидокаин может обладать местным эффектом, он поглощается системно и должен применяться с особыми мерами предосторожности при местном введении, поскольку нанесение на большую поверхность может приводить к тяжелой общей токсичности и смерти.
Voltaren® (гель диклофенала натрия) представляет собой нестероидный противовоспалительный агент (NSAID) в виде состава для местного применения. Он представляет собой имеющийся на рынке способ лечения пациентов с остеоартритом. Тогда как риск гастроинтестинальных побочных эффектов для NSAID местного применения является меньшим, чем риск для NSAID перорального применения, данные серьезные побочные эффекты остаются проблемой для местного применения диклофенака. Более того, недавно сообщалось о значительном увеличение количеств ферментов печени у некоторых пациентов при длительном применении диклофенака, делая необходимым регулярное наблюдение на гепатотоксичность у данной популяции пациентов (смотри, FDA website, MedWatch, 2009; Volteren Gel (diclofenac sodium) 1% topical gel; Safety Labeling Changes Approved by FDA Center for Drug Evaluation and Research -- September 2009).
Хорошо известно, что нейрональные потенциалзависимые натриевые каналы (Nav) модулируют передачу болевых сигналов. Например, мутация с потерей функции Nav1.7, который экспрессируется в основном в сенсорных нейронах периферической нервной системы и дезрегулируется или повреждением нерва и воспалением, вызывает состояние у человека, известное как врожденная нечувствительность к боли, которое характеризуется неспособностью чувствовать боль (смотри, например, Goldberg, Y.P. et al., Clin. Genet. (2007), Vol. 71, No. 4, pp. 311-119). Лидокаин и другие местные анастетики действуют в основном ингибированием Nav.
PCT опубликованная патентная заявка No. WO 06/110917 относится к спиро-оксиндольным соединениям, которые описываются в качестве пригодных в качестве блокаторов натриевых каналов. Данные соединения, в частности, ингибируют поток ионов натрия через натриевые каналы. Как таковые, данные соединения рассматриваются в качестве блокаторов натриевых каналов и, следовательно, являются пригодными для лечения заболеваний и состояний у млекопитающих, предпочтительно людей, которые являются результатом нарушенной биологической активности потенциалзависимых натриевых каналов или которые могут облегчаться регулированием биологической активности натриевых каналов.
Следовательно, существует необходимость в местной фармацевтической композиции, содержащей соединение, которое является блокатором натриевых каналов, предпочтительно антагонистом нейрональных потенциалзависимых натриевых каналов, для лечения боли, обладающей минимальным системным воздействием соединения и которая является косметически и фармацевтически приемлемой для продолжительного применения соединения на коже (т.е., нераздражающей, не вызывающей жжения и неаллергенной).
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим композициям, содержащим одно или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения или его фармацевтически приемлемой соли. В частности, настоящее изобретение относится к фармацевтическим композициям, содержащим одно или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, которое является блокатором натриевых каналов. Данные фармацевтические композиции являются пригодными для лечения и/или предотвращения заболеваний или состояний, опосредованных натриевыми каналами, и являются вводимыми местно нуждающемуся в лечении млекопитающему, предпочтительно человеку, с минимальным системным воздействием спиро-оксиндольного соединения.
Соответственно, в одном аспекте, настоящее изобретение относится к фармацевтической композиции для местного введения млекопитающему, в котором фармацевтическая композиция содержит один или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, имеющего следующую формулу:
в виде энантиомера, рацемата или нерацемической смеси энантиомеров или его фармацевтически приемлемой соли.
В другом аспекте, настоящее изобретение относится к способу лечения боли у млекопитающего, предпочтительно человека, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения или уменьшения тяжести заболевания, состояния или расстройства, когда активация или гиперактивация одного или более из нейрональных потенциалзависимых натриевых каналов, выбранных из NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8 или NaV1.9 вовлечена в заболевание, состояние или расстройство, в которых способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, в котором заболевания или состояния выбраны из, но не ограничиваются, боли, связанной с ВИЧ, невропатии, вызванной лечением ВИЧ, невралгии тройничного нерва, постгерпетической невралгии (PHN), семейной эритромелалгии, первичной эритромелалгии, семейной ректальной боли, эудинии, теплочувствительности, боли, связанной с множественным склерозом (РС), бокового амиотрофического склероза (ALS), болезненной диабетической нейропатии, периферической невропатии, артрита, ревматоидного артрита, остеоартрита, тендинита, бурсита, опорно-двигательных вывихов, тендовагинита, хондромаляции надколенника, миозита, миотонии (включая, но не ограничиваясь SCN4A-связанную миотонию), парамиотонии, рабдомиолиза, пароксизмальной дистонии, миастенических синдромов, злокачественной гипертермии, заболеваний, связанных с токсином натриевых каналов, боли, связанной с раком, синдрома беспокойных ног, фибромиалгии и нейродегенеративных заболеваний, а также других неврологических расстройств, включая множественный склероз, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, в котором заболевания или состояния выбраны из, но не ограничиваются, нейропротекции в ишемических условия, вызванных инсультом или травмой нервов, нейродегенеративного заболевания, а также других неврологических заболеваний, включая множественный склероз, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, в котором заболевания или состояния выбраны из, но не ограничиваются, зуда, дерматита, контактного дерматита, аллергического дерматита, экземы, угревой сыпи и воспалительных заболеваний кожи, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, за счет ингибирования тока ионов через потенциалзависимый натриевый канал у млекопитающего, предпочтительно нейрональный потенциалзависимый натриевый канал, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
Дополнительным аспектом настоящего изобретения является способ получения фармацевтической композиции настоящего изобретения.
Конкретные варианты осуществления данных аспектов настоящего изобретения описывают более подробно ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи образуют часть настоящего описания, и они включены для дополнительного описания определенных аспектов настоящего изобретения. Настоящее изобретение можно лучше понять со ссылкой на один или более из данных чертежей в комбинации с подробным описанием конкретных вариантов осуществления, представленных в настоящем изобретении.
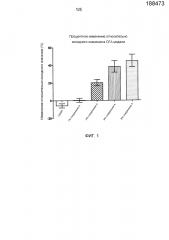
Фигура 1 представляет собой график, показывающий среднее процентное изменение относительно исходного значения (CFB) для каждой группы с определенной дозой, описанной в исследованиях с хронической воспалительной болью, вызванной CFA, примера 1. Данные выражены в виде среднее ± SD изменение относительно исходных величин.
Фигура 2 представляет собой график, показывающий средний порог отдергивания лапы, выраженный в виде процентного изменения относительно исходной величины (CFB) для каждой обрабатываемой группы, описанной в исследовании с моделью невропатической боли в примере 2. Данные построены в виде среднее ± SEM.
Фигура 3 представляет собой график, показывающий изменение при воздействии нити фон Фрея через 30 минут после введения дозы относительно исходной величины (CFB) для обработанной лапы в исследовании с диабетической невропатией в примере 4.
Фигура 4 представляет собой график, показывающий среднее процентное изменение относительно исходного значения (CFB) для каждой группы с введением дозы, описанной в CCI модели для невропатической боли в примере 5. Данные выражены в виде среднее ± SD изменение относительно исходных величин.
Фигура 5 представляет собой график, показывающий средние концентрации в плазме соединения A для каждой обработанной группы, описанной в исследовании с CCI моделью в примере 5.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Если не определено другим образом в настоящем описании, следующие термины и фразы должны иметь следующие значения:
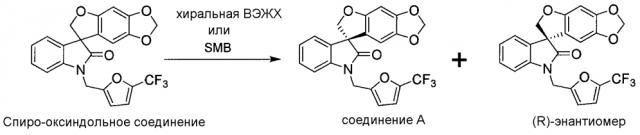
"Спиро-оксиндольное соединение" относится к соединению, имеющему следующую формулу:
или его фармацевтически приемлемой соли. Данное соединение описано в PCT опубликованной патентной заявке No. WO 06/110917, которая вводится полностью в настоящее изобретение с помощью ссылки. Спиро-оксиндольное соединение может существовать в виде одного энантиомера, рацемата или нерацемической смеси энантиомеров. Один из энантиомеров спиро-оксиндольного соединения имеет следующую формулу:
и назван в настоящем изобретении (S)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-оном. Данный энантиомер также обозначают в настоящем изобретении как "соединение A". Предполагается, что применение идентификатора "соединение A" включает энантиомер в виде свободного основания или в виде фармацевтически приемлемой соли.
Термин "приблизительно", когда его помещают перед числовой величиной "X" в настоящем изобретении, относится к интервалу, в диапазоне от X минус 10% X до X плюс 10% X и предпочтительно к интервалу, в диапазоне от X минус 5% X до X плюс 5% X.
Выражение "% вес./вес." относится к процентам по весу относительно суммарного веса рассматриваемой композиции.
Выражение "% вес./об." относится к весу растворенного вещества в указанном объеме растворителя. Например, 50% вес./об. PEG представляет собой 50 грамм PEG в 100 мл растворителя.
"Клатраты" относится к веществам с координированными газами, жидкостями или соединениями в качестве комплексов включения так, что комплекс можно транспортировать в твердой форме, и включенный компонент (или молекулу "гость") впоследствии высвобождают действием растворителя или плавлением. Термин "клатрат" можно применять взаимозаменяемо с фразой "молекула включения" или с фразой "комплекс включения". Клатраты, предусмотренные для применения в настоящем изобретении, можно получить из циклодекстринов. Циклодекстрины являются широко известными в качестве обладающих способностью образовывать клатраты (т.е., соединения включения) с различными молекулами. Смотри, например, Inclusion Compounds, edited by J.L. Atwood, J.E.D. Davies, and D.D. MacNicol, London, Orlando, Academic Press, 1984; Goldberg, I., "The Significance of Molecular Type, Shape and Complementarity in Clathrate Inclusion", Topics in Current Chemistry (1988), Vol. 149, pp. 2-44; Weber, E. et al, "Functional Group Assisted Clathrate Formation - Scissor-Like and Roof-Shaped Host Molecules", Topics in Current Chemistry (1988), Vol. 149, pp. 45-135; и MacNicol, D.D. et al., "Clathrates and Molecular Inclusion Phenomena", Chemical Society Reviews (1978), Vol. 7, No. 1, pp. 65-87. Известно, что превращение в циклодекстриновые клатраты увеличивает стабильность и растворимость определенных веществ, посредством этого облегчая их применение в качестве фармацевтических агентов. Смотри, например, Saenger, W., "Cyclodextrin Inclusion Compounds in Research and Industry", Angew. Chem. Int. Ed. Engl. (1980), Vol. 19, pp. 344-362; патент США No. 4886788 (Schering AG); патент США No. 6355627 (Takasago); патент США No. 6288119 (Ono Pharmaceuticals); патент США No. 614969 (Ono Pharmaceuticals); патент США No. 6235780 (Ono Pharmaceuticals); патент США No. 6262293 (Ono Pharmaceuticals); патент США No. 6225347 (Ono Pharmaceuticals); и патент США No. 4935446 (Ono Pharmaceuticals).
"Млекопитающее" включает людей и ручных животных, таких как лабораторные животные и домашних животных (например, кошек, собак, свиней, рогатый скот, овец, коз, лошадей и кроликов), и недомашних животных, таких как дикие и подобные.
"Фармацевтически приемлемое вспомогательное вещество" или "вспомогательное вещество" включает без ограничения любое неактивное вещество, которое смешивают со спиро-оксиндольным соединением настоящего изобретения для того, чтобы получить лекарственную форму для местного введения. Предполагается, что термин "фармацевтически приемлемое вспомогательное вещество" включает, но не ограничивается, любые растворители, агенты, улучшающие проникновение, антиоксиданты, агенты, увеличивающие густоту (т.е., загустители), мазевые основы, защитные агенты, адсорбенты, демульсенты, смягчающие средства, консерванты, увлажнители, буферы, вспомогательные вещества, усилители биодоступности, носители, вещества, способствующие скольжению, подсластители, разбавители, красители, усилители вкуса, вещества, увеличивающие растворимость (включая поверхностно-активные вещества), увлажнители, диспергаторы, суспендирующие агенты, стабилизаторы и изотонические агенты, которые одобрены контрольным органом, таким как, например, но не ограничиваясь, управление по контролю качества пищевых продуктов и лекарственных средств США, европейское агентство по лекарственным средствам и министерство здравоохранения Канады, в качестве приемлемых для применения в составах для местного введения фармакологически активного ингредиента и/или считающиеся общепризнанными в качестве безопасных веществ (GRAS вещества), и/или они перечислены в указатели неактивных ингредиентов, опубликованном управлением по контролю качества пищевых продуктов и лекарственных средств США. "Фармацевтически приемлемое вспомогательное вещество" также может включать приемлемые вспомогательные вещества, перечисленные в Remington: The Science and Practice of Pharmacy, Fox, 21st ed. 2005. Примеры фармацевтически приемлемых вспомогательных веществ включают, но не ограничиваются, следующие:
аскорбиновая кислота и эфиры;
бензиловый спирт;
бензилбензоат;
бутилированный гидрокситолуол ("BHT");
бутилированный гидроксианизол ("BHA");
каприловый/каприновый триглицерид;
цетиловый спирт;
хелатообразующие агенты (например, EDTA и лимонная кислота);
холестерин;
полимеры на основе поперечно-сшитой акриловой кислоты (например, Carbopol®);
децилметилсульфоксид;
диэтилсебакат;
диметиламин ("DMA");
диметикон;
диметилсульфоксид;
моноэфир диэтиленгликоля (например, Transcutol® P);
диизопропиладипат (например, Ceraphyl® 230);
этанол;
флавоноид;
глютатион;
глицерин;
глицерололеат/пропиленгликоль (например, Arlacel 186);
глицеролмоноолеат;
глицерилкаприлат/капрат и PEG-8 (полиэтиленгликоль)
каприлат/капратный комплекс;
каприлокапроилмакроголглицериды (например, Labrasol®);
глицерилмонокаприлат (например, Capmul® MCM C8);
глицерилмонолинолеат (например, Maisine™ 35-1);
глицерилмоноолеат (например, Peceol™);
глицерилмоностеарат;
гексиленгликоль;
гидроксипропил-β-циклодекстрин (ΗΡ-β-CD);
изопропиловый спирт;
изопропилмиристат;
лаурокапрам; (например, Azone®);
лауролилмакрогол-32 глицериды (например, Gelucire® 44/14);
макрогол-15 гидроксистеарат (например, Solutol® HS15);
триглицериды средней длины (например, Miglyol® 810, Miglyol® 840 или Miglyol® 812);
метиллаурат;
N-метил-2-пирролидон (например, Pharmasolve®);
минеральное масло;
монодиглицериды (например, Capmul® MCM);
октилдодеканол;
олеиновая кислота;
олеиновый спирт;
арахисовое масло;
1,2-пентандиол;
полисорбаты (например, Tween® 80);
полиэтиленгликоль (например, PEG-8, PEG 400, PEG1000, PEG 3350, PEG 6000 или Lutrol® E 400);
полиоксил 35 касторовое масло (например, Cremophor® EL);
полиоксил 40 гидрогенизированное касторовое масло (например, Cremophor® RH 40);
пропиленгликоль;
пропиленгликольдиацетат;
пропиленгликольмонокаприлат (например, Capmul PG-8, Capryol 90);
пропиленгликольмонолаурат (например, Capmul PG-12);
пропиленгликольмоноолеат;
2-пирролидон;
соевое масло;
стеариловый спирт;
сульфобутилэфир-β-циклодекстрин (например, Capitsol®);
токоферолы (например, ацетат витамина E);
α-токоферолполиэтиленгликольсукцинат (TPGS);
вода; и
медицинский вазелин.
Дополнительные фармацевтически приемлемые вспомогательные вещества описывают в настоящем изобретении.
"Растворители" относятся к веществам, которые легко растворяют другие вещества, такие как спиро-оксиндольное соединение настоящего изобретения, для того, чтобы образовать раствор. Подходящие растворители для целей настоящего изобретения включают полиэтиленгликоль (например, PEG 400, PEG 100 и PEG 3350), диэтиленгликольмоноэтиловый эфир (например, Transcutol®), Tween 80, спирты (например, олеиновый спирт и стеариновый спирт), Labrasol®, каприловый/каприновый триглицерид, эфиры жирных кислот (например, изопропилмиристат и диизопропиладипат (например, Ceraphyl® 230)), диэтилсебакат, пропиленгликольмонокаприлат (например, Capmul® PG-8), пропиленгликольлаурат (например, Capmul® PG-12), монодиглицериды (например, Capmul® MCM), глицерилмонокаприлат (например, Capmul® MCM C8), триглицериды со средней длинной цепи, гексиленгликоль, глицерилмоноолеат (например, Peceol™), 1,2-пентандиол, октилдодеканол, глицерилмонолинолеат (например, Maisine™ 35-1), изопропиловый спирт, глицерололеат/пропиленгликоль (например, Arlacel® 186), минеральное масло, воду и глицерин.
"Агенты, улучшающие проникновение" относятся к веществам, которые увеличивают проницаемость кожи или слизистой оболочки для фармакологически активного ингредиента, предпочтительно спиро-оксиндольного соединения настоящего изобретения, для того, чтобы увеличить скорость, с которой активный ингредиент проникает через кожу или слизистую оболочку млекопитающего, предпочтительно человека. Подходящие агенты, улучшающие проникновение, для целей настоящего изобретения включают, но не ограничиваются, диметилсульфоксид (DMSO), децилметилсульфоксид, лаурокапрам (например, Azone®), пирролидоны (например, 2-пирролидон и N-метил-2-пирролидон (Pharmasolve®)), поверхностно-активные вещества, спирты (например, олеиновый спирт), олеиновую кислоту, полиэтиленгликоль (например, PEG 400), диэтиленгликольмоноэтиловый эфир (например, Transcutol®) и эфиры жирных кислот (например, изопропилмиристат, метиллаурат, глицеролмоноолеат и пропиленгликольмоноолеат). Агент, улучшающий проникновение, можно применять независимо, или более чем один агент можно применять в фармацевтической композиции настоящего изобретения.
"Мазевые основы" относится к веществам, которые действует в качестве носителя и усиливают проникновение в кожу для того, чтобы доставить фармакологически активный ингредиент, предпочтительно спиро-оксиндольное соединение настоящего изобретения, в область, которую подвергают лечению, млекопитающего, предпочтительно человека. Подходящие "мазевые основы" для целей настоящего изобретения включают, но не ограничиваются, полиэтиленгликоли (например, PEG 400 и PEG 3350). Мазевую основу можно применять независимо, или более чем одну мазевую основу можно применять в фармацевтической композиции настоящего изобретения.
"Загуститель" относится к веществам, которые увеличивают вязкость и/или физическую стабильность фармацевтической композиции настоящего изобретения. Подходящие "загустители" для целей настоящего изобретения включают, но не ограничиваются, стеариловый спирт, карбополы, диметикон и полимеры. Загуститель можно применять независимо, или более чем один загуститель можно применять в фармацевтической композиции настоящего изобретения.
"Антиоксиданты" относится к веществам, которые способны предотвращать окисление другой молекулы. Подходящие "антиоксиданты" для целей настоящего изобретения включают, но не ограничиваются, бутилированный гидрокситолуол (BHT), бутилированный гидроксианизол (BHA), токоферолы (например, ацетат витамина E), флавоноид, глютатион, аскорбиновую кислоту и ее эфиры, DMSO и хелатообразующие агенты (например, EDTA и лимонная кислота).
"Фармацевтически приемлемая соль" включает и соли присоединения кислоты и соли присоединения основания.
"Фармацевтически приемлемая соль присоединения кислоты" относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными, и которые образуются с неорганическими кислотами, такими как, но не ограничиваясь, хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобными, и органическими кислотами, такими как, но не ограничиваясь, уксусная кислота, 2,2-дихлоруксусной кислоты, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфокислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфокислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламиновая кислоты, додецилсерная кислота, этан-1,2-дисульфокислота, этансульфоновая кислота, 2-гидроксиэтансульфокислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксо-глутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислоты, изомасляная кислота, молочная кислота, лактобионовая кислоты, лауриловая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфокислота, муциновая кислота, нафталин-1,5-дикислота, нафталин-2-сульфокислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглютаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфокислота, трифторуксусная кислота, ундециленовая кислота и подобные.
"Фармацевтически приемлемая соль присоединения основания" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Данные соли получают добавлением неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, но ими не ограничиваются, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и подобных. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничиваются, соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклических аминов и основных ионообменных смол, такие как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламина, лизин, аргинин, гистидин, кофеин, прокаин, гадрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и подобные. Особенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
"Фармацевтическая композиция" относится к составу спиро-оксиндольного соединения настоящего изобретения и среде, обычно принятой в данной области техники, для местного введения спиро-оксиндольного соединения млекопитающим, например, людям. Данная среда включает все фармацевтически приемлемые вспомогательные вещества. Для целей настоящего описания, фраза "фармацевтическая композиция" является взаимозаменяемой с фразой "фармацевтический состав".
"Заболевание или состояние, опосредованное натриевыми каналами" относится к заболеванию или состоянию, которое улучшается или облегчается регулированием натриевых каналов и включает, но не ограничивается, боль или постгерпетическую невралгию. Дополнительные примеры заболеваний или состояний, опосредованных натриевыми каналами, описаны ниже.
"Терапевтически эффективное количество" относится к такому количеству спиро-оксиндольного соединения настоящего изобретения или фармацевтической композиции настоящего изобретения, которое при введении млекопитающему, предпочтительно человеку, является достаточным для осуществления лечения, как определено ниже, указанного заболевания или состояния у млекопитающего, предпочтительно человека. Количество спиро-оксиндольного соединения или фармацевтической композиции, которое образует "терапевтически эффективное количество" будет изменяться в зависимости от спиро-оксиндольного соединения, фармацевтической композиции, характера заболевания или состояния и его тяжести, других условий (например, возраста, веса, общего состояния здоровья), воздействующих на здоровье млекопитающего, которого подвергают лечению, и способа введения, а также от эффективности, биодоступности и in vivo времени полувыведения компонентов применяемой фармацевтической композиции, но специалист в данной области техники может определить его обычным способом, принимая во внимание его собственные знания и данное описание.
"Лечить" или "лечение", как применяют в настоящем изобретении, включает лечение соответствующего заболевания или состояния у млекопитающего, предпочтительно человека, страдающего от соответствующего заболевания или состояния, и включает:
(i) предотвращение возникновения заболевания или состояния у млекопитающего, в частности, когда данное млекопитающее предрасположено к состоянию, но ему еще не поставлен диагноз данного заболевания;
(ii) ингибирование заболевания или состояния, т.е., остановка его развития;
(iii) облегчение заболевания или состояния, т.е., вызов регрессии заболевания или состояния; или
(iv) облечение симптомов, являющихся результатом заболевания или состояния.
Как применяют в настоящем изобретении, термины "заболевание" и "состояние" можно применять взаимозаменяемо, или они могут различаться в том, что конкретное заболевание или состояние может не иметь причинного фактора (так что этиология еще не определена), и оно, следовательно, еще не признано в качестве заболевания, но только как нежелательное состояние или синдром, в котором приблизительно конкретный набор симптомов обнаружен практикующими врачами.
"Анальгезия" относится к отсутствию боли в ответ на стимул, который в нормальных условиях является болевым.
"Аллодиния" относится к состоянию, при котором обычно безвредное раздражение, такое как давление или мягкое прикосновение, ощущается как чрезвычайно болевое.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Среди различных аспектов настоящего изобретения, описанных выше в сущности настоящего изобретения, определенные варианты осуществления являются предпочтительными.
Среди фармацевтических композиций настоящего изобретения, как изложено выше в сущности настоящего изобретения, один вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и одно или более фармацевтически приемлемых вспомогательных веществ, выбранных из приведенного списка фармацевтически приемлемых вспомогательных веществ, как изложено выше в определениях.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и одного или более фармацевтически приемлемых вспомогательных веществ, в которой фармацевтически приемлемые вспомогательные вещества выбраны из одного или более растворителей, необязательно из одного или более агентов, улучшающих проникновение, необязательно из одного или более загустителей, необязательно из одной или более мазевых основ, и необязательно из одного или более антиоксидантов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и два или более фармацевтически приемлемых вспомогательных веществ, в котором фармацевтически приемлемые вспомогательные вещества выбраны из одного или более растворителей, необязательно из одно или более агентов, улучшающих проникновение, необязательно из одного или более загустителей, необязательно из одной или более мазевых основ, и необязательно из одного или более антиоксидантов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и два или более фармацевтически приемлемых вспомогательных веществ, в которой фармацевтически приемлемые вспомогательные вещества выбраны из одного или более растворителей, необязательно из одного или более агентов, улучшающих проникновение, необязательно из одного или более загустителей, необязательно из одной или более мазевых основ, и необязательно из одного или более антиоксидантов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой одно из фармацевтически приемлемых вспомогательных веществ представляет собой растворитель, выбранный из полиэтиленгликоля, диэтиленгликоля моноэтилового эфира, полисорбатов, спиртов, каприлокапроилмакроголглицеридов, каприлового/капринового триглицерида, эфиров жирных кислот, диэтилсебаката, пропиленгликольмонокаприлата, пропиленгликольлаурата, монодиглицеридов, глицерилмонокаприлата, триглицеридов со средней длинной цепи, гексиленгликоля, глицерилмоноолеата, 1,2-пен