Визуализирующие агенты для фиброзных заболеваний
Иллюстрации
Показать всеИзобретение касается визуализирующих агентов, используемых в неинвазивных способах диагностики фиброзного заболевания, контроля фиброзного заболевания и способа определения эффекта лечения фиброзного заболевания. Способ диагностики включает стадию введения in vivo визуализирующего агента, содержащего ретиноид и детектируемую метку, тестируемому субъекту и контрольному субъекту и стадию сравнения изменения через 5-90 минут после введения интенсивности сигнала и/или распределения сигнала метки, детектируемой у тестируемого субъекта, с изменением через 5-90 минут после введения интенсивности контрольного сигнала и/или распределения контрольного сигнала метки, детектируемой у контрольного субъекта. Способы контроля и определения эффекта лечения включают стадию введения in vivo визуализирующего агента, содержащего ретиноид и детектируемую метку, субъекту и стадию сравнения интенсивности сигнала и/или распределения сигнала метки, детектируемой в первый момент времени у субъекта, с интенсивностью сигнала и/или распределением сигнала метки, детектируемой у указанного субъекта во второй момент времени, который является более поздним, чем первый момент времени. 3 н. и 6 з.п. ф-лы, 14 пр., 16 ил.
Реферат
Настоящая заявка имеет приоритет в соответствии с предварительной патентной заявкой США №61/096,488, поданной 12 сентября 2008 г., и японской патентной заявкой №2009-184806, поданной 7 августа 2009 г., содержание которых включено сюда посредством ссылки во всей своей полноте.
Здесь раскрыты композиции и способы, относящиеся к областям органической химии, фармацевтической химии, биохимии, молекулярной биологии и медицины. В частности, варианты осуществления изобретения, раскрытые здесь, относятся к агентам и способам визуализации клетки и/или части ткани, например, клетки и/или ткани, характеризующихся фиброзом, а также к агентам и способам для определения и/или диагностики фиброзных заболеваний.
Предшествующий уровень техники
Фиброз, или развитие избытка фиброзной соединительной ткани в теле, связан с рядом заболеваний и нарушений, таких как гепатитный фиброз, панкреатический фиброз, рубцы голосовых связок и многочисленные формы рака. Фиброзные заболевания являются группой заболеваний, характеризующихся таким фиброзом, который может встречаться в различных тканях, таки как печень. Например, гепатитный фиброз, который является одним из фиброзных заболеваний, вызывается, например, гепатитными звездчатыми клетками (HSC), активированными в результате заживления ран после повреждения ткани внутри печени вследствие вирусного гепатитного заболевания, вызванного вирусом гепатита В или С, неалкогольного стеатогепатита, диабета, связанного с недостаточностью питания, паразитов, инфекционных заболеваний, таких как туберкулез или сифилис, внутрипеченочной закупорки в связи с сердечным заболеванием, или нарушения в желчном протоке, и т.д., которые в свою очередь чрезмерно продуцируют и секретируют внеклеточный матрикс (ЕСМ), например, множество типов коллагеновых молекул и фибронектина, который откладывается на интерстициальной ткани. Конечная стадия гепатитного фиброза представляет собой гепатитный цирроз, который может вызывать гепатитное повреждение, гепатоклеточную карциному и т.д.
Применяли различные подходы в попытке ингибировать фиброз в органе или ткани. Один подход может ингибировать активацию одной или более звездчатых клеток, где активация таких клеток характеризуется повышенным продуцированном внеклеточного матрикса (ЕСМ). Другие подходы могут относиться к ингибированию продуцирования коллагена, например, способствуя деградации коллагена или контролируя метаболизм коллагена. Однако способа восстановления фиброзной ткани еще не существует, и когда большая часть ткани замещена фиброзной тканью до такой степени, что пораженная ткань не может нормально функционировать, действительно нет других вариантов, кроме трансплантации для восстановления такой ткани. Следовательно, важно обнаружить фиброзное заболевание на ранней стадии и обеспечить противофиброзное лечение.
Диагностирование фиброзных заболеваний обычно проводят биопсией ткани, для которой предполагается фиброз. Однако так как биопсия является высоко инвазивным методом, который может вызывать осложнения, такие как инфекцию, кровоизлияние, боль и повреждение другой ткани, проводятся различные исследования, относящиеся к неинвазивным диагностическим методам фиброзных заболеваний. Например, сообщают о попытке коррелировать аналитические значения диффузионных-взвешенных МР-томограмм с наличием цирроза (Aube et al., J Radiol. 2004; 85(3):301-6), попытке определить наличие цирроза детектированием его характерных признаков, например, морфологических изменений печени путем КТ, МРТ или ультразвукового исследования (Kudo et al., In tervirology. 2008; 51 Suppl 1: 17-26) и о попытке определить наличие цирроза при помощи биохимических индикаторов, таких как гиалуронат и протромбиновый индекс (Oberti et al., Gastroenterology. 1997; 113(5): 1609-16). Однако ни один из таких способов не является удовлетворимым, и необходима разработка дополнительных способов диагностики.
Кроме того, JP, А, 2009-518372 раскрывает синтез ретиноил-ПЭГ(12)-Lys-ОН в качестве диагностического контрастного агента, пригодного для диагностической визуализации фиброза, но не описывает, что это вещество действительно было пригодно в качестве контрастных агентов.
Краткое содержание изобретения Техническая задача
Настоящее изобретение главным образом направлено на обеспечение визуализирующего агента для фиброзных заболеваний, способа визуализации фиброзного заболевания, использующего указанный визуализирующий агент, диагностического агента фиброзного заболевания, содержащего указанный визуализирующий агент, диагностического способа фиброзного заболевания, использующего указанный диагностический агент и т.д.
Решение задачи
При исследовании нового диагностического способа для фиброзных заболеваний авторы обнаружили, что фиброзные заболевания могут обнаруживаться неинвазивно in vivo путем введения визуализирующего агента, который содержит ретиноид и детектируемую метку, достигая цели настоящего изобретения. Хотя известно, что носитель, содержащий витамин А, доставляет лекарства к гепатитным звездчатым клеткам (WO 2006/068232), вовсе не было известно, что фиброзные заболевания могут неинвазивно детектироваться in vivo при помощи визуализирующего агента, который содержит ретиноид и детектируемую метку.
Настоящее изобретение относится к:
(1) Визуализирующий агент для клетки и/или тканей, характеризующихся фиброзом, содержащий ретиноид и детектируемую метку.
(2) Визуализирующий агент (1), где ретиноид содержит ретинол.
(3) Визуализирующий агент (1) или (2), где визуализирующий агент служит для визуализации in vivo.
(4) Визуализирующий агент по любому из (1)-(3), где визуализирующий агент служит для визуализации фиброзного заболевания.
(5) Визуализирующий агент по любому из (1)-(4), содержащий полимерный конъюгат, содержащий по меньшей мере одно повторяющееся звено, выбранное из формул (I), (II), (III) и (IV):
[Схем. 1]
где:
m означает независимо 1 или 2;
n означает независимо 1 или 2;
А1 и А2 каждый независимо означают кислород или NR7;
А3 и А4 каждый независимо означают кислород или NR8;
А5 и А6 каждый независимо означают кислород или NR9;
R1, R2, R3, R4, R5 и R6 каждый независимо выбраны из группы, состоящей из при необходимости замещенного C1-10 алкила, при необходимости замещенного С6-20 арила, аммония, щелочного металла, ретиноида и группы, которая содержит детектируемую метку;
R7, R8 и R9 каждый независимо являются водородом или C1-4 алкилом;
о, р, q и r каждый независимо являются 0, 1 или более, где сумма о, р, q и r означает 2 или более; и
при условии, что по меньшей мере один из R1, R2, R3, R4, R5 и R6 означает группу, которая содержит детектируемую метку, и по меньшей мере один из R1, R2, R3, R4, R5 и R6 означает ретиноид.
(6) Полимерный конъюгат, содержащий по меньшей мере одно повторяющееся звено, выбранное из формул (I), (II), (III) и (IV):
[Схем. 2]
где:
m означает независимо 1 или 2;
n означает независимо 1 или 2;
А1 и А2 каждый независимо означают кислород или NR7;
А3 и А4 каждый независимо означают кислород или NR8;
А5 и А6 каждый независимо означают кислород или NR9;
R1, R2, R3, R4, R5 и R6 каждый независимо выбраны из группы, состоящей из при необходимости замещенного С1-10 алкила, при необходимости замещенного С6-20 арила, аммония, щелочного металла, ретиноида и группы, которая содержит детектируемую метку;
R7, R8 и R9 каждый независимо означают водород или С1-4 алкил;
о, р, q и r каждый независимо означают 0,1 или более, где сумма о, р, q и r означает 2 или более; и
при условии, что по меньшей мере один из R1, R2, R3, R4, R5 и R6 означает группу, которая содержит детектируемую метку, и по меньшей мере один из R1, R2, R3, R4, R5 и R6 означает ретиноид.
(7) Полимерный конъюгат согласно (6), где полимер также содержит по меньшей мере одно повторяющееся звено формулы (V):
[Схем. 3]
где:
s независимо означает 1 или 2;
А7 и А8 каждый независимо означают кислород или NR12;
R12 означает водород или C1-4 алкил;
R10 и R11 каждый независимо выбраны из группы, состоящей из при необходимости замещенного С1-10 алкила, при необходимости замещенного С6-20 арила, аммония и щелочного металла.
(8) Полимерный конъюгат согласно (6) или (7), где полимер также содержит по меньшей мере одно повторяющееся звено формулы (VI):
[Схем. 4]
где R13 означает водород, аммоний или щелочной металл.
(9) Полимерный конъюгат по любому из (6)-(8), где детектируемая метка содержит металл, выбранный из группы, состоящей из Gd(III), иттрия-88 и индия-111.
(10) Полимерный конъюгат по любому из (6)-(9), где детектируемая метка содержит лиганд, выбранный из группы, состоящей из: диэтилентриаминпентауксусная кислота (DTPA), тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA), (1,2-этандиилдинитрило)тетраацетат (EDTA), этилендиамин, 2,2′-бипиридин (bipy), 1,10-фенантролин (phen), 1,2-бис(дифенилфосфино)этан (DPPE), 2,4-пентандион (асас) и этандиоат(ox).
(11) Полимерный конъюгат по любому из (6)-(10), где детектируемая метка содержит лиганд, выбранный из группы, состоящей из: диэтилентриаминпентауксусная кислота (DTPA) и тетраазациклодекан-1,4,7,10-тетрауксусная кислота (DOTA).
(12) Полимерный конъюгат по любому из (6)-(11), где детектируемая метка представляет собой хелат парамагнитного металла.
(13) Полимерный конъюгат согласно (12), где хелат парамагнитного металла содержит
[Схем. 5]
или .
(14) Полимерный конъюгат по любому из (6)-(11), где детектируемая метка представляет собой краситель.
(15) Полимерный конъюгат согласно (14), где краситель содержит Техасский красный.
(16) Полимерный конъюгат по любому из (6)-(15), где m означает 1.
(17) Полимерный конъюгат по любому из (6)-(15), где m означает 2.
(18) Полимерный конъюгат по любому из (6)-(17), где n означает 1.
(19) Полимерный конъюгат по любому из (6)-(17), где n означает 2.
(20) Полимерный конъюгат по любому из пп.(7)-(19), где s означает 1.
(21) Полимерный конъюгат по любому из пп.(7)-(19), где s означает 2.
(22) Способ получения полимерного конъюгата по любому из (6)-(21), предусматривающий растворение или частичное растворение полимерного реагента, содержащего по меньшей мере одно повторяющееся звено формулы (VII) и повторяющееся звено формулы (VIII), в растворителе с образованием растворенного или частично растворенного полимерного реагента;
[Схем. 6]
где:
z означает 1 или 2;
А9 и А10 являются кислородом; и
R14, R15 и R16 каждый независимо выбраны из группы, состоящей из водорода, аммония и щелочного металла; и
реакцию растворенного или частично растворенного полимерного реагента со вторым реагентом, где второй реагент содержит группу, содержащую детектируемую метку или ретиноид; и
добавление третьего реагента, где третий реагент содержит группу, содержащую детектируемую метку, лиганд или ретиноид; при условии, что если второй реагент содержит группу, содержащую детектируемую метку или лиганд, то третий реагент содержит ретиноид, и если второй реагент содержит ретиноид, тогда третий реагент содержит группу, которая содержит детектируемую метку или лиганд.
(23) Способ согласно (22), где второй реагент содержит ретиноид.
(24) Способ согласно (22) или (23), где третий реагент содержит группу, которая содержит детектируемую метку.
(25) Способ согласно (22) или (23), где третий реагент содержит лиганд.
(26) Способ согласно (25), где лиганд выбран из группы, состоящей из: диэтилентриаминпентауксусной кислоты (DTPA), тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA), (1,2-этандиилдинитрило)тетраацетата (EDTA), эти-лендиамина, 2,2′-бипиридина (bipy), 1,10-фенантролина(phen), 1,2-бис(дифенилфосфино)этана (DPPE), 2,4-пентандиона (acac) и этандиоата (ох).
(27) Способ по любому из (22)-(26), также предусматривающий добавление четвертого реагента, где четвертый реагент содержит метал.
(28) Способ согласно (27), где метал выбирают из группы, состоящей из Gd(III), иттрия-88 и индия-111.
(29) Диагностическое средство для фиброзного заболевания, содержащее визуализирующий агент по любому из (1)-(5) и/или полимерный конъюгат по любому из (6)-(21).
(30) Композиция, содержащая визуализирующий агент по любому из (1)-(5) и/или полимерный конъюгат по любому из (6)-(21) и/или диагностическое средство согласно (29), и по меньшей мере один, выбранный из фармацевтически приемлемых наполнителя, носителя и разбавителя.
(31) Способ доставки детектируемой метки к части ткани, предусматривающий контактирование части ткани или клетки с по меньшей мере одним визуализирующим агентом по любому из (1)-(5), и/или полимерным конъюгатом по любому из (6)-(21), и/или диагностическим агентом согласно (29), и/или композицией согласно (30).
(32) Способ визуализации части ткани, предусматривающий контактирование части ткани или клетки с по меньшей мере одним визуализирующим агентом по любому из (1)-(5), и/или полимерным конъюгатом по любому из (6)-(21), или композицией по (30).
(33) Способ диагностирования заболевания или состояния, предусматривающий контактирование части ткани или клетки с по меньшей мере одним полимерным конъюгатом по любому из (6)-(21), и/или диагностическим агентом по (29), и/или композицией по (30).
(34) Способ по любому из (31)-(33), где ткань представляет собой фиброзную ткань.
(35) Способ визуализации фиброзного заболевания, предусматривающий стадию введения эффективного количества визуализирующего агента по любому из (1)-(5), полимерного конъюгата по любому из (6)-(21) и/или композиции (30) субъекту, нуждающемуся в этом, и стадию детектирования метки, содержащейся во введенном визуализирующем агенте, полимерном конъюгате или композиции.
(36) Способ определения фиброзного заболевания, предусматривающий стадию сравнения интенсивности сигнала и/или распределения сигнала метки, детектируемой у субъекта, которому вводили визуализирующий агент по любому из (1)-(5), и/или полимерный конъюгат по любому из (6)-(21), и/или диагностическое средство согласно (29), и/или композицию согласно (30), с интенсивностью контрольного сигнала и/или распределением контрольного сигнала.
(37) Способ контроля фиброзного заболевания, предусматривающий стадию сравнения интенсивности сигнала и/или распределения сигнала, детектируемого в первый момент времени у субъекта, которому вводят визуализирующий агент по любому из (1)-(5), и/или полимерный конъюгат по любому из (6)-(21), и/или диагностическое средство согласно (29), и/или композицию согласно (30), с интенсивностью сигнала и/или распределением сигнала метки, детектируемой во второй момент времени, который является более поздним, чем первый момент времени у указанного субъекта.
Способ определения эффекта лечения фиброзного заболевания, предусматривающий стадию сравнения интенсивности сигнала и/или распределения сигнала метки, детектируемой в первый момент времени у субъекта, которому вводится визуализирующий агент по любому из (1)-(5), и/или полимерный конъюгат по любому из (6)-(21), и/или диагностическое средство согласно (29), и/или композиция согласно (30), с интенсивностью сигнала и/или распределением сигнала метки, детектированной во второй момент времени, который является более поздним, чем первый момент времени для указанного субъекта, где первый момент времени имеет место перед тем, как субъект получит лечение фиброзного заболевания, а второй момент времени имеет место после того, как субъект получил лечение фиброзного заболевания, или, альтернативно, первый момент времени имеет место после того, как субъект получил первое лечение фиброзного заболевания, а второй момент времени имеет место после того субъект получил второе лечение фиброзного заболевания, которое осуществлялось после первого лечения фиброзного заболевания.
Некоторые варианты осуществления изобретения, описанные здесь, относятся к полимерному конъюгату, который может включать по меньшей мере одно повторяющееся звено, выбранное из формул (I), (II), (III) и (IV), как здесь установлено далее.
Другие варианты осуществления изобретения, описанные здесь, относятся к способу доставки детектируемой метки к части ткани или клетке, который может включать контактирование части ткани или клетки с по меньшей мере одним из полимерных конъюгатов, описанных здесь.
Еще одни варианты осуществления, описанные здесь, относятся к способу визуализации части ткани или клетки, который может включать контактирование части ткани или клетки с по меньшей мере одним из полимерных конъюгатов, описанных здесь.
Другие варианты осуществления, описанные здесь, относятся к способу диагностирования заболевания или состояния, такого как болезнь или состояние, характеризующиеся фиброзом, который может включать контактирование части тканей с по меньшей мере одним из полимерных конъюгатов, описанных здесь.
Некоторые варианты осуществления изобретения, описанные здесь, относятся к применению по меньшей мере одного или полимерных конъюгатов, описанных здесь, для доставки детектируемой метки к части ткани или клетке.
Другие варианты осуществления изобретения, описанные здесь, относятся к применению по меньшей мере одного из полимерных конъюгатов, описанных здесь, для визуализации части ткани или клетки.
Еще одни варианты осуществления изобретения, описанные здесь, относятся к применению по меньшей мере одного из полимерных конъюгатов, описанных здесь, для диагностирования заболевания или состояния, таких как болезнь или состояние, характеризующиеся фиброзом.
Некоторые варианты осуществления изобретения, описанные здесь, относятся к полимерному конъюгату, описанному здесь, для доставки детектируемой метки к части ткани или клетке.
Другие варианты осуществления изобретения, описанные здесь, относятся к полимерному конъюгату, описанному здесь, для визуализации части ткани или клетки.
Еще одни варианты осуществления изобретения, описанные здесь, относятся к диагностированию заболевания или состояния, таких как заболевание или состояние, характеризующиеся фиброзом.
Полезный эффект изобретения
Хотя точный механизм визуализирующего агента настоящего изобретения не был полностью объяснен, предполагают, что ретиноид функционирует как направленный (targeting) агент для клеток, положительных по альфа-SMA (гладкомышечный альфа-актин) и продуцирующих ЕСМ (внеклеточный матрикс), таких как активированные звездчатые клетки, и дает возможность детектировать указанные клетки путем доставки к ним метящего вещества.
Так как визуализирующий агент согласно настоящему изобретению позволяет недеструктивно, предпочтительно неинвазивно детектировать фиброзные заболевания in vivo, риск осложнений вследствие традиционной биопсии уменьшается, и, следовательно, можно значительно уменьшить нагрузку на исследуемого субъекта. Дополнительно, поскольку это может расширить диапазон исследуемых субъектов, облегчается раннее обнаружение фиброзных заболеваний, что позволяет эффективно замедлять прогрессирование указанных заболеваний. Таким образом, настоящее изобретение делает значительный вклад в лекарственные препараты для человека и ветеринарные препараты.
Кроме того, визуализирующий агент по настоящему изобретению позволяет недеструктивно, предпочтительно неинвазивно обнаруживать фиброзное заболевание in vivo в течение времени у одного и того же индивидуума, что приводит к оценке лечения указанного заболевания с высокой точностью.
Эти и другие варианты осуществления изобретения описаны более подробно ниже.
Краткое описание чертежей
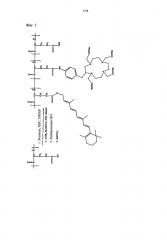
[фиг.1] Фиг.1 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, полиглутамат и тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), ретиноид-PGA-DOTA. [фиг.2] Фиг.2 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, полиглутамат и диэтилентриаминпентауксусная кислоту (DTPA), ретиноид-PGA-DTPA.
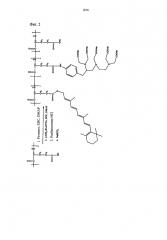
[фиг.3] Фиг.3 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, поли(L-гамма-глутамилглутамин) и тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), ретиноид-PGGA-DOTA.
[фиг.4] Фиг.4 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, поли(L-гамма-глутамилглутамин) и диэтилентриаминпентауксусную кислоту (DTPA), ретиноид-PGGA-DTPA.
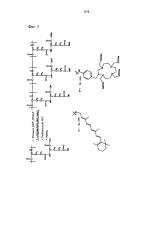
[фиг.5] Фиг.5 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, полиглутамат и тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA)Gd(III), ретиноид-PGA-[DOTA)Gd(III)].
[фиг.6] Фиг.6 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, полиглутамат и диэтилентриаминпентауксусную кислоту (DTPA)Gd(III), ретиноид-PGA-[(DTPA)Gd(III)].
[фиг.7] Фиг.7 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, поли(L-гамма-глутамилглутамин) и тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA)Gd(III), ретиноид-PGGA-[(DOTA)Gd(III)].
[фиг.8] Фиг.8 иллюстрирует реакционную схему получения полимерного конъюгата, который включает ретиноид, поли(L-гамма-глутамилглутамин) и диэтилентриаминпентауксусную кислоту (DTPA)Gd(III), ретиноид-PGGA-[(DTPA)Gd(III)].
[фиг.9] Фиг.9 является графиком, иллюстрирующим поглощение клетками техасского красного(TR)-полиглутамата (РСА)-ретиноида, TR-PGA-ретиноида, по сравнению с техасским красным(TR)-полиглутаматом (РСА)-холестерином, техасским красным-PGA-холестерином.
[фиг.10] Фиг.10 демонстрирует ЯМР-изображения крысиных DMA-моделей с течением времени.
[фиг.11] Фиг.11 является графиком относительной оптической плотности Gd(III) из PGGA-[(DPTA)Gd(III)] и ретиноида-PGGA-[(DPTA)Gd(III)] в печени крысиных DMA-моделей с течением времени. Количество Gd(III) из ретиноида-PGGA-[(DPTA)Gd(III)], обнаруженное в печени крыс, составляло намного больше, чем количество Gd(III) из PGGA-[(DPTA)Gd(III)], обнаруженное в печени фиброзных крысиных DMA-моделей.
[фиг.12] Фиг.12 демонстрирует интенсивность и распределение флуоресцентного сигнала у цирротической мыши (слева) и нормальной мыши (справа) через 5 мин (вверху) и 90 мин (внизу) после введения визуализирующего агента. Интенсивность флуоресцентного сигнала показана как среднее значение излучения (Сред. излуч., фотоны/сек/см2/стерадиан).
[фиг.13] Фиг.13 представляет собой график, показывающий изменение с течением времени интенсивности флуоресцентного сигнала в печени (слева) и кишечнике (справа) цирротической мыши (закрашенные кружочки) и нормальной мыши (закрашенные квадратики) через 5-90 мин после введения визуализирующего агента.
[фиг.14] Фиг.14 демонстрирует локализацию флуоресцентного сигнала в ткани печени цирротической мыши (слева) и нормальной мыши (справа) через 90 мин после введения визуализирующего агента с (верхние группы) или без (нижние группы) VA.
[фиг.15] Фиг.15 является диаграммой, демонстрирующей отношение Су™ 5.5/ФИТС (флуоресцеин изотиоцианат) двойной положительной области к суммарной Су™ 5.5-положительной области в печени цирротической мыши и обычной мыши через 90 мин после введения визуализирующего агента (среднее из 8 случайных полей).
[фиг.16] Фиг.16 является диаграммой, демонстрирующей отношение количества двойных положительных клеток по Су™ 5.5/ПТС к общему количеству Су™ 5.5-положительных клеток в печени цирротической мыши и обычной мыши через 90 мин после введения визуализирующего агента (среднее из 8 случайных полей).
Описание вариантов осуществления изобретения
Раннее диагностирование фиброза может обеспечить более высокие возможности обнаружения подходящего лечения. В настоящее время клинически доступным одобренным способом диагностирования фиброза является только биопсия. Однако биопсия требует забора ткани для исследования. Неинвазивный способ минимизировал бы необходимость удалять ткань и риски, связанные с наличием инородного предмета, вводимого субъекту. Такой неинвазивный способ разрешает вопросы, связанные с неудовлетворенным выбором средств для диагностирования фиброза.
Если не указано иное, все технические и научные термины, использованные здесь, имеют те же значения, которые обычно понятны специалисту в данной области техники. Все упомянутые здесь патенты, заявки, опубликованные заявки и другие публикации включены сюда путем ссылки во всей своей полноте, если не указано иное.
В том случае, если существует множество определений для термина, превалируют те, которые указаны в этом разделе, если не определено другое.
Термин "сложный эфир" используется здесь в своем обычном значении, и соответственно включает химический фрагмент с формулой -(R)n-COOR′, где R и R′ независимо выбраны из группы, состоящей из алкила, циклоалкила, арила, гетероарила (связанного через углерод кольца) и гетероалициклических структур (связанных через углерод кольца или гетероатом), и где n означает 0 или 1.
Термин "амид" используется здесь в своем обычном значении и, соответственно, включает химический фрагмент с формулой -(R)n-C(O)NHR′ или -(R)n-NHC(O)R′, где R и R′ независимо выбраны из группы, состоящей из алкила, циклоалкила, арила, гетероарила (связанного через углерод кольца) и гетероалициклических структур (связанных через углерод кольца или гетероатом), и где n означает 0 или 1. Амид может включаться в аминокислотную или пептидную молекулу, присоединенную к молекул лекарственного средства, как описано здесь, формируя таким образом пролекарство.
Любые амин, гидрокси-группа или карбоксильная боковая цепь на соединениях, раскрытых здесь, могут быть эстерифицирована или амидирована. Процедуры и специфические группы, используемые для достижения этого результата, известны специалистам в данной области техники и могут быть легко обнаружены в справочных материалах, таких как Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999, которая включена сюда во всей своей полноте.
При использовании здесь "алкил" относится к прямой или разветвленной углеводородной цепи, которая содержит полностью насыщенную (без двойных или тройных связей) углеводородную группу. Алкильная группа может иметь от 1 до 20 углеродных атомов (при любом здесь упоминании область числовых значений, такая как "1-20", относится к каждому целому числу в данном диапазоне; например, "1-20 углеродных атомов" означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., вплоть до и включая 20 углеродных атомов, хотя настоящее определение также охватывает случай употребления термина "алкил", когда область числовых значений не обозначена). Алкильная группа также может быть алкилом среднего размера, имеющим от 1 до 10 атомов углерода. Алкильная группа также может быть низшим алкилом, имеющим 1-5 атомов углерода. Алкильная группа соединений может обозначаться как "C1-C4 алкил" или подобными обозначениями. Только в качестве примера, "C1-C4 алкил" указывает, что существуют 1-4 атомов углерода в алкильной цепи, т.е., алкильная цепь выбирается из метила, этила, пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Типичные алкильные группы включают, но не ограничиваются этим, метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, петил, гексил и т.п.
Алкильная группа может быть замещенная или незамещенная. В случае, когда она замещенная, группа(ы)-заместитель(и) является(ются) одной или более групп, по отдельности и независимо выбранных из алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкинила, арила, гетероарила, гетероалициклила, аралкила, гетероаралкила, (гетероалициклил)алкила, гидрокси, защищенного гидроксила, алкокси, арилокси, ацила, сложного эфира, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, защищенного С-карбокси, O-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, сульфенила, сульфинила, сульфонила, галогеналкила (например, моно-, ди- и тригалогеналкила), галогеналкокси (например, моно-, ди- и тригалогеналкокси), тригалогенметансульфонила, тригалогенметансульфонамидо и амино, включая моно - и дизамещенные аминогруппы, и их защищенные производные. Где бы заместитель ни описывался как "при необходимости замещенный", он представляет собой заместитель, который может быть замещен одним из вышеупомянутых заместителей.
При использовании здесь "арил" относится к карбоциклической (только атомы углерода в кольце) моноциклической или мультициклической ароматической кольцевой системе, которая имеет полностью делокализованную пи-электронную систему. Примеры арильных групп включают, но не ограничиваются этим, бензол, нафталин и азулен. Арильная группа по этому изобретению может быть замещена или незамещена. В том случае, когда она замещена, атомы водорода замещаются группой(ами)-заместителем(ями), которая(ые) является(ются) одной или более групп, независимо выбранных из алкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкинила, арила, гетероарила, гетероалициклила, аралкила, гетероаралкила, (гетероалициклил)алкила, гидрокси, защищенного гидрокси, алкокси, арилокси, ацила, сложного эфира, меркапто, пиано, галогена, тиокарбонила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, защищенного С-карбокси, O-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, сульфенила, сульфинила, сульфонила, галогеналкила (например, моно-, ди- и тригалогеналкила), галогеналкокси (например, моно-, ди- и тригалогеналкокси), тригалогенметансульфонила, тригалогенме-тансульфонамидо и амино, включая моно- и дизамещенные аминогруппы, и их защищенные производные, если не указаны другие группы-заместители.
"Хелат парамагнитного металла " означает комплекс, где лиганд связан с ионом парамагнитного металла. Примеры включают, но не ограничиваются этим, 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA)-Gd(III), DOTA-иттрий-88, DOTA-индий-111, диэтилентриаминпентауксусная кислота (DTPA)-Gd(III), DTPA-иттрий-88, DTPA-индий-111.
"Ретиноид" является представителем класса соединений, состоящих из четырех изопреноидных единиц, соединенных способом голова-к-хвосту, см. G.P.Moss, "Biochemical Nomenclature and Related Documents," 2nd Ed. Portland Press, pp.247-251 (1992). "Витамин А" является общим идентификатором для ретиноидов, проявляющих качественно биологическую активность ретинола. При использовании здесь ретиноид относится к природным и синтетическим ретиноидам, включающим первое поколение, второе поколение и третье поколение ретиноидов. Примеры встречающихся в природе ретиноидов включают, но не ограничиваются этим, (1) 11-цис-ретиналь, (2) полностью транс-ретинол, (3) ретинилпальмитат, (4) полностью транс-ретиноевую кислоту и (5) 13-цис-ретиноевые кислоты. Кроме того, термин "ретиноид" охватывает ретинолы, ретинали и ретиноевые кислоты.
"Фиброз" используется здесь в своем обычном значении и относится к развитию фиброзной рубцовообразной соединительной ткани в органе или ткани как часть репаративного или реактивного процесса. "Аномальный фиброз" относится к развитию фиброзной рубцовообразной соединительной ткани в органе или ткани до такой степени, что это ухудшает функционирование органа или ткани. "Фиброзное заболевание" относится здесь к любым заболеваниям, характеризующимся фиброзом тканей, и включает, но не ограничивается этим, например, гепатитный фиброз, гепатитный цирроз, рубцы голосовых связок, фиброз слизистой оболочки голосовых связок, фиброз гортани, фиброз легких, миелофиброз, инфаркт миокарда и фиброз миокарда после инфаркта миокарда. В целях настоящего изобретения фиброзные заболевания обычно представляют собой те, в которые вовлечены клетки, положительные по альфа-SMA и продуцирующие внеклеточный матрикс, такие как гепатитные звездчатые клетки,
При использовании здесь "линкер" и "связывающая группа" относятся к одному или более атомов, которые соединяют один химический фрагмент с другим химическим фрагментом. Примеры связывающих групп включают группы с относительно низкой молекулярной массой, такие как амид, сложный эфир, карбонат и простой эфир, а также связывающие группы с более высокой молекулярной массой, такие как полиэтиленгликоль (ПЭГ).
При этом в любом соединении, описанном здесь, имеющем один или более хиральных центров, если абсолютная стереохимия не указана четко, тогда каждый центр может независимо иметь или R-конфигурацию, или S-конфигурацию, или их смесь. Таким образом, соединения, предоставляемые здесь, могут быть энантиомерно чистыми или представлять собой стереоизомерные смеси. Дополнительно, при этом в любом соединении, описанном здесь, имеется одна или более двойных связей, генерирующих геометрические изомеры, которые могут быть определены как Е или Z, при этом каждая двойная связь может быть независимо Е или Z, или их смесью. Также предполагается, что включены все таутомерные формы.
При использовании здесь аббревиатуры для любых защитных групп, аминокислот и других соединений приводятся, если не указано иное, согласно их общепринятому использованию, общепризнанными аббревиатурами или Комиссии по биохимической номенклатуре IUPAC-IUP (See, Biochem. 11:942-944 (1972)).
Один из объектов настоящего изобретения относится к визуализирующему агенту фиброзных заболеваний, содержащему ретиноид и детектируемую метку.
Ретиноид в настоящем изобретении может воздействовать на клетки, положительные по альфа-SMA и продуцирующие ЕСМ, такие как активированные звездчатые клетки, которые вовлечены в фиброзное заболевание. Хотя механизм, по которому ретиноид воздействует на клетки, положительные по альфа-SMA и продуцирующие ЕСМ, не объяснен полностью, предполагается, например, что ретиноид, специфически связанный с RBP (ретинол-связывающий белок), связывается с и/или поглощается указанными клетками через определенный тип рецептора на их поверхности.
Ретиноид, который может использоваться в настоящем изобретении, включает, но не ограничивается этим, производные ретиноида, такие как ретинол, ретиналь, ретиноевая кислота, сложный эфир ретинола и жирной кислоты, сложный эфир алифатического спирта и ретиноевой кислоты, этретинат, третиноин, изотретиноин, адапален, ацитретин, тазаротен и пальмитат ретинола, и аналоги витамина А, такие как фенретинид (4-HPR) и бексаротен. Ретиноид также включает рексиноиды, т.е. ретиноидные соединения, которые являются селективными для рецепторов ретиноида Х (RXR), такие как бексаротен.
Из них ретинол, ретиналь, ретиноевая кислота, сложный эфир ретинола и жирной кислоты (например, ретинил ацетат, ретинил пальмитат, ретинил стеарат и ретинил лаурат) и сложный эфир алифатического спирта и ретиноевой кислоты (например, этилретиноат) являются предпочтительными с точки зрения эффективности специфического нацеливания указанных ЕСМ-продуцирующих клеток. В другом предпочтительном варианте осуществления ретиноид в настоящем изобретении не включает ретиноевую кислоту и/или производные ретиноевой кислоты. Таим образом, предпочтительный ретиноид в этих вариантах осуществления включает ретинол, ретиналь, сложный эфир ретинола и жирной кислоты и т.д.
Для цели настоящего изобретения ретиноид также включает все изомеры ретиноида, такие как цис/транс изомеры. Специфические примеры таких изомеров включают,