Способ определения содержания малонового диальдегида в вегетативных органах растений методом капиллярного электрофореза
Иллюстрации
Показать всеИзобретение относится к аналитической химии, а именно к способу определения малонового диальдегида в вегетативных органах черешни, винограда, ореха грецкого и проростках озимой пшеницы. Для этого проводят экстракцию биологического материала 96% спиртом и с последующим центрифугированием. Далее супернатант обрабатывают 0,5%-ным водным раствором тиобарбитуровой кислоты и инкубируют 30 мин при 50°C. После охлаждения реакционную смесь центрифугируют. Содержание малонового диальдегида определяют методом капиллярного электрофореза в кварцевом капилляре с внутренним диаметром 75 мкм и эффективной длиной 0,5 м. Анализ проводят при длине волны 254 нм в токе электролита, содержащего 0,33% масс. борной кислоты и 0,05% масс. тетрабората натрия при положительной полярности напряжения. Расчет проводят с учетом того, что на одну молекулу малонового альдегида расходуется две молекулы тиобарбитуровой кислоты. Изобретение позволяет проводить количественное определение концентрации малонового диальдегида, который служит маркером оксидативного стресса растений. 1 табл., 4 ил., 4 пр.
Реферат
Изобретение относится к аналитической химии альдегидов, в частности к способу определения малонового диальдегида.
Малоновый диальдегид возникает в организме при деградации полиненасыщенных жиров активными формами кислорода и служит маркером перекисного окисления жиров и оксидативного стресса [Молекулярно-генетические и биохимические методы в современной биологии растений / под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. - М.: Бином. Лаборатория знаний, 2012. - 487 с.].
Известно, что для выделения и изучения малонового диальдегида используют различные методы, основанные на получении окрашенного триметинового комплекса малонового диальдегида с тиобарбитуровой кислотой, количество которого определяется по оптической плотности при 532 нм.
Для выделения малонового диальдегида в сыворотке крови ее инкубируют 30 мин при температуре 40°C, реакцию останавливают 3 мМ раствором дигидрокверцетина с последующим добавлением 1%-ного раствора трилона X-100, 0,6 М раствора HCl и 0,06 М рабочего раствора тиобарбитуровой кислоты, смесь которых нагревают на кипящей водяной бане в течение 10 мин. Окраску раствора стабилизируют 5 мМ раствором трилона Б и смесью этанола с хлороформом в соотношении (7:3). В качестве контроля используют образец, содержащий 0,06 М рабочего раствора тиобарбитуровой кислоты и бидистиллированную воду, которую добавляют вместо экстракта ткани. Оптическую плотность растворов измеряют при 532 нм. Контролем служит пробирка, в которую добавляют все эти же растворы, а вместо сыворотки - бидистиллированную воду. В расчетах концентрации малонового диальдегида используют коэффициент поглощения 156 мМ-1см-1 [Рогожин В.В., Курилюк Т.Т. Повышение чувствительности метода определения концентрации малонового диальдегида с помощью тиобарбитуровой кислоты // Тезисы VII конференции «Аналитика Сибири и Дальнего Востока - 2004». Устные доклады. Секция 5. Анализ биологических, медицинских и фармацевтических объектов // http:www.anchem.ru/literature/books/asbv-2004/095.asp].
Наиболее близким к заявляемому способу техническим решением является способ определения малонового диальдегида в растениях. Для этого растительный материал гомогенизируют в 20%-ной трихлоруксусной кислоте, центрифугируют и в супернатант добавляют 0,5%-ную тиобарбитуровую кислоту в 20%-ной трихлоруксусной кислоте и эту смесь инкубируют 30 мин при 95°C. В качестве контроля используют раствор тиобарбитуровой кислоты в трихлоруксусной кислоте [Молекулярно-генетические и биохимические методы в современной биологии растений / под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. - М.: Бином. Лаборатория знаний, 2012. - 487 с.].
Недостатки способа: при взаимодействии альдегидов с нуклеофилами образуются вещества, из которых альдегиды могут легко регенерироваться под действием кислоты, что снижает точность их количественного определения [Реутов О.А. Органическая химия. - Т. 3. - М.: Бином. Лаборатория знаний, 2004. - С. 10-134].
Малоновый диальдегид вступает в реакцию с тиобарбитуровой кислотой, образуя красный флуоресцентный состав, что позволяет проводить лишь приблизительный спектроморфометрический анализ содержания малонового диальдегида [Nair V., O′Neil C.L., Wang P.G. "Malondialdegyde" Enciclopedia for organic synthesis, 2008, John Wiley & Sons, New York. Doi: 10.1002/047084289X.rm013.pub 2 Article Online Posting Data: march 14. 2008].
Задачей изобретения является определение малонового диальдегида методом высокоэффективного капиллярного электрофореза для повышения точности обеспечения экспрессных и достоверных количественных результатов при минимальных затратах на пробоподготовку и выполнение анализа.
Техническим результатом при использовании предлагаемого изобретения является экспрессность и достоверность количественного определения малонового диальдегида методом капиллярного электрофореза с применением нетоксичных и доступных реактивов для проведения анализа.
Технический результат достигают за счет того, что способ определения малонового диальдегида предусматривает экстракционную пробоподготовку образца биологического материала 96%-ным этанолом, затем после экстракции и центрифугирования к супернатанту добавляют 0,5%-ный водный раствор тиобарбитуровой кислоты и реакционную смесь инкубируют 30 мин при 50°C, охлаждают, центрифугируют, содержание малонового диальдегида определяют по убыли количества тиобарбитуровой кислоты, пошедшей на реакцию, методом капиллярного электрофореза в кварцевом капилляре эффективной длиной 0,5 м, внутренним диаметром 75 мкм с использованием для анализа водного ведущего электролита, содержащего 0,33% масс. борной кислоты, 0,05% масс. тетрабората натрия при положительной полярности напряжения и длине волны детектирования 254 нм.
Для калибровки прибора используют стандартные водные растворы тиобарбитуровой кислоты.
Способ отличается тем, что с целью обеспечения экспрессности и достоверности анализа для выделения малонового диальдегида из растительной ткани образец гомогенизируют в 96% этаноле, затем после экстракции и центрифугирования к супернатанту добавляют 0,5%-ный водный раствор тиобарбитуровой кислоты и содержание малонового диальдегида определяют по убыли количества тиобарбитуровой кислоты, пошедшей на реакцию, методом капиллярного электрофореза.
Поставленная задача достигается за счет того, что для выделения малонового диальдегида из растительной ткани используется 96% этанол с последующим определением содержания малонового диальдегида по убыли количества тиобарбитуровой кислоты, пошедшей на реакцию с образованием триметинового комплекса, с учетом того, что на одну молекулу малонового диальдегида расходуется две молекулы тиобарбитуровой кислоты.
В результате проведенных исследований и сравнения с аналогом установлено, что предлагаемый способ определения содержания малонового альдегида в вегетативных органах, включающий экстракцию малонового диальдегида из растительной ткани 96% этанолом в течение 30 мин с последующим центрифугированием и инкубированием реакционной смеси экстракта с 0,5%-ным водным раствором тиобарбитуровой кислоты в течение 30 мин при 50°C и определением содержания малонового диальдегида по убыли количества тиобарбитуровой кислоты, пошедшей на реакцию с образованием триметинового комплекса, с учетом того, что на одну молекулу малонового альдегида расходуется две молекулы тиобарбитуровой кислоты, позволяет достичь объективного, экспрессного определения массового содержания малонового диальдегида в биологических пробах.
Преимущества заявляемого способа заключаются в использовании нетоксичных и доступных реактивов при пробоподготовке, получении более стабильного триметинового комплекса вследствие использования водного раствора тиобарбитуровой кислоты, снижения температуры реакционной смеси с 95°C до 50°C, что снижает потери от испарения реактивов, и осуществлении анализа на системах капиллярного электрофореза, например серии «Капель», обеспечении объективности и достоверности анализа образцов, стабильности во времени ведущего электролита, позволяющего обеспечить эффективное разделение анализируемого компонента.
Изобретение иллюстрируется следующими примерами.
Пример 1. Определение содержания малонового диальдегида методом капиллярного электрофореза
Согласно способу прототипа 100 мг растительного материала гомогенизируют в 1,5 см3 20% трихлоруксусной кислоты, центрифугируют при 10000 g в течение 15 мин при 4°C. К отобранным 0,3 см3 супернатанта добавляют 1,2 см3 0,5% тиобарбитуровой кислоты в 20% трихлоруксусной кислоте. Реакционную смесь инкубируют 30 мин при 95°C, охлаждают, центрифугируют 15 мин при 10000 g. Оптическую плотность супернатанта определяют при 532 нм и 600 нм. В качестве контроля используют раствор тиобарбитуровой кислоты в трихлоруксусной кислоте. Расчет содержания малонового диальдегида проводят по формуле:
где Cx - содержание малонового диальдегида, мкмоль/г сырой массы; E - оптическая плотность раствора; Ve - объем экстракта, мл; Va - объем экстракта, взятый для анализа, мл; k - коэффициент молярной экстинкции МДА=156 мМ-1 × см-1; mв - масса образца для экстракции, г.
По заявляемому способу. Образец листьев массой 0,1 г заливали 1,5 см 96%-ного этанола и тщательно гомогенизировали. Затем экстракцию проводили на шейкере в течение 30 минут. Полученный экстракт центрифугировали 15 мин при 10000 g. К 0,3 см супернатанта добавляли 1,2 см 0,5% водного раствора тиобарбитуровой кислоты в бидистиллированной воде и полученную реакционную смесь инкубировали 30 минут при 50°C, затем охлаждали и центрифугировали 15 мин при 10000 g. Содержание остаточной тиобарбитуровой кислоты в супернатанте определяли методом капиллярного электрофореза. В качестве контроля использовали 1,2 см3 0,5% водного раствора тиобарбитуровой кислоты в бидистиллированной воде в смеси с 0,3 см 96% этанола. Полученные растворы переносили для анализа в систему капиллярного электрофореза. Анализ осуществляли согласно описанным выше параметрам.
Расчет содержания малонового диальдегида проводили с учетом того, что на одну его молекулу при образовании триметинового комплекса приходится две молекулы тиобарбитуровой кислоты
где Cx - содержание малонового диальдегида, мкмоль/г сырой массы; Ак - содержание тиобарбитуровой кислоты в контрольном образце; Аоб - содержание тиобарбитуровой кислоты в опытном образце; Ve - объем экстракта, мл; Va - объем экстракта, взятый для анализа, мл; m - масса образца для экстракции, г.
Контролем служило определение малонового диальдегида этих же растительных образцов согласно способу-прототипу.
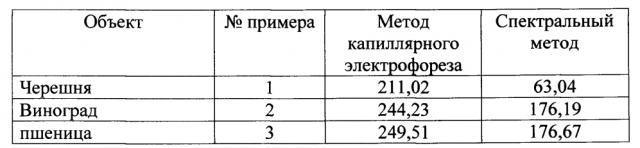
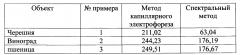
Полученные результаты приведены в таблице. Электрофореграммы определения малонового диальдегида в экстракте листьев черешни, винограда, в проростках пшеницы.
Пример 2. Определение содержания малонового диальдегида в листьях винограда
Аналогично примеру 1, кроме того, что пробоподготовке подвергали листья винограда сорта Красностоп АЗОС. Полученные результаты приведены в таблице.
Пример 3.
Аналогично примеру 1, кроме того, что пробоподготовке подвергали листья проростков озимой пшеницы сорта Краснодарская 99. Полученные результаты приведены в таблице.
Пример 4.
Аналогично примеру 1, кроме того, что пробоподготовке подвергали листья ореха грецкого.
Полученные результаты приведены в таблице.
Таблица - Содержание малонового диальдегида в листьях растений, мкмоль/г сырой массы
Применение заявляемого способа позволило получить воспроизводимый результат в обоих случаях для примеров 1-4.
Для проверки надежности метода капиллярного электрофореза использовали метод добавки тиобарбитуровой кислоты в пробу биологического материала. Установлено, что степень извлечения тиобарбитуровой кислоты для анализируемых образцов составила 103,5-104,1%.
Эти данные свидетельствуют о возможности корректного определения малонового диальдегида согласно заявляемому способу.
Предлагаемый способ практически лишен таких недостатков, как необходимость дополнительного разбавления проб для корректного анализа, влияние мешающих веществ биологической природы - фенольные соединения, водный раствор ведущего электролита стабилен во времени и не загрязняет внутреннюю поверхность капилляра.
При реализации способа получены количественные результаты определения массовой концентрации малонового диальдегида, превосходящие по своему качеству прототип, так как экстракцию проводят при комнатной температуре для снижения интенсивности окисления липидов. Реакцию малонового диальдегида с 0,5%-ным раствором биобарбитуровой кислоты в водно-спиртовом 20%-ном растворе проводят при температуре 50°C, что позволяет снизить регенерацию малонового диальдегида из триметинового комплекса.
Способ определения малонового диальдегида, характеризующийся тем, что предусматривает экстракционную подготовку пробы биологического материала, центрифугирование, взаимодействие выделенного малонового диальдегида с тиобарбитуровой кислотой, отличающийся тем, что для выделения малонового диальдегида из растительной ткани используется 96% этанол, затем после экстракции и центрифугирования к супернатанту добавляют 0,5%-ный водный раствор тиобарбитуровой кислоты и реакционную смесь инкубируют 30 мин при 50°С, охлаждают, центрифугируют, содержание малонового диальдегида определяют методом капиллярного электрофореза в кварцевом капилляре эффективной длиной 0,5 м, внутренним диаметром 75 мкм с использованием для анализа водного ведущего электролита, содержащего 0,33% масс. борной кислоты, 0,05% масс. тетрабората натрия при положительной полярности напряжения и длине волны детектирования 254 нм по убыли количества тиобарбитуровой кислоты, пошедшей на реакцию.