Производные пирролидина в качестве антагонистов nk3
Иллюстрации
Показать всеИзобретение относится к соединениям формулы I, где R1 представляет собой или фенил, пиридинил или пиридазинил, где фенил, пиридинил, пиридазинил могут быть замещены циано, низшим алкилом, галоген-замещенным фенилом, низшим алкил-замещенным [1,2,4]оксадиазол-3-илом или 2-оксо-пиперидин-1-илом, Х является NR или О, R представляет собой -С(O)-низший алкил, -С(O)-циклоалкил, замещенный низшим алкилом, циклоалкил или фенил, пиридинил или пиридазинил, где фенил, пиридинил, пиридазинил могут быть замещены низшим алкилом, низшим алкокси, циано, -С(O)-низшим алкилом, галогеном или низшим алкилом, замещенным галогеном, R2 представляет собой водород или низший алкил, R3 представляет собой водород, галоген, R4 представляет собой водород или низший алкил, где R2 и R4 одновременно не являются водородом или низшим алкилом, R5 представляет собой низший алкил, R6 - галоген, или их фармацевтически приемлемые кислотно-аддитивные соли. Было обнаружено, что соединения по настоящему изобретению имеют высокий потенциал в качестве антагонистов NK-3 рецепторов для лечения депрессии, боли, психоза, болезни Паркинсона, шизофрении, тревоги и дефицита внимания и гиперактивности (СДВГ). 5 н. и 13 з.п. ф-лы, 36 пр.
Реферат
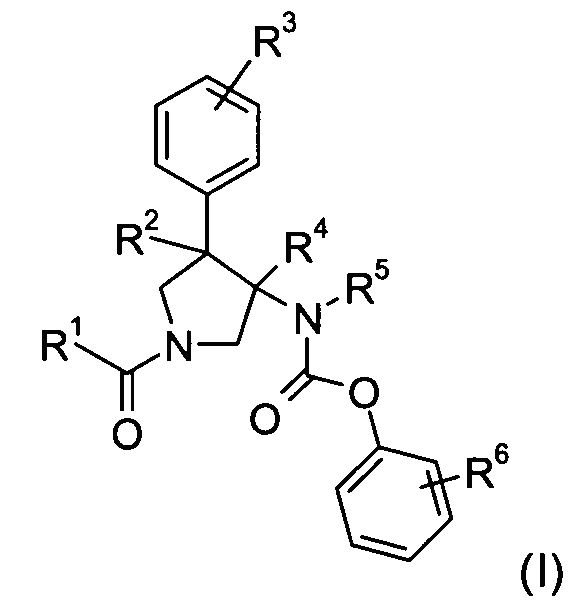
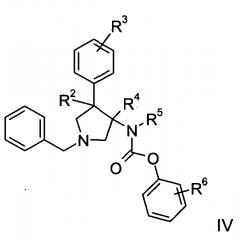
Изобретение относится к соединениям с формулой
где
R1 представляет собой или фенил, пиридинил или пиридазинил, где фенил, пиридинил, пиридазинил могут быть замещены циано, низшим алкилом, галоген-замещенным фенилом, низшим алкил-замещенным [1,2,4] оксадиазол-3-илом или 2-оксо-пиперидин-1-илом;
Х представляет собой NR или О;
R представляет собой -С(О)-низший алкил, -С(О)-циклоалкил, замещенный низшим алкилом, циклоалкил или фенил, пиридинил или пиридазинил, где фенил, пиридинил, пиридазинил могут быть необязательно замещены низшим алкилом, низшим алкокси, циано, -С(О)-низшим алкилом, галогеном или низший алкилом, замещенным галогеном;
R2 представляет собой водород или низший алкил;
R3 представляет собой водород, галоген, циано, низший алкил или низший алкил, замещенный галогеном;
R4 представляет собой водород или низший алкил; где R2 и R4 не являются водородом или низшим алкилом одновременно;
R5 представляет собой низший алкил;
R6 представляет собой галоген, гидрокси, низший алкил, низший алкокси, низший алкил, замещенный галогеном, S(O)2-низший алкил или циано;
или их фармацевтически приемлемая кислотно-аддитивная соль.
Изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры. Кроме того, все таутомерные формы соединений формулы I также охватываются настоящим изобретением.
Было обнаружено, что соединения по настоящему изобретению являются антагонистами NK-3 рецепторов с высоким потенциалом для лечения депрессии, боли, психоза, болезни Паркинсона, шизофрении, тревоги и синдрома дефицита внимания и гиперактивности (СДВГ).
Три основных тахикинина млекопитающих, субстанция Р (SP), нейрокинин А (NKA) и нейрокинин В (NKB) принадлежат к семейству нейропептидов с общей СООН-концевой пентапептидной последовательностью Phe-X-Gly-Leu-Met-NH2. Как нейротрансмиттеры, эти пептиды проявляют свою биологическую активность через три различных нейрокининовых (NK) рецептора, которые называются NK-1, NK-2 и NK-3. SP связывается преимущественно с рецептором NK-1, NKA с NK-2 и NKB с NK-3 рецепторами.
NK-3 рецептор преобладающе экспрессируется в ЦНС, и было показано его участие в модуляции центральной моноаминергической системы. Эти свойства делают NK-3 рецептор потенциальной мишенью для лечения заболеваний центральной нервной системы, таких как тревога, депрессия, биполярные расстройства, болезнь Паркинсона, шизофрения и боль (Neurosci. Letters, 2000, 283, 185-188; Exp. Opin. Ther. Patents 2000, 10, 939-960; Neuroscience, 1996, 74, 403-414; Neuropeptides, 1998, 32, 481-488).
Шизофрения является одним из основных психоневрологических расстройств, характеризующимся тяжелыми и хроническими психическими нарушениями. Этой разрушительной болезнью страдает около 1% населения мира. Симптомы начинаются в ранневзрослом возрасте с последующим периодом межличностной и социальной дисфункции. Шизофрения манифестирует слуховыми и зрительными галлюцинациями, паранойей, бредом (позитивные симптомы), притуплением аффектов, депрессией, ангедонией, бедностью речи, памяти и дефицитом внимания, а также социальной изоляцией (негативные симптомы).
На протяжении десятилетий ученые и врачи прилагают усилия с целью обнаружения идеального агента для фармакологического лечения шизофрении. Тем не менее, сложность расстройств, в связи с широким спектром симптомов, препятствует этим усилиям. Не существует конкретных фокальных характеристик для диагностики шизофрении, и нет такого симптома, который постоянно присутствует у всех пациентов. Следовательно, диагноз шизофрении как одного расстройства или различных расстройств уже обсуждался, но еще не урегулирован. Основной трудностью в разработке нового препарата для лечения шизофрении является отсутствие знаний о причинах и природе этого заболевания. Были предложены некоторые нейрохимические гипотезы на основе фармакологических исследований с целью рационализировать разработку соответствующей терапии: допаминовая, серотониновая и глутаматная гипотезы. Однако, принимая во внимание комплексный характер шизофрении, соответствующий мультирецепторно-аффинный профиль может потребоваться для эффективности против положительных и отрицательных признаков и симптомов. Кроме того, идеальный препарат против шизофрении предпочтительно должен иметь низкую дозу, позволяющую принимать ее один раз в день, из-за низкого соблюдения правил больными шизофренией.
В последние годы в литературе встречаются клинические исследования с селективным NK1 и МК2-рецепторами, показывающие результаты в лечении рвоты, депрессии, тревоги, боли и мигрени (NK1) и астмы (NK1 и NK2). Наиболее впечатляющие данные были получены при лечении рвоты, вызванной химиотерапией, тошноты и депрессии NK1- и астмы NK2-антагонистами. В противоположность этому, никаких клинических данных об антагонистах NK3 рецепторов не появлялось в литературе до 2000 года. Osanetant (SR 142801) из Sanofi-Synthelabo был впервые идентифицирован как мощный и селективный непептидный антагонист, описанный для NK3 рецепторов тахикининов для потенциального лечения шизофрении, о котором сообщалось в литературе (Current Opinion in Investigational Drugs, 2001, 2(7), 950-956 and Psychiatric Disorders Study 4, Schizophrenia, June 2003, Decision Recources, Inc., Waltham, Massachusetts). Предлагаемый препарат SR 142 801 на II стадии клинических испытаний показал активность для лечения позитивных симптомов шизофрении, таких как изменение поведения, бред, галлюцинации, экстремальные эмоции, возбужденная двигательная активность и бессвязная речь, но был неактивен для лечения негативных симптомов, таких как депрессия, ангедония, социальная изоляция или дефицит памяти и внимания.
Антагонисты рецептора нейрокинина-3 были описаны как полезные при лечении боли или воспаления, а также при шизофрении, Exp. Opinion. Ther. Patents (2000), 10(6), 939-960 and Current Opinion in Investigational Drugs, 2001, 2(7), 950-956 956 and Psychiatric Disorders Study 4, Schizophrenia, June 2003, Decision Recources, Inc., Waltham, Massachusetts).
Объектами настоящего изобретения являются новые соединения формулы I, их производство, лекарственные средства на основе соединений согласно изобретению и их получение, а также применение соединений формулы I для контроля или профилактики заболеваний, таких как депрессия, боль, биполярные расстройства, психоз, болезнь Паркинсона, шизофрения, тревога и синдром дефицита внимания и гиперактивности (СДВГ).
Предпочтительными показаниями для использования соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, шизофрения, тревога и синдром дефицита внимания и гиперактивности (СДВГ).
Используемый в данном документе, термин "низший алкил" означает насыщенную прямую или разветвленную цепь, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, и-бутил, 2-бутил, т-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Используемый в данном документе, термин "низший алкокси" означает группу, где алкильный остаток имеет значения, определенные выше, и который присоединен через атом кислорода.
Используемый в данном документе, термин "низший алкил, замещенный галогеном" означает алкильную группу, как определено выше, где, по крайней мере, один атом водорода замещен атомом галогена, например CF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CH2CF2CF3 и тому подобное.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "циклоалкил" означает алкиленовое кольцо, содержащее в кольце от 3 до 6 атомов углерода.
Термин "фармацевтически приемлемые кислотно-аддитивные соли" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и тому подобное.
Одним вариантом осуществления настоящего изобретения являются соединения, в которых R3 и R6 представляют собой галогены.
Еще одним вариантом осуществления настоящего изобретения являются соединения, в которых R4 является метилом и R2 является водородом, например, следующие соединения
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(1-изобутирил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(1-циклогексил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(4-циано-бензоил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-1-(1-ацетил-пиперидин-4-карбонил)-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(тетрагидропиран-4-карбонил)-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(6-метил-пиридазин-4-карбонил)-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-[1-(1-метил-циклопропанкарбонил)пиперидин-4-карбонил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(5′-метил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(5′-циано-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-хлорфенил)-1-[1-(4-циано-фенил)-пиперидин-4-карбонил]-3-метил-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-1-(5′-Ацетил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(5′-фтор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(6-циано-пиридин-3-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(5′-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил) пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(4′-фтор-бифенил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-[4-(5-метил-[1,2,4]оксадиазол-3-ил)бензоил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(6′-циано-3,4,5,6-тетрагидро-2Н-[1,3′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-хлорфенил)-1-[1-(6-метокси-пиридазин-3-ил)пиперидин-4-карбонил]-3-метил-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-[4-(2-оксо-пиперидин-1-ил)бензоил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
Еще одним вариантом осуществления настоящего изобретения являются соединения, где R4 является водородом и R2 является метилом, например, следующие соединения
рац-{(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-[1-(1-метил-циклопропанкарбонил)пиперидин-4-карбонил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3S,4R)-4-(4-хлорфенил)-1-[1-(4-циано-фенил)-пиперидин-4-карбонил]-4-метил-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(5′-фтор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(1-изобутирил-пиперидин-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
[(3S,4R)-4-(4-Хлор-фенил)-1-(1-циклогексил-пиперидин-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(4-циано-бензоил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-1-(1-ацетил-пиперидин-4-карбонил)-4-(4-хлорфенил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-(тетрагидропиран-4-карбонил)-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил
рац-[(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-(5′-метил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(5′-циано-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-1-(5′-Ацетил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-(4-хлор-фенил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-(5′-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор фениловый эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(6′-циано-3,4,5,6-тетрагидро-2Н-[1,3′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3S,4R)-4-(4-хлорфенил)-1-[1-(6-метокси-пиридазин-3-ил)пиперидин-4-карбонил]-4-метил-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-[4-(2-оксо-пиперидин-1-ил)бензоил]-пирролидин-3-ил}-метил-бутилового эфира 4-фтор-фенил эфир
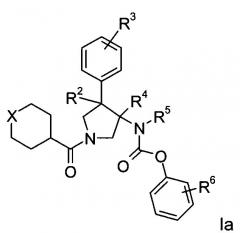
Еще одним вариантом осуществления настоящего изобретения являются соединения формулы Ia,
где
Х представляет собой NR или О;
R представляет собой-С(О)-низший алкил, -С(О)-циклоалкил, замещенный низшим алкилом, циклоалкил или фенил, пиридинил или пиридазинил, где фенил, пиридинил и пиридазинил могут быть необязательно замещены низшим алкилом, низшим алкокси, циано, -С(О)-низшим алкилом, галогеном или низшим алкилом, замещенным галогеном;
R2 представляет собой водород или низший алкил;
R3 представляет собой водород, галоген, циано, низший алкил или низший алкил, замещенный галогеном;
R4 представляет собой водород или низший алкил; где R2 и R4 не одновременно являются водородом или низшим алкилом;
R5 представляет собой низший алкил;
R6 представляет собой галоген, гидрокси, низший алкил, низший алкокси, низший алкил, замещенный галогеном, S(O)2-низший алкил или циано;
или их фармацевтически приемлемая кислотно-аддитивная соль.
Одним из вариантов исполнения этой группы соединений являются такие соединения, где Х представляет собой NR, например следующие соединения
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(1-изобутирил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(1-циклогексил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-1-(1-ацетил-пиперидин-4-карбонил)-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-[1-(1-метил-циклопропанкарбонил)пиперидин-4-карбонил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(5′-метил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(5′-циано-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-1-[1-(4-циано-фенил)-пиперидин-4-карбонил]-3-метил-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-1-(5′-Ацетил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(5′-фтор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(5′-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(6′-циано-3,4,5,6-тетрагидро-2Н-[1,3′]бипиридинил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-хлорфенил)-1-[1-(6-метокси-пиридазин-3-ил)пиперидин-4-карбонил]-3-метил-пирролидин-3-ил}метилкарбаминовой кислоты 4-фтор-фенил эфир
рац-{(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-[1-(1-метил-циклопропанкарбонил)пиперидин-4-карбонил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3S,4R)-4-(4-Хлор-фенил)-1-[1-(4-циано-фенил)-пиперидин-4-карбонил]-4-метил-пирролидин-3-ил-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(5′-фтор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(1-изобутирил-пиперидин-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
[(3S,4R)-4-(4-Хлор-фенил)-1-(1-циклогексил-пиперидин-4-карбонил)-4-метилпирролидин-3-ил]-метил-карбаминовая кислота 4-фтор-фенил эфир
рац-[(3S,4R)-1-(1-ацетил-пиперидин-4-карбонил)-4-(4-хлор-фенил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-(5′-метил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(5′-циано-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-метилпирролидин-3-ил]-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-1-(5′-Ацетил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-(4-хлор-фенил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-(5′-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбонил)пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(6′-циано-3,4,5,6-тетрагидро-2Н-[1,3′]бипиридинил-4-карбонил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир или
рац-{(3S,4R)-4-(4-хлорфенил)-1-[1-(6-метокси-пиридазин-3-ил)пиперидин-4-карбонил]-4-метил-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир.
Еще одним вариантом осуществления соединений формулы Ia являются такие соединения, где Х представляет собой О, например, следующие соединения:
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(тетрагидропиран-4-карбонил)-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир или
рац-[(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-(тетрагидропиран-4-карбонил)-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир.
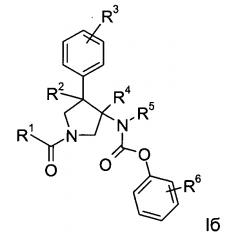
Еще одним вариантом осуществления настоящего изобретения являются соединения формулы Iб,
где
R1 представляет собой фенил, пиридинил или пиридазинил, где фенил, пиридинил, пиридазинил и могут быть необязательно замещены циано, низшим алкилом, галоген-замещенным фенилом, низший алкилом, замещенным [1,2,4] оксадиазол-3-илом или 2-оксо-пиперидин-1-илом;
R2 представляет собой водород или низший алкил;
R3 представляет собой водород, галоген, циано, низший алкил или низший алкил, замещенный галогеном;
R4 представляет собой водород или низший алкил; где R2 и R4 не одновременно являются водородом или низшим алкилом;
R5 представляет собой низший алкил;
R6 представляет собой галоген, гидрокси, низший алкил, низший алкокси, низший алкил, замещенный галогеном, мS(O)2-низший алкил или циано;
или их фармацевтически приемлемая кислотно-аддитивная соль.
Группой соединений по формуле Iб являются, например, следующие соединения:
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(4-циано-бензоил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-(6-метил-пиридазин-4-карбонил)-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(6-циано-пиридин-3-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(4′-фтор-бифенил-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-[4-(5-метил-[1,2,4]оксадиазол-3-ил)бензоил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-{(3R,4S)-4-(4-Хлор-фенил)-3-метил-1-[4-(2-оксо-пиперидин-1-ил)бензоил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир
рац-[(3S,4R)-4-(4-Хлор-фенил)-1-(4-циано-бензоил)-4-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир или
рац-{(3S,4R)-4-(4-Хлор-фенил)-4-метил-1-[4-(2-оксо-пиперидин-1-ил)бензоил]-пирролидин-3-ил}-метил-карбаминовой кислоты 4-фтор-фенил эфир.
Данные соединения по формуле I и их фармацевтически приемлемые соли могут быть получены способами, известными специалистам в данной области, например, с помощью процессов, описанных ниже, которые включают удаление защитной группы из соединения формулы
в обычной материи и в сочетании с соединением формулы
с соединением формулы
где определения R1, R2, R3, R4, R5 и R6 являются такими, как описано выше, и, при желании, полученные соединения превращаются в фармацевтически приемлемые кислотно-аддитивные соли.
Получение соединений формулы I по настоящему изобретению может осуществляться последовательным или конвергентным синтезом. Синтезы соединений по изобретению показаны на приведенной ниже схеме 1 и в описании для приготовления конкретных соединений 1-36. Навыки, необходимые для проведения реакции и очистки полученных продуктов, известны специалистам в данной области. Заместители и индексы, используемые в следующем описании процессов, имеют значения, указанные здесь ранее, если не указано обратное.
Схема 1
где R1-R6 являются такими, как определено выше, и R′′ представляет Me, Et и т.п. (любой эфир подходящей функциональности).
Следующая схема 1 описывает способы получения соединений формулы I более подробно. Исходное вещество формулы II является известным соединением или может быть получено в соответствии со способами, известными в данной области.
В соответствии со схемой 1 3,4-дизамещенный пирролидин III получают через стерео специфичное 1,3-биполярное циклоприсоединение между ненасыщенным производным сложного эфира II и азометинил илидом, генерированным на месте из N-(метоксиметил)-N-(фенилметил)-N-(триметилсилил) метиламина в присутствии каталитического количества кислоты, такой как TFA. Перегруппировка Курциуса освобожденной кислоты зависит от стандартных условий, например дифенилфосфорил азид в трет-бутаноле с получением соответствующего ВОС-защищенного амина. Это соединение удобно алкилировать в свободном положении NH с алкилгалогенидов в присутствии основания, такого как NEt3 или NaH. Затем ВОС-защитная группа расщепляется в кислых условиях с такими кислотами, как HCl или трифторуксусной кислоты. Аминогруппа преобразуется до соответствующей производной пирролидина IV с изоцианатами или, соответственно, с эквивалентом фосгена и соответствующего спирта или амина. Затем проводят селективное N-дебензилирование с использованием нескольких известных процедур, которые совместимы с заменой формы ароматического кольца с получением свободного пирролидина. Наконец, производные I готовят посредством муфты с соответствующим хлорангидридом или карбоновой кислотой.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. В частности, было обнаружено, что соединения по настоящему изобретению обладают хорошим сродством к рецептору NK 3.
Соединения исследовали в соответствии с тестом, приведенным в данном документе ниже.
Анализ [3Н] SR142801 конкурентного связывания.
Эксперимент связывания с рецептором hNK3 проводили с использованием [3Н] SR142801 (номер по каталогу TRK1035, удельная активность: 74,0 Ки/ммоль, Amersham, GE Healthcare UK limited, Buckinghamshire, UK) и клеточных мембран, выделенных из клеток НЕК293, временно экспрессирующих рекомбинантный человеческий рецептор NK3. После оттаивания, гомогенаты мембраны центрифугировали при 48000 g в течение 10 мин при 4°С, осадок ресуспендировали в 50 мМ Трис-HCl, 4 мМ MnCl2, 1 мкМ фосфорамидон, 0,1% BSA буфере для связывания при pН 7,4 до конечной концентрации 5 мкг белка/лунку. В экспериментах по ингибированию мембраны инкубировали с [3Н] SR142801 при концентрации, равной значению KD радиолиганда и 10 концентрации ингибирующего соединения (0.0003-10 мкМ) (в общем реакционном объеме 500 мкл) в течение 75 мин при комнатной температуре (RT). В конце инкубации мембраны фильтровали через фильтр (96-луночный белый планшет с GF/C фильтрами инкубировали 1 ч в 0,3% PEI+0,3% BSA, Packard BioScience, Meriden, CT) с помощью харвестера Filtermate 196 (Packard BioScience) и промывали 4 раза охлажденным 50 мМ трис-HCl, pН 7,4. Неспецифическое связывание измеряли в присутствии 10 мМ SB222200 как радиолиганда. Радиоактивность на фильтре подсчитывали (5 мин) на микропланшетном сцинтилляционном счетчике Packard Top-Count с коррекцией свечения после добавления 45 мкл Microscint 40 (Canberra Packard SA, Zurich, Switzerland) и встряхивания в течение 1 часа. Кривые ингибирования установлены в соответствии с уравнением Хилла: Y=100/(1+(X/IC50)nH), где nH = угловой коэффициент из программы Excel-fit 4 software (Microsoft). Величины IC50, полученные из кривой ингибирования и константа аффинности (Ki), рассчитывалась с использованием Cheng-Prussoff уравнения Ki=IC50/(1+[L/KD), где [L] означает концентрацию радиоактивного лиганда, а KD является его константой диссоциации с рецептором, полученные от насыщения изотермы. Все эксперименты проводили в двух повторениях, рассчитывали среднюю ± стандартная ошибка (SEM) отдельных значений Ki.
Результаты по химическим соединениям, обладающим хорошей аффинностью с рецептором hNK-3, приведены в таблице 1.
| Таблица 1 | |||
| Пример | Ki (мкМ) hNK3 | Пример | Ki (мкМ) hNK3 |
| 1 | 0.0105 | 19 | 0.0129 |
| 2 | 0.0201 | 20 | 0.2757 |
| 3 | 0.0678 | 21 | 0.0319 |
| 4 | 0.0116 | 22 | 0.0105 |
| 5 | 0.0864 | 23 | 0.0435 |
| 6 | 0.0649 | 24 | 0.0392 |
| 7 | 0.005 | 25 | 0.0915 |
| 8 | 0.013 | 26 | 0.6294 |
| 9 | 0.0021 | 27 | 0.051 |
| 10 | 0.0038 | 28 | 0.3476 |
| 11 | 0.0045 | 29 | 0.0245 |
| 12 | 0.0076 | 30 | 0.0053 |
| 13 | 0.01 | 31 | 0.0081 |
| 14 | 0.0774 | 32 | 0.0099 |
| 15 | 0.0115 | 33 | 0.02 |
| 16 | 0.2997 | 34 | 0.0029 |
| 17 | 0.0354 | 35 | 0.0213 |
| 18 | 0.0028 | 36 | 0.9973 |
Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли могут быть использованы в качестве лекарственных средств, например в виде фармацевтических препаратов. Фармацевтические препараты могут приниматься перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение может также быть осуществлено ректально, например, в форме суппозиторий, или парентерально, например, в виде растворов для инъекций.
Соединения формулы 1 и их фармацевтически приемлемые кислотно-аддитивные соли могут быть переработаны с фармацевтически инертными неорганическими или органическими эксципиентами для изготовления таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.д. могут быть использованы в качестве таких наполнителей, например, для таблеток, драже и твердых желатиновых капсул.
Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими наполнителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими наполнителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими наполнителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически ценные вещества.
Дозировка может варьироваться в широких пределах и, конечно, должна соответствовать индивидуальным требованиям в каждом конкретном случае. В целом, в случае перорального введения суточная доза составляет приблизительно от 10 до 1000 мг соединения общей формулы I, хотя верхний предел может быть также превышен, когда это необходимо.
Пример А
Таблетки следующего состава изготавливают обычным способом:
Количество вещества в мг на таблетку.
Активное вещество 5
Лактоза 45
Кукурузный крахмал 15
Микрокристаллическая целлюлоза 34
Стеарат магния 1
Масса таблетки 100
Пример Б
Капсулы следующего состава изготавливают:
Количество вещества в мг на капсулу
Активное вещество 10
Лактоза 155
Кукурузный крахмал 30
Тальк 5
Масса содержимого капсулы 200
Активное вещество, лактозу и кукурузный крахмал сначала смешивают в миксере и затем в измельчающей машине. Смесь возвращают в смеситель, добавляют тальк и тщательно смешивают.
Смесь помещают в твердые желатиновые капсулы.
Пример В
Суппозитории следующего состава изготавливают:
Количество вещества в мг на суппозиторию.
Активное вещество 15
Масса суппозитория 1285
Всего 1300
Суппозитории расплавляют в стеклянном или стальном сосуде, тщательно перемешивают и охлаждают до 45°С. Мелко измельченное активное вещество добавляют в смесь, перемешивают до его полного диспергирования. Смесь выливают в формы суппозиториев подходящего размера, дают остыть, затем суппозитории извлекают из форм и упаковывают по отдельности в вощеную бумагу или металлическую фольгу.
Следующие примеры 1-36 иллюстрируют настоящее изобретение, не ограничивая его. Все температуры даны в градусах по Цельсию.
Пример 1
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(1-изобутирил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
а) рац-(3R,4R)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-карбоновой кислоты метиловый эфир
Смесь 8,8 г (41,8 ммоль) (Е)-метил 3-(4-хлорфенил)-2-метилакрилата (свежеперегнанного), 0,476 г (4,18 ммоль) трифторуксусной кислоты и 12,4 г (52,2 ммоль) N-(метоксиметил)-N-(триметилсилилметил)-бензиламина в 100 мл дихлорметана перемешивали при 0-5°С в течение 1 ч и при комнатной температуре. NEt3 добавляли и смесь концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом этилацетата и гептана с получением после выпаривания фракций, содержащих 7,55 г (53%) продукта, указанного в заголовке соединения в виде бесцветного масла. MS м/е: 344,1 [М+Н]+.
б) рац-(3R,4R)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-карбоновой кислоты
Смесь 7,7 г (22,4 ммоль) рац-(3R,4R)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-карбоновой кислоты метилового эфира и 1,41 г (22,4 ммоль) LiOH. H2O в 80 мл ТГФ, 80 мл воды и 8 мл метанола нагревали с обратным холодильником в течение ночи. Органические растворители удаляли в вакууме и pН доводили до 4-5 добавлением HCl водн. (1 н.) Полученную смесь экстрагировали смесью этилацетат/ТГФ (2:1) и объединенные органические слои промывали рассолом, сушили с помощью Na2SO4, отфильтровывали и упаривали досуха. Остаток сушили с получением 7,2 г (97%) указанного в заголовке соединения в виде светло-коричневой пены. MS м/е: 328,3 [M+H]+.
в) рац-[(3R,4S)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-карбаминовой кислоты трет-бутиловый эфир
Смесь 5,6 г (17 ммоль) рац-(3R,4R)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-карбоновой кислоты, 2,4 г (18,7 ммоль) DIPEA и 5,14 г (18,7 ммоль) дифенилфосфорилазида в 120 мл трет-бутанола нагревали с обратным холодильником в течение ночи. Смесь концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом гептана и этилацетата с получением после выпаривания фракций, содержащих продукта 4,63 г (68%) указанного в заголовке соединения в виде желтого вязкого масла. MS м/е: 401,3 [М+Н]+.
г) рац-[(3R,4S)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метил-бутилового эфира 4-фтор-фенил эфир
Смесь 2,49 г (6,21 ммоль) рац-трет-бутил (3R,45)-1-бензил-4-(4-хлорфенил)-3-метилпирролидин-3-илкарбамат, 0,836 г (7,45 ммоль) трет.-бутилата калия и 0,98 г (7,76 ммоль) диметилсульфата в 80 мл ДМСО перемешивали при комнатной температуре в течение 1 часа. Смесь выливали в воду со льдом и экстрагировали ТВМЕ. Объединенные органические слои промывали солевым раствором, высушивали с помощью Na2SO4, отфильтровывали и упаривали досуха. Остаток растворяли в 40 мл дихлорметана и добавляли 7,68 г (67,3 ммоль) трифторуксусной кислоты. К смеси добавляли охлажденную воду и перемешивали при комнатной температуре в течение ночи. pН доводили до 12, а органический слой промывали насыщенным солевым раствором. Водный слой экстрагировали с помощью ДХМ и объединенные органические слои сушили над Na2SO4, фильтровали и упаривали досуха. Остаток растворяли в 40 мл дихлорметана и 1,04 г (8,08 ммоль) DIPEA и при -15°C, добавляли 1,29 г (7,41 ммоль) 4-фторфенил хлормуравьиной кислоты. Смесь перемешивали при 0°C в течение 2 ч и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом гептана и этилацетата с получением после выпаривания фракций, содержащих 1,68 г (59%) продукта указанного в заголовке соединения в виде светло-коричневого вязкого масла. MS м/е: 453,1 [М+Н]+.
д) рац-[(3R,4S)-4-(4-Хлор-фенил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
Смесь 1,65 г (3,64 ммоль) рац-[(3R,4S)-1-бензил-4-(4-хлор-фенил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор фениловый эфир, 0,75 г (5,83 ммоль) DIPEA и 0,78 г (5,46 ммоль) 1-хлорэтилхлорформиата в 40 мл толуола перемешивали при комнатной температуре и выпаривали досуха. Остаток растворяли в 40 мл метанола и перемешивали в течение 2 ч при комнатной температуре и выпаривали досуха с получением сырого указанного в заголовке соединения, которое использовали без дальнейшей очистки в следующих этапах.
е) рац-[(3R,4S)-4-(4-хлорфенил)-1-(1-изобутирил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфира
Смесь 34 мг (0,093 ммоль) рац-4-фторфенил (3R,4S)-4-(4-хлорфенил)-3-метилпирролидин-3-ил (метил) карбамата, 14,9 мг (0,075) ммоль 1-изобутирил-пиперидин-4-карбоновой кислоты, 34,2 (0,09 ммоль) HATU и 58 мг (0,45 ммоль) DIPEA в 2 мл диметилформамида встряхивали в течение 3 ч при комнатной температуре. Смесь подвергали очистке с помощью препаративной ВЭЖХ на обращенной фазе с элюированием градиентом ацетонитрила, воды и NEt3 с получением после выпаривания фракций, содержащих продукта 26.8 (66%) указанного в заголовке соединения в виде светло-желтого вязкого масла. MS м/е: 544,2 [М+Н]+.
Пример 2
рац-[(3R,4S)-4-(4-Хлор-фенил)-1-(1-циклогексил-пиперидин-4-карбонил)-3-метил-пирролидин-3-ил]-метил-карбаминовой кислоты 4-фтор-фенил эфир
По аналогии с про