Способ прогнозирования риска развития iii стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом
Иллюстрации
Показать всеИзобретение относится к области медицинской диагностики и может быть использовано как способ прогнозирования риска развития III стадии гипертонической болезни у индивидуумов русской национальности, являющихся уроженцами Центрального Черноземья РФ, больных гипертонической болезнью с метаболическим синдромом. Способ включает забор крови, выделение ДНК из периферической венозной крови, анализ сочетаний полиморфизмов генов -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2. Факторами риска развития III стадии у больных гипертонической болезнью, имеющих метаболический синдром, являются комбинации генетических вариантов -308A TNFα с +1663G TNFR2, или +250G Ltα с +36G TNFR1, или +250G Ltα с +1663G TNFR2. При определении комбинации -308GG TNFα с +250A Ltα, или -308G TNFα с +250AA Ltα, или -308G TNFα с +250A Ltα прогнозируют низкий риск развития III стадии у больных гипертонической болезнью с метаболическим синдромом. 5 ил., 6 пр.
Реферат
Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования риска развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом.
Гипертоническая болезнь наряду с ожирением, гиперинсулинемией, дислипидемией входит в состав метаболического синдрома [Клинические рекомендации по ведению больных с метаболическим синдромом, 2013]. У 60% пациентов, страдающих только гипертонической болезнью и не имеющих других клинических симптомов, на основе лабораторных тестов диагностируют метаболический синдром [Артериальная гипертония и метаболический синдром: к вопросу о возможностях метформина и β-блокаторов /О.Д. Остроумова, А.А. Зыкова, С.А. Жижина [и др.] //Consilium medicum. - 2008. - Т. 10, №5 - С. 73-79]. Риск сердечно-сосудистых заболеваний увеличивается у женщин в 5,9 раз, у мужчин - в 2,3 раза при сочетании гипертонической болезни с метаболическими нарушениями. Кроме того, гипертоническая болезнь у индивидуумов с метаболическим синдромом отличается ранней манифестацией заболевания и более высокими цифрами артериального давления [Место комбинированной терапии в лечении больных с метаболическим синдромом /И.Е. Чазова, Ю.В. Жернакова, В.Б. Мычка //Кардиоваскулярная терапия и профилактика. - 2010. - №4 - С. 104-106].
Следует подчеркнуть, что больные гипертонической болезнью в большинстве случаев (70%) не знают о наличии у себя данного заболевания и поэтому своевременно не обращаются за медицинской помощью и выявление гипертонической болезни происходит на стадиях, сопровождающихся поражением органов-мишеней и развитием ассоциированных клинических состояний. При этом положительный эффект от лечения регистрируется только у 22% пациентов [Национальные клинические рекомендации [Текст] /Всерос. науч. о-во кардиологов; под ред. Р. Г. Оганова. - 3-е изд. - Москва: Силицея-Полиграф, 2010. - 592 с. ]. Поэтому прогнозирование риска развития III стадии гипертонической болезни позволит формировать среди больных метаболическим синдромом группы риска и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятия по предупреждению прогрессирования гипертонической болезни.
Важную роль в патогенезе гипертонической болезни играют цитокины, в частности факторы некроза опухолей и их рецепторы, которые обладают множеством медико-биологических эффектов и могут влиять на развитие и прогрессирование данной патологии [Li, Y. Y. Tumor necrosis factor-alpha g308α gene polymorphism and essential hypertension: a meta-analysis involving 2244 participants [Text] /Y. Y. Li //PLoS One. - 2012. - Vol.7, №4. - Art. e35408].
Среди цитокинов особого внимания заслуживает фактор некроза опухоли α (TNFα) - белок, состоящий из 157 аминокислот. TNFα представляет собой провоспалительный многофункциональный цитокин, который синтезируется активированными макрофагами, моноцитами, нейтрофилами, дендритными клетками, Т- и В-лимфоцитами, эндотелиальными, гладкомышечными клетками, натуральными киллерами и тучными клетками [Hollegaard, M.V. Cytokine gene polymorphism in human disease [Text] /M.V. Hollegaard, J.L. Bidwell //Genes Immun. - 2006. - Vol.7. - Suppl. 3. - P. 269-276]. Он является активатором иммунной системы, регулирует воспалительные реакции, а также выполняет роль вазоактивного медиатора [The -308G/A of tumor necrosis factor (TNF)-α and 825C/T of guanidine nucleotide binding protein 3 (GNB3) are Associated with the Onset of Acute Myocardial Infarction and Obesity in Taiwan [Text] /W.-T. Chang, Y.-C. Wang, C.-C. Chen [et al.] //Int. J. Mol. Sci. - 2012. - Vol.13, №2. - P. 1846-1857].
Лимфотоксин α (Ltα или TNFbeta) представляет собой провоспалительный цитокин и относится к семейству фактора некроза опухоли. Ltα по своей структуре и по происхождению схож с TNFα. Они представляют собой два близких белка, имеющих около 30% гомологичных аминокислотных остатков [Tandem arrangement of the genes coding for tumor necrosis factor (TNF-alpha) and lymphotoxin (TNF-beta) in the human genome /S.A. Nedospasov, A.N. Shakhov, R.L. Turetskaya et al. //Cold Sping Harbor Symp. Quant. Biol. - 1986. - Vol.51. - P. 611-625]. Лимфотоксин α вырабатывается В и Т лимфоцитами, а также эпителио- и эндотелиоцитами, фибробластами, астроцитами, миеломными клетками, но в меньших количествах и значительно медленнее (на 2-е - 3-и сутки после активации) по сравнению с TNFα [Lymphotoxin-alpha and cardiovascular disease: clinical association and pathogenic mechanisms [Text] /J. J.Naoum, H. Chai, P. H. Lin [et al.] //Med. Sci. Monit. - 2006. - Vol.12, №7. - P.RA121-RA124]. Кроме того, их отличает то, что Ltα не синтезируется макрофагами и не вырабатывается в ответ на появление бактериальных эндотоксинов.
TNFα и Ltα являются плейотропными цитокинами и проявляют сходную активность в воспалительных реакциях, иммунных и опухолевых процессах [Association of cytokine gene polymorphisms with psoriasis in cases from the Nile Delta of Egypt [Text] /A. Settin, H. Hassan, R. El-Baz [et al.] //Acta Dermatovenerol. Alp. Pannonica Adriat. - 2009. - Vol.18, №3. - P. 105-112]. Для реализации своих эффектов Ltα и TNFα взаимодействуют с одними и теми же рецепторами.
Рецептор фактора некроза опухоли 1-го типа (TNFR1), который известен также как CD120a, имеет большое значение в передаче сигнала. Он реализует все возможные виды действий факторов некроза опухолей, такие как апоптоз, пролиферация и дифференцировка клеток, плюс ко всему проявляет противовирусную активность, регулирует воспалительный ответ [Peripheral receptor targets for analgesia: novel approaches to pain treatment [Text] /ed. by E. C. Brian. - Hoboken, N.J.: John Wiley Sons, 2009. - 541 p.].
Рецептор фактора некроза опухоли 2-го типа TNFR2, который известен также как CD120b, обеспечивает реализацию метаболических эффектов факторов некроза опухолей, регулируя углеводный и жировой обмен. Также TNFR2 вовлечен в регуляцию транскрипции генов, отвечающих за адаптацию клетки [Fischer, R. A soluble TNF receptor 2 agonist as a new therapeutic approach to treat autoimmune and demyelinating diseases [Text]: Einlöslicher TNF Rezeptor 2 Agonist alsneuer the rapeutischer Ansatzzur Behandlung von Autoimmun- und Demyel inisierenden Erkrankungen /R. Fischer; In-t für Zellbiologie und Immunologie Universität Stuttgart. - Stuttgart, 2011. - 139 p.].
В изученной научно-медицинской и доступной патентной литературе авторами не было обнаружено способа прогнозирования риска развития III стадии у больных гипертонической болезнью с метаболическим синдромом на основе данных о сочетаниях генетических полиморфизмов -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2.
Для оценки сложившейся патентной ситуации был выполнен поиск по охранным документам за период с 1990 по 2012 гг. Анализ документов производился по направлению: способ прогнозирования риска развития III стадии у больных гипертонической болезнью с метаболическим синдромом на основе молекулярно-генетических данных в зависимости от полиморфных маркеров генов факторов некроза опухолей и их рецепторов.
Известен способ прогнозирования развития метаболического синдрома при артериальной гипертонии у мужчин по заявке на изобретение №RU2005108895/15 (публикация:10.09.2006), включающий забор крови и определение биохимических показателей, стабильности клеточных мембран и расчет прогностического коэффициента.
Недостаток метода заключается в том, что он рассматривает риск развития метаболического синдрома, во-первых, только у мужчин. Во-вторых, не рассматриваются гены-кандидаты, связанные с воспалительным механизмом развития гипертонической болезни и метаболического синдрома, и не определяются риски развития III стадии у больных гипертонической болезнью с метаболическим синдромом, например ожирением, гиперинсулинемией, дислипидемией.
Задачей настоящего исследования является расширение арсенала способов диагностики, а именно создание способа прогнозирования развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом на основе данных о сочетаниях генетических вариантов.
Технический результат использования изобретения - получение критериев оценки риска развития III стадии гипертонической болезни у индивидуумов русской национальности, являющихся уроженцами Центрального Черноземья, страдающих гипертонической болезнью I стадии с метаболическим синдромом, т.е ожирением, гиперинсулинемией, дислипидемией, на основе данных о сочетаниях генетических вариантов локусов -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2.
В соответствии с поставленной задачей был разработан способ прогнозирования риска развития III стадии у больных гипертонической болезнью с метаболическим синдромом, включающий:
- забор крови;
- выделение ДНК из периферической венозной крови;
- анализ полиморфизмов генов -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2;
- прогнозирование повышенного риска развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом в случае выявления комбинаций генетических вариантов -308A TNFα с +1663G TNFR2, или +250G Ltα с +36G TNFR1, или +250G Ltα с +1663G TNFR2;
- прогнозирование низкого риска развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом в случае выявления комбинаций генетических вариантов: -308GG TNFα с +250A Ltα, или -308G TNFα с +250AA Ltα, или -308G TNFα с +250A Ltα.
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогноза риска развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом по данным о сочетаниях генетических вариантов локусов -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2.
Способ осуществляют следующим образом:
ДНК выделяют из образцов периферической венозной крови индивидуумов в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (pH=7,6). Полученную смесь перемешивают и центрифугируют при 4ºС, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН=8,0) и 75 мМNaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37ºС в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°С. Выделенную ДНК использовали для проведения полимеразной цепной реакции синтеза ДНК.
Анализ локусов -308G/A TNFα, +250G/A Ltα, +36A/G TNFR1, +1663A/G TNFR2 осуществляют методами полимеразной цепной реакции (ПЦР) синтеза ДНК. ПЦР проводят на аппарате IQ5 (Bio-Rad) в режиме real time с использованием стандартных олигонуклеотидных праймеров и зондов, синтезированных фирмой «Синтол» с последующим анализом полиморфизмов методом дискриминации аллелей. Для дискриминации аллелей использовалась программа Bio-Rad «IQ5-Standart Edition».
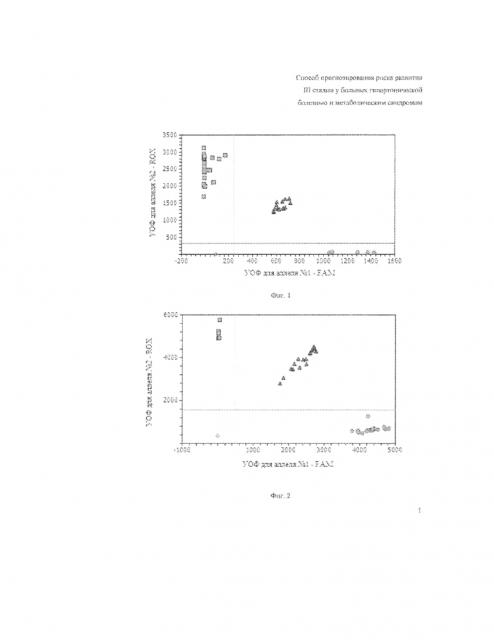
На фигурах 1-4 две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием RFU для одного флуорофора (на оси x) относительно RFU для другого флуорофора (на оси y) на диаграмме дискриминации аллелей.
• Если значения RFU неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (GA).
• Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно (в данном случае неопределенный образец - отрицательный контроль).
Для фигур 1, 3:
• Если значения RFU неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю A (RFU аллеля A отложены по оси y).
• Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю G (RFU аллеля G отложены по оси x).
Для фигур 2, 4:
• Если значения RFU неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю G (RFU аллеля G отложены по оси y).
• Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю A (RFU аллеля A отложены по оси x).
Изобретение охарактеризовано на следующих чертежах:
фиг. 1, где представлена дискриминация аллелей по локусу -308G/A TNFα, где ○ - гомозиготы-308АА TNFα, □ - гомозиготы-308GG TNFα, ∆ - гетерозиготы-308GA TNFα, ◊ - отрицательный контроль;
фиг. 2, где представлена дискриминация аллелей по локусу +250A/G Ltα, где
○ - гомозиготы+250GG Ltα, ∆ - гетерозиготы+250AG Ltα, □ - гомозиготы+250AA Ltα, ◊ - отрицательный контроль;
фиг. 3, где представлена дискриминация аллелей по локусу +36A/G TNFR1, где ○ - гомозиготы+36AA TNFR1, ∆ - гетерозиготы+36AG TNFR1, □ - гомозиготы+36GG TNFR1, ◊ - отрицательный контроль;
фиг. 4, где представлена дискриминация аллелей по локусу +1663A/G TNFR2, где ○ - гомозиготы+1663GG TNFR2, ∆ - гетерозиготы+1663AG TNFR2, □ - гомозиготы+1663AA TNFR2, ◊ - отрицательный контроль;
фиг. 5, на которой представлена таблица, где показана распространенность сочетаний аллелей/генотипов генов факторов некроза опухолей и их рецепторов у больных гипертонической болезнью III стадии с метаболическим синдромом и в контрольной группе.
Возможность использования предложенного способа для оценки риска развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом подтверждает анализ результатов наблюдений 54 пациентов с метаболическим синдромом и гипертонической болезнью III стадии и 531 человек контрольной группы. Формирование выборок больных и контроля осуществлялись на базе кардиологического отделения Белгородской областной клинической больницы Святителя Иоасафа.
Критерии включения в исследуемые выборки:
1. Индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья РФ и не имеющие родства между собой.
2. Добровольное согласие пациентов на проведение исследования.
3. В группу больных включались индивидуумы только после установления диагноза гипертонической болезни и наличия метаболического синдрома, как ожирение, гиперинсулинемия, дислипидемия, который подтверждался клиническими и лабораторно-инструментальными методами обследования, в соответствии с обязательными диагностическими стандартами, рекомендованными ВНОК [Рекомендации ВНОК, 2010].
4. В контрольную группу включались индивидуумы без метаболического синдрома и заболеваний сердечно-сосудистой системы.
Критерии исключения из исследуемых выборок:
1. Пациенты с симптоматическими артериальными гипертензиями.
2. Наличие тяжелой соматической патологии (печеночная, почечная недостаточность, аутоиммунные и онкологические заболевания).
3. Больные нерусской национальности, родившиеся вне Центрального Черноземья России.
4. Индивидуумы, отказавшиеся от проводимого исследования.
Типирование молекулярно-генетических маркеров осуществлялось в лаборатории «Молекулярной генетики человека» медицинского института Белгородского государственного национального исследовательского университета.
Изучение роли комбинаций генетических вариантов -308G/A TNFα, +250G/A Ltα, +36A/G TNFR1, +1663A/G TNFR2 в формирование III стадии у больных гипертонической болезнью с метаболическим синдромом проводилось с помощью программного обеспечения APSampler [http://sources.redhat.com/cygwin/], использующего метод Монте-Карло марковскими цепями и байесовскую непараметрическую статистику [A Gibbs sampler for identification of symmetrically structured, spaced DNA motifs with improved estimation of the signal length [Text] /A. V.Favorov, M. S. Gelfand, A. V. Gerasimova [et al.] //Bioinformatics. - 2005. - Vol.21, №10. - P. 2240-2245]. С целью минимизации ошибок 1-го рода, связанных с получением ложноположительных результатов при проведении множественных сравнений, вводили поправку Бонферрони - производили перерасчет уровня значимости р для множественных парных сравнений по формуле: pcor=р×n, где р - полученный уровень статистической значимости, n - количество парных сравнений. За статистически значимый уровень принимали pcor≤ 0,05 [Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA /О. Ю. Реброва. - [3-е изд.]. - Москва: Медиа Сфера, 2006. - 305 с.: ил.].
Как следует из данных, представленных в таблице на фиг. 5:
- повышенный риск развития III стадии у больных гипертонической болезнью с метаболическим синдромом (OR=2,20) определяется сочетанием двух генетических маркеров аллеля +250G Ltα с аллелем +1663G TNFR2. Концентрация этой комбинации среди пациентов (57,41%) в 1,51 раза превышает аналогичный показатель контрольной группы (38,01%, p=0,005, pcor=0,02, 95% CI 1,24-3,90).
Выявлены различия в концентрациях комбинации аллеля -308A TNFα с аллелем +1663G TNFR2 между больными с III стадией гипертонической болезни, имеющими метаболический синдром (44,44%), и контрольной группой (17,19%). Следовательно, данное сочетание является фактором риска формирования III стадии гипертонической болезни у индивидуумов с метаболическим синдромом (p=0,000015, pcor=0,00006, OR=3,85, 95% CI 2,13-6,98).
Сочетание аллеля +250G Ltα и аллеля +36G TNFR1 встречается среди больных с метаболическим синдромом и гипертонической болезнью III стадии с наибольшей частотой (57,41%) по сравнению с контролем (37,48%), т.е эта комбинация генетических вариантов цитокинов также является фактором риска развития гипертонической болезни III стадии у больных с метаболическим синдромом (p=0,004, pcor=0,016, OR=2,25, 95% CI 1,27-3,96).
Противоположной направленности различия зарегистрированы по сочетанию двух молекулярно-генетических факторов: аллеля -308G TNFα и генотипа +250AA Ltα. В контрольной группе (52,16%) данная комбинация встречается в 1,76 раза чаще по сравнению с группой больных гипертонической болезнью, имеющих III стадию заболевания и метаболический синдром. Следовательно, данное сочетание является протективным фактором формирования III стадии гипертонической болезни у индивидуумов с метаболическим синдромом (29,63%, p=0,0012, pcor=0,007, OR=0,39, 95% CI 0,21-0,71).
Также зарегистрированы различия в распространенности сочетаний аллеля -308G TNFα и аллеля +250A Ltα между больными гипертонической болезнью III стадии с метаболическим синдромом (81,48%) и контролем (93,41%). Данная комбинация полиморфных вариантов генов факторов некроза опухолей является протективной для формирования гипертонической болезни III стадии у больных с метаболическим синдромом (р=0,005, pcor=0,02, OR=0,31, 95% CI 0,14-0,67).
Кроме того, выявлены различия в концентрациях комбинации генотипа -308GG TNFα с аллелем +250A Ltα между больными с III стадией гипертонической болезни, имеющими метаболический синдром (50,00%), и контрольной группой (76,46%). Данное сочетание является протективным фактором формирования у индивидуумов III стадии гипертонической болезни с метаболическим синдромом (p=0,00006, pcor=0,00036, OR=0,31, 95% CI 0,17-0,54).
Таким образом, результаты, полученные с помощью биоинформатического анализа, свидетельствуют о вовлеченности комбинаций полиморфных вариантов генов фактора некроза опухоли α (-308G/A TNFα), лимфотоксина α (+250A/G Ltα), рецептора фактора некроза опухоли 1-го типа (+36A/G TNFR1) и рецептора фактора некроза опухоли 2-го типа (+1663A/G TNFR2) в формирование III стадии у больных гипертонической болезнью, имеющих метаболический синдром.
В качестве примеров конкретного выполнения предложенного способа было проведено генетическое обследование по локусам -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2 шестерых больных русской национальности, являющихся жителями Центрального Черноземья, страдающих гипертонической болезнью I стадии с метаболическим синдромом.
Пример 1. У пациента А. было выявлено сочетание генетических вариантов -308АА TNFα c +1663GG TNFR2. На основании этого у него прогнозируют неблагоприятное течение гипертонической болезни развитие III стадии заболевания и включают в группу повышенного риска развития III стадии гипертонической болезни. Ему назначен комплекс профилактических мероприятий по предупреждению развития III стадии гипертонической болезни: динамический контроль показателей артериального давления, спортивная ходьба не менее 1 часа в день, соблюдение гипохолестериновой диеты, а также ограничение употребления поваренной соли, снижение избыточного веса, нормализация психоэмоционального состояния, диспансерное наблюдение у врача кардиолога и др.
Пример 2. У пациента В. было выявлено сочетание генетических вариантов +250GG Ltα c +36GG TNFR1. На основании этих результатов у него прогнозируют повышенный риск развития III стадии гипертонической болезни. Пациент В. включен в группу повышенного риска развития III стадии гипертонической болезни и ему назначен комплекс профилактических мероприятий по предупреждению развития III стадии гипертонической болезни
Пример 3. У пациента С.было выявлено сочетание генетических вариантов +250GG Ltα c +1663GG TNFR2. На основании этих данных у него прогнозируют повышенный риск развития III стадии гипертонической болезни. Данный пациент включен в группу повышенного риска развития III стадии гипертонической болезни и ему назначен комплекс профилактических мероприятий по предупреждению развития III стадии гипертонической болезни.
Пример 4. У пациента Д. было выявлено сочетание генетических вариантов -308GG TNFα c +250А Ltα и на основании этого у него прогнозируют низкий риск развития III стадии гипертонической болезни.
Пример 5. У пациента Е. было выявлено сочетание генетических вариантов -308G TNFα c +250АА Ltα и на основании этого у него прогнозируют низкий риск развития III стадии гипертонической болезни.
Пример 6. У пациента Ж. было выявлено сочетание генетических вариантов -308G TNFα c +250А Ltα и на основании этого у него прогнозируют низкий риск развития III стадии гипертонической болезни.
Использование данного способа позволяет прогнозировать риск возникновения III стадии гипертонической болезни у индивидуумов русской национальности, являющихся жителями Центрального Черноземья, больных гипертонической болезнью с метаболическим синдромом.
Всем пациентам с гипертонической болезнью и метаболическим синдромом при выявлении генетических факторов риска развития III стадии гипертонической болезни следует рекомендовать динамический контроль за уровнем артериального давления с последующим назначением гипотензивных лекарственных средств: ингибиторов АПФ, блокаторов кальциевых каналов, диуретиков или блокаторов рецепторов ангиотензина II, с индивидуальным подбором препарата в каждом конкретном случае; диспансерное наблюдение у врача кардиолога, проведение с профилактической целью курсов антитромботической (антиагреганты и непрямые антикоагулянты) и гиполипидемической (статины) терапии, соблюдение гипохолестериновой диеты, ограничение употребления поваренной соли, снижение избыточного веса.
Способ прогнозирования риска развития III стадии гипертонической болезни у больных гипертонической болезнью с метаболическим синдромом, включающий забор крови, отличающийся тем, что из периферической венозной крови больных выделяют ДНК, проводят анализ полиморфизмов генов -308G/A TNFα, +250A/G Ltα, +36A/G TNFR1, +1663A/G TNFR2 и прогнозируют повышенный риск развития III стадии гипертонической болезни у индивидуумов русской национальности, являющихся уроженцами Центрального Черноземья РФ, больных гипертонической болезнью с метаболическим синдромом, в случае выявления комбинаций генетических вариантов -308А TNFα c +1663G TNFR2, или +250G Ltα c +36G TNFR1, или +250G Ltα c +1663G TNFR2; а низкий риск развития III стадии гипертонической болезни у индивидуумов русской национальности, являющихся уроженцами Центрального Черноземья РФ, больных гипертонической болезнью с метаболическим синдромом, прогнозируют в случае выявления комбинаций генетических вариантов -308G TNFα c +250А Ltα.