Новые соединения
Иллюстрации
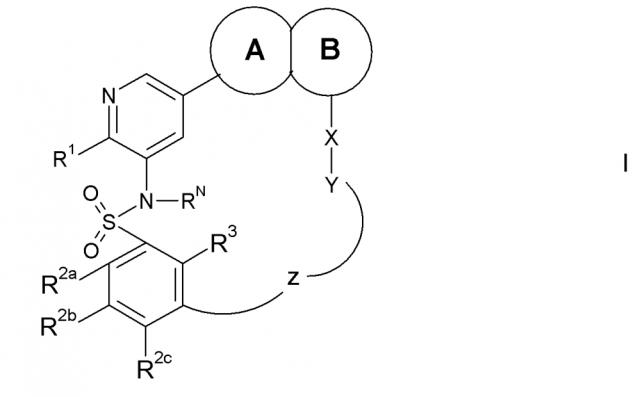
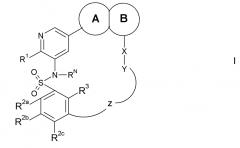
Показать всеИзобретение относится к соединению формулы I,
в которой кольцо А и кольцо В представляют собой конденсированную бициклическую группу, R1 обозначает заместитель, выбранный из водорода, галогена или ORf7; каждый R2a, R2b, R2c, R3 независимо выбраны из водорода, галогена, -CN, -ORf7 или C1-6 алкила, в случае необходимости замещенного одним или более заместителями, выбранными из =O и Е1; X обозначает прямую связь; Y обозначает -арилен-, -гетероарилен-, причем -арилен- и -гетероарилен- могут быть замещены Е3, причем Е3 обозначает галоген, или -гетероциклоалкилен-, в случае необходимости замещенный одним или более заместителями, выбранными из =O и Е4, RN обозначает водород или C1-6 алкил, в случае необходимости замещенный одним или более заместителями, выбранными из =O и Е5; Z обозначает -С(О)-[Т1] - или -С(О)N(Rx3)-[Т1]-, в которых Т1 обозначает -(СН2)0-4-Т2- и Т2 обозначает прямую связь или -С(O)-N(Н)-СН2-; или его фармацевтически приемлемый сложный эфир, амид, причем эти соединения являются пригодными для использования в лечении заболеваний, в которых желательно и/или требуется ингибирование протеин- или липид-киназы (например, PI3-K, особенно класса I PI3K, семейства киназ PIM и/или mTOR), и особенно в лечении рака. 5 н. и 4 з.п. ф-лы, 1 ил., 4 табл.
Реферат
Область изобретения
Это изобретение относится к новым фармацевтически полезным соединениям, которые могут быть использованы как ингибиторы протеин- или липид-киназ (такие как ингибиторы семейства фосфоинозитид 3'OH киназ (киназа PI3), особенно подтип класса I PI3K). Соединения могут также быть использованы как ингибиторы млекопитающей мишени рапамицина (mTOR) и могут также быть использованы как ингибиторы семейства киназ PIM (например, PIM-3 и особенно PIM-1). Эти соединения имеют потенциальную полезность в лечении таких заболеваний как рак. Изобретение также относится к применению таких соединений в качестве лекарственных средств, к применению таких соединений для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающих (или связанных патологических состояний), к содержащим их фармацевтическим композициям и к путям синтеза для их получения.
Уровень техники
Неправильное функционирование протеинкиназ (PKs) является признаком многочисленных заболеваний. Значительное число онкогенов и протоонкогенов, участвующих в раковых заболеваниях человека, кодирует PKs. Увеличенные активности PKs также участвуют во многих доброкачественных заболеваниях, таких как доброкачественная гиперплазия предстательной железы, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация гладкомышечных клеток сосудов, связанная с атеросклерозом, легочным фиброзом, артритом, гломерулонефритом и постоперационным стенозом и рестенозом. PKs также участвуют в воспалительных состояниях и в размножение вирусов и паразитов. PKs могут также играть главную роль в патогенезе и развитии нейродегенеративных нарушений.
В качестве общей ссылки в отношении неправильного функционирования или дисрегуляции PKs см., например, Current Opinion in Chemical Biology 1999, 3, 459-465.
Фосфатидилинозитол 3-киназы (PI3Ks) представляют собой семейство липид и серин/треонин-киназ, которые катализируют фосфорилирование мембранного липида фосфатидилинозитола (PI) на 3'-OH кольца инозитола с образованием фосфоинозитол-3-фосфата (PIP), фосфоинозитол-3,4-дифосфата (PIP2) и фосфоинозитол-3,4,5-трифосфата (PIP3), который действуют как участки рекрутирования для различных внутриклеточных сигнальных белков, которые в свою очередь образуют сигнальные комплексы для передачи внеклеточных сигналов к цитоплазматической поверхности плазматической мембраны. Эти подтипы 3'-фосфоинозитида функционируют как вторичные мессенджеры во внутриклеточных путях трансдукции сигналов (см., например, Trends Biochem. Sci 22 87,267-72 (1997), Vanhaesebroeck et al.; Chem. Rev. 101 (8), 2365-80 (2001), Leslie et al (2001); Annu. Rev. Cell. Dev. Boil. 17, 615-75 (2001), Katso et al; и Cell. Mol. Life Sci. 59 (5), 761-79 (2002), Toker et al).
Множественные изоформы PI3K, категоризированные по их каталитическим субъединицам, их регуляции соответствующими регуляторными субъединицами, структурам экспрессии и сигналспецифическим функциям (p110α, β, δ, γ) выполняют эту ферментативную реакцию (Exp. Cell. Res. 25 (1). 239-54 (1999), Vanhaesebroeck and Katso et al., 2001, выше).
Близко связанные изоформы p110α и β экспрессируются повсеместно, в то время как δ и γ более специфично экспрессируются в системе гематопоэтических клеток, гладкомышечных клетках, миоцитах и эндотелиальных клетках (см. например, Trends Biochem. Sci. 22 (7). 267-72 (1997), Vanhaesebroeck et al). Их экспрессия может также регулироваться индуцируемым образом в зависимости от клеточного, тканевого типа и стимулов, а также от контекста заболевания. Индуцируемость экспрессии белка включает синтез белка, а также стабилизацию белка, которая частично регулируется ассоциацией с регуляторными субъединицами.
Восемь PI3K млекопитающих были идентифицированы к настоящему времени, включая четыре PI3K класса I. Класс Ia включает PI3Kα, PI3Kβ и PI3Kδ. Все ферменты класса Ia представляют собой гетеродимерные комплексы, включающие каталитическую субъединицу (p110α, p110β или p110δ), связанную с доменом SH2, содержащим адаптерную субъединицу p85. Класс Ia PI3K активируется через трансдукцию сигналов тирозин киназы и участвует в пролиферации и выживании клеток. PI3Kα и PI3Kβ также участвуют в онкогенезе в различных видах человеческого рака. Таким образом, фармакологические ингибиторы PI3Kα и PI3Kβ могут быть использованы для лечения различных типов рака.
Потенциальная роль сверхсигнализации PI3K в развитии лимфоидных злокачественных образований была первоначально идентифицирована в эксперименте Borlado et al. (Borlado LR, Redondo C, Alvarez B, et al. Increased phosphoinositide 3-kinase activity induces a lymphoproliferative disorder and contributes to tumor generation in vivo., FASEB J 2000;14(7):895-903). В этом исследовании на модели мыши со сверхтрансдукцией сигналов PI3K развивали инфильтрационные лимфопролиферативные нарушения, а также аутоиммунное заболевание. Путь PI3K играет важную роль в развитии В-клеточных злокачественных образований, главным образом через активацию субъединицы p110δ. Ингибирование p110δ может играть роль в управлении В-клеточными злокачественными нарушениями, такими как хронический лимфоцитарный лейкоз (CLL), неходжкинская лимфома (NHL), плазмаклеточная миелома (PCM) и лимфома Ходжкина (HL) (в качестве обзора см. Expert Opin Investig Drugs. 2012 Jan;21(1):15-22. CAL-101: a phosphatidylinositol-3-kinase p110-delta inhibitor for the treatment of lymphoid malignancies., Castillo JJ, Furman M, Winer ES).
PI3Kγ, единственный член Класса Ib PI3Ks, состоит из каталитической субъединицы p110γ, которая связана с регуляторной субъединицей p110. PI3Kγ регулируется рецепторами, связанными с G-белком (GPCRs), через ассоциацию с субъединицами βγ гетеротримерных G-белков. PI3Kγ экспрессируется прежде всего в гематопоэтических клетках и кардиомиоцитах и участвует в воспалении и функции тучных клеток. Таким образом, фармакологические ингибиторы PI3Kγ могут быть использованы для лечения различных воспалительных заболеваний, аллергий и сердечно-сосудистых заболеваний.
Эти наблюдения показывают, что дерегуляция фосфоинозитол-3-киназы и апстрим- и даунстрим-компонентов этого сигнального пути представляет собой одну из наиболее общих дерегуляций, связанных с раковыми и пролиферативными заболеваниями человека (см. например. Parsons et al., Nature 436:792 (2005); Hennessey et al., Nature Rev. Drug Discovery 4: 988-1004 (2005)).
Млекопитающая мишень рапамицина (mTOR), также известная как 12-рапамицин-ассоциированный белок 1 FK506 связывающего белка (FRAP1), является белком, который у человека кодируется геном FRAP1. mTOR представляет собой серин/треонин-протеинкиназу, которая регулирует рост клеток, пролиферацию клеток, подвижность клеток, выживание клеток, синтез белка и транскрипцию. Ингибирование mTORs, как полагают, является полезным для лечения различных заболеваний/состояний, таких как рак (например, как описано в Easton et al. (2006). ″mTOR and cancer therapy″. Oncogene 25 (48): 6436-46).
Перечисление или обсуждение очевидно ранее опубликованного документа в этом описании не обязательно должно приниматься как подтверждение, что этот документ составляет часть уровня техники или относится к общим знаниям.
Для лечения рака нацеливаемые терапии становятся все более важными. Речь идет о терапии, которая имеет эффект интерференции со специфическими целевыми молекулами, которые связаны с ростом опухоли и/или онкогенезом. Такая терапия может быть более эффективной, чем существующие виды лечения (например, химиотерапия), и менее вредной для нормальных клеток (например, потому что химиотерапия имеет потенциал для уничтожения как нормальных клеток, так и злокачественных клеток). Это, и также факт, что нацеливаемые терапии могут быть селективными (то есть, могут ингибировать определенную молекулу-мишень более селективно по сравнению с другими молекулярными мишенями, например, как описано в дальнейшем), может иметь выгоду в плане уменьшения побочных эффектов и может также иметь выгоду в том, что определенный специфический вид рака может подвергаться лечению (также селективно). Последнее может, в свою очередь, также уменьшить побочные эффекты.
PIM-1 представляет собой протоонкоген, активируемый вирусом лейкоза мышей (сайт интеграции провируса для вируса лейкоза мышей Moloney-MoMuLV), который индуцирует Т-клеточную лимфому [Cuypers, H.T., et. al. Cell, 1984, 37, 141-150].
Экспрессия протоонкогена продуцирует нетрансмембранную серин/треонин-киназу из 313 остатков, включая киназный домен, состоящий из 253 аминокислотных остатков. Две изоформы известны альтернативной инициацией (p44 и p33) [Saris, C.J.M. et al. EMBO J. 1991, 10, 655-664].
PIM-1, PIM-2 и PIM-3 фосфорилируют белковые субстраты, которые являются важными в неогенезе и прогрессии рака. Например, PIM-1 фосфорилирует, среди прочего, p21, Bad, c-myb, Cdc 25a и eIF4B (см., например, Quian, K. C. et al, J. Biol. Chem. 2005, 280(7), 6130-6137, и указанные там ссылки).
Были описаны два гомолога PIM-1 [Baytel, D. Biochem. Biophys. Acta 1998, 1442, 274-285; Feldman, J. et al. J. Biol. Chem. 1998, 273, 16535.16543]. PIM-2 и PIM-3 являются, соответственно, на 58% и 69% идентичными PIM-1 на уровне аминокислот. PIM-1 главным образом экспрессируется в тимусе, яичке и клетках гематопоэтической системы [Mikkers, H.; Nawijn, M.; Allen, J.; Brouwers, C.; Verhoeven, E.; Jonkers, J.; Berns, Mol. Cell. Biol. 2004, 24, 6104; Bachmann, M.; Moroy, T. Int. J. Biochem. Cell Biol. 2005, 37, 726-730. 6115]. Экспрессия PIM-1 непосредственно индуцируется факторами транскрипции STAT (Signal Transducers and Activators of Transcription), и экспрессия PIM-1 индуцируется многими сигнальными путями цитокина, такими как интерлейкины (IL), колониестимулирующий фактор гранулоцитов-макрофагов (ГМ-КСФ), α- и γ-интерферон, эритропоэтин и пролактин [Wang, Z et al. J. Vet. Sci. 2001, 2, 167-179].
PIM-1 участвует в развитие лимфомы. Индуцированная экспрессия PIM-1 и протоонкогена c-myc проявляет синергизм, увеличивая частоту лимфомагенеза [Breuer, M. et al. Nature 1989, 340, 61-63; van Lohuizen M. et al. Cell, 1991, 65, 737-752]. PIM-1 функционирует в сигнальных путях цитокина, и было показано, что он играет роль в развитии Т-клеток [Schmidt, T. et al. EMBO J. 1998, 17, 5349-5359; Jacobs, H. et al. JEM 1999, 190, 1059-1068]. Сигнализируя через субъединицу gp130, общую для рецепторов семейства цитокинов IL-6, активирует фактор транскрипции STAT3 и может привести к пролиферации гематопоэтических клеток [Hirano, T. et al. Oncogene 2000, 19, 2548-2556]. По-видимому, киназа-активный PIM-1 является существенным для gp130-опосредованного сигнала пролиферации STAT3. В кооперации с c-myc PIM-1 может промотировать STAT3-опосредованную прогрессию клеточного цикла и антиапоптоз [Shirogane, T. et sl., immunity, 1999, 11, 709-719]. PIM-1 также, по-видимому, необходим для IL-3-стимулируемого роста происходящих из костного мозга тучных клеток [Domen, J. et al., Blood, 1993, 82, 1445-1452] и выживания клеток FDCP1 после удаления IL-3 [Lilly, M. et al., Oncogene, 1999, 18, 4022-4031].
Дополнительно, контроль пролиферации и выживания клеток PIM-1 может быть произведен посредством фосфорилирования им известных регуляторов клеточного цикла cdc25 [Mochizuki, T. et al., J. Biol. Chem. 1999, 274, 18659-18666] и/или p21 (Cip1/WAF1) [Wang Z. et al. Biochim. Biophys. Acta 2002, 1593, 45-55] или фосфорилирования гетерохроматинового белка 1, молекулы, участвующей в структуре и регуляции транскрипции хроматина [Koike, N. et al, FEBS Lett. 2000, 467, 17-21].
Мыши с дефицитом всех трех генов PIM показали ослабленную реакцию на гематопоэтические факторы роста и продемонстрировали, что белки PIM требуются для эффективной пролиферации периферических T-лимфоцитов. В частности, было показано, что функция PIM требуется для эффективной индукции клеточного цикла Т-лимфоцитов в ответ на синергическую передачу сигналов Т-лимфоцитарного рецептора и IL-2. Большое количество партнеров взаимодействия и субстратов PIM-1 было идентифицировано, что позволяет предположить ведущую роль PIM-1 в контроле клеточного цикла, пролиферации, а также в выживании клеток.
Онкогенный потенциал этой киназы сначала демонстрировался на E µ PIM-1 трансгенных мышах, у которых суперэкспрессия PIM-1 нацелена на В-клеточную линию, что приводит к формированию В-клеточных опухолей [van Lohuizen, M.et al.; Cell 1989, 56, 673-682]. Впоследствии сообщалось, что PIM-1 суперэкспрессировался во множестве случаев рака предстательной железы, эритролейкемий и нескольких других типов человеческих лейкозов [Roh, M.et al.;. Cancer Res. 2003, 63, 8079-8084; Valdman, A. et al; Prostate 2004, 60, 367-371].
Например, хромосомная транслокация PIM-1 приводит к суперэкспрессии PIM-1 в диффузной крупноклеточной лимфоме [Akasaka, H.et al.; Cancer Res. 2000, 60, 2335-2341]. Кроме того, о множестве миссенс-мутаций в PIM-1 сообщалось в случаях лимфом нервной системы и СПИД-индуцированных неходжкинских лимфом, которые вероятно воздействуют на активность или стабильность киназы PIM-1 [Pasqualucci, L. et al, Nature 2001, 412, 341-346; Montesinos-Rongen, M. et al., Blood 2004, 103, 1869-1875; Gaidano, G. et al., Blood 2003, 102, 1833-184]. Таким образом, прочная связь между приводимыми данными суперэкспрессии и частотой мутаций PIM-1 при раке позволяет предположить доминирующую роль PIM-1 в онкогенезе.
Несколько других протеинкиназ были описаны в литературе, где активность и/или повышенная активность таких протеинкиназ участвовали в таких заболеваниях как рак, подобно PIM-1, PIM-2 и PIM-3.
Также сообщалось, что PIM-1 играет роль в гипертензии легочной артерии (РАН), см. журнальную статью Paulin et al, ″Signal transducers and activators of transcription-3/PIM-1 axis plays a critical role in the pathogenesis of human pulmonary arterial hypertension″.
Существует постоянная потребность в получении альтернативных и/или более эффективных ингибиторов протеинкиназ, и особенно ингибиторов PIM-1, PIM-2 и/или PIM-3. Такие модуляторы, как ожидается, предложат альтернативные и/или улучшенные подходы к борьбе с медицинскими состояниями, связанными с активностью и/или повышенной активностью протеинкиназ PIM-1, PIM-2 и/или PIM-3.
Для лечения рака нацеливаемые терапии становятся все более важными. Речь идет о терапии, которая имеет эффект интерференции со специфическими целевыми молекулами, которые связаны с ростом опухоли и/или онкогенезом. Такая терапия может быть более эффективной, чем существующие виды лечения (например, химиотерапия), и менее вредной для нормальных клеток (например, потому что химиотерапия имеет потенциал для уничтожения как нормальных клеток, так и злокачественных клеток). Это, и также факт, что нацеливаемые терапии могут быть селективными (то есть, могут ингибировать определенную молекулу-мишень более селективно по сравнению с другими молекулярными мишенями, например, как описано в дальнейшем), может иметь выгоду в плане уменьшения побочных эффектов и может также иметь выгоду в том, что определенный специфический вид рака может подвергаться лечению (также селективно). Последнее может, в свою очередь, также уменьшить побочные эффекты.
Следовательно, очевидной насущной целью онкологов является разработка нацеливаемых терапий (например, которые являются селективными). В этом отношении должно быть подчеркнуто, что могут существовать несколько различных молекулярных мишеней, которые связаны с некоторыми заболеваниями (например, раком). Однако просто невозможно предсказать, может ли терапия (например, малая молекула как терапевтическое средство), которая интерферирует или ингибирует одну целевую молекулу, ингибировать другую молекулярную мишень (в конечном счете иметь эффект лечения того же самого заболевания или другого заболевания).
В международных заявках на патент WO2009/055418, WO2010/108074, WO2009/040552, WO2010/112874 и WO2011/022439 (а так же в журнальной статье J Med Chem by Okseon Kim et al ″Design and Synthesis of Imidazopyridine Analogues as Inhibitors of PI3K Signaling and Angiogenesis″) раскрыты различные соединения для использования в качестве ингибиторов киназ. Однако ни в одном из этих документов не раскрыты макроциклы.
Перечисление или обсуждение очевидно ранее опубликованного документа в этом описании не обязательно должно приниматься как подтверждение, что этот документ составляет часть уровня техники или относится к общим знаниям.
Раскрытие изобретения
Согласно изобретению, оно относится к соединению формулы I,
в которой:
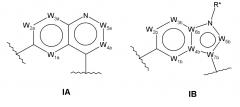
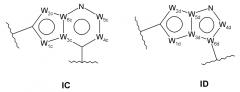
кольцо A и кольцо B представляют собой конденсированную бициклическую группу любой из следующих формул:
в которых
в формуле IA: W1a обозначает CH, CF или N; W2a обозначает CH, CF или N; W3a обозначает CR4a или N; W4a обозначает CR5a или N; W5a обозначает CR6a или N;
в формуле IB: W1b обозначает CH, CF или N; W2b обозначает CH, CF или N; W3b обозначает CR4b или N; W4b обозначает C или N; W5b обозначает CR6b или N; W6b обозначает C или N; W7b обозначает C или N, и причем, когда W3b обозначает N, W4b и W6b обозначают C, и W5b обозначает C или N, тогда R* обозначает водород (во всех других случаях, R* отсутствует);
в формуле IC: W1c обозначает CH, CRt1, N, NRq1, O или S; W2c обозначает CH, CRt2, N, NRq2, O или S; W3c обозначает C или N; W4c обозначает CR5c или N; W5c обозначает CR6c или N; W6c обозначает C или N;
в формуле ID: W1d обозначает CH, CRt3, N, NRq3, O или S; W2d обозначает CH, CRt4, N, NRq4, O или S; W3d обозначает C или N; W4d обозначает CR5d или N; W5d обозначает C или N; W6d обозначает C или N;
каждый Rt1, Rt2, Rt3 и Rt4 независимо выбраны из галогена, C1-3 алкила (например, ациклического C1-3 алкила или циклопропил), 3-5-членной гетероциклоалкильной группы, -ORs1, -CN, -N(Rs2)Rs3, -S(O)w1CH3 или -C(O)CH3;
w1 означает 0, 1 или 2;
каждый Rs1, Rs2 и R3s независимо обозначают водород или C1-2 алкил;
каждый Rq1, Rq2, Rq3 и Rq4 независимо выбраны из C1-3 алкила (например, ациклического C1-3 алкила или циклопропила), 3-5-членный гетероциклоалкильной группы или -C(O)CH3;
каждый R1, R2a, R2b, R2c, R3, R4a, R5a, R6a, R4b, R6b, R5c, R6c и R5d независимо выбраны из водорода или заместителя, выбранного из галогена, -CN, -C(O)N(Rf1)Rf2, -C(O)Rf3, -N(Rf4)Rf5, -C(O)ORf6, -ORf7, -OC(O)-Rf8, -S(O)w2CH3 или C1-8 алкила (например, ациклического C1-6 алкила или C3-7 циклоалкила) и 3-8-членных гетероциклоалкильных групп, причем алкильная и гетероциклоалкильная группы могут быть замещены одним или более заместителями, выбранными из =O и E1;
w2 означает 0, 1 или 2;
Rf1, Rf2, Rf4, Rf5 и Rf7 независимо обозначают водород или C1-6 алкил, в случае необходимости замещенный одним или более заместителями, выбранными из =O и E2; или
Rf1 и Rf2 и/или Rf4 и Rf5 могут образовывать 4-8-(например, 5-6-) членное кольцо, в случае необходимости замещенное одним или более заместителями, выбранными из C1-3 алкила и галогена;
Rf3, Rf6 и Rf8 независимо обозначают C1-6 алкил, в случае необходимости замещенный одним или более заместителями, выбранными из =O и E2;
X обозначает прямую связь, -C(Ra)(Rb)-, -O-, -S-, -N(Rc)-, -N(Rd)C(O)-, -C(O)N(Re)- или -N(Rf)-C(O)-N(Rg)-;
Y обозначает -арилен-, -гетероарилен- (причем последние две группы могут быть замещены одним или более заместителями, выбранными из E3), -гетероциклоалкилен- или -C1-12алкилен- (причем последние две группы могут быть замещены одним или более заместителями, выбранными из =O и E4);
RN обозначает водород или C1-6, алкил, в случае необходимости замещенный одним или более заместителями, выбранными из =O и E5;
Z обозначает -(Ах)1-7- или, особенно, -(Ах)2-7-, причем каждый Ах независимо обозначает -C(Rx1)(Rx2)-, -N(Rx3)-, -C(O)-, -O-, -S-, -S(O)- или -S(O)2-;
Rx1, Rx2 и Rx3, каждый независимо, обозначает водород или заместитель, выбранный из Ех;
каждый Ех независимо обозначает галоген, -C(O)Ry1, -N(Ry2)-C(O)-N(Ry3)(Ry4), C1-6 алкил или гетероциклоалкил (из которых последние две группы могут быть замещены одним или более атомами галогена);
Ry1, Ry2, Ry3 и Ry4, каждый независимо, обозначают водород или C1-3 алкил, в случае необходимости замещенный одним или более атомами галогена;
каждый Ra, Rb, Rc, Rd, Re, Rf и Rg независимо обозначают водород или C1-6, алкил, в случае необходимости замещенный одним или более атомами галогена;
каждый E1, E2, E3, E4 и E5 независимо обозначают, в каждом случае:
(i) Q4;
(ii) C1-12 алкил или гетероциклоалкил, которые оба могут быть замещены одним или более заместителями, выбранными из =O и Q5;
любые две группы E1, E2, E3, E4 и/или E5 (например, на C1-12 алкильных группах, например, когда они присоединены к одним и тем же или смежным атомам углерода, или на ароматических радикалах, когда они присоединены к смежным атомам), могут образовывать 3-12-членное кольцо, в случае необходимости содержащее один или более (например, один-три) ненасыщенных (предпочтительно, двойных связей), и это кольцо может быть замещено одним или более заместителями, выбранными из =O и J1;
каждый Q4 и Q5 независимо обозначает, в каждом случае:
галоген, -CN, -N(R20)R21, -OR20, -C(=Y1)-R20, -C(=Y1)-OR20, -C(=Y1)N(R20)R21, -C(=Y1)N(R20)-O-R21a, -OC(=Y1)-R20, -OC(=Y1)-OR20, -OC(=Y1)N(R20)R21, -OS(O)2OR20, -OP(=Y1)(OR20)(OR21), -OP(OR20)(OR21), -N(R22)C(=Y1)R21, -N(R22)C(=Y1)OR21, -N(R22)C(=Y1)N(R20)R21, -NR22S(O)2R20, -NR22S(O)2N(R20)R21, -S(O)2N(R20)R21, -SC(=Y1)R20, -SC(=Y1)OR20, -SC(=Y1)N(R20)R21, -S(O)2R20, -SR20, -S(O)R20, -S(O)2OR20, C1-6 алкил или гетероциклоалкил (причем последние две группы могут быть замещены одним или более заместителями, выбранными из =O и J2);
каждый Y1 независимо обозначает, в каждом случае, =O, =S, =NR23 или =N-CN;
каждый R21a обозначает C1-6 алкил или гетероциклоалкил (причем последние две группы могут быть замещены одним или более заместителями, выбранными из J4 и =O);
каждый R20, R21, R22 и R23 независимо обозначают, в каждом случае, водород, C1-6 алкил или гетероциклоалкил (причем последние две группы могут быть замещены одним или более заместителями, выбранными из J4 и =O); или
любая релевантная пара R20, R21 и R22 может (например, когда она присоединена к одному и тому же атому, смежному атому (то есть 1,2-отношение) или к атомам, которые являются двумя обособленными атомами, то есть в 1,3-отношении) образовывать (например, наряду с необходимым атомом азота, к которому они могут быть присоединены) 4-20-(например, 4-12-) членное кольцо, в случае необходимости содержащее один или более гетероатомов (например, в дополнение к тем, которые могут уже присутствовать, например, (a) гетероатом(ы), выбранный из кислорода, азота и серы), в случае необходимости содержащее одну или более ненасыщенных (предпочтительно, двойных связей), и это кольцо может быть замещено одним или более заместителями, выбранными из J6 и =O;
каждый J1, J2, J4 и J6 независимо обозначает, в каждом случае:
(i) Q7;
(ii) C1-6 алкил или гетероциклоалкил, которые оба могут быть замещены одним или более заместителями, выбранными из =O и Q8;
каждый Q7 и Q8 независимо обозначают, в каждом случае:
галоген, -CN, -N(R50)R51, -OR50, -C(=Ya)-R50, -C(=Ya)-OR50, -C(=Ya)N(R50)R51, -N(R52)C(=Ya)R51, -NR52S(O)2R50, -S(O)2N(R50)R51, -N(R52)-C(=Ya)-N(R50)R51, -S(O)2R50, -SR50, -S(O)R50, C1-6 алкил (в случае необходимости замещенный одним или более атомами фтора) или гетероциклоалкил (в случае необходимости замещенный одним или более заместителями, выбранными из галогена, -OR60 и -N(R61)R62);
каждый Ya независимо обозначает, в каждом случае, =O, =S, =NR53 или =N-CN;
каждый R50, R51, R52 и R53 независимо обозначает, в каждом случае, водород или C1-6 алкил, в случае необходимости замещенный одним или более заместителями, выбранными из фтора, -OR60 и -N(R61)R62; или
любая релевантная пара R50, R51 и R52 может (например, когда она присоединена к одним и тем же или смежным атомам) образовывать 3-8-членное кольцо, в случае необходимости содержащее один или более гетероатомов (например, в дополнение к тем, которые могут уже присутствовать, гетероатомы, выбранные из кислорода, азота и серы), в случае необходимости содержащее одну или более ненасыщенных (предпочтительно, двойных связей), и это кольцо может быть замещено одним или более заместителями, выбранными из =O и C1-3 алкила;
R60, R61 и R62 независимо обозначают водород или C1-6 алкил, в случае необходимости замещенный одним или более атомами фтора;
или к его фармацевтически приемлемому сложному эфиру, амиду, сольвату или соли,
причем эти соединения, сложные эфиры, амиды, сольваты и соли упоминаются в дальнейшем как ″соединения по изобретению″.
Фармацевтически приемлемые соли включают соли присоединения с кислотой и соли присоединения с основанием. Такие соли можно сформировать обычными средствами, например, реакцией формы свободной кислоты или свободного основания соединения формулы I с одним или более эквивалентами подходящей кислоты или основания, в случае необходимости в растворителе или в среде, в которой соль является нерастворимой, с последующим удалением указанного растворителя или указанной среды, с использованием стандартных методик (например, в вакууме, сушкой сублимацией или фильтрацией). Соли могут также быть получены путем обмена противоиона соединения по изобретению в форме соли с другим противоионом, например, с использованием подходящей ионобменной смолы.
Под ″фармацевтически приемлемым сложным эфиром, амидом, сольватом или солью″ понимают также соли такого сложного эфира или амида, и сольваты такого сложного эфира, амида или соли. Например, могут быть упомянуты фармацевтически приемлемые сложные эфиры и амиды, такие как определенные здесь, а также фармацевтически приемлемые сольваты или соли.
Фармацевтически приемлемые сложные эфиры и амиды соединений по изобретению также включены в рамки изобретения. Фармацевтически приемлемые сложные эфиры и амиды соединений формулы I могут иметь подходящую группу, например, кислотную группу, преобразованную в подходящий сложный эфир или амид. Например, фармацевтически приемлемые сложные эфиры (карбоновых кислот), которые могут быть упомянуты, включают в случае необходимости замещенные сложные C1-6 алкиловые, C5-10 ариловые и/или C5-10 арил-C1-6 алкиловые эфиры. Фармацевтически приемлемые амиды (карбоновых кислот), которые могут быть упомянуты, включают таковые формулы -C(O)N(Rz1)Rz2, в которой Rz1 и Rz2 независимо обозначают в случае необходимости замещенный C1-6 алкил, C5-10 арил или C5-10 арил-C1-6 алкилен-. Предпочтительно, C1-6 алкильные группы, которые могут быть упомянуты в контексте таких фармацевтически приемлемых сложных эфиров и амидов, не являются циклическими, например, являются линейными и/или разветвленными.
Предпочтительно, определенные сложные эфиры и амиды соединений по изобретению, которые могут быть упомянуты, включают сложные эфиры и амиды, упомянутые здесь в отношении соединений формулы I (или соединений по изобретению).
Далее, соединения по изобретению, которые могут быть упомянуты, включают карбамат, карбоксамидо или уреидо производные, например, такие производные существующих функциональных аминогрупп.
В целях этого изобретения, поэтому, пролекарства соединений по изобретению также включены в рамки изобретения.
Термин ″пролекарство″ релевантного соединения по изобретению включает любое соединение, которое, после перорального или парентерального введения, метаболизируется in vivo, образуя это соединение в экспериментально обнаруживаемом количестве и за предварительно определенное время (например, в пределах интервала введения от 6 до 24 часов (то есть от одного до четырех раз в сутки)). Для устранения сомнения, термин ″парентеральное″ введение включает все формы введения, отличные от перорального введения.
Пролекарства соединений по изобретению могут быть получены модификацией функциональных групп, присутствующих на соединении, таким способом, что эти модификации отщепляются in vivo, когда такое пролекарство вводят млекопитающему. Модификации обычно осуществляют, синтезируя родительское соединение с заместителем пролекарства. Пролекарства включают соединения по изобретению, в которых гидроксильная, амино, сульфгидрильная, карбокси или карбонильная группа в соединении по изобретению присоединена к любой группе, которая может быть расщеплена in vivo с регенерацией свободной гидроксильной, амино, сульфгидрильной, карбокси или карбонильной группы, соответственно.
Примеры пролекарств включают, но не ограничены ими, сложные эфиры и карбаматы функциональных гидроксильных групп, сложноэфирных групп функциональных карбоксильных групп, производных N-ацила и оснований Манниха. Общая информация о пролекарствах может быть найдена например, в Bundegaard, H. ″Design of Prodrugs″ p. l-92, Elesevier, New York-Oxford (1985).
Соединения по изобретению могут содержать двойные связи и могут таким образом существовать как E (entgegen) и Z (zusammen) геометрические изомеры относительно каждой индивидуальной двойной связи. Позиционные изомеры могут также быть охвачены соединениями по изобретению. Все такие изомеры (например, если соединение по изобретению включает двойную связь или конденсированное кольцо, охвачены цис- и транс-формы) и их смеси включены в рамки изобретения (например, отдельные позиционные изомеры и смеси позиционных изомеров могут быть включены в рамки изобретения).
Соединения по изобретению могут также показывать таутомерию. Все таутомерные формы (или таутомеры) и их смеси включены в рамки изобретения. Термин ″таутомер″ или ″таутомерная форма″ относится к структурным изомерам с различной энергией, которые являются взаимопревращаемыми через низкий энергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимные превращения через миграцию протона, такие как изомеризации кето-енол и имин-енамин. Таутомеры валентности включают взаимные превращения реорганизацией некоторых из электронов связи.
Соединения по изобретению могут также содержать один или более асимметрических атомов углерода и могут поэтому демонстрировать оптическую изомерию и/или диастереоизомерию. Диастереоизомеры могут быть разделены с использованием обычных методик, например, хроматографии или фракционной кристаллизации. Различные стереоизомеры могут быть выделены разделением рацемической или другой смеси соединений с использованием обычных методик, например, фракционной кристаллизации или ВЭЖХ. Альтернативно, желаемые оптические изомеры могут быть получены реакцией подходящих оптически активных исходных материалов в условиях, которые не будут вызывать рацемизацию или эпимеризацию (то есть способ 'хирального пула'), реакцией подходящого исходного материала с 'хиральным вспомогательным соединением', которое может затем быть удалено на подходящей стадии, дериватизацией (то есть, разделением, включая динамическое разделение), например, с гомохиральной кислотой, с последующим разделением диастереомерных производных обычным способом, таким как хроматография, или реакцией с подходящим хиральным реактивом или хиральным катализатором, все в условиях, известными специалисту.
Все стереоизомеры (включая, но не ограничиваясь ими, диастереоизомеры, энантиомеры и атропоизомеры) и их смеси (например, рацемические смеси) включены в рамки изобретения.
В структурах, показанных здесь, если стереохимия любого специфического хирального атома не определена, тогда все стереоизомеры рассматриваются и включены как соединения по изобретению. Если стереохимия определена клиновидной чертой или пунктирной линией, представляющей специфическую конфигурацию, тогда этот стереоизомер является таким, как он показан и определен.
Соединения согласно настоящему изобретению могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п., и изобретение охватывает как сольватированные, так и несольватированные формы.
Настоящее изобретение также охватывает изотопно меченные соединения согласно настоящему изобретению, которые являются идентичными перечисленным здесь, но в которых один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно обнаруживаемого в природе (или наиболее распространенного в природе). Все изотопы любого специфического атома или элемента, как определено здесь, рассматриваются в рамках соединений по изобретению. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2H, 3H, 11C, 13C, 14C , 13N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I и 125I. Некоторые изотопно меченные соединения согласно настоящему изобретению (например, меченные изотопами 3H и 14C) могут быть использованы в соединении и для тестов распределения субстрата в ткани. Содержащие тритий (3H) и углерод-l4 (14C) изотопы полезны в силу легкости их получения и детекции. Далее, замещение более тяжелыми изотопами, такими как дейтерий (то есть, 2H, может предоставить определенные терапевтические преимущества, следующие из большей метаболической стабильности (например, увеличенного периода полужизни in vivo или сниженных требований к дозировке), и следовательно, может быть предпочтительно при некоторых обстоятельствах. Позитрон-испускающие изотопы, такие как 15O, 13N, 11C и 18F, пригодны для исследования в позитронной эмиссионной томографии (ПЭТФ), чтобы исследовать заполнение рецептора субстратом. Изотопно меченные соединения согласно настоящему изобретению могут в целом быть получены в соответствии со следующими процедурами, аналогичными раскрытым в, например, схемах и/или Примерах, приведенных ниже, с заменой изотопно не меченного реагента изотопично меченным реагентом.
Если не указано иное, C1-q алкильные группы (где q означает верхнюю границу диапазона), определенные здесь, могут быть прямыми или, когда имеется достаточное число (то есть, минимум два или три, в зависимости от обстоятельств) атомов углерода, быть разветвленными и/или циклическими (образуя C3-q-циклоалкильную группу). Такие циклоалкильные группы могут быть моноциклическими или бициклическими и могут быть дополнительно соединены мостиковой связью. Далее, когда имеется достаточное число (то есть, минимум четыре) атомов углерода, такие группы могут также быть циклической частью. Такие алкильные группы могут также быть насыщенными или, когда имеется достаточное число (то есть, минимум два) атомов углерода, быть ненасыщенным (образуя, например, C2-q алкенильную или C2-q алкинильную группу).
Если не указано иное, термин C1-q алкилен (где q означает верхнюю границу диапазона), определенный здесь, может быть прямым или, когда имеется достаточное число атомов углерода, быть насыщенным или ненасыщенным (образуя, например, алкениленовые или алкиниленовые линкерные группы). Однако такие C1-q алкиленовые группы предпочтительно являются не разветвленными. Такие ″алкиленовые″ группы могут быть подходящими линкерными группами, которые являются частью макроциклической структуры формулы I. Для предотвращения сомнения, любые дополнительные заместители на алкиленовых группах не являются неотъемлемой частью связывающей группы, то есть, когда ″Y″ обозначает замещенный алкилен, тогда заместитель(и) не связан с ″X″ или ″Z″, но расположен на алкиленовой группе.
C3-q циклоалкильные группы (где q означает верхнюю границу диапазона), которые могут быть специфично названы, могут быть моноциклическими или бициклическими алкильными группами, причем эти циклоалкильные группы могут быть дополнительно соединены мостиковой связью (образуя, например, конденсированные кольцевые системы, такие как три конденсированные циклоалкильные группы). Такие