Комбинированная терапия антагонистами с-мет и egfr
Иллюстрации
Показать всеНастоящее изобретение относится в основном к областям молекулярной биологии и медицины. В частности, изобретение относится к комбинированной терапии патологических состояний, таких как рак. Способ лечения рака включает введение терапевтически эффективного количества антагониста c-met и антагониста EGFR. 4 з.п. ф-лы, 9 табл., 9 пр., 25 ил.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке в соответствии с 35 USC § 119(e) испрашивается приоритет предварительной заявки США № 61/034446, поданной 6 марта 2008 года, и предварительной заявки США № 61/044438, поданной 11 апреля 2008 года, содержание которых включено в настоящий документ в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ, К КОТОРОЙ ОТНОСИТСЯ ЗАЯВКА
Настоящее изобретение относится в основном к области молекулярной биологии и регуляции факторов роста. Более конкретно, изобретение относится к комбинированной терапии для лечения патологических состояний, таких как рак.
ПРЕДПОСЫЛКИ
HGF является плейотропным фактором мезенхимального происхождения с митогенной, мотогенной и морфогенетической активностью на целый ряд различных типов клеток. Воздействие HGF опосредовано через специфическую тирозинкиназу, c-met, и патологическую экспрессию HGF и c-met часто наблюдают в различных опухолях. Смотри, например, Maulik et al., Cytokine & Growth Factor Reviews (2002), 13:41-59; Danilkovitch-Miagkova & Zbar, J. Clin. Invest. (2002), 109(7):863-867. Регуляция сигнального пути HGF/c-Met вовлечена в развитие и метастазирование опухоли. Смотри, например, Trusolino & Comoglio, Nature Rev. (2002), 2:289-300).
HGF связывается с экстрацеллюлярным доменом рецептора тирозинкиназы c-met (RTK) и регулирует различные биологические процессы, такие как распространение, пролиферация и выживание клеток. Сигнальная система HGF-Met необходима для нормального эмбрионального развития, особенно для миграции мышечных клеток-предшественников и развитии печени и нервной системы (Bladt et al., Nature (1995), 376, 768-771; Hamanoue et al., Faseb J (2000), 14, 399-406; Maina et al., Cell (1996), 87, 531-542; Schmidt et al., Nature (1995), 373, 699-702; Uehara et al., Nature (1995), 373, 702-705). Фенотипы развития нокаутных по Met и HGF мышей очень схожи, что предполагает, что HGF является специфическим лигандом рецептора Met (Schmidt et al., 1995, выше; Uehara et al., 1995, выше). HGF-Met также играет роль в регенерации печени, ангиогенезе и заживлении ран (Bussolino et al., J Cell Biol (1992), 119, 629-641; Matsumoto and Nakamura, Exs (1993), 65, 225-249; Nusrat et al., J Clin Invest (1994) 93, 2056-2065). Предшественник рецептора Met подвергается протеолитическому расщеплению с образованием экстрацеллюлярной субъединицы α и мембранной субъединицы β, соединенных дисульфидными связями (Tempest et al., Br J Cancer (1988), 58, 3-7). Субъединица β содержит цитоплазматический киназный домен и содержит мультисубстратный стыковочный сайт на С-конце, где адаптерные белки связываются и индуцируют сигнальный путь (Bardelli et al., Oncogene (1997), 15, 3103-3111; Nguyen et al., J Biol Chem (1997), 272, 20811-20819; Pelicci et al., Oncogene (1995), 10, 1631-1638; Ponzetto et al., Cell (1994), 77, 261-271; Weidner et al., Nature (1996), 384, 173-176). При связывании HGF активация Met приводит к фосфорилированию тирозина и прохождению сигнала через активацию PI3-киназы и Ras/MAPK, опосредованную Gab1 и Grb2/Sos, соответственно, которые управляют клеточной подвижностью и пролиферацией (Furge et al., Oncogene (2000), 19, 5582-5589; Hartmann et al., J Biol Chem (1994), 269, 21936-21939; Ponzetto et al., J Biol Chem (1996), 271, 14119-14123; Royal and Park, J Biol Chem (1995), 270, 27780-27787).
Было показано, что в обработанной канцерогеном клеточной линии остеосаркомы Met трансформируется (Cooper et al., Nature (1984), 311, 29-33; Park et al., Cell (1986), 45, 895-904). Была отмечена сверхэкспрессия или амплификация гена Met в различных злокачественных опухолях человека. Например, экспрессия белка Met повышается по меньшей мере в 5 раз при колоректальном раке и, как сообщается, происходит амплификация гена в метастазах печени (Di Renzo et al., Clin Cancer Res (1995), 1, 147-154; Liu et al., Oncogene (1992), 7, 181-185). Также было опубликовано, что белок Met сверхэкспрессируется при плоскоклеточной карциноме ротовой полости, гепатоцеллюлярной карциноме, почечноклеточной карциноме, карциноме молочной железы и карциноме легких (Jin et al., Cancer (1997), 79, 749-760; Morello et al., J Cell Physiol (2001), 189, 285-290; Natali et al., Int J Cancer (1996), 69, 212-217; Olivero et al., Br J Cancer (1996), 74, 1862-1868; Suzuki et al., Br J Cancer (1996), 74, 1862-1868). Кроме того, сверхэкспрессия мРНК отмечалась при гепатоцеллюлярной карциноме, карциноме желудка и колоректальной карциноме (Boix et al., Hepatology (1994), 19, 88-91; Kuniyasu et al., Int J Cancer (1993), 55, 72-75; Liu et al., Oncogene (1992), 7, 181-185).
Был обнаружен целый ряд мутаций в киназном домене Met при папиллярной карциноме почек, что приводит к активации конститутивного рецептора (Olivero et al., Int J Cancer (1999), 82, 640-643; Schmidt et al., Nat Genet (1997), 16, 68-73; Schmidt et al., Oncogene (1999), 18, 2343-2350). Эти активирующие мутации обуславливают фосфорилирование тирозина конститутивного Met и приводят к активации MAPK, формированию очага патологического процесса и онкогенезу (Jeffers et al., Proc Natl Acad Sci USA (1997), 94, 11445-11450). Кроме того, эти мутации повышают клеточную подвижность и инвазию (Giordano et al., Faseb J (2000), 14, 399-406; Lorenzato et al., Cancer Res (2002), 62, 7025-7030). HGF-зависимая активация Met в трансформированных клетках опосредует повышенную подвижность, распространение и миграцию, что в конечном счете приводит к инвазивному опухолевому росту и метастазированию (Jeffers et al., Mol Cell Biol (1996), 16, 1115-1125; Meiners et al., Oncogene (1998), 16, 9-20).
Было показано, что Met взаимодействует с другими белками, которые управляют активацией рецептора, трансформацией и инвазией. Было опубликовано, что в опухолевых клетках Met взаимодействует с интегрином α6β4, рецептором компонентов экстрацеллюлярного матрикса, таких как ламинины, для стимуляции HGF-зависимого инвазивного роста (Trusolino et al., Cell (2001), 107, 643-654). Кроме того, было показано, что экстрацеллюлярный домен Met взаимодействует с членом семейства семафоринов, плексином В1, и увеличивает инвазивный рост (Giordano et al., Nat Cell Biol (2002), 4, 720-724). Более того, также было опубликовано, что CD44v6, который вовлечен в онкогенез и метастазирование, образует комплекс с Met и HGF и приводит к активации рецептора Met (Orian-Rousseau et al., Genes Dev (2002), 16, 3074-3086).
Met является членом подсемейства рецепторов тирозинкиназы (RTK), к которым относятся Ron и Sea (Maulik et al., Cytokine Growth Factor Rev (2002), 13, 41-59). Прогнозирование экстрацеллюлярной доменной структуры Met предполагает общую гомологию с семафоринами и плексинами. N-конец Met содержит домен Sema размером приблизительно 500 аминокислот, которые являются консервативными у всех семафоринов и плексинов. Семафорины и плексины относятся к огромному семейству секретируемых и мембраносвязанных белков, впервые описанных в связи с их ролью в развитии нервной системы (Van Vactor and Lorenz, Curr Bio (1999), 19, R201-204). Однако совсем недавно была обнаружена связь сверхэкспрессии семафорина с опухолевой инвазией и метастазированием. Домен PSI, богатый цистеином, (также называемый домен, относящийся к последовательности Met), обнаруженный в плексинах, семафоринах и интегринах, расположен рядом с доменом Sema вслед за четырьмя повторами IPT, которые являются иммуноглобулин-подобными областями, обнаруженными в плексинах и транскрипционных факторах. На основании недавних исследований было сделано предположение, что домен SEMA Met является достаточным для связывания HGF и гепарина (Gherardi et al., Proc Natl Acad Sci USA (2003), 100(21):12039-44).
Как указано выше, рецептор тирозинкиназы Met активируется специфическим лигандом HGF, и фосфорилирование рецептора активирует метаболические пути MAPK, PI3-киназы и PLC-γ (L. Trusolino and P. M. Comoglio, Nat Rev Cancer 2, 289 (2002); C. Birchmeier et al., Nat Rev Mol Cell Biol 4, 915 (2003)). Фосфорилирование Y1234/Y1235 в киназном домене крайне важно для активации киназы Met, в то время как Y1349 и Y1356 в мультисубстратном стыковочном сайте необходимы для связывания с src- гомологичным 2 (SH2), фосфотирозинсвязывающим (PTB) и Met-связывающим доменным (MBD) белками (C. Ponzetto et al., Cell 77, 261 (1994); K. M. Weidner et al., Nature 384, 173 (1996); G. Pelicci et al., Oncogene 10, 1631 (1995)), способствуя активации нисходящих сигнальных путей. Дополнительный околомембранный сайт фосфорилирования, Y1003, был в достаточной степени охарактеризован с точки зрения его связывания с тирозинкиназным связывающим (TKB) доменом Cbl E3-лигазы (P. Peschard et al., Mol Cell 8, 995 (2001); P. Peschard, N. Ishiyama, T. Lin, S. Lipkowitz, M. Park, J Biol Chem 279, 29565 (2004)). Как сообщалось, связывание Cbl запускает эндофилин-опосредованный эндоцитоз рецептора, убиквитинизацию и последующее разрушение рецептора (A. Petrelli et al., Nature 416, 187 (2002)). Этот механизм дезактивации рецептора был уже описан ранее для семейства EGFR, которое также имеет подобный сайт связывания Cbl (K. Shtiegman, Y. Yarden, Semin Cancer Biol 13, 29 (2003); M. D. Marmor, Y. Yarden, Oncogene 23, 2057 (2004); P. Peschard, M. Park, Cancer Cell 3, 519 (2003)). Как уже сообщалось, нарушение регуляции Met и HGF встречается в различных опухолях. Запускаемая лигандом активация Met отмечалась в различных злокачественных опухолях. Было отмечено повышенное содержание сывороточного и внутриопухолевого HGF при раке легкого, молочной железы и множественной миеломе (J. M. Siegfried et al., Ann Thorac Surg 66, 1915 (1998); P. C. Ma et al., Anticancer Res 23, 49 (2003); B. E. Elliott et al. Can J Physiol Pharmacol 80, 91 (2002); C. Seidel, et al, Med Oncol 15, 145 (1998)). Повышенная экспрессия Met и/или HGF, амплификация или мутация Met описана при различных злокачественных опухолях, таких как колоректальный рак, рак легкого, желудка и почки, как предполагается запускает независимую от лиганда активацию рецептора (C. Birchmeier et al, Nat Rev Mol Cell Biol 4, 915 (2003); G. Maulik et al., Cytokine Growth Factor Rev 13, 41 (2002)). Кроме того, индуцибельная сверхэкспрессия Met на мышиной модели печени приводит к возникновению гепатоцеллюлярной карциномы, что указывает на то, что повышенная экспрессия рецептора запускает независимый от лиганда онкогенез (R. Wang, et al, J Cell Biol 153, 1023 (2001)). Наиболее убедительные доказательства того, что Met вовлечен в развитие злокачественных опухолей отмечены у пациентов, имеющих семейную и спорадическую формы папиллярной карциномы почек (RPC). Мутации в киназном домене Met, которые приводят к конститутивной активации рецептора, были идентифицированы как генеративная и соматическая мутации в RPC (L. Schmidt et al., Nat Genet 16, 68 (1997)). Применение этих мутаций в трансгенных мышиных моделях приводит к онкогенезу и метастазированию (M. Jeffers et al., Proc Natl Acad Sci USA 94, 11445 (1997)).
Публикации, касающиеся c-met и антагонистов c-met, включают Martens, T, et al (2006) Clin Cancer Res 12 (20 Pt 1):6144; US 6468529; WO2006/015371; WO2007/063816; WO2006/104912; WO2006/104911; WO2006/113767; US2006-0270594; US2006-US патент № 7481993; WO2009/007427; WO2005/016382; WO2009/002521; WO2007/143098; WO2007/115049; WO2007/126799.
Семейство рецептора эпидермального фактора роста (EGFR) включает четыре близко родственных рецептора (HER1/EGFR, HER2, HER3 и HER4), вовлеченных в клеточные ответы, такие как дифференциация и пролиферация. Повышенная экспрессия киназы EGFR или ее лиганда TGF-альфа как правило связана с большим числом злокачественных опухолей, включая рак молочной железы, легких, колоректальный рак, рак яичника, клеток почечного эпителия, мочевого пузыря и шеи, глиобластомы и астроцитомы, и, по-видимому, участвует в росте этих опухолей. Также было обнаружено, что специфичная делеционная мутация в гене EGFR (EGFRvIII) повышает онкогенность клеток. Активация сигнальных путей стимулированным EGFR запускает большое число процессов, которые являются вероятными стимуляторами развития злокачественной опухоли, например, пролиферацию, ангиогенез, клеточную подвижность и инвазию, сниженный апоптоз и индукцию лекарственной устойчивости. Повышенная экспрессия HER1/EGFR как правило связана с прогрессированием заболевания, метастазированием и плохим прогнозом. Например, было показано, что при NSCLC и раке желудка, повышенная экспрессия HER1/EGFR связана с высокой скоростью метастазирования, низкой степенью дифференциации опухоли и повышенной пролиферацией опухоли.
Мутации, которые активируют внутреннюю белковую активность рецептора тирозинкиназы и/или усиливают нисходящее проведение сигнала, были обнаружены при NSCLC и глиобластоме. Однако роль мутаций как основного механизма придания чувствительности к ингибиторам рецептора EGF, например эрлотинибу (TARCEVA®) или гефитинибу неоднозначна. Было описано, что мутантные формы полноразмерного рецептора EGF рассчитаны на восприимчивость к гефитинибу - ингибитору рецептора тирозинкиназы EGF (Paez, J. G. Et al. (2004) Science 304:1497-1500; Lynch, T. J. et al. (2004) N. Engl. J. Med. 350:2129-2139). Исследования на клеточных культурах показали, что клеточные линии, которые экспрессируют такие мутантные формы рецептора EGF (т.е. H3255), были более чувствительными к ингибированию роста гефитинибом - ингибитором рецептора тирозинкиназы EGF, и что для ингибирования опухолевых клеточных линий, экспрессирующих рецептор EGF дикого типа требуются гораздо более высокие концентрации гефитиниба. Эти наблюдения предполагают, что специфические мутантные формы рецептора EGF могут отражать более высокую чувствительность к ингибиторам рецептора EGF, но не определять полностью невосприимчивый фенотип.
Разработка применения соединений в качестве противоопухолевых средств, которые напрямую ингибируют киназную активность EGFR, а также антител, которые уменьшают киназную активность EGFR путем блокирования активации EGFR, является областью интенсивной научно-исследовательской работы (de Bono J.S. and Rowinsky, E.K. (2002) Trends in Mol. Medicine 8:S19-S26; Dancey, J. and Sausville, E.A. (2003) Nature Rev. Drug Discovery 2:92-313). Различные исследования продемонстрировали, обнаружили или предположили, что некоторые ингибиторы киназы EGFR могут усиливать уничтожение опухолевой клетки или неоплазии при применении в сочетании с некоторыми другими противораковыми или химиотерапевтическими средствами или способами лечения (например, Herbst, R.S. et al. (2001) Expert Opin. Biol. Ther. 1:719-732; Solomon, B. et al (2003) Int. J. Radiat. Oncol. Biol. Phys. 55:713-723; Krishnan, S. et al. (2003) Frontiers in Bioscience 8, e1-13; Grunwald, V. and Hidalgo, M. (2003) J. Nat. Cancer Inst. 95:851-867; Seymour L. (2003) Current Opin. Investig. Drugs 4(6):658-666; Khalil, M.Y. et al. (2003) Expert Rev. Anticancer Ther.3:367-380; Bulgaru, A.M. et al. (2003) Expert Rev. Anticancer Ther.3:269-279; Dancey, J. and Sausville, E.A. (2003) Nature Rev. Drug Discovery 2:92-313; Ciardiello, F. et al. (2000) Clin. Cancer Res. 6:2053-2063; and Patent Publication No: US 2003/0157104).
Эрлотиниб (например, эрлотиниб HCl, также известный как TARCEVA® или OSI-774) является ингибитором киназы EGFR для перорального применения. In vitro эрлотиниб демонстрировал значительную ингибиторную активность в отношении киназы EGFR на многих опухолевых клеточных линиях человека, включая колоректальный рак и рак молочной железы (Moyer J.D. et al. (1997) Cancer Res. 57:4838), и доклинические исследования выявили активность по отношению ко многим EGFR-экспрессирующим опухолевым ксенотрансплантантам человека (Pollack, V.A. et al (1999) J. Pharmacol. Exp. Ther. 291:739). Эрлотиниб продемонстрировал активность в клинических испытаниях при многих показаниях к применению, включая рак головы и шеи (Soulieres, D., et al. (2004) J. Clin. Oncol. 22:77), NSCLC (Perez-Soler R, et al. (2001) Proc. Am. Soc. Clin. Oncol. 20:310a, abstract 1235), CRC (Oza, M., et al. (2003) Proc. Am. Soc. Clin. Oncol. 22:196a, abstract 785) and MBC (Winer, E., et al. (2002) Breast Cancer Res. Treat. 76:5115a, abstract 445; Jones, R.J., et al. (2003) Proc. Am. Soc. Clin. Oncol. 22:45a, abstract 180). В третьей фазе испытаний монотерапия эрлотинибом существенно увеличивала выживаемость, задерживала прогрессирование заболевания и задерживала ухудшение симптомов, связанных с раком легких, у пациентов с прогрессирующим, невосприимчивым к лечению NSCLC (Shepherd, F. et al. (2004) J. Clin. Oncology, 22:14S (July 15 Supplement), Abstract 7022). В ноябре 2004 Управление по контролю за продуктами питания и лекарственными средствами (FDA) США разрешило применение TARCEVA® для лечения пациентов с местно-распространенным или метастатическим немелкоклеточным раком легкого (NSCLC) после безрезультатной по меньшей мере одной предыдущей схемы лечения химиотерапией.
Несмотря на значительный прогресс в лечении рака, все еще необходимы усовершенствованные способы лечения.
Все перечисленные в настоящем документе ссылки, в том числе патентные заявки и публикации, включены в качестве ссылки в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к комбинированной терапии для лечения патологического состояния, такого как рак, где антагонист c-met объединен с антагонистом EGFR, тем самым, обеспечивая значительную противоопухолевую активность.
В одном из аспектов настоящее изобретение относится к способам лечения рака у индивида, включающим введение индивиду терапевтически эффективных количеств антагониста c-met и антагониста EGFR.
Примеры антагонистов c-met включают, но ими не ограничиваются, растворимые рецепторы c-met, растворимые варианты HGF, аптамеры или пептидные антитела, специфичные к c-met или HGF, низкомолекулярные молекулы c-met, антитела анти-c-met и антитела анти-HGF. В некоторых вариантах осуществления изобретения антагонист c-met является анти-c-met антителом.
В одном из вариантов осуществления изобретения антитело анти-c-met содержит вариабельный домен тяжелой цепи, содержащий одну или несколько последовательностей CDR1-HC, CDR2-HC и CDR3-HC, показанных на фигуре 7 (SEQ ID NO:13-15). В некоторых вариантах осуществления изобретения антитело содержит вариабельный домен легкой цепи, содержащий одну или несколько последовательностей CDR1-LC, CDR2-LC и CDR3-LC, показанных на фигуре 7 (SEQ ID NO:5-7). В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи содержит последовательности FR1-HC, FR2-HC, FR3-HC и FR4-HC, показанных на фигуре 7 (SEQ ID NO:9-12). В некоторых вариантах осуществления изобретения вариабельный домен легкой цепи содержит последовательности FR1-LC, FR2-LC, FR3-LC и FR4-LC, показанных на фигуре 7 (SEQ ID NO:1-4). В некоторых вариантах осуществления изобретения антитело анти-c-met является моновалентным и содержит участок Fc. В некоторых вариантах осуществления изобретения антитело содержит последовательность Fc, показанную на фигуре 7 (SEQ ID NO:17).
В некоторых вариантах осуществления изобретения антитело является моновалентным и содержит участок Fc, где участок Fc содержит первый и второй полипептид, где первый полипептид содержит последовательность Fc, показанную на фигуре 7 (SEQ ID NO:17), и второй полипептид содержит последовательность Fc, показанную на фигуре 8 (SEQ ID NO:18).
В одном из вариантов осуществления изобретения антитело анти-c-met содержит (а) первый полипептид, содержащий вариабельный домен тяжелой цепи с последовательностью:
QVQLQQSGPELVRPGASVKMSCRASGYTFTSYWLHWVKQRPGQGLEWIGMIDPSNSDTRFNPNFKDKATLNVDRSSNTAYMLLSSLTSADSAVYYCATYGSYVSPLDYWGQGTSVTVSS (SEQ ID NO:19), с последовательностью CH1, показанной на фигуре 7 (SEQ ID NO:16) и с последовательностью Fc, показанной на фигуре 7 (SEQ ID NO:17); и (b) второй полипептид, содержащий вариабельный домен легкой цепи с последовательностью: DIMMSQSPSSLTVSVGEKVTVSCKSSQSLLYTSSQKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTITSVKADDLAVYYCQQYYAYPWTFGGGTKLEIK (SEQ ID NO:20), и с последовательностью CL1, показанной на фигуре 7 (SEQ ID NO:8); и (с) третий полипептид, содержащий последовательность Fc, показанную на фигуре 8 (SEQ ID NO:18).
В одном из аспектов антитело анти-c-met обладает по меньшей мере одним характерным свойством, которое способствует гетеродимеризации, и в то же время сводя к минимуму гомодимеризацию, последовательностей Fc в пределах фрагмента антитела. Такое характерное свойство(а) улучшает выход и/или степень чистоты и/или гомогенность иммуноглобулиновых популяций. В одном из вариантов осуществления изобретения антитело содержит мутации Fc, формирующие «выпячивания» и «ямки», как описано в WO2005/063816. Например, мутацией, приводящей к образованию «ямки», может быть одна или несколько из мутаций T366A, L368A и/или Y407V в полипептиде Fc, а мутацией, приводящей к образованию «впадины», может быть T366W.
В некоторых вариантах осуществления изобретения антагонистом c-met является SGX-523, PF-02341066, JNJ-38877605, BMS-698769, PHA-665752, SU5416, SU1274, XL-880, MGCD265, ARQ 197, MP-470, AMG 102, антитело 223С4 или гуманизированное антитело 223С4 (WO2009/007427), L2G7, NK4, XL-184, MP-470 или Comp-1.
Антагонисты c-met могут быть использованы для уменьшения или ингибирования одного или нескольких аспектов HGF/c-met-связанных эффектов, включая, но ими не ограничиваясь, активацию c-met, нисходящий молекулярный сигнальный путь (например, фосфорилирование митоген-активируемой протеинкиназы (МАРК), фосфорилирование AKT, фосфорилирование c-met, опосредуемый киназой PI3 сигнальный путь), клеточную пролиферацию, клеточную миграцию, клеточное выживание, клеточный морфогенез и ангиогенез. Эти эффекты могут быть изменены любым биологическим механизмом, включая нарушение связывания лиганда (например, HGF) с c-met, фосфорилирование c-met и/или мультимеризация c-met.
Примеры антагонистов EGFR включают антитела и низкомолекулярные молекулы, которые связываются с EGFR. Антагонисты EGFR также включают низкомолекулярные молекулы, такие как соединения, описанные в US5616582, US5457105, US5475001, US5654307, US5679683, US6084095, US6265410, US6455534, US6521620, US6596726, US6713484, US5770599, US6140332, US5866572, US6399602, US6344459, US6602863, US6391874, WO9814451, WO9850038, WO9909016, WO9924037, WO9935146, WO0132651, US6344455, US5760041, US6002008, US5747498. Специфические низкомолекулярные антагонисты EGFR включают OSI-774 (CP-358774, эрлотиниб, OSI Pharmaceuticals); PD 183805 (CI 1033, 2-пропенамид, N-[4-[(3-хлор-4-фторфенил)амино]-7-[3-(4-морфолинил)пропокси]-6-хиназолинил]-, дигидрохлорид, Pfizer Inc.); Iressa® (ZD1839, гефитиниб, AstraZeneca); ZM 105180 ((6-амино-4-(3-метилфениламино)-хиназолин, Zeneca); BIBX-1382 (N8-(3-хлор-4-фторфенил)-N2-(1-метилпиперидин-4-ил)-пиримидо[5,4-d]пиримидин-2,8-диамин, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-фенилэтил)амино]-1H-пирроло[2,3-d]пиримидин-6-ил]-фенол);(R)-6-(4-гидроксифенил)-4-[(1-фенилэтил)амино]-7H-пирроло[2,3-d]пиримидин); CL-387785 (N-[4-[(3-бромфенил)амино]-6-хиназолинил]-2-бутинамид); EKB-569 (N-[4-[(3-хлор-4-фторфенил)амино]-3-циано-7-этокси-6-хинолинил]-4-(диметиламино)-2-бутенамид); лапатиниб (Tykerb, GlaxoSmithKline); ZD6474 (Zactima, AstraZeneca); CUDC-101 (Curis); канертиниб (CI-1033); AEE788 (6-[4-[(4-этил-1-пиперазинил)метил]фенил]-N-[(1R)-1-фенилэтил]-7H-пирроло[2,3-d]пиримидин-4-амин, WO2003013541, Novartis) и PKI166 4-[4-[[(1R)-1-фенилэтил]амино]-7H-пирроло[2,3-d]пиримидин-6-ил]-фенол, WO9702266 Novartis).
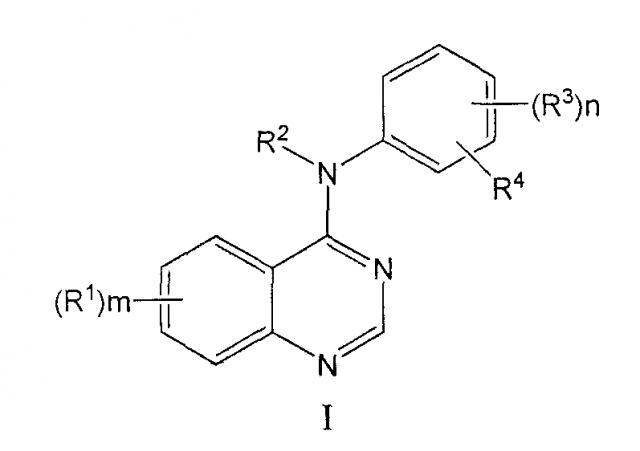
В конкретном варианте осуществления изобретения антагонист EGFR имеет общую формулу I:
в соответствии с патентом США №5757498, приведенным в настоящее описание в качестве ссылки, где:
m равно 1, 2 или 3;
каждый R1 независимо выбран из группы, состоящей из водорода, галогена, гидрокси, гидроксиамино, карбокси, нитро, гуанидино, уреидо, циано, трифторметила и -(С1-С4 алкилен)-W-(фенила), где W представляет собой одинарную связь, О, S или NH;
или каждый R1 независимо выбран из R9 и С1-С4 алкила, замещенного циано, где R9 выбран из группы, состоящей из R5, -OR6, -NR6R6, -C(O)R7, -NHOR5, -OC(O)R6, циано, А и -YR5; R5 представляет собой С1-С4 алкил; R6 независимо представляет собой водород или R5; R7 представляет собой R5, -OR6 или -NR6R6; А выбран из пиперидино, морфолино, пирролидино, 4-R6-пиперазин-1-ил, имидазол-1-ил, 4-пиридон-1-ил, -(С1-С4 алкилен)(СО2Н), фенокси, фенил, фенилсульфанил, С2-С4 алкенил и -(С1-С4 алкилен)C(O)NR6R6; и Y представляет собой S, SO или SO2; где алкильные фрагменты в R5, -OR6 и -NR6R6 необязательно замещены галозаместителями в количестве от одного до трех, и алкильные фрагменты в R5, -OR6 и -NR6R6 необязательно замещены 1 или 2 R9 группами, и где алкильные фрагменты указанных необзхательных заместителей необязательно замещены галогеном или R9 при условии, что два гетероатома не присоединены к одному и тому же атому углерода;
или каждый R1 независимо выбран из -NHSO2R5, фталимидо-(С1-С4)-алкилсульфониламино, бензамидо, бензенсульфониламино, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил, и R10-(C2-C4)-алканоиламино, где R10 выбран из галогена, -OR6, С2-С4 алканоилокси, -С(O)R7 и -NR6R6; и где указанные -NHSO2R5, фталимидо-(С1-С4)-алкилсульфониламино, бензамидо, бензенсульфониламино, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил, и R10-(C2-C4)-алканоиламино R1 группы необязательно замещены 1 или 2 заместителями, независимо выбранными из галогена, С1-С4 алкила, циано, метансульфонила и С1-С4 алкокси;
или две R1 группы взяты вместе с углеродами, к которым они присоединены для образования 5-8-членной циклической структуры, которая включает 1 или 2 гетероатома, выбранных из O, S и N;
R2 представляет собой водород или С1-С6 алкил, необязательно замещенный заместителями в количестве от 1 до 3, независимо выбранными из галогена, С1-С4 алкокси, -NR6R6 и -SO2R5;
n представляет собой 1 или 2 и каждый R3 независимо выбран из водорода, галогена, гидрокси, С1-С6 алкила, -NR6R6, и С1-С4 алкокси, где алкильные фрагменты указанных R3 групп необязательно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогена, С1-С4 алкокси, -NR6R6 и -SO2R; и
R4 представляет собой азидо или -(этинил)-R11, где R11 представляет собой водород или С1-С6 алкил, необязательно замещенный гидрокси, -OR6, или -NR6R6.
В конкретном варианте осуществления изобретения антагонист EGFR является соединением согласно формуле I, выбранным из группы, включающей:
(6,7-диметоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6,7-диметоксихиназолин-4-ил)-[3-(3'-гидроксипропин-1-ил)фенил]-амин;
[3-(2'-(аминометил)-этинил)фенил]-(6,7-диметоксихиназолин-4-ил)-амин;
(3-этинилфенил)-(6-нитрохиназолин-4-ил)-амин;
(6,7-диметоксихиназолин-4-ил)-(4-этинилфенил)-амин;
(6,7-диметоксихиназолин-4-ил)-(3-этинил-2-метилфенил)-амин;
(6-аминохиназолин-4-ил)-(3-этинилфенил)-амин;
(3-этинилфенил)-(6-метансульфониламинохиназолин-4-ил)-амин;
(3-этинилфенил)-(6,7-метилендиоксихиназолин-4-ил)-амин;
(6,7-диметоксихиназолин-4-ил)-(3-этинил-6-метилфенил)-амин;
(3-этинилфенил)-(7-нитрохиназолин-4-ил)-амин;
(3-этинилфенил)-[6-(4'-толуолсульфониламино)хиназолин-4-ил]-амин;
(3-этинилфенил)-{6-[2'-фталимидо-эфир-1'-ил-сульфониламино]хиназолин-4-ил}-амин;
(3-этинилфенил)-(6-гуанидинохиназолин-4-ил)-амин;
(7-аминохиназолин-4-ил)-(3-этинилфенил)-амин;
(3-этинилфенил)-(7-метоксихиназолин-4-ил)-амин;
(6-карбометоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(7-карбометоксихиназолин-4-ил)-(3-этинилфенил)-амин;
[6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)-амин;
(3-азидофенил)-(6,7-диметоксихиназолин-4-ил)-амин;
(3-азидо-5-хлорфенил)-(6,7-диметоксихиназолин-4-ил)-амин;
(4-азидофенил)-(6,7-диметоксихиназолин-4-ил)-амин;
(3-этинилфенил)-(6-метансульфонилхиназолин-4-ил)-амин;
(6-этансульфанилхиназолин-4-ил)-(3-этинилфенил)-амин;
(6,7-диметоксихиназолин-4-ил)-(3-этинил-4-фторфенил)-амин;
(6,7-диметоксихиназолин-4-ил)-[3-(пропин-1'-ил)-фенил]-амин;
[6,7-бис-(2-метокси-этокси)-хиназолин-4-ил]-(5-этинил-2-метилфенил)-амин;
[6,7-бис-(2-метоксиэтокси)-хиназолин-4-ил]-(3-этинил-4-фторфенил)-амин;
[6,7-бис-(2-хлорэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
[6-(2-хлорэтокси)-7-(2-метоксиэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
[6,7-бис-(2-ацетоксиэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
2-[4-(3-этинил-фениламино)-7-(2-гидрокси-этокси)-хиназолин-6-илокси]-этанол;
[6-(2-ацетоксиэтокси)-7-(2-метоксиэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
[7-(2-хлорэтокси)-6-(2-метоксиэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
[7-(2-ацетоксиэтокси)-6-(2-метоксиэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
2-[4-(3-этинилфениламино)-6-(2-гидроксиэтокси)-хиназолин-7-илокси]-этанол;
2-[4-(3-этинилфениламино)-7-(2-метоксиэтокси)-хиназолин-6-илокси]-этанол;
2-[4-(3-этинилфениламино)-6-(2-метоксиэтокси)-хиназолин-7-илокси]-этанол;
[6-(2-ацетоксиэтокси)-7-(2-метоксиэтокси)-хиназолин-4-ил]-(3-этинилфенил)-амин;
(3-этинилфенил)-{6-(2-метоксиэтокси)-7-[2-(4-метилпиперазин-1-ил)-этокси]-хиназолин-4-ил}-амин;
(3-этинилфенил)-[7-(2-метоксиэтокси)-6-(2-морфолин-4-ил)-этокси)-хиназолин-4-ил]-амин;
(6,7-диэтоксихиназолин-1-ил)-(3-этинилфенил)-амин;
(6,7-дибутоксихиназолин-1-ил)-(3-этинилфенил)-амин;
(6,7-диизопропоксихиназолин-1-ил)-(3-этинилфенил)-амин;
(6,7-диэтоксихиназолин-1-ил)-(3-этинил-2-метилфенил)-амин;
[6,7-бис-(2-метоксиэтокси)-хиназолин-1-ил]-(3-этинил-2-метилфенил)-амин;
(3-этинилфенил)-[6-(2-гидроксиэтокси)-7-(2-метоксиэтокси)-хиназолин-1-ил]-амин;
[6,7-бис-(2-гидроксиэтокси)-хиназолин-1-ил]-(3-этинилфенил)-амин;
2-[4-(3-этинилфениламино)-6-(2-метоксиэтокси)-хиназолин-7-илокси]-этанол;
(6,7-дипропоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6,7-диэтоксихиназолин-4-ил)-(3-этинил-5-фторфенил)-амин;
(6,7-диэтоксихиназолин-4-ил)-(3-этинил-4-фторфенил)-амин;
(6,7-диэтоксихиназолин-4-ил)-(5-этинил-2-метилфенил)-амин;
(6,7-диэтоксихиназолин-4-ил)-(3-этинил-4-метилфенил)-амин;
(6-аминометил-7-метоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминометил-7-метокси-хиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилметил-7-метоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилэтил-7-метоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилметил-7-этокси-хиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилэтил-7-этокси-хиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилметил-7-изопропокси-хиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилметил-7-пропокси-хиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилметил-7-метоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6-аминокарбонилэтил-7-изопропокси-хиназолин-4-ил)-(3-этинилфенил)-амин; и
(6-аминокарбонилэтил-7-пропоксихиназолин-4-ил)-(3-этинилфенил)-амин;
(6,7-диэтоксихиназолин-1-ил)-(3-этинилфенил)-амин;
(3-этинилфенил)-[6-(2-гидроксиэтокси)-7-(2-метоксиэтокси)-хиназолин-1-ил]-амин;
[6,7-бис-(2-гидроксиэтокси)-хиназолин-1-ил]-(3-этинилфенил)-амин;
[6,7-бис-(2-метокси-этокси)-хиназолин-1-ил]-(3-этинилфенил)-амин;
(6,7-диметоксихиназолин-1-ил)-(3-этинилфенил)-амин;
(3-этинилфенил)-(6-метансульфониламинохиназолин-1-ил)-амин; и
(6-амино-хиназолин-1-ил)-(3-этинилфенил)-амин.
В конкретном варианте осуществления изобретения антагонист EGFR формулы I представляет собой N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин. В конкретном варианте осуществления изобретения антагонист EGFR N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин находится в форме соли HCl. В другом конкретном варианте осуществления изобретения антагонист EGFR N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин находится в форме практически гомогенного кристаллического полиморфа (описан как полиморф В в WO 01/34574), который демонстрирует порошковую рентгенограмму, имеющую характерные пики, выраженные в градусах 2-тета, приблизительно при 6,26, 12,48, 13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91. Такая форма полиморфа N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин называется TarcevaTM, а также OSI-774, CP-358774 и эрлотинибом.
Антагонисты EGFR могут быть использованы для уменьшения или ингибирования одного или нескольких лиганд-связанных эффектов EGFR-EGFR, включая, но ими не ограничиваясь, активацию EGFR, нисходящий молекулярный сигнальный путь, клеточную пролиферацию. Эти эффекты могут быть изменены любым встречающимся в природе соответствующим механизмом, включая нарушение связывания лиганда с EGFR и нарушение фосфорилирования EGFR.
Способы настоящего изобретения могут быть использованы для воздействия на любое подходящее патологическое состояние. Например, способы изобретения могут быть применимы для лечения различных злокачественных опухолей, как солидных опухолей, так и опухолей мягких тканей в равной степени. Неограниченное количество примеров злокачественных опухолей, поддающихся лечению по настоящему изобретению, включает рак молочной железы, колоректальный рак, рак прямой кишки, немелкоклеточный рак легкого (NSCLC), неходжкинскую лимфому (NHL), почечноклеточный рак, рак простаты, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную карциному, рак головы и шеи, глиобластому, меланому, рак яичника, рак желудка, мезотелиому, множественную миелому. В определенных аспектах злокачественные опухоли являются метастатическими. В других аспектах злокачественные опухоли являются не метастатическими.
В одном из вариантов осуществления изобретения антитело анти-c-met и эрлотиниб используются в комбинированной терапии злокачественных опухолей, таких как немелкоклеточная карцинома легкого.
В определенных вариантах осуществления изобретения рак не является устойчивым к антагонисту EGFR (например, эрлотинибу или гефитинибу) раком. В определенных вариантах осуществления изобретения рак не является устойчивым к эрлотинибу или гефитинибу раком.
В определенных вариантах осуществления изобретения рак не является устойчивым к ингибитору тирозинкиназы раком. В определенных вариантах осуществления изобретения рак не является устойчивым к низкомолекулярному ингибитору тирозинкиназы EGFR раком.
В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют экспрессию, амплификацию или активацию c-met и/или EGFR. В определенных вариантах осуществления в злокачественной опухоли не выявляют экспрессию, амплификацию или активацию c-met и/или EGFR. В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют амплификацию c-met. В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют амплификацию c-met и амплификацию EGFR.
В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют ген EGFR дикого типа. В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют ген EGFR дикого типа и амплификацию c-met и/или мутацию c-met.
В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют мутацию EGFR. Мутации могут быть расположены в любой части гена EGFR или регуляторной области, связанной с геном EGFR. Типичные мутации EGFR включают, например, мутации в экзоне 18, 19, 20 или 21, мутации в киназном домене, G719A, L858R, E746K, L747S, E749Q, A750P, A755V, V765M, S768I, L858P, делеция E746-R748, делеция R748-P753, вставка M766-A767 AI, вставка S768-V769 SVA, вставка P772-H773 NS, 2402OC, 2482OA, 2486T>C, 2491 G>C, 2494OC, 251 0OT, 2539OA, 2549OT, 2563OT, 2819T>C, делеция 2482-2490, делеция 2486-2503, 2544-2545 вставка GCCATA, 2554-2555 вставка CCAGCGTGG или 2562-2563 вставка AACTCC. Другие примеры активирующих мутаций EGFR известны в данной области техники (смотри, например, публикацию патента США № 2005/0272083). В определенных вариантах изобретения клетка или клеточная линия не содержит мутацию Т790М в гене EGFR.
В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют активацию c-met и/или EGFR. В определенных вариантах осуществления изобретения в злокачественной опухоли не обнаруживают активацию c-met и/или EGFR.
В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют активацию конститутивных c-met и/или EGFR. В некоторых вариантах осуществления изобретения, конститутивный EGFR содержит мутацию в тирозинкиназном домене. В определенных вариантах осуществления изобретения в злокачественной опухоли не выявляют активацию конститутивных c-met и/или EGFR.
В определенных вариантах осуществления изобретения в злокачественной опухоли выявляют лиганд-независимую активацию c-met и/или EGFR. В определенных вариантах осуществления изобретения в злокачественной опухоли не обнаруживают лиганд-независимую активацию c-met и/или EGFR.
Антагонист c-met может быть введен последовательно или в комбинации с антагонистом EGFR либо в одной и той же композиции или в виде отдельных композиций. Введение антагониста c-met и антагониста EGFR может быть осуществлено одновременно, например, в виде единой композиции или в виде двух или нескольких отдельных композиций, используя одни и те же или различные способы введения препарата. Альтернативно или дополнительно введение может быть осуществлено последовательно в любом порядке. Альтернативно или дополнительно последовательность действий может быть выполнена как комбинация: и последовательно, и одновременно в любом порядке. В определенных вариантах осуществления изобретения интервалы в диапазоне от минут до дней, от недель до месяцев могут присутствовать между применениями двух или большего количества композиций. Например, антагонист EGFR может быть введен первым с последующим приемом антагониста c-met. Однако, одновременное введение или введение антагониста c-met в первую очередь также предусмотрено. Таким образом, в одном аспекте, изобретение относится к способам, включающим введение антагониста c-met (такого как антитело анти-c-met) с последующим введением антагониста EGFR (такого как эрлотиниб (TARCEVA®)). В определенных вариантах осуществления изобретения интервалы в диапазоне от минут до дней, от недель до месяцев могут присутствовать между введениями двух или более композиций.
В одном аспекте изобретение относится к композиции для применения в лечении рака, содержащей эффективное количество антагониста c-met и фармацевтически приемлемого носителя, где указанное применение заключается в одновременном или последовательном введении антагониста EGFR. В некоторых вариантах осуществления изобретения антагонист c-met представляет собой антитело анти-c-met. В некоторых вариантах осуществления изобретения антагонист EGFR представляет собой эрлотиниб (TARCEVA®).
В одном аспекте изобретение относится к композиции для применения в лечении рака, содержащей эффективное количество антагониста c-met и фармацевтически приемлемого носителя, где указанное применение заключается в одновременном или последовательном введении антагониста EGFR. В некоторых вариантах осуществления изобретения антагонист c-met представляет собой антитело анти-c-met. В некоторых вариантах осуществления изобретения антагонист EGFR представляет собой эрлотиниб (TARCEVA®).
В зависимости от специфическо