Композиция, содержащая липидные наночастицы и кортикостероид или производное витамина d
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции для местного применения, содержащей в качестве терапевтически активного ингредиента кальципотриол или моногидрат кальципотриола, включенный в виде твердого раствора или дисперсии в липидные наночастицы, причем указанные липидные наночастицы являются твердыми при комнатной температуре и содержат 60-92% по массе первого липида с температурой плавления выше температуры тела, где указанный первый липид представляет собой воск, выбранный из группы, состоящей из цетилпальмитата, жирного С14-28 спирта, гидрогенизированного пальмового масла и триглицеридов с кислотным числом, равным 0,1 или ниже, и 1-40% по массе липидных наночастиц второго липида, который представляет собой масло при комнатной температуре, способное смешиваться с первым липидом, причем указанный второй липид выбран из группы, состоящей из среднецепочечных триглицеридов, таких как триглицериды каприловой/каприновой кислоты, или длинноцепочечных триглицеридов, таких как касторовое масло, где указанные липидные наночастицы дополнительно содержат 2-22% по массе фармацевтически приемлемого поверхностно-активного вещества, выбранного из группы, состоящей из полоксамеров. Изобретение обеспечивает улучшенную химическую стабильность действующего вещества в композиции, в т.ч. стабильность при хранении, а также возможность увеличения лекарственной нагрузки. 10 з.п. ф-лы, 4 пр., 14 ил.
Реферат
Область изобретения
Настоящее изобретение относится к композиции, содержащей липидные наночастицы и кортикостероид и/или аналог витамина D в качестве активного(ых) ингредиента(ов), способу получения липидных наночастиц и применению композиции при лечении дерматологических заболеваний и состояний.
Предпосылки создания изобретения
Атопический дерматит (AD) представляет собой хроническое рецидивирующее воспалительное заболевание кожи с высоким уровнем преобладания в раннем детстве, поскольку оно поражает 10-20% всех детей (Katoh, J. Dermatol. 36, 2009, pp. 367-376). Заболевание характеризуется кожным зудом, покраснением, лихенизацией, папулами и сухостью кожи с ослабленным эпидермальным барьером и склонностью к кожным инфекциям (Reitamo et al., Textbook of Atopic Dermatitis, 1st Ed., Informa Healthcare, London, 2008). В патогенезе AD преимущественно придают значение иммунологическим нарушениям. Однако результаты нескольких недавних исследований демонстрируют значимость дефекта кожного барьера в AD в качестве движущей силы воспалительного процесса, а также в качестве обеспечения доступа иммунных клеток в коже к антигенам. Высоко значимая связь между AD и генетическим дефектом филагрина показывает, что разрушение кожного барьера критично для патогенеза AD (Palmer et al., Nat. Genet. 38, 2006, pp. 441-446; Weidinger et al., J. Allergy Clin. Immunol. 118, 2006, pp. 214-219).
В настоящее время лечение первой линии при AD представляет собой местное введение кортикостероидов, которые проявляют противовоспалительное и иммуносупрессивное действие широкого диапазона, в сочетании с увлажняющими средствами, которые могут способствовать заживлению сухой кожи и восстановить барьер (Reitamo et al., выше). Мази или кремы с высоким содержанием масла часто предпочитаются дерматологами, поскольку они более эффективны при поддержании кожи гидратированной и могут усиливать проникновение нанесенного вещества лекарственного средства (Wiedersberg et al., Eur. J. Pharm. Biopharm. 68, 2008, pp. 453-466; Reitamo et al., выше). Однако косметическая приемлемость препаратов такого типа может быть низкой, что отражается в меньшей подверженности лечению среди пациентов с AD (Yentzer et al., J. Drug Dermatol. 9, 2010, pp. 324-329). Кроме того, высвобождение вещества лекарственного средства из традиционных носителей, таких как мази и кремы, и его последующее проникновение в кожу может быть достаточно ограниченным и приводить к неспецифической доставке, например, уровень лекарственного средства может быть слишком низким для индукции у некоторых пациентов терапевтического эффекта, притом, что у других возникают неблагоприятные воздействия или системное проникновение препарата (Korting and Schaefer-Korting, Handbook Exp. Pharmacol., 2010, 435-468). Тот факт, что кожный барьер при AD ослаблен, дополнительно осложняется направленная доставка лекарственного средства в кожу, поскольку состояние барьера является ключевым для того, какое количество вещества лекарственного средства попадет в кожу и проникнет через нее (Bronaugh and Stewart, J. Pharm. Sci. 74, 1985, pp. 1062-1066; Moon and Maibach, Exogenous Dermatoses. Environmental Dermatitis (Menne and Maibach, Eds.), CRC, Boca Raton, 1991, pp. 217-226; Simonsen and Fullerton, Skin Pharmacol. Physiol. 20, 2007, pp. 230-236; Wilhelm et al., J. Invest. Dermatol. 97, 1991, pp. 927-932).
Путем оптимизации доставки кожных лекарственных средств является применение носителей на основе наночастиц. Особенно перспективными являются носители на основе частиц, полученных из липидов (липидные наночастицы, липосомы, микро- и наноэмульсии), поскольку они могут обладать преграждающими свойствами, усиливать проникновение в кожу и обладать свойствами направленного действия (Korting and Schaefer-Korting, выше). Твердые липидные наночастицы (SLN) составляют от 40 до 1000 нм и в принципе совместимы с эмульсией масла в воде, но жидкое масло замещается липидом при температуре плавления выше температуры тела. (Muller et al., Adv. Drug Del. Review 54, Suppl. 1, 2002, S131-S155). В результате их твердого состояния и малого размера SLN обладают сильными адгезивными свойствами, которые могут способствовать образованию преграды после нанесения на кожу, и они в большей степени косметически приемлемы по сравнению с мазью (Jenning et al., Int. J. Pharm. 199, 2000, pp. 167-177; Santos et al., J. DrugTarget, 2002, pp. 489-495; Wissing and Muller, Eur. J. Pharm. Biophar. 56, 2003, pp. 67-72). Преграждающие свойства снижают трансэпидермальную потерю воды (TEWL) и могут способствовать физическому восстановлению кожного барьера при заболевании кожи, подобном AD (Keck and Schwabe, J. Biomed. Nanotechnol. 5, 2009, pp. 428-436).
Псориаз является хроническим воспалительным кожным заболеванием, которое проявляется в виде покрасневших, сухих чешуйчатых бляшек в результате гиперкератоза. Бляшки чаще всего находятся на локтях, коленях и коже головы, хотя более интенсивные повреждения могут появляться и на других частях тела, в частности, в пояснично-крестцовой области. В наиболее обычном лечении легкого до умеренного псориаза используется местное применение композиции, содержащей кортикостероид в качестве активного ингредиента. Применение кортикостероидов, хотя оно эффективно, имеет недостаток, заключающийся в ряде неблагоприятных воздействий, таких как атрофия кожи, стрии, угревидная сыпь, периоральный дерматит, разрастание на коже грибов и бактерий, гипопигментация кожи и розовые угри.
Однако в течение многих лет предпочтительное нестероидное лечение псориаза состояло из местного лечения соединением-аналогом витамина D, кальципотриолом, составленным в композицию мази (в продаже в виде мази Daivonex® или Dovonex® от LEO Pharma), в которой кальципотриол присутствует в композиции раствора или крема (в продаже в виде крема Daivonex® или Dovonex® от LEO Pharma). Растворитель в композиции мази представляет собой пропиленгликоль, который имеет преимущество повышенного проникновения активного ингредиента в кожу, что ведет к повышенной эффективности, которая, как также известно, действует как раздражитель кожи. Таким образом, опубликовано, что включение пропиленгликоля в местные композиции часто вызывает у пациентов развитие контактного дерматита (в одном из исследований сообщается о ряде реакций раздражения в ответ на 12,5% пропиленгликоль (см. M. Hannuksela et al., Contact Dermatitis, 1, 1975, pp. 112-116), и число реакций раздражения повышается, когда пропиленгликоль применяют в высоких концентрациях (обзор Z. Catanzaro and J. Graham Smith, J. Am. Acad. Dermatol. 24, 1991, pp. 90-95). Вследствие повышенного проникновения кальципотриола в кожу, которое приводит, среди прочего, к присутствию пропиленгликоля, мазь Daivonex®, как было обнаружено, более эффективна при лечении псориатических повреждений, чем крем Daivonex®, но она также вызывала у значительной доли пациентов с псориазом раздражении кожи.
Человеческая кожа, в частности, внешний роговой слой, обеспечивает эффективный барьер против проникновения микробных патогенов и токсичных химикатов. В то время как это свойство кожи, как правило, предпочтительно, оно усложняет кожное введение фармацевтических препаратов, так что большое количество, если не большая часть активного ингредиента, наносимого на кожу пациента, страдающего кожным заболеванием, может не проникать в живые слои кожи, где он должен оказывать свое действие. Для обеспечения адекватного проникновения активного ингредиента в дерму и эпидермис, как правило, предпочтительно включать активный ингредиент в растворенном состоянии, как правило, в присутствии растворителя в виде спирта, например, этанола, или диола, например, пропиленгликоля. Как указано выше, пропиленгликоль является хорошо известным усилителем впитывания, т.е. веществом, которое способствует проникновению через роговой слой и «увлекает» низкомолекулярные компоненты, такие как терапевтически активные компоненты носителя, в эпидермис. Пропиленгликоль сам по себе может вызывать значительное раздражение кожи, и он также может «увлекать» низкомолекулярные потенциально раздражающие компоненты носителя в эпидермис, что ведет к общему раздражающему эффекту традиционных носителей, включая пропиленгликоль. По этой причине, присутствие пропиленгликоля в качестве растворителя в композициях, предназначенных для лечения воспалительных кожных заболеваний, может обострять воспалительный ответ.
Задачей настоящего изобретения является предоставление композиции с усиленным проникновением в кожу и улучшенной биологической активностью кортикостероида или аналога витамина D, входящих в композицию для местного применения в качестве активных ингредиентов, по сравнению с коммерчески доступными мазями в отсутствие традиционных усилителей впитывания, таких как пропиленгликоль, или других эксципиентов, которые потенциально являются раздражающими веществами. Другой задачей является предоставление композиций, которые обладают преграждающими свойствами, но имеют улучшенные косметические свойства, т.е. они являются менее жирными по сравнению с мазью и более приятны на коже по ощущениям.
Акне является кожным состоянием, представляющим собой мультифакториальное заболевание, поражающее сально-волосяные фолликулы, характеризующееся повышенной продукцией сального секрета из сальных желез, благодаря присутствию избыточного количества сального секрета в протоке сально-волосяного фолликула, приводящего к образованию комедонов (затвердевших порций сала в фолликулярном протоке). Дальнейшее закрытие протоков приводит к образованию пустул, папул или цист, которые часто являются объектом заселения бактериями, особенно Propionibacterium acnes, и в них локализуется воспаление. Обычное акне является наиболее распространенным кожным нарушением среди тинейджеров, но существенное число взрослых в возрасте 20-40 лет также подвержены акне. Доступные в настоящее время лекарственные средства для лечения акне включают пероксид бензоила, азелаовую кислоту, местные и системные антибиотики, такие как Fucidin®, клиндамицин, эритромицин и тетрациклин, ретиноиды, такие как адапалин, третиноин, изотретиноин, и гормоны, такие как эстроген. Однако с этими лекарственными средствами связаны серьезные недостатки, включая тератогенность, раздражение кожи, фотосенсибилизацию и т.д. По причине отрицательных психосоциальных последствий пораженных индивидуумов, относительно небольшого количества лекарственных средств, доступных для местного лечения акне, и тяжести известных побочных эффектов этих лекарственных средств, предоставление новых лекарственных средств для адекватной терапии акне очень важно.
Таким образом, еще одной задачей настоящего изобретения является предоставление композиции, способной направлять включенный в нее активный ингредиент в волосяные фолликулы кожи. Направленная доставка в фолликулы представляет особый интерес в случае композиций, предназначенных для лечения акне и родственных нарушений, таких как розовые угри. Доставка активного ингредиента непосредственно в участок действия может иметь дополнительное преимущество снижения неблагоприятных воздействий, таких как раздражение кожи, так что предоставляется терапия акне, которая лучше переносится, по сравнению с вариантами лечения, находящимися на рынке в настоящее время.
Сущность изобретения
Проникновение в кожу вещества лекарственного средства, предназначенного для местного кожного применения, является сложным процессом, включающим три основных стадии: 1) высвобождении вещества из носителя, 2) проникновение в роговой слой и 3) распределение из рогового слоя в участки-мишени в живом эпидермисе и дерме. Первая стадия зависит от физико-химических свойств лекарственного средства и носителя, которые могут быть оптимизированы обработкой. Вторая и третья стадии более сложны. Физико-химические свойства лекарственного вещества и степень насыщения лекарственного средства в носителе опять же важны для распределения лекарственного вещества между носителем и кожей, и на него можно воздействовать оптимизацией носителя. Кроме того, на состояние основного биологического барьера, препятствующего проникновению в кожу - рогового слоя - воздействуют кожные заболевания. В исследовании, приведшем к настоящему изобретению, липидные наночастицы оценивали на предмет их свойств в качестве системы местной доставки лекарственного средства в кожу с ослабленной барьерной функцией. Липидные наночастицы сравнивали с традиционными препаратами мазей, которые подходят для доставки липофильных соединений в кожу и обладают преграждающими свойствами.
Недавние исследования in vitro кожи с ослабленной барьерной функцией показали, что SLN способны сохранять в коже значительно более высокий уровень кортикостероида по сравнению с мазью. Этот резервуарный эффект наблюдали как для интактной кожи, так и для кожи с поврежденным барьером in vitro, и лекарственное средство четко локализовалось в роговом слое. Корреляция между специфичной локализацией лекарственного вещества в верхних слоях кожи, резервуарным эффектом кожи и терапевтическим эффектом лекарственного средства, нанесенного на кожу, после применения SLN, содержащего лекарственное средство, описана мало. Задачей настоящего изобретения является предоставление композиции с повышенной эффективностью лекарственного средства в результате способности липидных наночастиц закупоривать кожу или повышать взаимодействие с кожей с поврежденной барьерной функцией.
Таким образом, настоящее изобретение относится к фармацевтической композиции для местного применения, содержащей в качестве терапевтически активного ингредиента кортикостероид, введенный в виде твердого раствора или дисперсии в липидные наночастицы, причем указанные липидные наночастицы являются твердыми при температуре окружающей среды и содержат приблизительно 60-92% по массе первого липида с температурой плавления выше температуры тела, где указанный первый липид представляет собой воск, выбранный из группы, состоящей из сложных эфиров C12-24 спиртов и C12-24 жирных кислот, сложных моно-, ди- или триэфиров глицерина с C12-24 жирными кислотами, жирных C12-24 спиртов и холестерина, где указанные липидные наночастицы дополнительно содержат приблизительно 2-25% по массе фармацевтически приемлемого поверхностно-активного вещества.
В другом аспекте изобретение относится к фармацевтической композиции для местного применения, содержащей в качестве терапевтически активного ингредиента производное витамина D, введенное в виде твердого раствора или дисперсии в липидные наночастицы, причем указанные липидные наночастицы являются твердыми при температуре окружающей среды и содержат приблизительно 60-92% по массе первого липида с температурой плавления выше температуры тела, где указанный первый липид представляет собой воск, выбранный из группы, состоящей из сложных эфиров C12-24 спиртов и C12-24 жирных кислот, сложных моно-, ди- или триэфиров глицерина с C12-24 жирными кислотами с кислотным числом, равным 0,1 или ниже, жирных C12-24 спиртов и холестерина, где указанные липидные наночастицы дополнительно содержат приблизительно 2-25% по массе фармацевтически приемлемого поверхностно-активного вещества, выбранного из группы, состоящей из полоксамеров или этоксилированных жирных спиртов.
Краткое описание фигур
Изобретение далее описано в прилагаемых фигурах.
На фиг.1 показано относительное количество 3H BMV, проникающее через различные слои кожи, после нанесения BMV в мази и в трех различных SLN, соответственно, на интактную кожу (a) и кожу с ослабленной барьерной функцией (b) на период 24 часов. Результаты приведены по отношению к общему количеству измеренного 3H BMV. Среднее±SD (n=8).
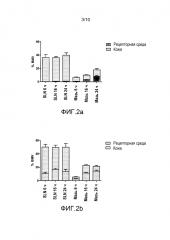
На фиг.2 показано относительное количество 3H BMV, проникающее в кожу и в рецепторную среду, соответственно, после нанесения BMV в мази и в SLN из дистеарата, соответственно, на интактную кожу (a) и кожу с ослабленной барьерной функцией (b) на период 6, 16 или 24 час. Результаты приведены по отношению к общему количеству измеренного 3H BMV. Среднее±SD (n=6).
На фиг.3 показано относительное количество 3H BMV, проникающее в кожу (а) и в рецепторную среду (b), после нанесения SLN из дистеарата и мази, соответственно, на период 24 часов. Кожа, подвергнутая воздействию SLN, в некоторых случаях закупоривалась после нанесения SLN. Результаты приведены по отношению к общему количеству измеренного 3H BMV. Среднее±SD (n=8).
На фиг.4 показана концентрация BDP в коже безволосых крыс, обработанных BDP в SLN, составленных из дистеарата глицерина, по сравнению с BDP в мази. Композиция SLN описана в примере 1.
На фиг.5a показана AUC толщины ушей в исследовании, где сравнивали эффект BMV, введенного в SLN, с BMV в мази. Среднее±SEM (n=10). На 5b показана AUC толщины ушей в исследовании по подбору дозы. Среднее±SEM (n=8). Всех животных лечили оксазолоном по схеме лечения, описанной в примере 3, для индукции фенотипа AD.
На фиг.6a и 6b показаны уровни цитокинов IL-4 и IL-1 у сенсибилизированных мышей. Всех животных лечили оксазолоном по схеме лечения, описанной в примере 3, для индукции фенотипа AD. Среднее±SEM (n=4-10).
Фиг.7a и 7b представляют собой графики, показывающие снижение трансэпидермальной потери воды (TEWL) за счет нанесения липидных наночастиц, содержащих BMV, на уши обработанных оксазолоном мышей, по сравнению с применением мази, содержащей BMV. На фиг.7a показано сравнение SLN с мазью. На фиг.7b показаны значения TEWL в исследовании по подбору дозы.
Подробное описание изобретения
Определения
Термин "липидные наночастицы", как предполагается, означает твердые липидные наночастицы (SLN) или наноструктурированные липидные носители (IMLC). SLN представляют собой частицы наноразмера, полученные из липидов, твердых при температуре окружающей среды, (например, длинноцепочечных триглицеридов, жирных кислот и восков) и из поверхностно-активных веществ, в которых активный ингредиент может растворяться или диспергироваться. NLC представляют собой частицы наноразмера, полученные из липидов, твердых при температуре окружающей среды, и из липидов, жидких при температуре окружающей среды (масел), и из поверхностно-активных веществ, в которых активный ингредиент может растворяться или диспергироваться. Размер частиц в липидных наночастицах может находиться в диапазоне приблизительно 10-800 нм, например, 50-600 нм или 100-500 нм.
Термин "активный ингредиент", как предполагается, означает терапевтически активное вещество лекарственного средства, выбранное из производных или аналогов витамина D и кортикостероидов.
Термин "производное витамина D", как предполагается, означает биологически активный метаболит витамина D3, такой как кальцитриол, или предшественник такого метаболита, такой как альфакальцидол.
Термин "аналог витамина D", как предполагается, означает синтетическое соединение, содержащее остов витамина D с модификациями боковых цепей и/или модификациями самого остова. Аналог проявляет биологическую активность в отношении рецептора витамина D, сравнимую с такой активностью природных соединений витамина D.
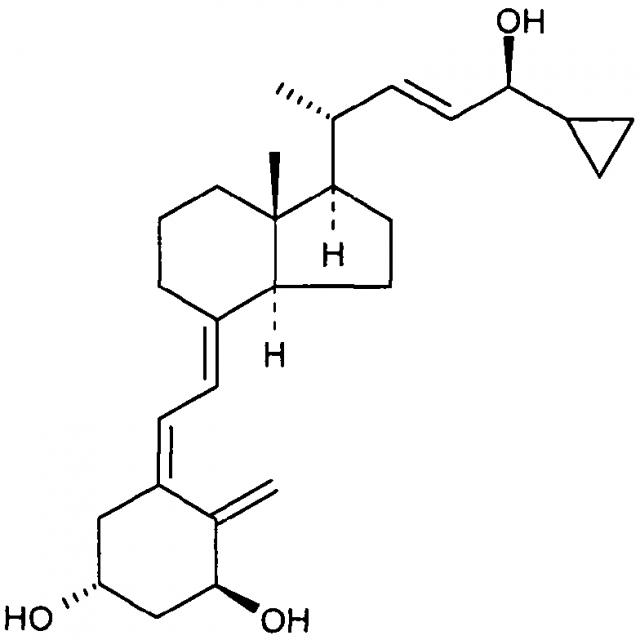
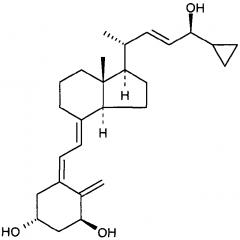
"Кальципотриол" представляет собой аналог витамина D формулы:
Было обнаружено, что кальципотриол существует в двух кристаллических формах, ангидрата и моногидрата. Моногидрат кальципотриола и его получение описаны в WO 94/15912.
Термин "кортикостероид", как предполагается, означает стероидные соединения, синтезируемые в коре надпочечников из холестерина и его производных, в частности, таких производных, которые оказывают противовоспалительное действие. Неограничивающие примеры кортикостероидов включают амцинонид, бетаметазон, буденозид, клобетазол, клобетазон, кортизон, десонид, дезоксикортизон, дезоксиметазон, дексаметазон, дифлукортолон, дифлоразон, флукортизон, флуметазон, флунисолид, флуоцинонид, флуоцинолон, фторметолон, флупреднизолон, флурандренолид, флутиказон, халцинонид, галобетазол, гидрокортизон, мепреднизон, метилпреднизон, мометазон, параметазон, предникарбат, преднизон, преднизолон и триамцинолон или их фармацевтически приемлемый сложный эфир или ацетонид. Примерами наиболее используемых в настоящее время кортикостероидов являются бетаметазон и его сложные эфиры, такие как 17-валерат или 17,21-дипропионат, или 17-пропионат клобетазола.
Термин "стабильность при хранении" или "стабильный при хранении", как предполагается, означает, что композиция обладает характеристиками химической и физической стабильности, которые обеспечивают хранение композиции в течение достаточного периода времени при охлаждении или, предпочтительно, при комнатной температуре, что придает композиции возможность коммерческого использования, например, по меньшей мере, в течение 12 месяцев, в частности, по меньшей мере, в течение 18 месяцев и, предпочтительно, по меньшей мере, в течение 2 лет.
Термин "химическая стабильность" или "химически стабильный", как предполагается, означает, что не более чем 10%, предпочтительно, не более чем 6% активных ингредиентов деградирует в течение срока годности продукта, как правило, равного 2 годам, при комнатной температуре. Оценку химической стабильности при комнатной температуре осуществляют, подвергая композицию ускоренным исследованиям стабильности при 40°C, в которых композицию помещают в нагреваемый шкаф при 40°C, образцы забирают через 1 и 3 месяца и тестируют на присутствие продуктов разрушения ВЭЖХ. Если менее чем приблизительно 10% вещества деградировали через 3 месяца при 40°C, это, как правило, принимается за соответствие сроку годности 2 года при комнатной температуре. Когда активный ингредиент, включенный в композицию, представляет собой кальципотриол, "химическая стабильность", как правило, означает, что кальципотриол значимо не деградирует в течение времени с образованием 24-эпикальципотриола или других продуктов разрушения кальципотриола в конечном фармацевтическом препарате.
Термин "физическая стабильность" или "физически стабильный", как предполагается, означает, что активные ингредиенты не осаждаются из фаз пропеллента или носителя в течение срока годности композиции.
Термин "по существу безводный", как предполагается, означает, что содержание свободной воды в композиции мази не превышает приблизительно 2% по массе, предпочтительно, не превышает приблизительно 1% по массе композиции.
Термин "среднецепочечные триглицериды" используется для обозначения триглицеридных сложных эфиров жирных кислот с длиной цепи в 6-12 атомов углерода. Примером предпочтительно используемых в настоящее время таких среднецепочечных триглицеридов является смесь триглицеридов каприловой (C8) и каприновой (C10) кислот, например, доступная под торговым названием Miglyol 812.
Термин "полутвердый" используется для обозначения композиции или эксципиента, которые показывают вязкоупругие свойства и являются неньютоновскими по характеристикам, т.е. не текут при стрессе малого сопротивления сдвигу, но обладают свойствами пластичного, псевдопластичного или тиксотропного потока при высокой скорости сдвига при комнатной температуре. Обычными примерами полутвердых композиций являются мази и кремы.
Термин "закупоривающий", как предполагается, означает предоставление липидного слоя на поверхности кожи, который образует барьер для гидратации, достаточный для снижения трансэпидермальной потери воды, что приводит к гидратации кожи.
Термин "проникновение в кожу" как предполагается, означает диффузию активного ингредиента в различные слои кожи, например, в роговой слой, эпидермис и дерму.
Термин "проницаемость кожи", как предполагается, означает поток активного ингредиента через кожу в системный кровоток или в случае исследований in vitro, описанных ниже в примере 2, рецепторной жидкости в аппарат с клетками Franz, используемый в эксперименте.
Варианты осуществления
В настоящей композиции первый липид может содержаться в количестве приблизительно 65-92% по массе или приблизительно 70-90% по массе, или приблизительно 75-85% по массе, или приблизительно 80% по массе липидных наночастиц, и поверхностно-активное вещество содержится в количестве приблизительно 8-22% по массе, например, приблизительно 10-20% по массе липидных наночастиц. Первый липид может предпочтительно быть выбран из группы, состоящей из цетилпальмитата, пчелиного воска, стеарилпальмитата, стеарилбегената, моностеарата глицерина, дистеарата глицерина, дибегената глицерина, тримиристата глицерина, трипальмитата глицерина, тристеарата глицерина, бегенола, стеариновой кислоты, гидрогенизированного пальмового масла, гидрогенизированных глицеридов жирных кислот кокосового масла, гидрогенизированного касторового масла или цетостеарилового спирта.
В настоящей композиции поверхностно-активное вещество может представлять собой гидрофильное поверхностно-активное вещество и может предпочтительно быть выбрано из группы, состоящей из полоксамеров, таких как полоксамер 188 или полоксамер 407, полисорбатов, таких как полисорбат 80, сложные эфиры сахарозы (такие как стеарат сахарозы или пальмитат сахарозы), этоксилированные жирные спирты, такие как производные полиоксиэтиленового эфира касторового масла, или оно может представлять собой липофильное поверхностно-активное вещество, такое как фосфолипид, например, фосфатидилхолин сои или яичный лецитин.
Кроме того, липидные наночастицы могут включать приблизительно 1-40%, например, приблизительно 10-30% по массе или приблизительно 15-15% по массе, или приблизительно 20% по массе липидных наночастиц второго липида, который представляет собой масло при температуре окружающей среды, способное смешиваться с первым липидом, или липофильный эмульгатор (например, полиоксипропиленовый эфир жирной кислоты) или смягчающее средство. Второй липид может быть выбран из группы, состоящей из C6-10 моноглицерида, C6-10 диглицерида, изопропилмиристата или изопропилпальмитата, среднецепочечных триглицеридов или длинноцепочечных триглицеридов, включая растительные масла, такие как касторовое масло, подсолнечное масло, сафлоровое масло, масло энотеры, масло бурачникового семени, сезамовое масло, кукурузное масло, косточковое пальмовое масло, оливковое масло, масло авокадо, миндальное масло, рапсовое масло, кокосовое масло, хлопковое масло, арахисовое масло, соевое масло, масло зародышей пшеницы, виноградное масло или масло жожоба.
Настоящая композиция может представлять собой крем (эмульсия «масло-в-воде»), лосьон, распыляемый состав или водный гель, где липидные наночастицы обычно присутствуют в количестве примерно 1-40% по массе, например, приблизительно 5-30% по массе или приблизительно 10-20% по массе композиции. Композиция дополнительно содержит водную фазу, в которой липиды могут в некоторых обстоятельствах формировать сеть, так что происходит образование из композиции геля, или которая может содержать загуститель. Загуститель может быть выбран из группы, состоящей из карбомера, производного целлюлозы, такого как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, гиалуроновой кислоты, альгината, декстрана или их производных. Загуститель, как правило, присутствует в количестве приблизительно 0,1-5% по массе, например, приблизительно 0,5% по массе композиции. Композиция может дополнительно содержать смягчающее средство, которое может быть выбрано из группы, состоящей из силиконового масла, парафинового масла и холестерина или глицерина, аллантоина, пантенола, полиглицерина или сложного эфира полиглицерина. Смягчающее средство может быть включено в количестве приблизительно 10-50% по массе или приблизительно 20-40% по массе, или приблизительно 30% по массе композиции.
Активный ингредиент может присутствовать в композиции в различных формах, т.е. растворяться или диспергироваться в водной фазе, растворяться или диспергироваться липидной/водной фазе поверхностного слоя или растворяться или диспергироваться в липидных наночастицах, на их поверхности или в их ядре. Ранее было показано, что активный ингредиент с наибольшей вероятностью ассоциирован с липидной поверхностью и не встраивается в ядро наночастиц с высокой эффективностью, что приводит к нулевым профилям высвобождения и отсутствию специфичного направленного действия на кожу через 6 часов [L.B. Jensen et al., Int. J. Pharm. 390(1), 2010, pp. 53-60]. Это согласуется с открытиями последнего времени, согласно которым некоторое количество активного ингредиента растворяется или диспергируется в водной фазе, по меньшей мере, в липидных наночастицах из цетилпальмитата и трипальмитата, тогда как большая часть активного ингредиента встраивается в липидную поверхность или ассоциируется с ней. Как правило, полагают, что более высокая растворимость липидного компонента и более эффективная инкапсуляция активного ингредиента может достигаться с применением более полярного липида по сравнению с менее полярным липидом [J. Zhang and E. Smith, J. Pharm. Sci. 10 DOI 1002/jps.22329, 2010]. Таким образом, исследования растворимости валерата бетаметазона (BMV, модельный активный ингредиент) в расплавленном липиде характеризовались корреляцией между полярностью липида и растворимостью в носителе, что соответствует предшествующим результатам по липидам, содержащим различные количества моноглицеридов [L.B. Jensen et al., выше; V.V. Kumar et al., Int. J. Pharm. 335(1-2), 2007, pp. 167-175]. Как показано, полярность липида контролирует высвобождение BMV в исследованиях высвобождения in vitro, проводимых с разнообразными липидами с различной полярностью [L.B. Jensen et al., выше].
Эффект липидной полярности может также отражаться на проникновении в кожу активных ингредиентов, введенных в липидные наночастицы, возможно в результате изменяющихся взаимодействий липидных наночастиц с липидами кожи. Компоненты с параметрами растворимости, близкими к таким параметрам кожи, могут характеризоваться хорошей смешиваемостью с кожей, и изменение параметров растворимости липида может быть способом контроля высвобождения активного ингредиента из липидных наночастиц и его распределения в коже [K.B. Sloan et al., J. Invest. Dermatol. 87(2), 1986, pp. 244-252]. В качестве примера, параметры растворимости BMV в коже оцениваются числом 12 [L.B. Jensen et al., выше] и около 10 для свиной кожи [Z. Liron и S. Cohen, J. Pharm. Sci. 73(4), 1984, pp. 538-542]. Используемые липиды имеют параметры растворимости от 8,7 до 9,5. Липидные наночастицы, составленные из дистеарата, которые имеют параметр растворимости 9,5, близкий к коже, таким образом, как ожидается, будут в большей степени смешиваемыми с кожными липидами, чем липидные наночастицы из трипальмитата и цетилпальмитата. BMV растворим в данном липиде, и липидные наночастицы из дистеарата меньше по размеру, чем другие липидные наночастицы; их диаметр составлял 150,9±0,12 нм. Этим может объясняться большее количество BMV в коже и, особенно, в роговом слое после применения BMV в липидных наночастицах из дистеарата, по сравнению с липидными наночастицами из трипальмитата и цетилпальмитата (см. пример 2).
Для минимизации любых различий в профилях проникновения, вызванных различиями по размеру, предусматривалось, чтобы липидные частицы значительно не колебались по среднему диаметру. Средний диаметр коррелирует с площадью поверхности частиц, который, как полагают, является важным параметром взаимодействия липидных наночастиц с кожей и проникновения в нее, а также их любых преграждающих свойств [S. Wissing et al., J. Cosmet. Sci. 52(5), 2001, pp. 313-324; R.H. Muller et al., Adv. Drug Deliv. Rev. 54, Suppl. 1, 2002, S131-S155]. Таким образом, в настоящей композиции липидные наночастицы могут иметь средний диаметр в диапазоне приблизительно 10-800 нм, в частности, приблизительно 50-600 нм, например, 100-500 нм. Средний диаметр конкретных липидных наночастиц с BMV (см. пример 1) находился в диапазоне 150-212 нм при PdI менее чем 0,24. В общем, полагают, что частицы более 10 нм не проникают в интактную кожу, но пораженная кожа может пропускать частицы больших размеров (с диаметром 500-700 нм), поскольку барьер в ней ослаблен. Измеренный размер частиц указывает на то, что частицы не могут проникать в интактную кожу, тогда как кожа с поврежденным барьером может быть проницаемой для частиц. Липидные наночастицы, полученные из цетилпальмитата, были более монодисперсными, чем другие типы липидов, и это может быть следствием того, что цетилпальмитат является липидом типа воска с отличающейся кристаллической структурой. Данный тип липида, как ранее было показано, образовывал гомогенные частицы малого размера с превосходной физической стабильностью [V. Jenning и S. Gohla, Int. J. Pharm. 196(2), 2000, pp. 219-222]. Измерения размера указывали на то, что SLN не могут проникать через интактную кожу, но, если кожа характеризуется ослабленной барьерной функцией, проникновение частиц возможно. Исследования, обсуждаемые ниже в примере 2, с меченными 14C липидными частицами и меченным 3H BMV показали, что отношение BMV/липид повышалось по направлению внутрь кожи и достигало максимума в рецепторном слое, и поэтому был сделан вывод, что BMV не доставляется в клетки-мишени более глубоких слоев кожи липидными наночастицами, которые, тем не менее, служат в качестве резервуара вещества лекарственного средства в верхних слоях кожи. С применением меченного 14C липида также было показано, что липидные частицы в основном остаются на поверхности кожи и в роговом слое в интактной коже и в коже с ослабленной барьерной функцией. Таким образом, активный ингредиент должен высвобождаться из частиц, чтобы дополнительно диффундировать в кожу и достичь клеток-мишеней в живом эпидермисе и дерме.
Считается предпочтительным, чтобы липидные наночастицы не проникали через кожу, даже если барьер сильно ослаблен, как проиллюстрировано в настоящем описании на коже, на которую воздействовали отрывом липкой ленты. Тот факт, что липидные частицы остаются на поверхности кожи также дает возможность того, что липидные наночастицы могут улучшать гидратацию кожи и физически усиливать барьерные свойства. Это свойство имеет отношение к лечению кожного заболевания, такого как AD, при котором состояние физического кожного барьера сильно связано с патогенезом AD, поскольку в его основе лежит взаимодействие с иммунным барьером кожи.
Липидные наночастицы превосходили мазь в плане достижения высокого уровня лекарственного вещества в коже. Это может быть хорошо видно из результатов, приведенных на фиг.3. Большая доля активного ингредиента, как было обнаружено, находится в верхнем слое как интактной кожи, так и кожи с ослабленной барьерной функцией, что с наибольшей вероятностью связано с большой площадью поверхности и адгезивными свойствами липидных наночастиц. Кроме того, липидные наночастицы и активный ингредиент могут проникать через волосяные фолликулы и складки кожи, из которых частицы могут действовать в качестве резервуара для лекарственного средства. После нанесения липидных наночастиц из дистеарата на интактную кожу и кожу с нарушенной барьерной функцией большее количество активного ингредиента присутствовало в роговом слое и эпидермисе, по сравнению с частицами из трипальмитата и цетилпальмитата, что, как предполагается, связано с различиями в полярности липидов и размером частиц (фиг.1). Таким образом, тесное взаимодействие с кожей, слияние с липидами кожи и высвобождение вещества лекарственного средства контролируемым образом может представлять собой механизм усиливающих проникновение свойств липидных наночастиц, в дополнение к обнаруженному ранее преграждающему эффекту [R.H. Muller et al., выше].
Большее количество BMV в эпидермисе интактной кожи и в рецепторной среде интактной кожи и кожи с ослабленной барьерной функцией при нанесении SLN из цетилпальмитата может быть связано с другой структурой липида, более низкой полярности и меньшей растворимости в BMV [J. Zhang и E. Smith, выше; V. Jenning и S. Gohla, выше]. Это может вызывать более легкое высвобождение BMV из носителя SLN и распределение по коже.
BMV очень эффективно задерживался в коже, когда барьер был интактным (фиг.1a), но проникал через нее подобно мази, когда барьер был ослаблен (фиг.1b). Однако по сравнению с использованием мази в коже с ослабленной барьерной функцией было обнаружено большее количество активного ингредиента. Наиболее предпочтительный профиль проникновения тестируемых липидных наночастиц (ср. пример 2) получали с липидными наночастицами из дистеарата, использование которых приводило к большей растворимости активного ингредиента и сохранению более высокого количества активного ингредиента в коже, и его меньшее количество оказывалось в рецепторной среде. Уровень активного ингредиента в коже был сходным для интактной кожи и