Биомаркеры для терапии на основе ингибитора hedgehog
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа анализа биологического образца пациента, страдающего медуллобластомой, включающего определение уровня экспрессии пяти биомаркеров GLI-1, ОТХ-2, SHROOM2, PDLIM3 и SPHK1 в биологическом образце, взятом у пациента, где увеличенный уровень экспрессии биомаркеров GLI-1, SHROOM2, PDLIM3 и SPHK1 и сниженный уровень экспрессии биомаркера ОТХ-2 по сравнению с контролем служит диагностическим индикатором того, имеет ли пациент повышенную вероятность ответа на [6-(цис-2,6-диметилморфолин-4-ил)-пиридин-3-ил]-амид метил-4′-трифторметоксибифенил-3-карбоновой кислоты. Группа изобретений также касается способа отбора пациента, страдающего медуллобластомой, для лечения ингибитором сигнального пути Hedgehog; набора для определения того, чувствительна ли медуллобластомная опухоль к лечению ингибитором сигнального пути Hedgehog; способа лечения медуллобластомы у пациента, который в этом нуждается. Группа изобретений обеспечивает предсказание ответа пациентов с медуллобластомой на лечение с использованием ингибитора сигнального пути Hedgehog. 4 н. и 4 з.п. ф-лы, 5 пр., 3 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу персонифицированной терапии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Известно, что сигнальный путь Hedgehog регулирует многообразный диапазон биологических процессов, таких как клеточная пролиферация, дифференциация и формирование органов, тканеспецифическим и дозозависимым образом. Обычно сигнальный путь Hedgehog строго контролируется в процессе клеточной пролиферации, дифференциации и формирования эмбрионального профиля. Однако аберрантная активность сигнального пути Hedgehog, вызванная мутациями, которые конститутивно активируют данный путь, например, может иметь патологические последствия. В качестве примера, мутации с потерей функции белка Patched обнаруживают при синдроме Горлина (наследственный синдром с высоким риском возникновения рака кожи и мозга, также известный как синдром базальноклеточного невуса (СБКН)); и мутации Smo и Gli, приводящие к появлению патологических функций, связывают с базальноклеточной карциномой и глиобластомой. Базальноклеточная карцинома (БКК) представляет собой самый распространенный тип рака кожи, поражающий более 90000 американцев каждый год.
Было обнаружено, что конститутивная активация сигнального пути Hedgehog способствует онкогенезу при БКК, медуллобластоме (самой распространенной опухоли мозга у детей), рабдомиосаркоме, раке поджелудочной железы, мелкоклеточном раке легкого, раке предстательной железы и раке молочной железы. Помимо функций в онкогенезе, сигнальный путь Hedgehog также вовлечен в процесс метастазирования рака предстательной железы. Сигнальный путь Hedgehog может быть задействован при многих других типах опухолей, и ожидается, что обнаружение подобных связей будет продолжаться; данная область является областью активного исследования во многих онкоцентрах во всем мире.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии, что конкретные биомаркеры могут применяться для отбора отдельных пациентов, страдающих раком, которые, по-видимому, отвечают на лечение ингибитором сигнального пути Hedgehog. В частности, было обнаружено, что уровень экспрессии биомаркера, приведенного в таблице 1, например уровень экспрессии мРНК биомаркера, приведенного в таблице 1, и/или повышенное содержание или уменьшение количества белкового продукта, кодируемого биомаркером, приведенным в таблице 1, в образце пациента, страдающего раком, по сравнению с контрольным образцом можно применять для прогнозирования того, будет ли данный пациент отвечать на лечение ингибитором сигнального пути Hedgehog.
В одном аспекте данное изобретение включает способ отбора пациента, страдающего раком, для лечения ингибитором сигнального пути Hedgehog, при этом данный способ включает определение уровня экспрессии по меньшей мере одного биомаркера, приведенного в таблице 1, такого как SHROOM 2 или SPHK1, в биологическом образце, полученном от пациента, чтобы, таким образом, прогнозировать повышенную вероятность ответа на ингибитор сигнального пути Hedgehog. В одном варианте осуществления данное изобретение включает отбор по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми биомаркеров из таблицы 1. В способе данного изобретения ингибитор сигнального пути Hedgehog представляет собой циклопамин, Йервин, GANT61, пурморфамин, SAG, SANT-2, томатидин, зерумбон, GDC-0449; XL139, IPI926, IPI609 (IPI269609) или BMS-833923/XL139, или их производные. В одном варианте осуществления ингибитор сигнального пути Hedgehog представляет собой [6-(цис-2,6-диметилморфолин-4-ил)-пиридин-3-ил]-амид метил-4'-трифторметоксибифенил-3-карбоновой кислоты (Соединение I) или 2-[(R)-4-(6-бензил-4,5-диметилпиридазин-3-ил)-2-метил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-ил]-пропан-2-ол (Соединение II). В способе данного изобретения рак может представлять собой БКК, хроническую миелоидную лейкемию (ХМЛ), саркому кости, саркому мягкой ткани, медуллобластому, рабдомиосаркому, рак поджелудочной железы, мелкоклеточный рак легких, рак предстательной железы, синдром Горлина, рак желудочно-кишечного тракта, миелопролиферативную неоплазию и острые лейкемии или рак молочной железы. В одном варианте осуществления биологический образец представляет собой образец опухолевой ткани, такой как свежезамороженный образец или зафиксированный в формалине заключенный в парафин образец ткани.
В другом аспекте данное изобретение включает способ отбора пациента, страдающего раком, для лечения ингибитором сигнального пути Hedgehog, при этом данный способ включает определение уровня экспрессии по меньшей мере одного биомаркера, приведенного в таблице 1, в биологическом образце, полученном от пациента, страдающего медуллобластомой, чтобы, таким образом, прогнозировать повышенную вероятность ответа на [6-(цис-2,6-диметилморфолин-4-ил)-пиридин-3-ил]-амид метил-4'-трифторметоксибифенил-3-карбоновой кислоты.
Определение уровня экспрессии с помощью способов данного изобретения может включать определение уровня экспрессии мРНК или определение уровня белка.
В другом аспекте данное изобретение включает способ отбора пациента, страдающего раком, для лечения ингибитором сигнального пути Hedgehog, при этом данный способ включает определение уровня экспрессии биомаркера сигнального пути Hedgehog, приведенного в таблице 1, в биологическом образце, полученном от пациента, страдающего раком; определение уровня мРНК одного или более референсных/нормировочных генов, приведенных в таблице 2; и нормировку уровня экспрессии биомаркера сигнального пути Hedgehog по референсному гену.
В другом аспекте данное изобретение включает набор для определения того, чувствительна ли опухоль к лечению ингибитором сигнального пути Hedgehog, включающий два зонда или праймера для определения уровня экспрессии по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми биомаркеров, приведенных в таблице 1. Набор данного изобретения может включать множество агентов для определения уровня одного или более биомаркеров, приведенных в таблице 1, и необязательно также включает агенты для определения уровня экспрессии одного или более биомаркеров, приведенных в таблице 2 и инструкции по применению.
В одном аспекте набор данного изобретения может представлять собой набор для прогнозирования того, получит ли пациент, страдающий раком, положительный результат при лечении ингибитором сигнального пути Hedgehog, при этом данный набор включает: множество агентов для определения уровня экспрессии мРНК одного или более биомаркеров, определенных в таблице 1; и средства для анализа экспрессии и получения показателя для прогнозирования того, получит ли пациент положительный результат при лечении ингибитором сигнального пути Hedgehog. Агенты для определения экспрессии мРНК могут включать набор полинуклеотидов, комплементарных одному или более биомаркерам, определенным в таблице 1. Агенты для измерения экспрессии мРНК включают множество ПЦР зондов и/или праймеров для кРВ-ПЦР.
Еще в одном аспекте данное изобретение может включать микрочип, содержащий полинуклеотидные зонды, комплементарные или гибридизуемые, по меньшей мере с одним биомаркером, приведенным в таблице 1.
Еще в одном аспекте данное изобретение может включать композицию, содержащую множество отдельных последовательностей нуклеиновых кислот, где каждая отдельная последовательность нуклеиновой кислоты гибридизуется по меньшей мере с одним из РНК продуктов, выбранных из приведенных далее генов GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20, когда композиция применяется для измерения уровня экспрессии мРНК данных генов.
Еще в одном аспекте данное изобретение может включать программное обеспечение для отбора пациента, страдающего или с подозрением на медуллобластому, для лечения препаратом-ингибитором SMO: способы получения данных, соответствующих уровню экспрессии по меньшей мере одного гена, приведенного в таблице 1, в образце от пациента; способы получения значения экспрессии для каждого гена; и способы получения показателя на основании введения значения уровня экспрессии в базу данных, включающую в себя референсный профиль экспрессии, связанной с отбором, при этом данный показатель прогнозирует, получит ли пациент положительный результат при лечении ингибитором SMO. Данное программное обеспечение может применяться в любом из способов, описанных выше.
«Биомаркер» представляет собой молекулу, которую применяют в качестве индикатора биологического состояния пациента. Что касается настоящего объекта изобретения, биомаркеры, раскрытые в контексте данного описания, могут представлять собой молекулы, которые показывают изменение в экспрессии для прогнозирования того, получит ли пациент положительный результат после получения лечения ингибитором сигнального пути Hedgehog, например ингибитором SMO.
«Hedgehog» по природе относится к любым из гомологов млекопитающих, белку hedgehog мухи Drosophila, и включает по меньшей мере Sonic hedgehog (SHedgehog), Desert hedgehog (DHedgehog) и Indian hedgehog (Hedgehog).
Термин «сигнальный путь Hedgehog», применяемый в контексте данного описания, относится к сигнальному каскаду, опосредованному (или регулируемому) белками hedgehog и его рецепторами, который приводит к изменениям экспрессии генов и другим фенотипическим изменениям, характерным для активности hedgehog. Активация сигнального пути может осуществляться с помощью компонента сигнального пути Hedgehog, который положительным образом влияет на передачу Hedgehog сигнала, т.е. стимулирует последующие биологические события при наличии Hedgehog. Примерами таких компонентов являются Hedgehog, Ptch, Smo и Gli. Hedgehog положительные (Hh+) опухоли представляют собой такие опухоли, которые обладают генетическими изменениями, что приводит к конститутивной активации пути hedgehog, и такая активация Hedgehog, оказывается, является главной движущей силой образования и роста опухоли.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Существует постоянно увеличивающаяся база доказательств, которые показывают, что генетический профиль пациента может быть решающим фактором для восприимчивости пациента к терапевтическому лечению. Принимая во внимание многочисленные типы терапий, доступных для лечения рака, определение генетических факторов, которые влияют, например, на ответ на конкретный препарат, можно было бы применять для обеспечения пациенту персонифицированного режима лечения. Подобные персонифицированные режимы лечения обеспечивают возможности для максимизации терапевтического эффекта у пациента, тогда как сопутствующие побочные эффекты, которые могут быть связаны с альтернативными режимами лечения, минимизируются. Таким образом, существует потребность в определении факторов, которые можно применять для прогнозирования того, будет ли пациент с большой вероятностью реагировать на конкретный вид терапии.
Для максимизации возможного клинического эффекта у пациента, получающего ингибитор сигнального пути Hedgehog, важна способность выбора тех пациентов, которые имеют опухоли с активированным сигнальным путем Hedgehog. Способы, описанные в контексте данного описания, основаны отчасти на определении одного или множества биомаркеров, приведенных в таблице 1, которые можно применять для определения вероятности получения положительного результата у пациента при лечении ингибитором сигнального пути Hedgehog, таким как ингибитор SMO.
Биомаркеры данного изобретения были целенаправленно оптимизированы для применения в зафиксированных в формалине, заключенных в парафин (ЗФЗП) образцах тканей, чтобы сделать их пригодными для применения в повседневных клинических исследованиях.
Ингибиторы сигнального пути Hedgehog
Ингибиторы сигнального пути Hedgehog, применяемые в настоящем изобретении, представляют собой агенты, известные ингибированием сигнального пути Hedgehog. Подобные агенты могут представлять собой агенты, которые ингибируют аберрантные стадии развития, обусловленные фенотипами, такие как мутации с потерей функций в Ptch или Sufu или мутации с приобретением патологических функций в Hedgehog, Smoothened или Gli. Ингибиторы Hedgehog известны в данной области техники и включают, например, низкомолекулярные соединения, короткие пептиды, антитела, антисмысловые олигонуклеотиды, короткие интерферирующие РНК и тому подобное.
В некоторых вариантах осуществления ингибитор сигнального пути Hedgehog представляет собой низкомолекулярное соединение. В некоторых вариантах осуществления ингибитор сигнального пути Hedgehog представляет собой циклопамин или его производное. В некоторых вариантах осуществления ингибитор сигнального пути Hedgehog представляет собой Йервин, GANT61, пурморфамин, SAG, SANT-2, томатидин, зерумбон или их производные. В некоторых вариантах осуществления ингибитор сигнального пути Hedgehog представляет собой GDC-0449 (доступен от компании Genentech и/или Curis); XL139, IPI926 (доступны от компании Infinity Pharmaceuticals), IPI609 (IPI269609), BMS-833923/XL139 (доступны от компании Bristol-Myers Squibb и/или Exelixis), TAK-441 (Millennium) или PF-04449913 (Pfizer).
Дополнительные ингибиторы сигнального пути Hedgehog представлены в PCT/US2010/038568, PCT/US2010/044168, PCT/US2009/061573, PCT/US2009/063696, PCT/US2009/039065, которые все полностью включены в контексте данного описания путем ссылки.
Ингибиторы сигнального пути Hedgehog, описанные в контексте данного описания, могут представлять собой сами агенты, их фармацевтически приемлемые соли, их фармацевтически приемлемые эфиры, а также стереоизомеры, энантиомеры, рацемические смеси и тому подобное. В одном варианте осуществления ингибитор сигнального пути Hedgehog представляет собой ингибитор SMO, такой как [6-(цис-2,6-диметилморфолин-4-ил)-пиридин-3-ил]-амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, также известный как N-[6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]-2-метил-4'-(трифторметокси)[1,1'-бифенил]-3-карбоксамид, который раскрыт в международных патентных заявках № WO 2007/131201 и WO 2008/154259, которые все полностью включены в контекст данного описания путем ссылки. В другом варианте осуществления ингибитор сигнального пути Hedgehog представляет собой 2-[(R)-4-(6-бензил-4,5-диметилпиридазин-3-ил)-2-метил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-ил]-пропан-2-ол, раскрытый в WO 2010/007120, который полностью включен в контекст данного описания путем ссылки.
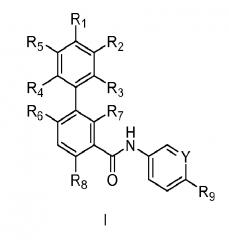
Ингибиторы сигнального пути Hedgehog включают соединение формулы I:
,
в которой
Y выбран из N и CR10; где R10 выбран из водорода, галогена, C1-6алкила, галогензамещенного С1-6алкила, С1-6алкоксильной группы, галогензамещенной С1-6алкоксильной группы и -OXNR10aR10b; где R10a и R10b независимо выбраны из водорода и С1-6алкила;
R1 выбран из цианогруппы, галогена, С1-6алкила, галогензамещенного С1-6алкила, С1-6алкоксильной группы, галогензамещенной С1-6алкоксильной группы, C6-10арила, диметиламиногруппы, C1-6алкил-сульфанила и C3-8гетероциклоалкила, необязательно замещенного до 2 С1-6алкильными радикалами;
R2 и R5 независимо выбраны из водорода, цианогруппы, галогена, С1-6алкила, галогензамещенного С1-6алкила, С1-6алкоксильной группы, галогензамещенной С1-6алкоксильной группы и диметиламиногруппы;
R3 и R4 независимо выбраны из водорода, галогена, цианогруппы, С1-6алкила, галогензамещенного С1-6алкила, С1-6алкоксильной группы и галогензамещенной С1-6алкоксильной группы; или либо R1 и R2 или R1 и R5 вместе с фенильной группой, к которой они оба присоединены, образуют C5-10гетероарил;
R6 и R7 независимо выбраны из водорода, С1-6алкила, галогензамещенного С1-6алкила, С1-6алкоксильной группы и галогензамещенной С1-6алкоксильной группы; с условием, что R6 и R7 оба не являются водородом;
R8 выбран из водорода, галогена, С1-6алкила, галогензамещенного С1-6алкила, С1-6алкоксильной группы и галогензамещенной С1-6алкоксильной группы;
R9 выбран из -S(O)2R11 и -R11; где R11 выбран из арила, гетероарила, циклоалкила и гетероциклоалкила;
где указанный арил, гетероарил, циклоалкил и гетероциклоалкил R9 может быть необязательно замещен от 1 до 3 радикалами, независимо выбранными из C1-6алкила, галогензамещенного C1-6алкила, C1-6алкоксильной группы, галогензамещенной C1-6алкоксильной группы, C6-10арил-C0-4алкила, С5-10гетероарил-С0-4алкила, C3-12циклоалкила и C3-8гетероциклоалкила;
где указанный арилалкильный заместитель R9 необязательно замещен от 1 до 3 радикалами, независимо выбранными из галогена, C1-6алкила, галогензамещенного C1-6алкила, C1-6алкоксильной группы, галогензамещенной C1-6алкоксильной группы и метилпиперазинила; и их фармацевтически приемлемых солей.
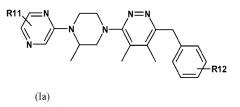
В другом варианте осуществления настоящее изобретение включает ингибиторы сигнального пути Hedgehog формулы I(a):
или их фармацевтически приемлемые соли, где
R11 представляет собой C1-8алкил, C2-8алкенил, C3-14циклоалкил, C6-14арильную группу, 5-14-членную гетероарильную группу, 3-14-членную циклогетероалкильную группу, C1-8алкоксильную группу, галоген, NR13R14, C(O)OR13, C(O)NR13R14, C1-8галогеналкил, формил, карбалкоксильную группу, C1-8алкилОН, C(O)R13, SO2R13, C(O)NHC1-8алкилR13, NR13R14, SO2NR13R14, OCF3, NHC(O)R13, CH2OC(O)NR13R14, CH2NR13R14, NHC(O)OR13, NHC(O)NR13R14, CH2NHSO2R13, CH2NHC(O)OR13, OC(O)R13 или NHC(O)R13, которые могут быть замещенными или незамещенными;
R12 представляет собой H, C1-8алкил, C6-14арильную группу, C1-8галогеналкил, C1-8алкосильную группу, галоген, NH2, CN, OCF3, OH, C(O)NR13R14, C(O)R13, NR13R14, NHC(O)R13, SO2R13, SO2NR13R14;
R13 и R14 независимо представляют собой H, C1-8алкил, C2-8алкенил, C3-14циклоалкил, C6-14арильную группу, 5-14-членную гетероарильную группу, 3-14-членную циклогетероалкильную группу, C1-8галогеналкил, C1-8алкилОН, C1-8алкоксильную группу, или R13 и R14 на одном атоме могут образовывать кольцо, содержащее гетероатом; и
где R11, R13 и R14 могут быть незамещенными или замещенными одним или более C1-8алкилом, C3-14циклоалкилом, C6-14 арильной группой, 5-14-членной гетероарильной группой, 3-14-членной циклогетероалкильной группой, C1-8алкилОН, OH, оксогруппой, C1-8галогеналкилом, карбоксС1-8алкилом или SO2C1-8алкилом, галогеном, -OCH3, -OCF3, -OH, -NH2.
Биомаркер
Биомаркер(ы) данного изобретения включает один или более генов, приведенных в таблице 1, или продукты этих генов. Анализируя уровень экспрессии одного или более биомаркеров, определенных в таблице 1, можно выбрать людей, страдающих раком, у которых путь hedgehog активирован и которые, таким образом, с высокой вероятностью ответят на лечение ингибитором сигнального пути Hedgehog, например антагонистом Smoothened (SMO).
Биомаркеры данного изобретения включают GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20. GLI-1, SHROOM2, PDLIM3, SPHK1, SFRP1 и APBA2 активируются (увеличение экспрессии мРНК), в то время как OTX-2 и SPATA20 подавляются (уменьшение экспрессии мРНК). В одном примере профиль экспрессии может представлять собой набор значений, представляющих уровни мРНК одного или более из приведенных далее генов GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20. В другом примере профиль экспрессии может представлять собой набор значений, представляющих уровни мРНК одного или более из приведенных далее генов GLI-1, OTX-2, SHROOM2, PDLIM3 и SPHK1. Еще в одном примере профиль экспрессии может включать набор значений, представляющих уровни одного или более белков или полипептидов, которые кодируются GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20. Фраза «экспрессия мРНК» может означать увеличение или уменьшение величины экспрессии мРНК в образце пациента, страдающего раком, по сравнению с контрольным образцом. Обычно под увеличением или уменьшением экспрессии мРНК подразумевается изменение экспрессии в 1,5 раза или более (как, например, в 2, 3, 4 или 5 раз) по сравнению с контролем (например, нормальным уровнем, определенным в контрольном образце).
Подготовка образцов
Можно применять любой подходящий исследуемый образец клеток, взятый у пациента, имеющего пролиферативное заболевание. Обычно исследуемый образец клеток или образец ткани получают от пациента, страдающего раком, проводя биопсию или хирургическое удаление. Образец клеток, ткани или жидкости может быть взят при помощи пункционной биопсии. Для этого хирургической тонкой иглой, надетой на шприц, проникают через кожу и в соответствующую ткань. Иглу обычно направляют в нужную область при помощи визуализации методом ультразвуковой или компьютерной томографии (КТ). Как только игла введена в ткань, шприцом создают вакуум таким образом, что клетки или жидкость можно засосать через иглу и набрать в шприц. Образец клеток или ткани также может быть отделен эксцизионной или толстоигольной биопсией. Для этого конусовидный, цилиндрический или небольшой кусочек ткани отделяют из нужной области. Для проведения данного типа биопсии обычно применяют КТ визуализацию, ультразвук или эндоскоп. Конкретнее, весь опухолевый участок может быть удален при помощи эксцизионной биопсии или хирургического удаления. В настоящем изобретении исследуемый образец обычно представляет собой образец клеток, выделенный в ходе хирургического удаления.
Исследуемый образец, например ткани, можно также хранить, например, в растворе RNAlater (Ambion; Austin Tex.) или быстро заморозить и хранить при -80°C для последующего применения. Образец ткани после биопсии можно также фиксировать при помощи фиксатора, такого как формальдегид, параформальдегид или смесь уксусная кислота/этанол. Образец фиксированной ткани может быть заключен в воск (парафин) или пластичный полимер. Заключенный образец ткани (или замороженный образец ткани) можно нарезать на тонкие срезы. РНК или белок также можно выделить из фиксированного или заключенного в воск образца ткани или замороженного образца ткани. Как только образец клеток или образец ткани удаляют у пациента, страдающего раком, его можно подвергать обработке с целью выделения РНК или белка при помощи методик, которые хорошо известны в данной области техники и которые описаны ниже.
Пример выделения РНК из биопсии, взятой у пациента, страдающего раком, может включать, например, лизис при помощи гуанидина тиоцианата с последующим центрифугированием в CsCl (Chirgwin, et al., Biochemistry 18:5294-5299, 1979). РНК из отдельных клеток можно получить, как описано в способах подготовки кДНК библиотек для отдельных клеток (см., например, Dulac, Curr. Top. Dev. Biol. 36:245, 1998; Jena, et al., J. Immunol. Methods 190:199, 1996). В одном варианте осуществления РНК популяция может быть обогащена нужными последовательностями, как указано в таблицах 1 и 2. Обогащение можно провести, например, синтезом кДНК с применением случайных гексамеров и синтезом кДНК с применением специфических праймеров, или множественными циклами линейной амплификации на основании кДНК синтеза и матричной in vitro транскрипции (см., например, Wang, et al., Proc. Natl. Acad. Sci. USA 86:9717, 1989; Dulac, et al., выше; Jena, et al., выше). Другие способы выделения РНК из образца также известны в данной области техники и включают Trizol (Invitrogen), гуанидина тиоцианат-фенол-хлороформную экстракцию, PureLink Micro-to-Midi Total RNA Purification System (invitrogen), RNeasy kit (Qiagen), Oligotex kit (Qiagen), PureYield™ RNA Midiprep (Promega), PolyATtract System 1000 (Promega), Maxwell(R) 16 System (Promega), SV Total RNA Isolation (Promega), ToTALLY RNA™ Kit (Ambion), Poiy(A)Purist™ Kit (Ambion) и любые другие способы. Способы выделения и анализа РНК образца раскрыты в Molecular Cloning, A Laboratory Manual (Sambrook and Russell (ed.), 3rd edition (2001), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, USA.
Профиль экспрессии Hedgehog может быть определен по биопсии, взятой у пациента, такой как свежая ткань, замороженная ткань, ткань, обработанная формалином (ЗФЗП) иди другими фиксаторами. В частности, если образец представляет собой образец ЗФЗП, то РНК выделяют из ЗФЗП срезов при помощи набора для выделения ЗФЗП Qiagen RNeasy (Qiagen) и обратно транскрибируют в кДНК при помощи случайных гексамеров и набора ABI's High Capacity cDNA archive kit (Applied Biosystems, Foster City, CA).
Пациент, страдающий раком или имеющий опухоль, обычно представляет собой млекопитающее, такое как примат. В примерном варианте осуществления пациентом является человек. Применяемые в контексте данного описания термины пациент и субъект являются синонимами.
Любой вид рака или опухоли можно проверить в соответствии со способами данного изобретения, и они включают, но не ограничиваются ими, рак прямой кишки, рак легких, рак поджелудочной железы, рак желудка, рак предстательной железы и гепатоцеллюлярную карциному, базальноклеточную карциному, рак молочной железы, саркому кости, саркому мягких тканей, хроническую миелоидную лейкемию, острый миелолейкоз, гемобластоз, медуллобластому, рабдомиосаркому, нейробластому, рак поджелудочной железы, рак молочной железы, менингиому, глиобластому, астроцитому, меланому, рак желудка, рак пищевода, рак желчных протоков, рак предстательной железы, мелкоклеточный рак легких, немелкоклеточный рак легких, рак глиальных клеток, множественную миелому, рак прямой кишки, нейроэктодермальную опухоль, нейроэндокринную опухоль, мастоцитому и синдром Горлина, глиому, рак толстой и прямой кишки, стомальные опухоли желудочно-кишечного тракта, рак желудка и пищевода, миелопролиферативную неоплазию и острый лейкоз.
Определение экспрессии биомаркера
В одном примере способ включает определение экспрессии одного или более генов GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20. Нужные последовательности генов можно обнаруживать при помощи агентов, которые можно применять для специфического определения конкретного гена, например, РНК, транскрибируемой с гена, или полипептидов, кодируемых данным геном.
В одном варианте осуществления способ включает: обеспечение зонда на основе нуклеиновой кислоты, содержащего нуклеотидную последовательность, например, по меньшей мере 10, 15, 25 или 40 нуклеотидов, и всю или почти всю кодирующую последовательность, которая комплементарна части кодирующей последовательности нуклеотидной последовательности генов GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20; получение образца ткани из млекопитающего, имеющего раковые клетки; введение в контакт в жестких условиях зонда на основе нуклеиновой кислоты и РНК, полученной из биопсии, взятой у пациента с медуллобластомой (например, в Нозерн-блоттинге, гибридизации in situ, ПЦР и т.д.); и определение количества гибридизованного зонда с РНК. Нуклеиновые кислоты могут быть помечены в течение или после процесса обогащения и/или амплификации РНК.
Подразумевается, что биомаркеры GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20 должны также включать естественные последовательности, включая аллельные варианты, и другие члены семейства. Биомаркеры данного изобретения также включают последовательности, которые комплементарны тем перечисленным последовательностям, которые получены в результате вырожденности кода, а также последовательности, которые являются достаточно гомологичными, и последовательности, которые гибридизуются в жестких условиях с генами данного изобретения.
Условия гибридизации известны специалистам в данной области техники, и их можно найти в Current Protocols in Molecular Biology, John Wiley and Sons, N.Y. (1989), 6.3.1-6.3.6. Предпочтительным неограничивающим примером крайне жестких условий гибридизации является гибридизация в 6 X растворе натрия хлорида/натрия цитрата (SSC) при около 45 градусах по Цельсию с последующим одним или более промываниями в 0,2 X растворе SSC, 0,1-процентном растворе SDS при 50-65 градусах по Цельсию. Под термином «достаточно гомологичный» подразумевается аминокислотная или нуклеотидная последовательность биомаркера, которая содержит достаточное или минимальное число одинаковых или эквивалентных (например, аминокислотный остаток, который имеет схожую боковую цепь) аминокислотных остатков или нуклеотидов со второй аминокислотной или нуклеотидной последовательностью так, что первая или вторая аминокислотные или нуклеотидные последовательности имеют общие структурные домены или мотивы и/или общую функциональную активность. Например, аминокислотные или нуклеотидные последовательности, которые имеют общие структурные домены, обладающие по меньшей мере около 50-процентной гомологией, по меньшей мере около 60-процентной гомологией, по меньшей мере около 70-процентной гомологией, по меньшей мере около 80-процентной гомологией, по меньшей мере около 90-95-процентной гомологией в целом по аминокислотным последовательностям доменов, определены в контексте данного описания как достаточно гомологичные. Более того, аминокислотные или нуклеотидные последовательности, которые обладают по меньшей мере около 50-процентной гомологией, по меньшей мере около 60-70-процентной, по меньшей мере около 70-80-процентной, по меньшей мере около 80-90-процентной и по меньшей мере около 90-95-процентной гомологией и имеют общую функциональную активность, определены в данном документе как достаточно гомологичные.
Сравнение последовательностей и определение гомологии в процентах между двумя последовательностями можно выполнить при помощи математического алгоритма. Предпочтительный неограничивающий пример математического алгоритма, применяемого для сравнения последовательностей, представляет собой алгоритм Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-68, модифицированный согласно Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-77. Подобный алгоритм введен в NBLAST и XBLAST программы (version 2.0) Altschul, et al. (1990) J. Mol. Biol. 215:403-10. Нуклеотидные поиски BLAST можно производить при помощи программы NBLAST, значение=100, длина слова=12, для получения нуклеотидных последовательностей, гомологичных TRL молекулам нуклеиновых кислот данного изобретения. Белковые BLAST поиски можно производить при помощи программы XBLAST, значение=50, длина слова=3, для получения аминокислотных последовательностей, гомологичных белковым последовательностям, кодируемым генами/олигонуклеотидами, приведенным в таблице 1, 2 и/или таблице 3. Для получения выравниваний с разрывами для целей сравнения можно применять программу Gapped BLAST, как описано в Altschul et al., (1997) Nucleic Acids Research 25(17):3389-3402. При применении программ BLAST и Gapped BLAST можно применять параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). См. http://www.ncbi.nlm.nih.gov. Другой предпочтительный неограничивающий пример математического алгоритма, применяемого для сравнения последовательностей, представляет собой алгоритм ALIGN Myers и Miller, CABIOS (1989). При применении программы ALIGN для сравнения аминокислотных последовательностей можно применять матрицу PAM1 20 массовых остатков, штраф за удлинение пропуска в последовательности 12 и штраф за пропуск в последовательности 4.
Настоящее изобретение включает измерение экспрессии одного или более генов GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20 в образце из биопсии опухоли, взятой у пациента, страдающего раком, вследствие активации пути hedgehog. Уровни экспрессии можно проанализировать и применять для получения показателя, который можно применять для дифференциации тех пациентов, которые имеют опухоль, показывающую активацию пути hedgehog, от тех пациентов, у которых такой опухоли нет.
В одном варианте осуществления способ данного изобретения включает измерение любого из GLI-1, OTX-2, SHROOM2, PDLIM3, SPHK1, SFRP1, APBA2 и SPATA20, приведенных в таблице 1. В другом варианте осуществления способ данного изобретения включает измерение по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми генов из таблицы 1.
В одном примере измеряют уровень экспрессии одного гена, например GLI-1 из таблицы 1. В другом примере измеряют уровень экспрессии двух генов, например GLI-1, OTX-2 из таблицы 1. Еще в одном примере измеряют уровень экспрессии трех генов GLI-1, OTX-2 и SHROOM2 из таблицы 1. Еще в одном примере измеряют уровень экспрессии четырех генов GLI-1, OTX-2, SHROOM2 или PDLIM3 из таблицы 1. Еще в одном примере измеряют уровень экспрессии пяти генов GLI-1, OTX-2, SHROOM2, PDLIM3 и SPHK1 из таблицы 1.
| Таблица 1 | |
| Название гена | Номер доступа Uni Gene ID |
| GLI-1 | UGID:2139596 |
| OTX-2 | UGID:178376 |
| SHROOM2 | UGID:1782725 |
| PDLIM3 | UGID:237739 |
| SPHK1 | UGID:139253 |
| SFRP1 | UGID:164788 |
| APBA2 | UGID:2087123 |
| SPATA20 | UGID:143131 |
Биомаркеры данного изобретения также включают любую комбинацию генов, определенных в таблице 1, уровень экспрессии или генный продукт которых служит в качестве прогностического биомаркера. Биомаркеры данного изобретения, включая их генную последовательность, известны в данной области техники (как приведено выше) или, например, для GLI-1 (GLI семейство цинковых пальцев 1; Nature 332:371-374(1988)), для OTX-2 (ортодентический гомеобокс 2; EBO J. 12:2735-2747(1993)), для SHROOM2 (член семейства Shroom 2; Hum. Mol. Genet. 4:373-382(1995)), для PDLIM3 (PDZ и LIM домен 3; J. Cell Biol. 139:507-515(1997)), для SPHK1 (сфингозинкиназа 1; Gene 251:19-26(2000)), для SFRP1 (секретируемый связанный с ожогом белок 1; Proc. Natl. Acad. Sci. U.S.A. 94:6770-6775(1997)), для APBA2 (бета амилоид (A4) связывающий белок-предшественник, семейство A; J. Biol. Chem. 272:31459-31464(1997)), для SPATA20 (сперматогенез связанный 20; Proc. Natl. Acad. Sci. U.S.A. 99 (26), 16899-16903 (2002)). В способе данного изобретения измеряют, анализируют и сравнивают с контролем уровень экспрессии одного или более генов, описанных в таблице 1. Контроль для сравнения может быть определен специалистом в данной области техники. В одном примере контроль определяют выбором значения, которое служит в качестве предельного значения. Например, значение может представлять собой значение, которое разделяет, например, те исследуемые образцы, в которых есть активация hedgehog (hedgehog+), и те образцы, которые не проявляют активации hedgehog (hedgehog-). В другом примере профиль генной экспрессии биомаркера данного изобретения сравнивают с контролем (наличие экспрессии биомаркера в образце, взятом у здорового человека, или из опухоли, в которой активирован hedgehog).
В конкретном варианте осуществления данного изобретения контроль предварительно определен и вычислен показатель, который можно применять для отбора пациентов, имеющих опухоль, опосредованную активацией пути hedgehog. Порог экспрессии можно применять для отбора для тех пациентов, которые будут отвечать на ингибитор сигнального пути Hedgehog.
В другом примере контроль может включать один или более нормировочных генов (таких как описанные ниже), которые являются генами, которые проявляют относительно постоянный уровень генной экспрессии. Нормировочные гены корректируют (нормируют) как для различия в количестве исследуемой РНК, так и вариативности качества применяемой РНК. Следовательно, данный анализ обычно измеряет и включает экспрессию нескольких нормировочных генов, таких как нормировочные гены, показанные в таблице 2.
| Таблица 2 | |
| Название гена | Номер доступа |
| HUWE1 | UGID: 150675 |
| LARP1 | UGID: 179374 |
| SOD1 | UGID: 238951 |
| YME1L1 | UGID: 714304 |
В одном из способов данного изобретения измеряют экспрессию одного или более генов таблицы 1 (например, двух, трех, четырех, пяти, шести, семи или восьми генов) и обычно конвертируют данные в величину экспрессии после нормировки на уровень экспрессии одного контрольного гена или среднего значения 4 или 3 или 2 контрольных генов, описанных в таблице 2. Полученные величины экспрессии затем применяют для определения показателя, который затем сравнивают с предельным значением для того, чтобы выбрать пациентов, которые имеют Hedgehog-активированную опухоль и, следовательно, с высокой вероятностью получат положительный результат при лечении ингибитором сигнального пути Hedgehog. В одном примере измеряют уровень мРНК по меньшей мере двух, трех, четырех или всех пяти генов GLI-1, OTX-2, SHROOM2, PDLIM3 и SPHK1 и значения мРНК конвертируют в величину экспрессии после нормировки на уровень экспрессии контрольного гена или среднего значения для 4 или 3 или 2 контрольных генов, описанных в таблице 2. Нормировочные гены данного изобретения, UBA и WWE домен содержащий 1 (HUWEI), La семейство доменов рибонуклеопротеинов, член 1 (LARP1), супероксиддисмутаза 1, растворимый (SOD1), данного изобретения, YME1-like 1 (YME1L1), включая их